杜仲叶提取物减肥功能评价
2016-09-01郑红星相辉张志健祁珊珊刘晶杨星陕西理工学院生物科学与工程学院陕西汉中723000陕西省黑色有机食品工程技术研究中心陕西汉中723000
郑红星,相辉,张志健,祁珊珊,刘晶,杨星(.陕西理工学院生物科学与工程学院,陕西汉中723000;2.陕西省黑色有机食品工程技术研究中心,陕西汉中723000)
杜仲叶提取物减肥功能评价
郑红星1,2,相辉1,张志健1,2,祁珊珊1,刘晶1,杨星1
(1.陕西理工学院生物科学与工程学院,陕西汉中723000;2.陕西省黑色有机食品工程技术研究中心,陕西汉中723000)
为开发杜仲叶提取物的保健食品,本文对其进行了减肥功能研究。以杜仲叶乙醇提取物为受试样品,50只昆明小鼠随机分成5组:空白对照组,模型对照组,以及高剂量组(600 mg/kg·BW)、中剂量组(300 mg/kg·BW),低剂量组(150 mg/kg·BW),每组10只,模型对照组和剂量组饲喂营养饲料,空白对照组给予基础饲料,饲养30 d,试验期间分别测定每只动物的摄食量、饮水量及体重。试验结束时称体重,解剖取体脂并称重,计算脂/体比,食物利用率、Lee's指数。结果:各剂量组的体重和脂/体比明显低于模型对照组,并且其摄食量不显著低于模型对照组。该研究表明杜仲叶乙醇提取物具有减肥功能。
杜仲叶;乙醇提取物;营养性肥胖;减肥;功能;评价
随着社会、经济的快速发展,我们的饮食和身体活动模式发生了巨大的变化。高脂、高能量食品摄入量持续增加;同时工作形式、交通方式的变化以及城市化加剧,造成身体活动的缺乏。据WHO报道,超重和肥胖在全球流行,2013年,全世界约有4200万5岁以下儿童超重或肥胖。2014年,逾19亿成年人超重,其中有6亿多人肥胖。全世界约有13%的成年人肥胖。身体质量指数升高是患非传染性疾病的重大风险因素,如:心血管疾病[1]、糖尿病[2]、肌肉骨骼疾患[3]、某些癌症[4]。因此研究开发安全有效的减肥药物与功能食品,已成为世界关注的研究领域。
杜仲是中国名贵滋补药材,也是中国特有的树种,主要分布于陕西、甘肃、河南、湖北、四川、云南、贵州、湖南、安徽、江西、广西及浙江等省区,2015年我国杜仲栽培面积35万公顷,占世界总量约90%以上,被广泛应用于医药保健、工业、农业、林业等领域。目前,除传统药材杜仲皮外,杜仲叶、花、果等也具有很高的食用和药用价值,杜仲皮和杜仲叶已被列入《中华人民共和国药典》和《可用于保健食品的物品名单》,而杜仲籽油、杜仲雄花分别于2009年、2014年已被列入《国家新食品原料名单》。在《中华人民共和国药典》中记载杜仲功能主治:“补肝肾,强筋骨,安胎功效。可用于治疗肝肾不足,腰膝酸痛,筋骨无力,头晕目眩,妊娠漏血,胎动不安[5]”。另外,现代医学研究表明,杜仲具有降血压、抗氧化、抗疲劳、增强免疫力、抗骨质疏松、抗肿瘤、保肝护肝、降血糖和抗衰老等多种功效[6-7],而在减肥功能上很少有报道。本研究旨在评价杜仲叶乙醇提取物的减肥功能,为其减肥功能食品开发提供参考。
1 材料与方法
1.1试验材料
1.1.1试验动物
KM小鼠(SPF级,18 g~22 g,雌性):由西安交通大学医学部实验动物中心提供,实验动物生产许可证号SCXK(陕)2012-003。
1.1.2受试样品、试剂与仪器
杜仲叶乙醇提取物:陕西昊辰生物科技有限公司;蒸馏水:实验室自制;JA2002电子天平:上海浦春计量仪器有限公司;常规解剖器械等。
1.2方法
1.2.1剂量分组及受试样品给予时间
ERP是以建立企业的内部资源信息以及完善管理系统为目标,目前,我国很多企业大多数都是选取其中的一部分模块来实施,并且在使用中很多的功效还没能发挥出来,企业仍处于一个探索的初级阶段,主要存在以下主要问题:
试验设3个剂量组、1个模型对照组和1个空白对照组,每组10只,高、中、低剂量组给药剂量分别为600、300、150 mg/kg·BW,受试样品经口灌胃给药,受试样品给予时间30 d。
1.2.2饲料配方
基础饲料:由西安交通大学医学部实验动物中心提供。
营养饲料:基础饲料80%(西安交通大学医学部实验动物中心)、猪油10%(市场购买)、蛋黄粉10%(安徽亳州红日蛋制品有限责任公司),按上述比例自行配制获得。
1.2.3试验步骤
将动物随机分为空白对照组、肥胖模型对照组和3个受试样品剂量组,自试验开始,模型对照组、剂量组动物给予等量的营养饲料,空白对照组以相同方式给予等量的基础饲料,剂量组给不同剂量的杜仲叶乙醇提取物,模型对照组和空白对照组给予相应溶剂。试验时间为30 d,试验期间定期记录每组动物的给食量、剩食量及饮水量,并称体重。试验结束时将小鼠颈椎脱臼处死,对每只动物称体重,剖腹取体脂并称重,计算食物利用率、脂/体比与Lee's指数[8]。
Lee's指数=BW1/3×103/BL,式中:BW为体重,g;BL为体长,cm,即小鼠鼻尖到肛门的长度[9-10]。
体重、饮水量、摄食量、食物利用率、体内脂肪重量(肾周围脂肪垫)、脂/体比、Lee's指数。
1.3数据处理和结果判定
采用统计学软件SPSS19.0进行方差分析,采用t检验,试验数据以平均值±标准差()表示。差异显著水平为P<0.05,差异极显著水平为P<0.01。依据《保健食品检验与评价技术规范》,若模型对照组的体重和体内脂肪重量,或体重和脂/体比高于空白对照组,差异有显著性,则说明营养性肥胖模型建立成功;若剂量组的体重和体内脂肪重量,或体重和脂/体比低于模型对照组,差异有显著性,并且摄食量不显著低于模型对照组,则判定杜仲叶乙醇提取物对营养性肥胖小鼠具有减肥功能。
2 结果与分析
2.1杜仲叶乙醇提取物对肥胖小鼠体重的影响
杜仲叶乙醇提取物对肥胖小鼠体重的影响见表1。
表1 杜仲叶乙醇提取物对肥胖小鼠体重的影响(,n=10)Table 1 Effect of ethanol extract of Eucommia ulmoides leaves on body weight levels in obese mice(,n=10)
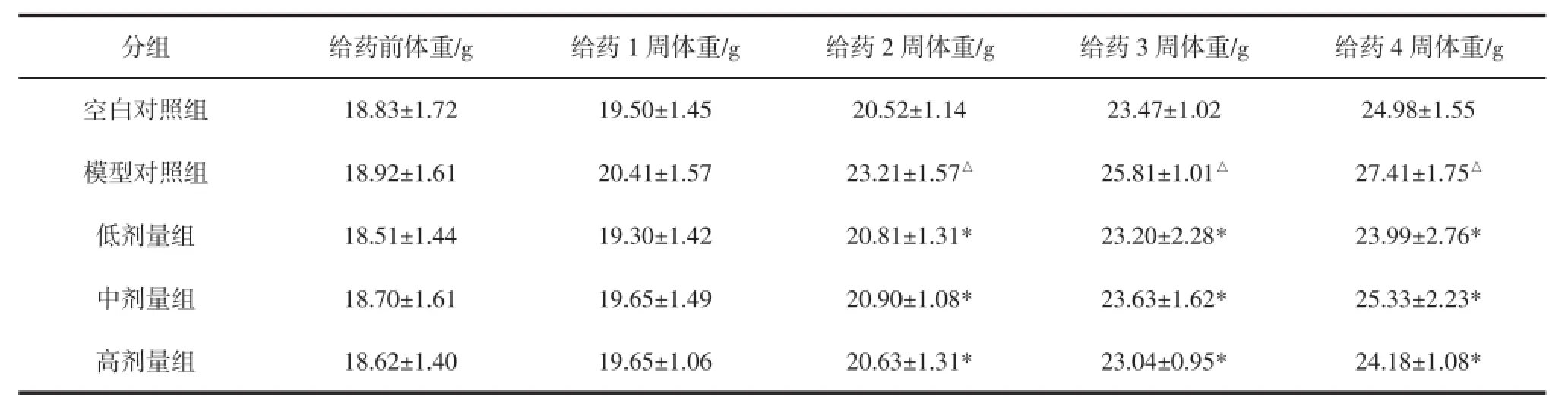
表1 杜仲叶乙醇提取物对肥胖小鼠体重的影响(,n=10)Table 1 Effect of ethanol extract of Eucommia ulmoides leaves on body weight levels in obese mice(,n=10)
注:△表示模型对照组与空白对照组比较,有显著性差异(P<0.05);*表示剂量组与模型对照组比较,有显著性差异(P<0.05)。
分组 给药前体重/g 给药1周体重/g 给药2周体重/g 给药3周体重/g 给药4周体重/g空白对照组 18.83±1.72 19.50±1.45 20.52±1.14 23.47±1.02 24.98±1.55模型对照组 18.92±1.61 20.41±1.57 23.21±1.57△ 25.81±1.01△ 27.41±1.75△低剂量组 18.51±1.44 19.30±1.42 20.81±1.31* 23.20±2.28* 23.99±2.76*中剂量组 18.70±1.61 19.65±1.49 20.90±1.08* 23.63±1.62* 25.33±2.23*高剂量组 18.62±1.40 19.65±1.06 20.63±1.31* 23.04±0.95* 24.18±1.08*
如表1所示,模型对照组与空白对照组比较,从给药第2周开始,小鼠体重显著高于空白对照组,说明营养饲料具有显著增重作用。各剂量组与模型对照组比较,低剂量、中剂量组与高剂量组给药前体重均无差异显著性(P>0.05);从给药第2周开始,杜仲叶乙醇提取物各剂量组均可以降低肥胖小鼠的体重,与模型对照组比较,有显著性差异(P<0.05)。
2.2杜仲叶乙醇提取物对肥胖小鼠饮水量、摄食量、食物利用率的影响
杜仲叶乙醇提取物对肥胖小鼠饮水量、摄食量、食物利用率的影响见表2。
表2 杜仲叶乙醇提取物对肥胖小鼠饮水量、摄食量、食物利用率的影响(,n=10)Table 2 Effect of ethanol extract of Eucommia ulmoides leaves on water intake,food intake and food utilization in obese mice(,n=10)
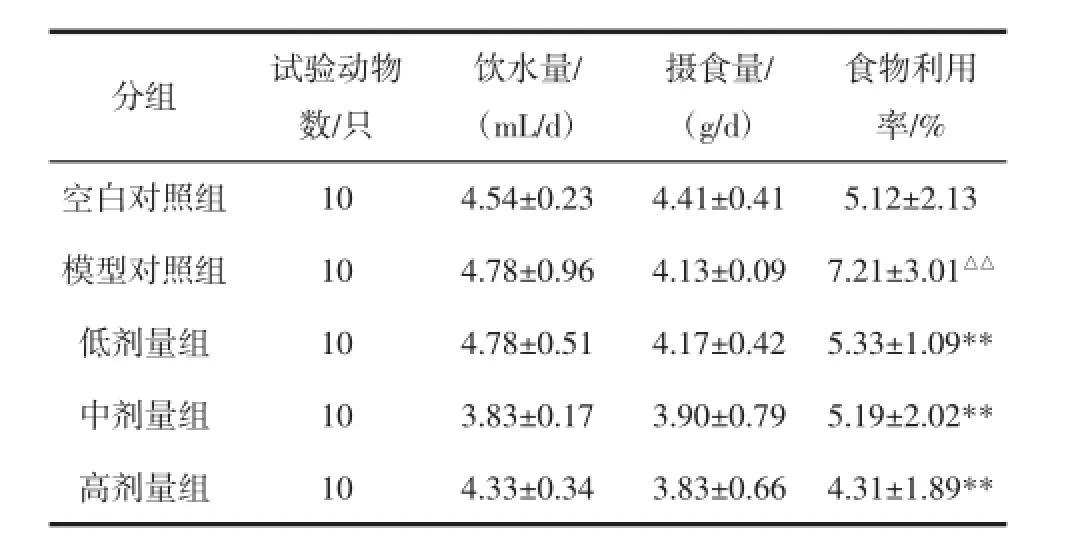
表2 杜仲叶乙醇提取物对肥胖小鼠饮水量、摄食量、食物利用率的影响(,n=10)Table 2 Effect of ethanol extract of Eucommia ulmoides leaves on water intake,food intake and food utilization in obese mice(,n=10)
注:△△表示模型对照组与空白对照组比较,有极显著性差异(P<0.01);**表示剂量组与模型对照组比较,有极显著性差异(P<0.01)。
食物利用率/%空白对照组 10 4.54±0.23 4.41±0.41 5.12±2.13模型对照组 10 4.78±0.96 4.13±0.09 7.21±3.01△△低剂量组 10 4.78±0.51 4.17±0.42 5.33±1.09**中剂量组 10 3.83±0.17 3.90±0.79 5.19±2.02**高剂量组 10 4.33±0.34 3.83±0.66 4.31±1.89**分组 试验动物数/只饮水量/(mL/d)摄食量/(g/d)
如表2所示,模型对照组与空白对照组比较,每日平均饮水量与摄食量均无显著性差异(P>0.05),而食物利用率显著高于空白对照组(P<0.01)。另外,杜仲叶乙醇提取物高、中、低剂量组分别与模型对照组比较,每日平均饮水量与摄食量均无显著性差异(P>0.05);而杜仲叶乙醇提取物高、中、低剂量组的食物利用率均低于模型对照组,有极显著性差异(P<0.01)。
2.3杜仲叶乙醇提取物对肥胖小鼠体脂重量、脂/体比、Lee's指数的影响
杜仲叶乙醇提取物对肥胖小鼠体脂重量、脂/体比、Lee's指数的影响见表3。
如表3所示,模型对照组与空白对照组比较,模型对照组的体脂重量、脂/体比和Lee's指数均显著高于空白对照组(P<0.05),表明营养性肥胖模型建立成功;另外,杜仲叶乙醇提取物高、中、低剂量组分别与模型对照组比较,杜仲叶乙醇提取物均可降低体脂重量、脂/体比和Lee's指数,均有显著性差异(P<0.05)。
表3 杜仲叶乙醇提取物对肥胖小鼠体脂重量、脂/体比、Lee's指数的影响(,n=10)Table 3 Effect of ethanol extract of Eucommia ulmoides leaves on fat tissue weight,fat tissue index and Lee's index in obese mice(,n=10)
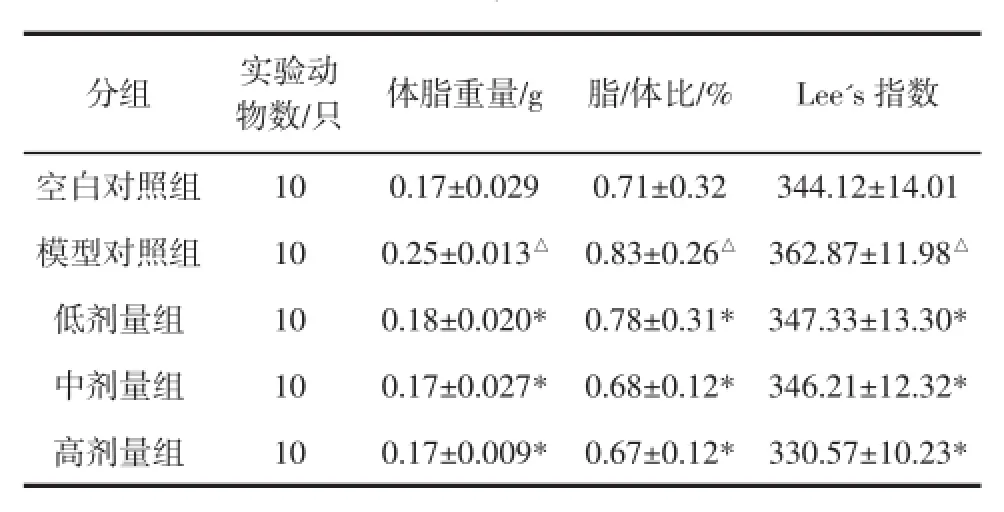
表3 杜仲叶乙醇提取物对肥胖小鼠体脂重量、脂/体比、Lee's指数的影响(,n=10)Table 3 Effect of ethanol extract of Eucommia ulmoides leaves on fat tissue weight,fat tissue index and Lee's index in obese mice(,n=10)
注:△表示模型对照组与空白对照组比较,有显著性差异(P<0.05);*表示剂量组与模型对照组比较,有显著性差异(P<0.05)。
分组 实验动物数/只 体脂重量/g 脂/体比/% Lee's指数空白对照组 10 0.17±0.029 0.71±0.32 344.12±14.01模型对照组 10 0.25±0.013△ 0.83±0.26△ 362.87±11.98△低剂量组 10 0.18±0.020* 0.78±0.31* 347.33±13.30*中剂量组 10 0.17±0.027* 0.68±0.12* 346.21±12.32*高剂量组 10 0.17±0.009* 0.67±0.12* 330.57±10.23*
3 结论
本文利用杜仲叶乙醇提取物对营养性肥胖小鼠进行了减肥功能的研究,结果表明,试验组的体重和脂/体比低于模型对照组,差异有显著性,并且摄食量不显著低于模型对照组,依据《保健食品检验与评价技术规范》可判定该杜仲叶乙醇提取物具有减肥功能作用。另外,研究人员利用杜仲叶提取物对肥胖性仓鼠、大鼠进行了减肥降脂功能的试验,结果均表明,杜仲叶提取物具有良好的减肥功能[11-12]。本研究与Hirata T,Choi M S等的研究结论基本一致。
超重和肥胖通常采用的治疗措施较多,但是饮食疗法、运动疗法、行为疗法经常发生效果不佳或复发率高,另外,目前许多减肥功能食品和药物毒副作用较大,如奥利司他是目前全球唯一的OTC减肥药,虽然是一种相对较安全的减肥药物,但是使用后经常引起胃肠排气增多,大便紧急感,脂肪性大便,脂肪泻,大便次数增多和大便失禁等不良反应[13-14]。在中药减肥药物及功能食品中常以泻下药如决明子、番泻叶、大黄等为主要原料,由于含有蒽醌及其苷类化合物,服用后经常出现腹泻,长期或大剂量使用对胃肠、肝脏、肾脏等脏器有毒性,甚至有三致作用[15-18]。而杜仲与杜仲叶提取物属无毒级,安全性极高[19-20]。因此,杜仲叶提取物可作为功能食品的功效成分生产制备安全、有效减肥功能类保健食品,为杜仲叶有关的功能食品开发提供重要参考。另外,目前,有关杜仲叶提取物减肥的物质基础的研究报道很少,可能与其主要活性成分绿原酸有关[21],杜仲叶提取物减肥的物质基础与其减肥作用机制有待后续进一步研究。
[1]杜松明,李艳平,房红芸,等.不同类型肥胖与心血管疾病危险因素关联的比较[J].中华流行病学杂志,2010,31(6):626-632
[2]Langenberg C,Sharp S J,Schulze M B,et al.Long-term risk of incident type 2 diabetes and measures of overall and regional obesity: the EPIC-InterAct case-cohort study[J].PLoS Medicine,2012,9(6): e1001230
[3]Antonios S K,Metsios G S,Koutedakis Y,et al.Obesity in rheumatoid arthritis[J].Rheumatology,2011,50(3):450-462
[4]Renehan A G,Tyson M,Egger M,et al.Body-mass index and incidence of cancer:a systematic review and meta-analysis of prospective observational studies[J].Lancet,2008,371(9612):569-578
[5]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:154
[6]He X,Wang J,Li M,et al.Eucommia ulmoides Oliv.:Ethnopharmacology,phytochemistry and pharmacology of an important traditional Chinese medicine[J].Journal of Ethnopharmacology,2014,151(1): 78-92.
[7]Yuan T Y,Fang L H,Lv Y,et al.Advance in study on pharmacological effect of Eucommiae Folium[J].Zhongguo Zhong Yao Za Zhi,2013,38(6):781-785
[8]中华人民共和国卫生部.保健食品检验与评价技术规范[M].北京:人民卫生出版社,2003:81-83
[9]吴建璋,杨子明,颜小捷,等.L-阿拉伯糖对营养性肥胖大鼠的减肥作用研究[J].食品研究与开发,2012,33(5):181-183
[10]李彩君,操红缨,刘静,等.黄精对营养性肥胖小鼠的减肥作用研究[J].时珍国医国药,2013,24(1):99-100
[11]Hirata T,Kobayashi T,Wada A,et al.Anti-obesity compounds in green leaves of Eucommia ulmoides[J].Bioorganic&Medicinal Chemistry Letters,2011,21(6):1786-1791
[12]Choi M S,Jung U J,Kim H J,et al.Du-zhong(Eucommia ulmoides Oliver)Leaf Extract Mediates Hypolipidemic Action in Hamsters Fed a High-Fat Diet[J].The American Journal of Chinese Medicine,2008,36(1):81-93
[13]Filippatos T D,Derdemezis C S,Gazi I F,et al.Orlistat-associated adverse effects and drug interactions:a critical review[J].Drug Safety,2008,31(1):53-65
[14]马微,付丽,王海波,等.新型减肥药奥利司他的研究进展[J].华西药学杂志,2009,24(4):431-433
[15]Qin Y,Wang J B,Kong W J,et al.The diarrhoeogenic and antidiarrhoeal bidirectional effects of rhubarb and its potential mechanism[J].Journal of Ethnopharmacology,2011,133(3):1096-1102
[16]Annabella V,Francesca M I,Roberto R,et al.Surveillance of suspected adverse reactions to herbal products used as laxatives[J].European Journal of Clinical Pharmacology,2012,68(3):231-238
[17]周宇红,汪会玲,杨华,等.决明子亚慢性毒性病理实验[J].毒理学杂志,2005,19(3):265-266
[18]李荣群,张跃明,余道军,等.番泻叶提取物的急性毒性实验研究[J].现代中西医结合杂志2008,17(6):820-822
[19]刘月凤,龚朋飞,袁慧,等.杜仲提取物的急性毒性试验研究[J].陕西农业科学,2009,55(3):52-52
[20]隋海霞,高苋,徐海滨,等.杜仲的快速毒性筛选试验[J].癌变·畸变·突变,2004,16(6):355-358
[21]李文娜,肖苑,黄燮南,等.杜仲叶绿原酸提取物对大鼠的减肥作用机制[J].中国临床药理学杂志,2012,28(7):534-535,538
Assessment of Extract of Eucommia ulmoides Leaves on Weight Loss Function
ZHENG Hong-xing1,2,XIANG Hui1,ZHANG Zhi-jian1,2,QI Shan-shan1,LIU Jing1,YANG Xing1
(1.School of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong 723000,Shaanxi,China;2.Shaanxi Province Black Organic Food Engineering Technology Research Center,Hanzhong 723000,Shaanxi,China)
To develop health food of Eucommia leaf extract,the weight loss function was studied.Taking ethanol extracts of Eucommia ulmoides leaves as tested drug,50 kunming mice were randomly divided into five groupsfor 10 animalsin each group:blank control group,model group,and high dose group(600 mg/kg·BW),middle dose group(300 mg/kg·BW)and low dose group(150 mg/kg·BW).Three dose group and model group were fed with high fat food,and the blank control group was given basal food.Water intake,food intake and body weight of every animal was measured during the feeding period for 30 days.Body weight and body fat of mices were weighted at the end of experiment,and fat/body weight ratio,food utilization and Lee's index.The weight and fat/body ratio of every dose group was significantly lower than the model group,and food intake wasn't significantly lower than the model control group.This experiment showed that ethanol extract of Eucommia ulmoides leaves has a weight loss function.
Eucommia ulmoides leaves;ethanol extract;alimentary obesity;weight loss;function;assessment
10.3969/j.issn.1005-6521.2016.13.040
陕西理工学院人才启动项目(SLGQD14-01);陕西省教育厅项目(2013JK0721)
郑红星(1981—),男(汉),讲师,博士,研究方向:功能食品的研究与开发。
2015-06-12
