地参多糖抗氧化活性的研究
2016-09-01王文净高春燕大理大学公共卫生学院云南大理671003
王文净,高春燕(大理大学公共卫生学院,云南大理671003)
地参多糖抗氧化活性的研究
王文净,高春燕*
(大理大学公共卫生学院,云南大理671003)
采用水提醇沉法提取2个采收地3个采收期的地参多糖,并采用硫酸-苯酚法测定其多糖含量;通过DPPH自由基清除活性、FRAP和对亚硝酸盐的清除作用评价了地参多糖的抗氧化活性。结果表明,地参多糖得率范围为28.40 g/100 g~42.20 g/100 g,且随着采收期的延后,呈现先升高后降低的趋势;地参多糖含量范围为16.95 g/100 g DW~31.61 g/100 g DW,且在整个采收过程中,不同采收地的地参其多糖含量变化不同;地参多糖具有较强的抗氧化活性,对DPPH自由基的清除率范围为68.34%~76.38%,铁还原抗氧化能力范围为122.75 μmol Fe(II)/g~239.00 μmol Fe(II)/g,对亚硝酸盐的清除率范围为58.82%~87.37%;且同一抗氧化体系中,不同采收地的地参在整个采收过程中其抗氧化活性的变化不同;不同采收地的地参,在不同的抗氧化体系中,随着采收期的延后其变化也不同。
地参;多糖;抗氧化活性
1 材料与方法
1.1材料与仪器
地参:分别于2013年11月19日(T1)、2013年12月22日(T1)和2014年1月25日(T3)采于云南省剑川县沙溪镇四联村(S1)和鳌凤村(S2),真空冷冻干燥备用;1,1-二苯基-2-苦苯肼自由基(DPPH·):美国sigma公司;2,4,6-三(2-吡啶基)-1,3,5-三嗪(TPTZ):FLUKA公司;葡萄糖、浓硫酸,硫酸亚铁、三氯化铁、冰乙酸、氯化钠、对氨基苯磺酸、亚硝酸钠等试剂均为分析纯。
RE-52A型旋转蒸发仪:上海亚东生化仪器厂;FD-1型冷冻干燥机:北京博医康技术有限公司;WFJ2000型可见分光光度计:尤尼柯(上海)仪器有限公司。
1.2方法
1.2.1地参多糖的提取
参照陈贵元等[13]的方法,并稍作修改。精密称取地参粉末5.0 g,加蒸馏水75 mL,80℃水浴提取3 h,抽滤,滤液加水重复提取1次,合并提取液,旋转蒸发至15 mL左右,加入3倍体积95%乙醇,放入4℃冰箱醇沉24 h;待醇沉结束,除去上清液,取其沉淀,用95%乙醇、无水乙醇、丙酮依次洗3次,冷冻干燥,即得地参多糖精制粗品,按下式计算多糖得率。
精思的关键是善于提出问题和解决问题。读书的时候,要用脑子把作者的观点过滤一遍,提出有疑虑的地方,然后千方百计地解决疑问。这个过程能使我们在学习前人的基础上,取得发展和进步。
多糖得率/%=多糖质量/原料质量×100
1.2.2地参多糖含量的测定
按文献[14]采用硫酸-苯酚法进行测定,以配制好的葡萄糖标准溶液(100 μg/mL)做标准曲线,得回归方程为y=7.658 9x-0.103 7,相关系数R2=0.999 3,多糖含量以g/100 g DW表示。
1.2.3抗氧化活性的测定
1.2.3.1地参多糖清除DPPH自由基能力测定
分别吸取2 mL地参多糖溶液(2.0 mg/mL)与2 mL DPPH乙醇溶液(60 μmol/L)混合,于室温暗室放置15 min后,在517 nm下测定吸光度值。各试样对DPPH自由基清除率用下式计算:
DPPH自由基清除率/%=[1-(M2-M1)/M0]×100
式中:M0为2 mL乙醇+2 mL DPPH溶液的吸光度值;M1为2 mL样品溶液+2 mL甲醇的吸光度值;M2为2 mL样品溶液+2 mL DPPH溶液的吸光度值。
1.2.3.2铁还原抗氧化能力的测定
将TPTZ用40 mmol/L HCl配制成10 mmol/L溶液,然后与新鲜配制的0.3 mol/L乙酸纳缓冲液,20 mmol/L FeCl3·6H2O,以1∶10∶1(体积比)的比例混合制成FRAP工作液,使用之前于37℃水浴中保温30 min。将0.1mL试样,1.4mL FRAP工作液,2mL蒸馏水混合,并于37℃水浴中保温30min,之后于593nm下测定吸光度值。以FeSO4·7H2O做标准曲线(100μmol/L~1 000 μmol/L),得回归方程为y=0.000 6x+0.011 8,相关系数R2=0.998 0。地参多糖铁还原抗氧化能力以μmol Fe(II)/g表示。
1.2.3.3地参多糖对亚硝酸盐清除作用研究
参照郭小鹏等[15]方法,稍作修改。准确称取50 mg的地参多糖置于50 mL容量瓶中,加入25 mL模拟胃液,用超声辅助增溶,37℃预热10 min,再加入5 μg/mL亚硝酸钠溶液2 mL,然后把混合物置于37℃水浴锅中避光反应30 min;加入0.4%对氨基苯磺酸2 mL,摇匀静置5 min;再加入0.2%盐酸萘基乙二胺显色剂1 mL,摇匀加水定容,静置15 min后,在可见光538 nm下测各溶液的吸光值,按以下公式计算地参多糖对NO2-的清除率:
清除率/%=(A-A0)/A
式中:A为未加样液的吸光度值;A0为加提取液后的吸光度值。
1.3数据处理
2 结果与讨论
2.1地参多糖得率及含量
地参多糖得率及含量结果见表1。
由表1可以看出,S1和S2采收的地参,随着采收期的延后,多糖得率都呈现先升高后降低的趋势;而多糖含量不同采收地在整个采收过程中其变化不同;S1采收的地参,随着采收期的延后,多糖含量呈现先升高后降低的趋势;而S2采收的地参,随着采收期的延后,多糖含量没有显著性的差异。表明同不同采收地点对地参生长发育过程中多糖的合成与代谢具有显著的影响。糖类的合成主要通过光合作用[16],因此光照强度直接影响植物体内糖类的合成与代谢;已有报道,在低温条件下,植物体内与糖类的合成与代谢相关的酶发生变化,而导致植物体内糖的积累改变[17];K、Zn等矿物质元素对植物体内糖类的合成与代谢也有显著影响,而植物体内矿物质元素的含量与土壤中的含量密切相关[18-19];此外,田间管理如灌溉、施肥等也会影响植物体内糖类的合成与代谢。因此,不同采收地的地参在采收过程中多糖的变化是光照、温度、土壤中矿物质元素含量、田间管理等共同作用的结果。

表1 地参多糖得率及含量Table 1 Yield and content of polysaccharide from L.lucidus Turcz.
2.2地参抗氧化活性
采用DPPH自由基、铁还原力和亚硝酸盐清除活性3种体系评价了地参多糖的抗氧化活性,结果见表2。

表2 地参多糖抗氧化活性Table 2 Antioxidant activity of polysaccharide from lycopus lucidus Turcz.
由表2中数据可以看出,2 mg/mL地参多糖对DPPH自由基具有一定的清除活性。除了S2地TI采收的地参,其他地参多糖样品对DPPH自由基的清除活性均超过了70%,其中以S1地T2采收的地参清除率最高,达到76.38%;铁还原抗氧化能力体系中,各地参多糖样品均表现出了一定的铁还原力,其中以S2地T3采收的地参为最低,S2地T1采收的地参为最高;亚硝酸盐清除体系中,各地参多糖样品均对亚硝酸盐均有一定的清除作用,其中以S2地T2采收的地参为最低,S1地T1采收的地参为最高,且整体上而言,S1地采收的地参对亚硝酸盐的清除作用强于S2地。
由表2中数据可以看出,同一抗氧化体系中,不同采收地的地参在整个采收过程中其抗氧化活性的变化不同,如在FRAP体系中,S1采收的地参其铁还原力随着采收期的延后呈现先升高后降低的趋势,而S2地采收的地参呈现出不断降低的趋势;此外,S1采收的地参,在不同的抗氧化体系中随着采收期的延后其变化相同,都呈现出先升高后降低的趋势;而S2采收的地参在不同的抗氧化体系中随着采收期的延后其变化存在差异,如在DPPH自由基清除体系中呈现逐渐升高的趋势,而在FRAP体系中呈现出逐渐降低的趋势。多糖单糖的组成、结构的差异导致其抗氧化活性不同。不同采收地地参多糖抗氧化活性的差异可以归功于其多糖单糖的组成以及结构的差异。另外,多糖提取物中的非糖类物质可能也具有一定的抗氧化活性,对于不同采收地地参多糖抗氧化活性的差异也具有一定的贡献。
2.3相关性分析
对地参多糖含量与抗氧化活性以及不同抗氧化体系之间进行了相关性分析,结果见表3。
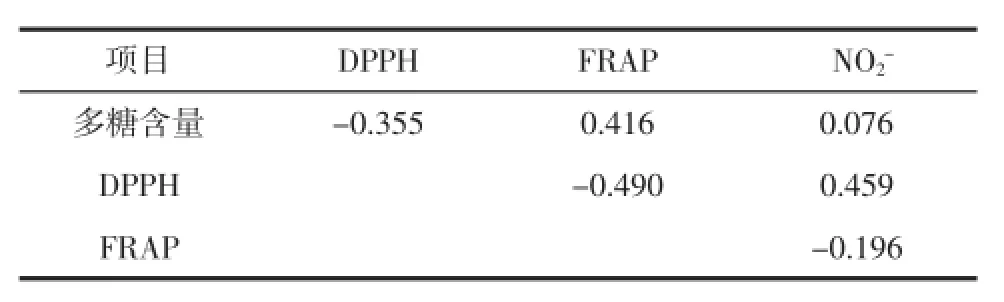
表3 相关性分析Table 3 Correlational analyses
由表3中数据可以看出,地参多糖含量与抗氧化活性无显著相关性,表明多糖提取物中的非糖类成分对抗氧化活性也具有一定的贡献;此外,由于抗氧化体系反应机理的差异,不同抗氧化体系之间也无显著的相关性。
3 结论
2个不同采收地3个不同采收期的地参,其多糖得率范围为28.40 g/100 g~42.20 g/100 g,且随着采收期的延后,呈现先升高后降低的趋势;地参多糖含量范围为16.95 g/100 g DW~31.61 g/100 g DW,且在整个采收过程中,不同采收地的地参其变化不同;地参多糖具有较强的抗氧化活性,对DPPH自由基的清除率范围为68.34%~76.38%,铁还原抗氧化能力范围为122.75 μmol Fe(II)/g~239.00 μmol Fe(II)/g,对亚硝酸盐的清除率范围为58.82%~87.37%;且同一抗氧化体系中,不同采收地的地参在整个采收过程中其抗氧化活性的变化不同;不同采收地的地参,在不同的抗氧化体系中,随着采收期的延后其抗氧化活性的变化也不同。
[1]罗孟禹,董开居.浅析名特珍稀野菜地参种植与开发[J].中国野生植物资源,2006,25(5):64-65
[2]许泳吉,钟惠民,杨波,等.野生植物地参中营养成分的测定[J].光谱实验室,2003,20(4):528-530
[3]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:558-559
[4]张荣平,周宁娜,罗天浩,等.地参中氨基酸、粗蛋自和元素分析[J].中医药研究,1998,14(5):52-53
[5]许泳吉,钟惠民,杨波,等.野生植物地参中营养成分的测定[J].光谱实验室,2003,20(4):528-529
[6]周宁娜,杨秀英,淤泽溥,等.地参的急性毒性和部分药效学实验[J].云南中医学院学报,1998,21(1):6-11
[7]熊伟,陈贵元,谭德勇,等.野生地参多糖对四氧嘧啶致糖尿病小鼠血糖和血脂的影响[J].生物加工过程,2011,9(6):45-48
[8]熊伟,焦扬,罗永会,等.地参多糖对实验肿瘤细胞体内外增殖的影响[J].生物加工过程,2012,10(4):64-69
[9]林春榕,左绍远,熊伟,等.地参多糖对D-半乳糖所致衰老小鼠的抗氧化作用研究[J].安徽农业科学,2012,40(18):9646-9647
[10]熊伟,谭德勇,陈贵元,等.地参多糖对正常及实验性糖尿病小鼠血糖的影响实验研究[J].生命科学仪器,2010,8(10):64-66
[11]熊伟,陈贵元,谭德勇,等.野生地参多糖对四氧嘧啶致糖尿病小鼠血糖和血脂的影响[J].生物加工过程,2011,9(6):45-48
[12]熊伟,焦扬,罗永会,等.地参多糖对实验肿瘤细胞体内外增殖的影响[J].生物加工过程,2012,10(4):64-69
[13]陈贵元,张翠香,罗永会,等.地参多糖的提取工艺研究[J].中国实验方剂学杂志,2011,21(11):38-40
[14]李芙蓉,吕博.刺五加多糖的微波提取及含量测定[J].新疆中医药,2003(1):11-12
[15]郭小鹏,田呈瑞,高春燕,等.黄参粗多糖脱蛋白工艺以及对亚硝酸盐清除作用的研究[J].食品工业科技,2011(2):274-276
[16]罗玉.植物中的糖代谢及其相关酶[J].文山师范高等专科学校学报,2004,17(2):155-159
[17]孙永梅,刘丽杰,冯明芳,等.植物在低温胁迫下的糖代谢研究进展[J].东北农业大学学报,2015,46(7):95-102
[18]柳洪鹃,史春余,张立明,等.钾素对食用型甘薯糖代谢相关酶活性的影响[J].植物营养与肥料学报,2012,18(3):724-732
[19]肖蕊.缺锌对苹果树生长和生理指标的影响[J].福建农业,2014(8):12-13
Antioxidant Activity of Polysaccharide from Lycopus lucidus Turcz.
WANG Wen-jing,GAO Chun-yan*
(College of Public Health,Dali University,Dali 671003,Yunnan,China)
The polysaccharide of Lycopus lucidus Turcz.harvested form two sites and three periods were obtained through hot water extraction and ethanol precipitation.The polysaccharide content was determined by Folin-phenol method.The antioxidant activity of L.lucidus Turcz.polysaccharide was evaluated by DPPH radical scavenging activity,FRAP and nitrite scavenging effect.The results showed that the polysaccharide yield of L.lucidus Turcz.was in range of 28.40 g/100 g to 42.20 g/100 g,which was first increased and then decreased with the harvest time delayed.The polysaccharide content of L.lucidus Turcz.was in range of 16.95 g/100 g DW to 31.61 g/100 g DW,and their changes were various in the period of harvest.The polysaccharide of L.lucidus Turcz.possesed higher antioxidant activity.The DPPH radical scavenging capacity,FRAP value and nitrite scavenging effect ranged from 68.34%to 76.38%,122.75μmol Fe(II)/g to 239.00 μmol Fe(II)/g and 58.82% to 87.37%,respectively.In the same antioxidant system,the antioxidant activity of L.lucidus Turcz.polysaccharide obtained from different sites were discrepant in the period of harvest.The antioxidant activity of L.lucidus Turcz.polysaccharide obtained from different sites were varoius in different antioxidant system in the period of harvest.
Lycopus lucidus Turcz.;polysaccharide;antioxidant activity
10.3969/j.issn.1005-6521.2016.13.005
大理大学博士科研启动费(KYBS201303)
王文净(1986—),女(汉),在读硕士研究生,研究方向:营养与慢性疾病。
高春燕(1981—),女,副教授,博士,硕士生导师,主要从事植源性食品资源开发与利用的研究。
2016-04-13
