香菇中多糖含量测定方法的比较研究
2016-09-01周勇易延逵杨晓敏李亚平无限极中国有限公司广东广州50665南方医科大学广东广州5055
周勇,易延逵,杨晓敏,李亚平(.无限极(中国)有限公司,广东广州50665;.南方医科大学,广东广州5055)
香菇中多糖含量测定方法的比较研究
周勇1,易延逵2,*,杨晓敏2,李亚平2
(1.无限极(中国)有限公司,广东广州510665;2.南方医科大学,广东广州510515)
采用苯酚-硫酸法、蒽酮-硫酸法测定香菇中多糖含量,考察二种方法的线性关系,重复性,精密度,稳定性、准确度。香菇中多糖采用苯酚-硫酸法、蒽酮-硫酸法测定结果接近,二种方法的线性关系、重复性、精密度、稳定性均较好,回收率平均值均在95%~105%之间。本试验为香菇中多糖含量测定方法的选择提供了试验依据。
香菇;多糖;含量测定;苯酚-硫酸法;蒽酮-硫酸法
香菇为真菌类担子菌纲伞菌目伞菌科香蕈[Lentinus edodes(Berk.)Sing],的干燥子实体。性甘,平。功能益气不饥,治风破血,化痰理气,益味助食,经常食用可以预防人体因缺乏VD引起的血磷和血钙代谢的障碍后所患的佝偻病,预防人体各种粘膜及皮肤的炎症,预防身体衰弱、毛细血管破裂,牙床以及腹腔出血等。香菇主要含VD原(麦角甾醇)、VB(2核黄素)、V(C抗坏血酸)、腺嘌呤香茹精等等;孢子还含甘露醇、海藻糖(trehalose)[1-2]。
香菇多糖是香菇中重要的活性成分,香菇多糖近年来发现具有(β~1,3葡聚糖)增强细胞免疫能力,从而抑制癌细胞的生长,抗病毒,抗肝炎作用[3]。中华人民共和国农业行业标准NY/T1676-2008《食用菌中粗多糖含量的测定》关于食用菌粗多糖含量的测定中采用苯酚硫酸法建立多糖的含量测定方法,为此我们采用苯酚-硫酸法、蒽酮-硫酸法测定香菇中多糖含量,对结果进行比较研究。
1 材料
1.1原料与试剂
香菇购自广州市药材公司,经南方医科大学中药鉴定教研室鉴定为伞菌科香蕈Lentinus edodes(Berk.)Sing的干燥子实体。
葡萄糖(批号:130529,由广州市齐云生物科技有限公司提供);水为重蒸水;其它试剂均为分析纯。
1.2仪器设备
UV-2401可见紫外分光光度仪:日本岛津;电子天平(0.01 g):上海佑科;BS-llOS电子天平(0.001 g):德国Sartorius公司;XY-600B多功能粉碎机:永康市小宝电器有限公司;KH-100DE型数控超声仪:昆山禾创超声仪器有限公司;KH-100DE型数控超声波清洗器:昆山禾创超声仪器有限公司;TDL-40B离心机:飞鸽牌。
2 方法与结果
2.1苯酚-硫酸法测定香菇中多糖含量[4-5]
2.1.1标准曲线的制备
萄糖对照品溶液的配制:取已干燥的无水葡萄糖10 mg,精密称定,置100 mL容量瓶中,加水适量溶解,加水至刻度,摇匀,即得(每1 mL中含无水葡萄糖0.1 mg)。
标准曲线的绘制:精密量取对照品溶液0.0、0.1、0.2、0.5、0.8、1.0、1.5 mL,分别置具塞试管中,分别加水补至2.0 mL,分别加5%的苯酚溶液1 mL,混匀,迅速加入浓硫酸5 mL,混匀,温水中恒温(50℃)反应15 min,再于冰水中冷却,终止其反应;以第一份为空白,照分光光度法(中国药典附录ⅤB),在485 nm处测定吸光度。以葡萄糖的浓度C为纵坐标,以吸光度A为横坐标进行回归处理,结果求得回归方程y=6.371 5x+ 0.012 7(浓度单位mg/2 mL),R2=0.998 9。结果见表1、图1、图2。
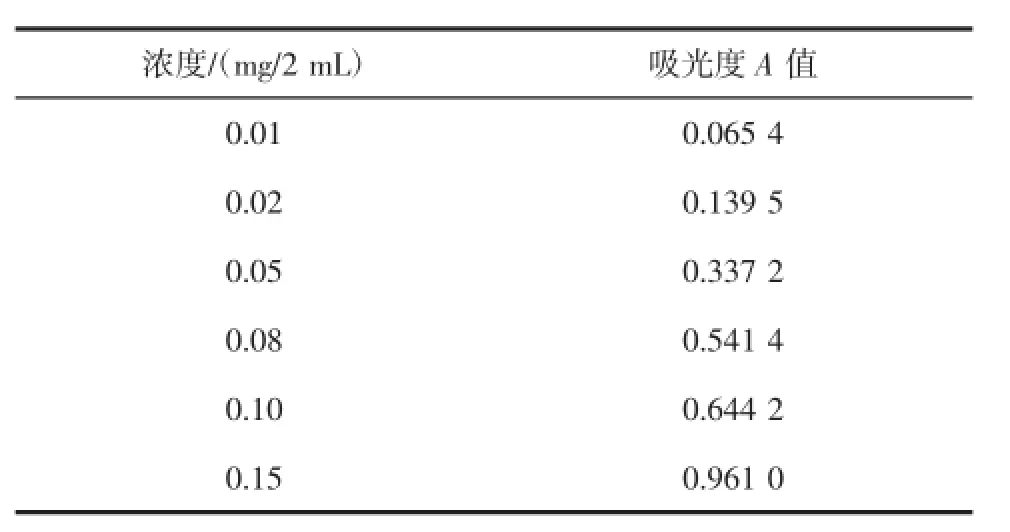
表1 线性关系考查结果Table 1 Results of linear correlation review
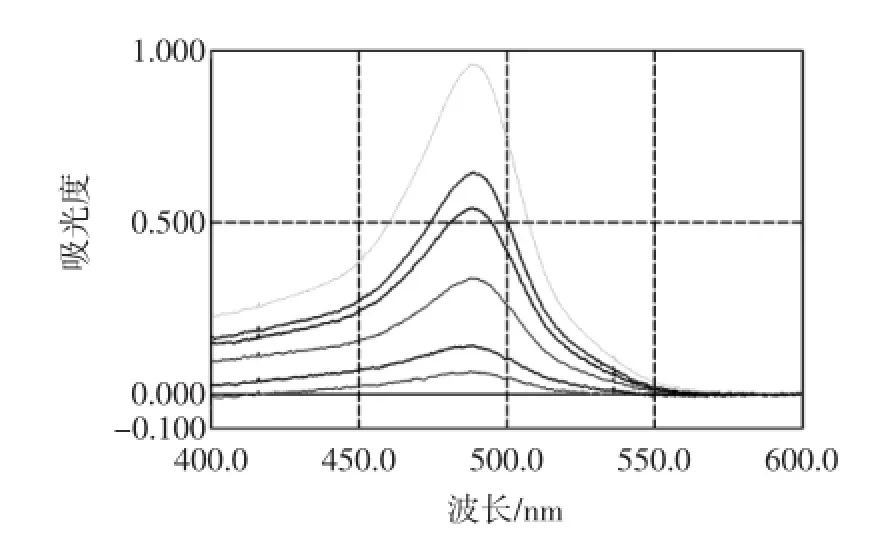
图1 葡萄糖标准曲线紫外扫描色谱图Fig.1 Amylaceum standard curve UV chromatogram
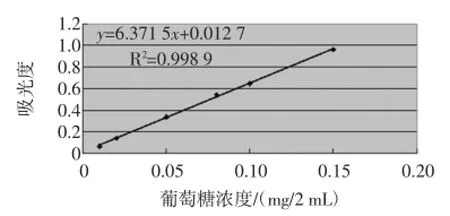
图2 葡萄糖标准曲线图Fig.2 Amylaceum standard curve diagram
2.1.2供试品溶液的制备及样品测定[6]
取香菇粗粉约0.03 g,精密称定,加水5 mL浸润样品,缓慢加入20 mL 95%乙醇,摇匀,超声提取(1 000 Hz)30 min,滤过,用少量乙醇洗涤滤器,滤渣连同滤纸置烧瓶中,加水50 mL,加热回流2 h,趁热滤过,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至100 mL量瓶中,用水稀释至刻度,摇匀,即得供试品溶液。精密量取供试品溶液2.0 mL,置具塞依法测定吸光度A,根据标准曲线计算出供试品溶液中多糖含量,计算,即得。结果见表1、图1。
2.1.3提取方法的优化
目前香菇多糖测定供试品溶液提取方法主要是提取方法的选择,为此对提取方法进行了比较研究[7-8]。
水提醇沉法:取香菇粗粉约0.1 g,精密称定,加水50 mL,加热回流2 h,趁热滤过,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至100 mL量瓶中,用水稀释至刻度,摇匀,精密量取上述样品液2mL,加乙醇10mL,搅拌,在5 000 r/min离心10 min,取沉淀加水溶解,置100 mL量瓶中,并稀释至刻度,即得供试品溶液。
醇提后水提法:取香菇粗粉约0.5 g,精密称定,加水5 mL浸润样品,缓慢加入20 mL 95%乙醇,摇匀,超声提取(1 000 Hz)30 min,滤过,用少量乙醇洗涤滤器,滤渣连同滤纸置烧瓶中,加水50 mL,加热回流2 h,趁热滤过,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至100 mL量瓶中,用水稀释至刻度,摇匀,即得供试品溶液。
取供试品溶液2 mL,加入5%苯酚水溶液1 mL,混匀,再迅速加浓硫酸5 mL,立刻混匀,温水中恒温(50℃)反应15 min,再于冰水中冷却,终止其反应;以空白调零,于485 nm波长处测定[8]。进行3次平行实验,分别计算多糖含量。结果见表2,图3。
结果表明水提醇沉法结果偏高。
2.1.4检测波长的确定
以空白为对照,对葡萄糖对照品溶液和供试品溶液在400 nm~600 nm波长范围进行扫描测定。
结果表明葡萄糖对照品溶液和供试品溶液在485 nm左右有最大吸收,故确定485 nm为香菇多糖的测定波长。
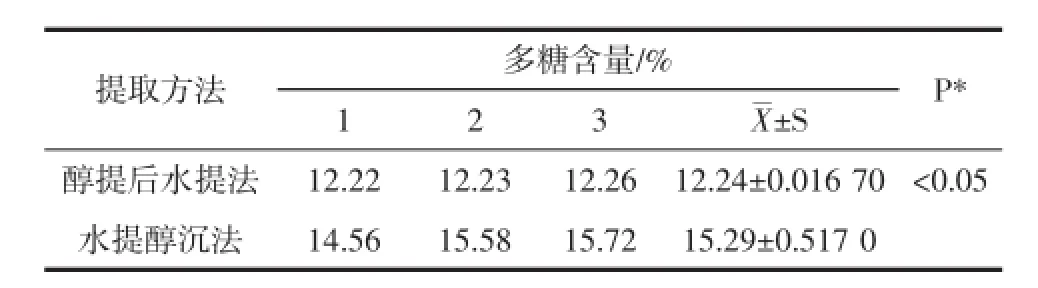
表2 提取方法优化试验结果(n=3)Table 2 Results of extracting method optimizing experiment(n=3)
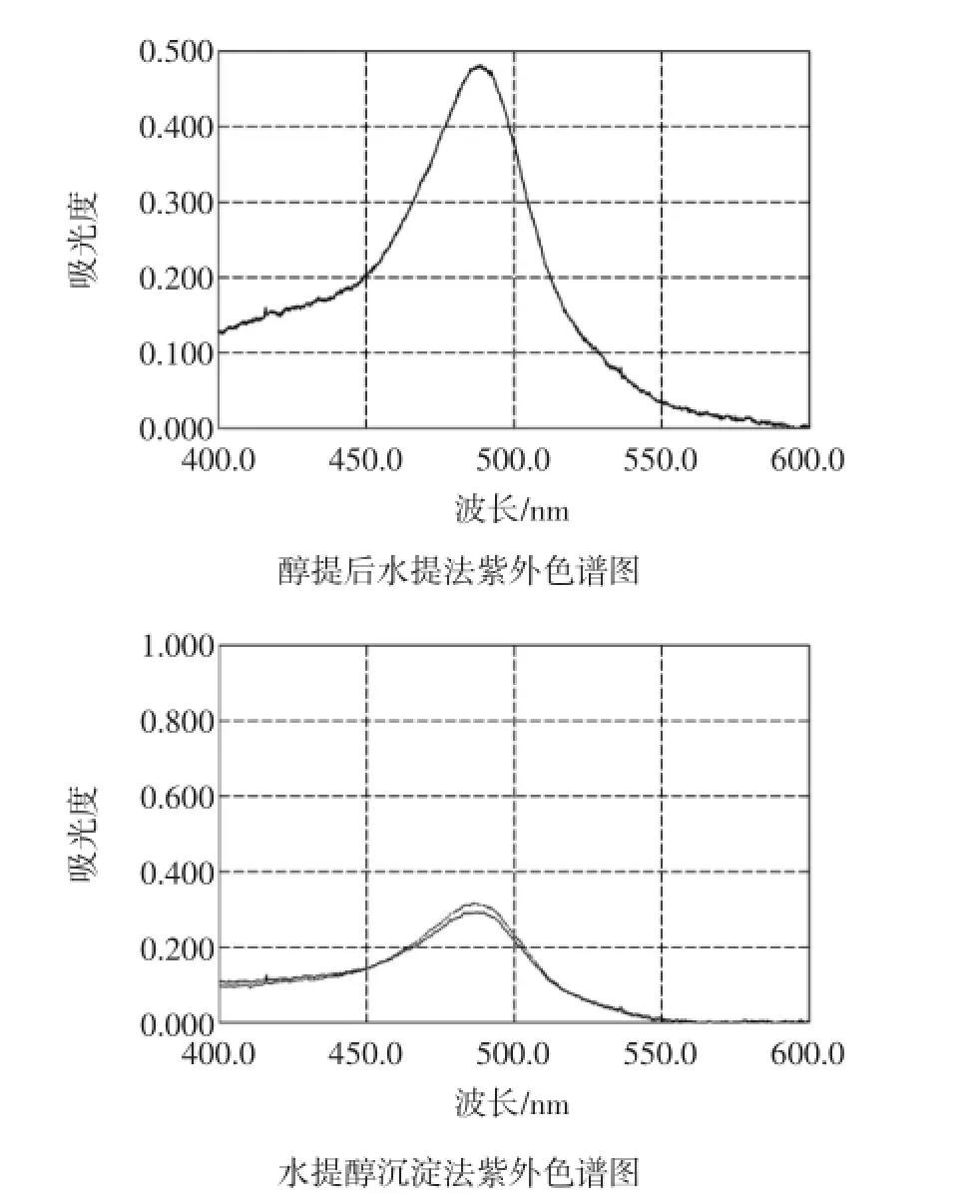
图3 提取方法优化紫外色谱图Fig.3 UV diagram of extracting method optimizing experiment
2.1.5重复性试验
按照供试品制备的方法同时制备6份供试品溶液,依法显色后分别测定其吸光度A,计算香菇多糖含量。结果重复性RSD值为1.01%。结果表明,本法重复性良好。
2.1.6精密度试验
取一份供试品溶液,依法显色后连续测定其吸光度A6次。结果精密度RSD值为0.650%。结果表明:本法精密度良好。
2.1.7稳定性试验
取一份供试品溶液,依法显色后分别在0.0、10、20、30、40、50 min测定其吸光度。结果稳定性RSD值为2.02%。结果表明,供试品溶液在1小时内吸光度值基本稳定。
2.1.8加样回收率测定
取同一批次香菇6份,精密称定,置50 mL量瓶中,分别加入1 mg/mL葡萄糖1 mL对照品适量,按供试品溶液的制备方法处理,测定,计算加样回收率。结果平均回收率为97.10%,RSD值为0.722%。
2.1.9香菇多糖含量测定
按优选的供试品溶液制备方法,取香菇依法测定。进行3次平行实验,分别计算多糖含量。结果见表4、图6。
2.2蒽酮-硫酸法测定香菇中多糖含量[9]
2.2.1标准曲线的制备
葡萄糖对照品溶液的配制:取已干燥的无水葡萄糖20 mg,精密称定,置100 mL容量瓶中,加水适量溶解,加水至刻度,摇匀,即得(每1 mL中含无水葡萄糖0.2 mg)。
标准曲线的绘制:精密量取对照品溶液0.0、0.2、0.5、1.0、1.5、2.0 mL,分别加水补至2 mL,置具塞试管中,分别加0.5%的蒽酮-浓硫酸溶液4 mL,摇匀,沸水中恒温反应15 min,再于冰水中冷却,终止其反应;以第一份为空白,照分光光度法(中国药典附录ⅤB),在615 nm处测定吸光度。以葡萄糖的浓度C为纵坐标,以吸光度A为横坐标进行回归处理,求得回归方程y= 3.105 5x-0.041 1(浓度单位mg/2 mL),R2=0.997 7,结果见表3、图4、图5。
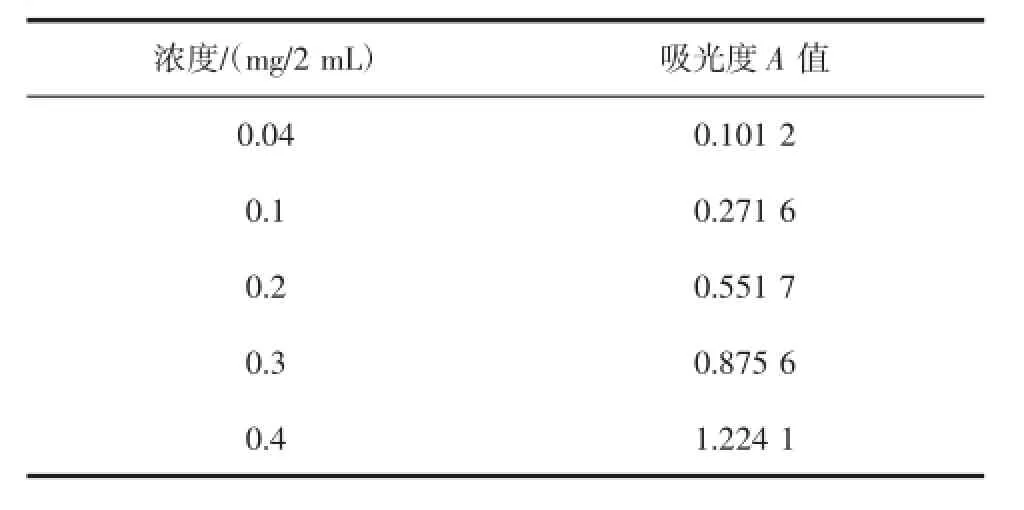
表3 线性关系考查结果Table 3 Results of linear correlation review
图4 葡萄糖标准曲线紫外扫描色谱图Fig.4 Rmylaceum standard curve UV chromatogram
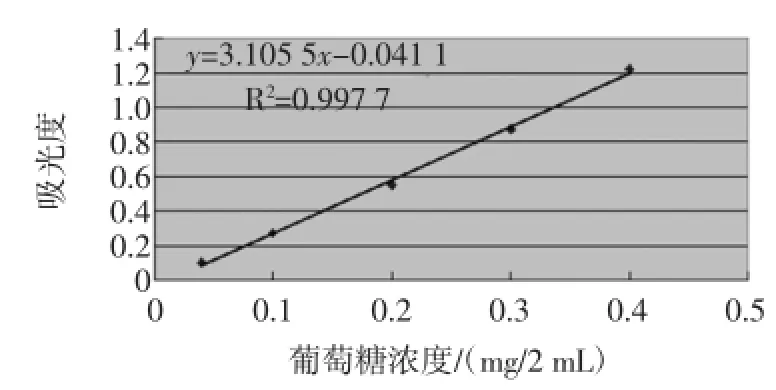
图5 葡萄糖标准曲线图Fig.5 Amylaceum standard curve diagram
2.2.2供试品溶液的制备
取香菇粗粉约0.03 g,精密称定,加水5 mL浸润样品,缓慢加入20 mL 95%乙醇,摇匀,超声提取(1 000 Hz)30 min,滤过,用少量乙醇洗涤滤器,滤渣连同滤纸置烧瓶中,加水50 mL,加热回流2 h,趁热滤过,用少量热水洗涤滤器,合并滤液与洗液,放冷,移至100 mL量瓶中,用水稀释至刻度,摇匀,即得供试品溶液。精密量取供试品溶液2.0 mL,照标准曲线的制备项下的方法,自“分别加0.5%的蒽酮-浓硫酸溶液4 mL”起,依法测定吸光度A,根据标准曲线计算出供试品溶液中多糖含量,计算,即得。
2.2.3检测波长的确定
以空白为对照,对葡萄糖对照品溶液和供试品溶液在400 nm~800 nm波长范围进行扫描测定。
结果表明葡萄糖对照品溶液和供试品溶液在615 nm左右有最大吸收,故确定615 nm为香菇多糖的测定波长。
2.2.4重复性试验
按照供试品制备的方法同时制备6份供试品溶液,依法显色后分别测定其吸光度A,计算香菇多糖含量。结果重复性RSD值为2.21%。本法重复性良好。
2.2.5精密度试验
取一份供试品溶液,依法显色后连续测定其吸光度A6次。结果精密度RSD值为1.26%。本法精密度良好。
2.2.6稳定性试验
取一份供试品溶液,依法显色后分别在0.0、10、20、30、40、60 min测定其吸光度。结果稳定性RSD值为2.61%。结果表明,供试品溶液在1 h内吸光度值基本稳定。
2.2.7加样回收率试验
加样回收率测定:取同一批次香菇6份,精密称定,置100mL量瓶中,分别加入1mL0.2mg/mL葡萄糖对照品,按供试品溶液的制备方法处理,测定,计算加样回收率。结果平均回收率为96.8%,RSD值为2.19%。
2.2.8香菇多糖含量测定
按优选的供试品溶液制备方法,取香菇依法测定。进行3次平行实验,分别计算多糖含量。结果见表4,图6。
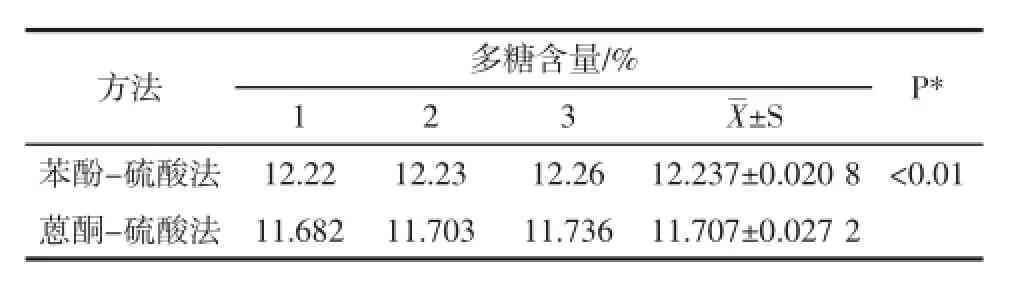
表4 香菇多糖含量测定结果Table 4 Results of Polycose of champignon content determine
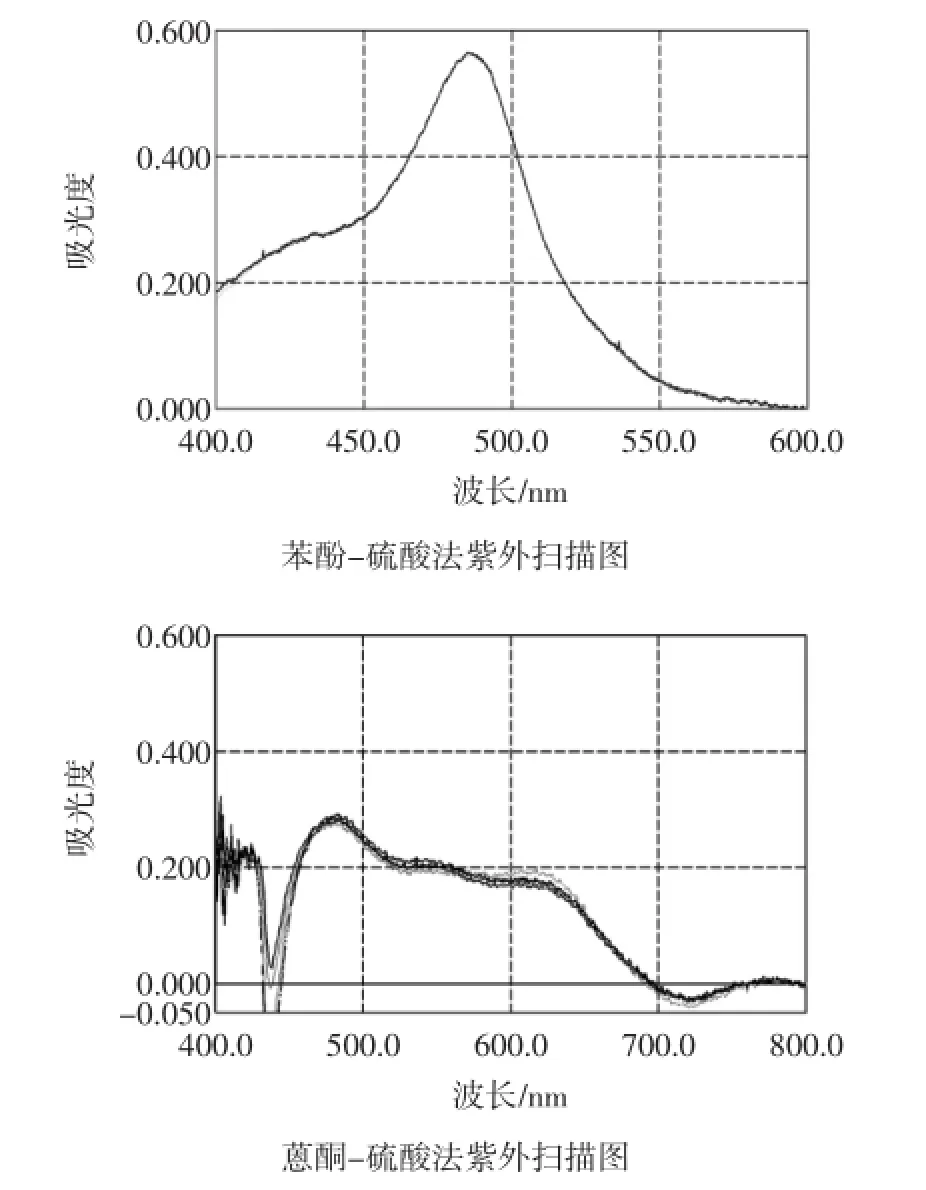
图6 香菇多糖含量测定紫外色谱图Fig.6 UV diagram of Polycose of champignon content determine
3 讨论
苯酚-硫酸法和蒽酮-硫酸法都是测定多糖的常用方法。苯酚-硫酸法是糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,其颜色深浅与糖的含量成正比,在485 nm波长左右有最大吸收峰,故而在此波长下测定。苯酚-硫酸法可用于甲基化的糖、戊糖和多聚糖的测定。蒽酮-硫酸法是糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量,蒽酮-硫酸法几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等,故应注意淀粉、纤维素的干扰;同时蒽酮-硫酸法不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。因为苯酚-硫酸法在一些方面的优势,比蒽酮-硫酸法更为常用。
本试验对同一批次的香菇采用苯酚-硫酸法和蒽酮-硫酸法进行了多糖含量的测定。测定结果二种方法重复性、精密度、稳定性均较好,回收率平均值均在95%~105%之间,测定多糖的含量结果虽然有显著性差异(P<0.01)(结果的差异性可能跟蒽酮-硫酸法不同的糖类与蒽酮试剂的显色深度不同这一原因存在联系),但结果数值很接近。因而两种方法都能用于香菇中多糖的含量测定。中华人民共和国农业行业标准NY/T1676-2008《食用菌中粗多糖含量的测定》选用了苯酚-硫酸法作为香菇多糖的含量测定方法。
本试验对香菇供试品溶液制备中提取方法进行了比较研究,即对常用的水提醇沉法和醇回流后水提取法进行了比较,试验过程发现水提醇沉法更容易受干扰成分的的影响,导致结果偏高,因而宜选用醇回流后水提取法。
[1]王国强.全国中草药汇编(卷二)[M].北京:人民卫生出版社,2014: 285
[2]吴锦文.天然生理活性物质香菇多糖和灵芝多糖的国内外研究进展[J].江苏食用菌,1995,16(5):33-34
[3]国家中医药管理局《中华本草》编委会.中华本草(第一部)[M].上海:上海科学技术出版社,1998:571
[4]李翔,石代勇,李般程,等.香菇水提液多糖提取工艺及测定研究[J].农产品加工,2013(6):33-35
[5]王广慧,戴明,王相刚.香菇多糖的提取条件研究[J].食品研究与开发,2013,29(24):71-73
[6]周玲,唐静,李娇,等.野生及人工培养香菇和黑木耳中粗多糖含量测定[J].大理学院学报(综合版),2008,7(8):58-60
[7]石来宝,陈静,殷霞.香菇多糖提取方法的研究[J].药学研究,2014,33(4):200-202
[8]金贞姬,王菁.香菇多糖提取工艺的研究[J].中国医药指南,2013,11(13):71-72
[9]连锦明,黄颖,陈前火,等.蒽酮-硫酸法测定菌类保健品中的活性多糖[J].吉林化工学院学报,2003(1):13-15
Compare Study on Quantity Determine Method of Polycose of Lentinus edodes
ZHOU Yong1,YI Yan-kui2,*,YANG Xiao-min2,LI Ya-ping2
(1.Infinitus(China)Co.,Ltd.,Guangzhou 510665,Guangdong,China;2.Southern Medical University,Guangzhou 510515,Guangdong,China)
Taking phenol-sulphuric method and anthrone-sulphuric method determine quantity of polycose of champignon,to review the linear correlation,reproducibility,precision,stability and accuracy rating of the two method.There was no significant difference between the results of polycose of champignon by phenol-sulphuric method and anthrone-sulphuric method.Verification test results showed the linear correlation,reproducibility,precision,stability were all fairly well,the accuracy rating were all between 95%-105%.The experiment provided basis for the selection of quantity determine method of polycose of champignon.
Lentinus edodes;polycose;quantity determine;phenol-sulphuric method;anthrone-sulphuric method
10.3969/j.issn.1005-6521.2016.13.030
广州市白云区科技计划项目(2012-KZ-85)
周勇(1980—),男(汉),工程师,硕士,主要从事保健食品研究开发。
易延逵,男,副教授,博士,主要研究方向:药物新剂型、新技术的研究。
2015-07-10
