壳聚糖-海藻酸钠载药微球的缓释性能研究*
2016-09-01贾利娜何俊男赵敬东尚宏周
贾利娜,何俊男,赵敬东,张 鑫,尚宏周
(华北理工大学化学工程学院,河北 唐山 063009)
壳聚糖-海藻酸钠载药微球的缓释性能研究*
贾利娜,何俊男,赵敬东,张鑫,尚宏周
(华北理工大学化学工程学院,河北唐山063009)
采用乳化交联法制备出负载5-氟尿嘧啶(5-Fu)的壳聚糖-海藻酸钠磁性载药微球。利用红外(FIRT)、X射线衍射(XRD)、热重(TG)、紫外-可见分光光度计(UV)对1其进行结构表征和缓释性能研究,考察了不同因素对载药微球缓释性能的影响。 结果表明,油水相体积比为1:1时载药性能最佳,载药量为6.69%,包封率为22.00%,产物发生交联反应且保持原有晶型,同时在不同pH值环境下载药微球相对5-Fu药物有明显的缓释作用,并且在pH=8.4时药物达到最大释放量,微球适用于给肠癌细胞靶向供药。
壳聚糖;海藻酸钠;5-氟尿嘧啶;乳化交联法;缓释性能
5-氟尿嘧啶(5-Fu)作为一种抗代谢药物,已广泛应用于各种实体肿瘤的治疗,如大肠癌、胰腺癌、乳腺癌、头颈部肿瘤、胃癌和卵巢癌等,目前已成为消化道恶性肿瘤普遍使用的化疗药物[1-3]。但是由于5-Fu本身毒副作用大,不仅能抑制癌细胞,而且也对正常细胞产生毒副作用,而且市场上出现的药物制剂大多不具有选择性,存在着用量多,药效小,副作用大等不足。靶向药物是目前研究的热点[4-8],可以在病灶部位富集,具有较高的选择性强,可以抑制癌细胞,同时减少对患者正常细胞的损害。
本论文以磁性Fe3O4为靶向磁核,以壳聚糖和海藻酸钠复合材料为载体,通过反相乳液法制备负载5-Fu的磁性靶向载药微球。利用红外(IR)、XRD、热重(TG)等对其微球制剂进行结构表征,采用紫外-可见分光光度计(UV)分析制备条件对载药微球缓释性能的影响,为高分子载药微球研究提供理论基础。
1 实验部分
1.1实验试剂与仪器
海藻酸钠(化学纯),天津市光复精细化工研究所;壳聚糖(脱乙酰度96.12%),浙江金壳生物化学有限公司;5-氟尿嘧啶(原药),江苏美达化学品有限公司;Span80(化学纯),天津市永大化学试剂有限公司;冰乙酸,天津市永大化学试剂有限公司;正丁醇,天津市天力化学试剂有限公司;液体石蜡,天津市永大化学试剂有限公司;甲醛,天津市天力化学试剂有限公司;戊二醛,天津市光复精细化工研究所;无水煤油,天津市大茂化学试剂厂;氯化钙,天津市大茂化学试剂厂;磷酸二氢钾,天津市永大化学试剂有限公司;磷酸氢二钠,天津市天力化学试剂有限公司;氢氧化钠,天津市永大化学试剂有限公司;盐酸,天津市凯信化学工业有限公司;除了特殊标注以外,以上试剂皆为分析纯。
DF-101S集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;BSA124S电子天平,赛多利斯科学仪器北京有限公司;101系列数显鼓风干燥箱,上海叶拓仪器仪表有限公司;平衡离心机,金坛市科析仪器有限公司;AVATAR360型傅里叶红外光谱仪,美国尼高力公司;DMAX2500PC型X射线衍射仪,日本理学株式会社;ZRT-B型热重分析仪,德国耐驰公司;FE20型实验室pH计,梅特勒-托利多仪器上海有限公司;UV-1901紫外双光束分光光度计,北京普析通用仪器。
1.2磁性壳聚糖的制备
采用乳化交联法,将1.0000 g 磁性Fe3O4加入壳聚糖乙酸溶液(1.0000 g壳聚糖加入50 mL体积比为2.5%的乙酸中,至壳聚糖全部溶解),以1:2(V:V)比例加入表面活性剂Span-80(5 mL)和表面活性剂正丁醇(10 mL),加人100 mL的液体石蜡,升温到60 ℃加入3 mL 25%的戊二醛反应1 h,再升温至80 ℃继续反应1 h,洗涤得磁性壳聚糖。
1.3壳聚糖-海藻酸钠载药微球的制备
将制备的磁性壳聚糖(1.0000 g溶于40 mL体积比为2.5%的乙酸溶液中)、5-Fu(0.4000 g)、海藻酸钠(0.5000 g溶于20 mL 2.5%的乙酸溶液)配制的水相滴加到溶有Span-80乳化剂的煤油中(各10 mL/50 mL),搅拌均匀后,加入交联剂2.0% 的CaCl2溶液交联1~2 h,离心除去上层油层,用石油醚洗涤下层微球,干燥后得壳聚糖-海藻酸钠载药微球。采用单因素实验法改变实验中油水相比例为1:1、2:1、3:1条件下制备壳聚糖-海藻酸钠载药微球。
1.4测定壳聚糖-海藻酸钠载药微球的载药量和包封率
取0.1000 g壳聚糖海藻酸钠载药微球于锥形瓶中,加入100 mL缓冲溶液,磁力搅拌24 h,离心取上清液,在波长266 nm下测量吸光度,借助标准曲线计算浓度,从而进行载药量和包封率的计算,公式如(1)和(2)。
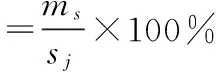
(1)
其中:ms——所加微球中药物全部释放质量
mj——所加微球总质量

(2)
式中:mb——微球中包封药物的质量
my——加入药物的总质量
1.5壳聚糖-海藻酸钠载药微球在不同pH缓冲液中的释药性
称取0.1000 g载药微球和0.1000 g 5-氟尿嘧啶各三份,分别用滤纸包裹,外包两层纱布,放入编号1、2、3、4、5、6的六个150 mL的烧杯中,1、2、3组作为实验组分别加入pH为6.85、7.4、8.4的缓冲溶液100 mL,4、5、6组作为对照组也分别加入pH为6.85、7.4、8.4的缓冲溶液100 mL。
依次在过0.5 h、1 h、2 h、4 h、6 h、8 h、10 h、12 h、20 h、24 h、48 h、72 h、96 h时间取样测试,每次取出2 mL,放入100 mL容量瓶稀释至100 mL,测吸光度,同时向烧杯中补加2 mL相应的缓冲溶液。
由测所得数据计算累积释药率W:
(3)
式中:Wn——第n个取样点的累积释药率
Cn——第n个取样点的浓度
V——实验释放介质的体积
V取——每次取样的体积
m0——加入微球中药品总含量
1.6性能表征
采用溴化钾压片法,对Fe3O4微粒、磁性壳聚糖、壳聚糖-海藻酸钠载药微球进行红外光谱表征分析,用X-射线衍射仪对Fe3O4微粒、磁性壳聚糖、壳聚糖-海藻酸钠载药微球的晶型结构进行分析。用热分析仪在40~1000 ℃范围内测定Fe3O4微粒、磁性壳聚糖、壳聚糖-海藻酸钠载药微球的热失重曲线,分析其热稳定性,确定成分含量。
2 结果与讨论
2.1红外数据分析
采用溴化钾压片法,用AVATAR360型傅里叶红外光谱仪对样品进行分析,测试范围为400~4000 cm-1,Fe3O4(曲线A)、磁性壳聚糖(曲线B)、壳聚糖-海藻酸钠载药微球(曲线C)的红外光谱图如图1所示。
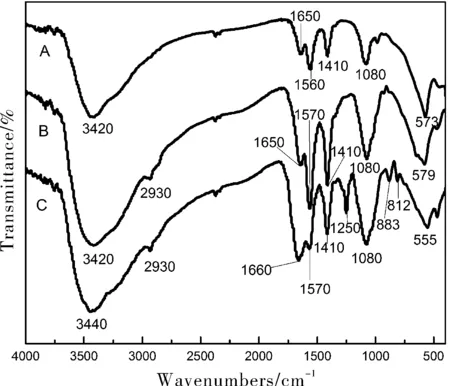
图1 磁性Fe3O4(A)和磁性壳聚糖(B)和载药微球(C)红外谱图
由图1可知,Fe3O4的红外吸收曲线A,3420 cm-1附近出现宽峰,是由-OH的伸缩振动引起的,在1650 cm-1和1560 cm-1附近出现特征峰是由-OH的弯曲振动引起,在573 cm-1附近有Fe-O振动特征峰。
在磁性壳聚糖红外吸收曲线中,壳聚糖的特征峰:3420 cm-1处-OH、2930 cm-1处C-H;在1650 cm-1、1570 cm-1处峰强度增加,除由-OH的弯曲振动引起外,可能是-NH2和N-H作用,1410 cm-1明显峰C-N的伸缩振动峰,1080 cm-1处的强峰为C=O。此外在579 cm-1处有特征峰,说明壳聚糖包裹了磁性铁。
在壳聚糖-海藻酸钠载药微球红外吸收曲线中,2930 cm-1处C-H特征峰,1570 cm-1处-OH的弯曲振动引起及-NH2和N-H作用峰,1410 cm-1处C-N的伸缩振动峰,1080 cm-1处 C=O峰基本保持不变;3440 cm-1处-OH与壳聚糖相比发生了位移,说明-OH参加了反应;而1660 cm-1处出现强峰,由发生反应造成;1250 cm-1处增加峰,说明交联发生在-NH2处;833 cm-1和812 cm-1处峰可能由于交联了5-氟尿嘧啶出现的特征峰;555 cm-1处仍有强度基本不变的特征峰,说明壳聚糖-海藻酸钠载药微球仍保有磁性。
2.2X-射线衍射分析
用X射线衍射仪对Fe3O4微粒、磁性壳聚糖、壳聚糖-海藻酸钠载药微球的晶型结构进行分析,如图2所示。
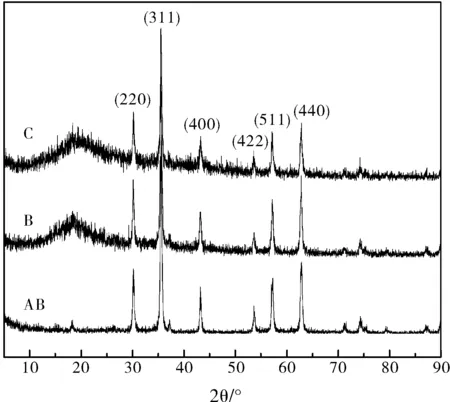
图2 磁性Fe3O4(A)和磁性壳聚糖(B)和载药微球(C)XRD衍射图
从XRD衍射谱图可看出,图谱中主要衍射峰的d值与标准的Fe3O4的特征衍射峰值相对应。将磁性壳聚糖(B)和载药微球(C)XRD衍射图与Fe3O4(A)对比,六个主要衍射峰:(220)、(311)、(400)、(422)、(440)、(511)基本一致,说明Fe3O4的晶型结构未发生变化,其顺磁性也都未改变。同时衍射峰尖锐,表明晶体结构较好,粒径分布较窄。B和C在衍射角2θ=20°时分别出现了馒头峰,应该是四氧化三铁表面的包覆壳聚糖-海藻酸钠形成的无定型结构。
2.3热重数据分析
用热分析仪测定Fe3O4微粒、磁性壳聚糖、壳聚糖-海藻酸钠载药微球的热失重曲线,分析其热稳定性,确定成分含量。
如图3所示,在40~1000 ℃范围内测试,由图3A可知Fe3O4随温度升高,重量几乎不变,未分解。磁性壳聚糖(图3B)TG曲线大致可分为三阶段:40~100 ℃升温脱水,出现第一个质量减少阶段;200~460 ℃间有大幅度下降,可推测是包裹的壳聚糖分解导致,后期又变缓,最后33.18%保持不变。壳聚糖-海藻酸钠载药微球(图3C)的TG曲线与磁性壳聚糖相比在200~460 ℃间下降幅度更大,是因为壳聚糖分解的同时,也伴随着海藻酸钠的分解和5-氟尿嘧啶的升华,之后又有小幅度减少,最后剩28.92%。
在一定程度上也可以看出Fe3O4微粒、磁性壳聚糖、壳聚糖-海藻酸钠载药微球的相对热稳定性顺序为Fe3O4微粒>磁性壳聚糖>壳聚糖-海藻酸钠载药微球。
2.4载药微球载药特性分析
考查油水相体积比:根据测得的各油水比例条件下的吸光度值,据载药量和包封率的计算公式(1)和(2)求得载药微球的载药量和包封率,绘制载药量和包封率关于油水相比的折线图,如图4和图5所示。
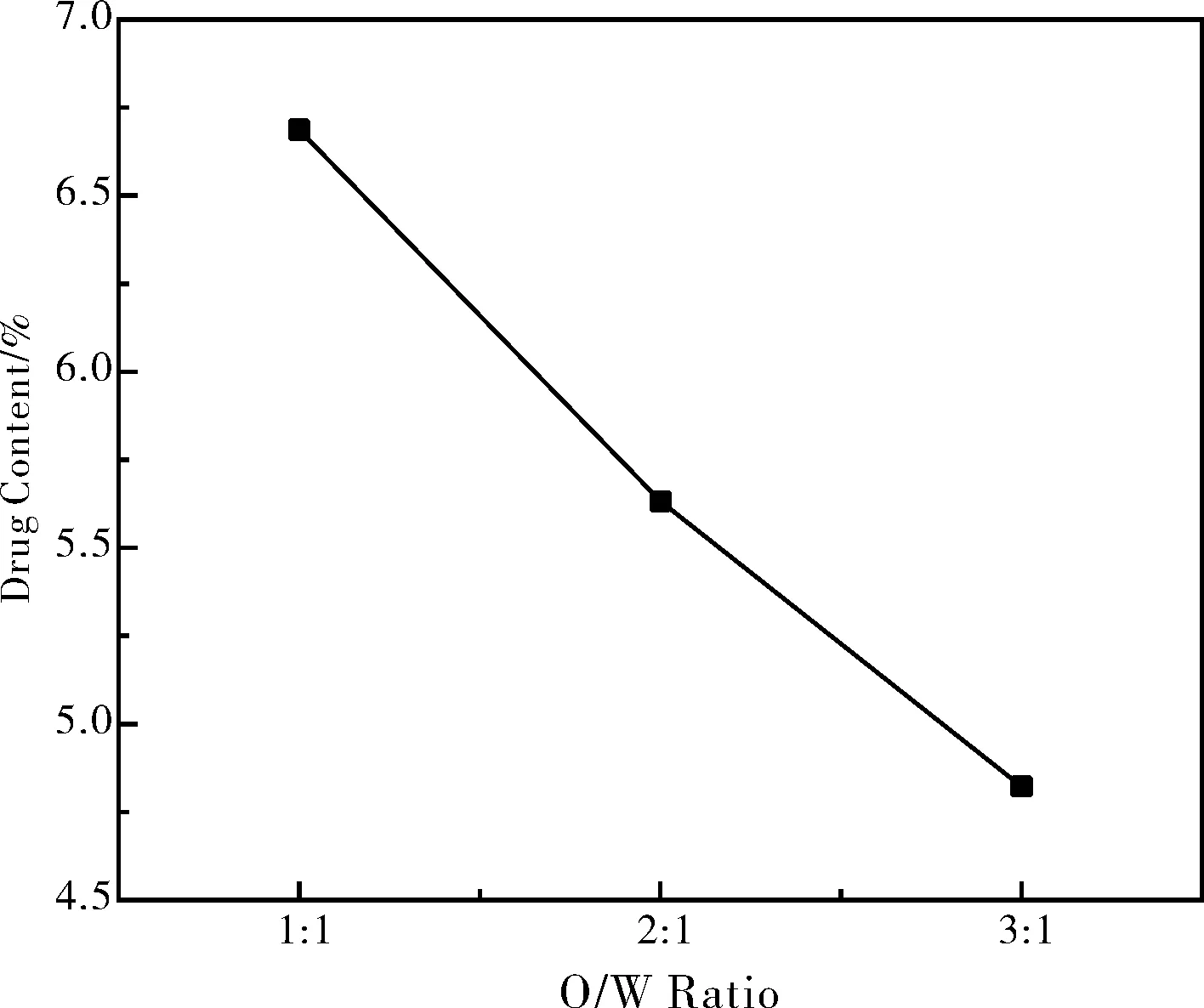
图4 油水相体积比与载药量关系图

图5 油水相体积比与包封率关系图
由图4和图5中可看出在一定范围内,随着油水相体积比的增加,载药量和包封率都减小,当油水相体积比为1:1时可取得最大的载药量和包封率,对应的最大载药量为6.69%,最大包封率为22.00%。
2.5壳聚糖-海藻酸钠载药微球在不同pH缓冲液中的释药性
将pH为6.85、7.4、8.4的三组不同缓冲液中壳聚糖-海藻酸钠载药微球的累积释药率-时间曲线对比结果如图6。
图6中曲线a,b,c分别为在pH=6.85,7.4,8.4下载药微球的累积释药率-时间曲线。从图6上可以观察到,在不同pH条件下,载药微球释放5-Fu药物的速率和释药量有较大不同。在10 h左右微球释药量基本达到最大值,其释药速率为 c>b>a。在10 h内,累计释药量最大值为c>b>a。从图中明显看出,在实验范围内,当pH=8.4时,载药微球的最大累积释药量和释药速率都达到最大。

图6 不同pH值下载药微球释药性曲线
3 结 论
(1)以海藻酸钠、壳聚糖为基准,5-氟尿嘧啶(5-Fu)为模型药物,采用乳化交联法制备了壳聚糖-海藻酸钠载药微球,采用单因素实验法考查油水相体积比对载药微球载药量和包封率的影响。结果表明,油水相体积比为1:1时载药性能最佳,载药量为6.69%,包封率为22.00%。
(2)采用傅里叶红外仪、X-射线衍射及热重分析等对载药微球进行了结构及性能表征。
(3)在不同pH值缓冲液中,载药微球相对5-Fu药物有明显的缓释作用。缓释速率和累积释药量随着pH值变化而变化,在实验范围内,当pH=8.4时,载药微球的最大累积释药量和释药速率都达到最大。
[1]Patients B P, Justo L B, Cornelia D, et al. Inherited variability in a master regulator polymorphism associates with survival in 5-FU treated colorectal cancer patients [J]. Mutation Research Fundamental and Molecular Mechanisms of Mutagenesis, 2014(766-767): 7-13.
[2]Seungho C, Ja-Lok K. Resistance of colorectal cancer cells to radiation and 5-FU is associated with MELK expression [J]. Biochemical and Biophysical Research Communications, 2011(412): 207-213.
[3]N. Ashwanikumara, Nisha A Kumarb, S. Asha Nairb, G.S. Vinod Kumara. Dual drug delivery of 5-fluorouracil (5-FU) and methotrexate (MTX)through random copolymeric nanomicelles of PLGA andpolyethylenimine demonstrating enhanced cell uptake andcytotoxicityN[J]. Colloids and Surfaces B: Biointerfaces, 2013(122): 520-5.
[4]Agnihotri S A, Mallikarjuna N N, Aminabhavi T M. Recent advances on chitosan based micro-and nanoparticles in drug delivery[J]. Journal of Controlled Release, 2004, 100(1): 25-28.
[5]Ohya Y, Cai R. Preparation of PEG-grafted chitosan nanoparticle for peptide drug carrier[J]. International Journal of Pharmaceutics, 2010, 26: 655-656.
[6]He P, Davis S S, Illum L. Chitosan microspheres prepared by spray drying[J]. International Journal of Pharmaceutics, 2009, 187(1): 53-65.
[7]Al-Helw A A, Al-Angary A A, Mahrous G M, et al. Preparation and evaluation of sustained release cross-linked chitosan microspheres containing phenobarbitone[J]. Journal of Microencapsulation, 2008, 15(3): 373-382.
[8]Chandy T, Wilson R F, Rao G H R, et al. Changes in cisplatin delivery due to surface coated poly(lactic acid)-poly(q-caprolactone) microspheres[J]. Journal of Biomater Applied, 2011, 16(2): 275-291.
Preparation and Drug Release Property of Chitosan-sodium Alginate Carrier Drug Microspheres*
JIALi-na,HEJun-nan,ZHAOJing-dong,ZHANGXin,SHANGHong-zhou
(College of Chemical Engineering,North China University of Technology and Science,Hebei Tangshan 063009,China)
The chitosan-sodium alginate magnetic drug-carried microspheres were prepared through the method of emulsion crosslinking, in which 5-fluorouracil was loaded. Structure and performance were characterized and researched respectively by infrared spectroscopy (FTIR) and X-ray diffraction (XRD), thermal gravimetric analyzer (TG), and ultraviolet-visible spectrophotometer, the influence on sustained release property of drug-carried microspheres brought by different factors were observed. The results showed that the drug-loaded property of microspheres became optimal with drug loading and embedding ratios of 6.69% and 20.00% accordingly, as well as the cross-linking reaction occurred in products and original crystalline continued to keep when the ratio between oil and water reached 1:1. Meanwhile, under different pH environments, drug-loaded microspheres performed obvious sustained released in terms of 5-Fu, and while pH was 8.4, the drug reached its maximum release capacity, which was suitable to supply treatment targeting to colorectal cancer cells.
chitosan sodium alginate; 5-fluorouracil; the method of emulsion crosslinking; release function
华北理工大学大学生创新性实验计划项目(编号:x2013028)。
尚宏周,博士,副教授,主要从事功能有机材料的研究。
O646.8
A
1001-9677(2016)02-0065-04
