元素“位置、结构、性质”问题学习要点点拨
2016-08-31安徽省灵璧中学张茹英
安徽省灵璧中学 汤 伟 张茹英
元素“位置、结构、性质”问题学习要点点拨
安徽省灵璧中学汤伟张茹英

元素的“位置、结构、性质”问题是我们学习元素周期律和周期表的重点,也是我们学习化学的难点之一。为使大家更好地掌握该知识要点,下面笔者针对该知识点做一分析归纳。
一、明确“位置、结构、性质”三者间的关系

二、学习“位置、结构、性质”关键点
1.“结构与位置”间的典型关系导析
(1)学习该知识要点时,重点需要掌握如下几个关系式:
①电子层数=周期数。
②质子数=原子序数。
③主族元素原子最外层电子数=主族序数。
④主族元素的最高化合价=主族序数。
最低化合价=主族序数-8(一般规律)。
(2)元素周期表中的一些特殊规律
①各周期所含元素的种数,一到七周期分别为2、8、8、18、18、32、26。
②明确稀有气体的原子序数及其在周期表中的具体位置:

元素符号 He Ne Ar Kr Xe Rn原子序数 2 10 18 36 54 86周期数 1 2 3 4 5 6
③理解同主族上下相邻元素原子序数的关系:

位置 关系 实例位于过渡元素左侧的主族元素,即ⅠA、ⅡA族钠与钾的原子序数差为19-11=8(即钠原子所在第3周期所能容纳元素种数)位于过渡元素右侧的主族元素,即ⅢA~ⅦA族同主族、邻周期元素原子序数之差为上一周期元素所在周期所能容纳元素种数同主族、邻周期元素原子序数之差为下一周期元素所在周期所能容纳元素种数氯和溴的原子序数之差为35-17=18(溴原子所在第4周期所能容纳元素种数)
2.“性质与位置”的典型关系导析
(1)根据不同元素的性质差异可以推知元素在周期表中的相对位置
例如:若同周期元素A、B、C的金属性逐渐增强,则A、B、C在同周期中按照C、B、A的顺序从左到右排列。
(2)根据元素在周期表中的位置关系可以推断元素间的性质差异
例如:若同主族元素A、B、C在同一主族中从上往下排列,则可推知A、B、C的单质的氧化性依次减弱或还原性依次增强。
3.“结构和性质”的典型关系导析

三、“位置、结构、性质”经典例题分析
例1短周期元素Q、W、X、Y、Z在元素周期表中的相对位置如图所示,其中只有Z为金属元素。则下列说法正确的是()。
A.W、X两种元素在自然界中都存在相应的单质
B.Q、W相比,后者更易与氢气发生反应
C.Y、Z分别形成的简单离子中,前者的半径较大
D.X、Z的最高价氧化物对应的水化物之间容易发生反应
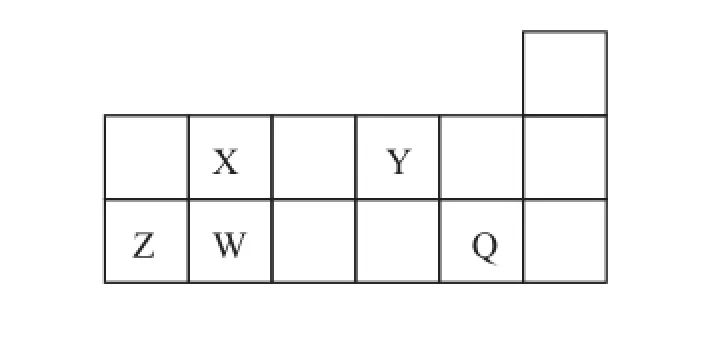
解析由短周期元素Q、W、X、Y、Z在元素周期表中的相对位置及只有Z为金属元素,可以确定分别为Cl、Si、C、O、Al。自然界中存在碳单质,但没有硅单质,A错误;Cl的非金属性强于Si,因此更易与氢气反应,B错误;O、Al形成的简单离子O2-、Al3+具有相同的电子层排布,但O的核电荷数小,因此离子半径大,C正确;X、Z的最高价氧化物对应的水化物分别为碳酸、氢氧化铝,二者不能反应,D错误。
答案C
例2短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T原子的M层电子数比K层多2个,下列叙述不正确的是()。
A.氢化物的稳定性:R>Q>T
B.T的氧化物是一种良好的半导体材料
C.Q、R的简单氢化物分子所含质子数、电子数与Ne相同
D.T、W的最高价氧化物对应的水化物的酸性:W>T

解析T原子的M层电子数比K层多2个,所以T为Si,故Q、R、W分别为N、O、Cl。氢化物的稳定性:H2O>NH3>SiH4,A正确;半导体材料是Si,而不是其氧化物,B错误;NH3、H2O、Ne都是10个质子、10个电子的微粒,C正确;高氯酸的酸性强于硅酸,D正确。
答案B
例3四种短周期元素在元素周期表中的位置如图所示,其中只有M为金属元素。下列说法不正确的是()。
A.原子半径:Z<M
B.Y的最高价氧化物对应的水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的弱
D.Z位于元素周期表中第2周期、第ⅥA族

解析由题给信息可知,M为Al,X为Si,Y为N,Z为O。原子半径Al>Si>N>O,A正确;因为N的非金属性比Si强,所以HNO3的酸性比H2SiO3强,B错误;因为O的非金属性比Si强,所以简单气态氢化物的热稳定性:H2O>SiH4,C正确;氧元素位于元素周期表的第2周期、第ⅥA族,D正确。
答案B
虽然元素“位置、结构、性质”问题属于高一化学必修教材中所学习的内容,但该知识点近年来却是我们新课标卷中的高频考点。该类试题借助化学中较为基础的知识要点,不仅能够很好地考查物质结构、元素周期表、元素周期律的知识,而且能够考查我们的推断能力、对信息的挖掘能力以及解决综合问题的能力,所以我们要重视和学好“位置、结构、性质”的相关知识要点。◀
