抑制miR-101表达对结直肠癌SW480细胞增殖、周期及凋亡的影响
2016-08-31刘燕陆滟霞周敏郑林李学农
刘燕,陆滟霞,周敏,郑林,李学农
(1 川北医学院病理学系,四川南充637000;2 川北医学院附属医院;3 南方医科大学病理学系)
抑制miR-101表达对结直肠癌SW480细胞增殖、周期及凋亡的影响
刘燕1,2,陆滟霞3,周敏3,郑林3,李学农3
(1 川北医学院病理学系,四川南充637000;2 川北医学院附属医院;3 南方医科大学病理学系)
目的观察抑制miR-101表达对结直肠癌细胞SW480增殖、细胞周期及凋亡的影响。方法取SW480细胞分为A、B、C组,A组转染miR-101抑制物,抑制miR-101表达,B组转染无义序列miRNA,C组为不做任何处理的空白组。转染48 h时观察各组细胞增殖、周期及凋亡情况。结果随时间增加,各组细胞细胞增殖的OD值均升高(P均<0.05);培养第2、3、4、5天A组细胞增殖的OD值均高于B、C组(P均<0.05)。转染48 h时A组S期细胞所占比例明显高于B、C组,G1与G2/M期细胞所占比例明显低于B、C组(P均<0.05)。A、B、C组细胞凋亡率分别为3.29%±0.09%、4.57%±0.21%、2.00%±0.11%( F=230.762;P<0.05)。结论抑制miR-101表达可促进SW480细胞增殖、阻滞细胞周期于S期、抑制细胞凋亡。干扰miR-101后能够促进结直肠癌细胞SW480的增殖,细胞S期周期阻滞及抑制细胞凋亡。
微小RNA;miR-101;结肠肿瘤;直肠肿瘤;细胞增殖;细胞凋亡;细胞周期
miR-101是微小RNA(miRNA)家族中的一员,在肿瘤的发生、转移及侵袭等过程中发挥重要作用[1,2]。miR-101抑制肿瘤细胞的增殖、迁移、侵袭[3,4]。目前关于miR-101对结直肠癌细胞的增殖、凋亡影响的相关研究较少。本课题组前期研究发现,miR-101在低转移的结直肠癌细胞株SW480中表达水平较高,而在高转移细胞株SW620中表达水平较低,并能靶向调控RACl的表达[5]。2013年8月~2014年6月,我们观察了miR-101SW480细胞增殖、细胞周期及凋亡的影响,现将结果报告如下。
1 材料与方法
1.1细胞、材料、试剂及仪器结直肠癌细胞株SW480由本实验室保存,置于含5%胎牛血清的RPMI1640完全培养基,37 ℃、5%CO2细胞培养箱内培养。胰酶购自于杭州吉诺公司,细胞周期试剂盒、细胞凋亡试剂盒均购自南京凯基生物科技发展有限公司。
1.2SW480细胞分组及miR-101抑制物转染方法取适量对数生长期SW480细胞,分为A、B、C组,A组转染miR-101抑制物,抑制miR-101表达,B组转染无义序列miRNA,所有操作均严格按照使用说明书进行;C组为不做任何处理的空白组。转染36 h时采用荧光定量PCR检测各组miR-101,A组miR-101的相对表达量(0.546 1±0.028 7)低于B、C组(分别为0.816 7±0.0597 4、1.000±0),差异具有统计学意义,说明转染成功。
1.3各组细胞增殖情况观察采用CCK-8法。取转染48 h时各组细胞,消化后计数,接种于96孔板中,2 000/孔,每组3个复孔。待细胞贴壁后,每孔加入10 μL CCK-8试剂后37 ℃孵育2 h,以blank对照孔进行调零,分别于第2、3、4、5天使用Glo MaxTM96 Microplate Luminometer发光检测仪检测各组OD值,以OD值表示该组细胞增殖能力的大小,OD值越大代表细胞增殖能力越强。实验重复3次,取平均值。
1.4各组细胞周期观察干预48 h时取对数生长期各组细胞,PBS清洗2次,加入胰酶消化,2 000 r/min离心5mim,第2 d于室温下1 000 r/min离心5min,PBS清洗2次,然后加入100 μL RNase A,37 ℃水浴30 min后,加入400 μL PI,混匀后4 ℃避光30 min。采用流式细胞仪观察各组细胞周期,计算细胞周期G1、S、G2/M期所占比例。实验重复3次,取平均值。
1.5各组细胞凋亡情况观察干预48 h时取对数生长期各组细胞,PBS冲洗2次,2 000 r/min离心5min,收集(1~5)×105细胞,加入500 μL 1×Binding Buffer 悬浮细胞,加入1 μL AnneXinV-PE,轻轻混匀,4 ℃避光反应15 min,加入5 μL7AAD再次混匀,4℃避光孵育15min,采用流式细胞仪检测各组细胞凋亡情况,计算细胞凋亡率。
2 结果
2.1各组细胞增殖情况比较不同培养时间A、B、C组细胞增殖的OD值比较见表1。随时间增加,各组细胞细胞增殖的OD值均升高(P均<0.05)。分别培养第2、3、4、5天,A组细胞增殖OD值高于B、C组(P均<0.05)。
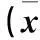
表1 不同培养时间各组细胞增殖的OD值±s)
2.2各组细胞周期比较分析转染48 h时各组细胞周期比较见表2。转染48 h时A组S期细胞所占比例明显高于B、C组,G1与G2/M期细胞所占比例明显低于B、C组(P均<0.05)。

表2 干预48 h时各组细胞周期分布
2.3各组细胞凋亡率比较A、B、C组细胞凋亡率分别为3.29%±0.09%、4.57%±0.21%、2.00%±0.11%,组间两两比较,P均<0.05。
3 讨论
miRNAs是一类类似于癌或抑癌基因作用的非编码小分子RNA家族[4]。研究发现,miR-101在乳腺癌[1]、肺癌、肝癌、前列腺癌、垂体腺瘤、胰腺癌、骨肉瘤[2,4]、胆囊癌[3]等实体肿瘤中表达下调,可能参与肿瘤的发生、转移、侵袭等过程,起着抑制肿瘤发生的作用[3]。在肺癌细胞中,miR-101通过靶向调控COX-2的表达可抑制肺癌细胞的增殖与迁移[6,7]。Lv等[8,9]研究表明,在胃癌细胞及其组织中miR-101的表达均下调,并且与肿瘤的生长、侵袭和转移密切相关。在结直肠癌中,miR-101可在转录后水平调控EP4受体的表达[10]。在结直肠癌中miR-101可调控EP4受体、PTGS2及ASPN的表达[11]。miR-101可靶向调控下调EZH2抑制食管癌细胞的增殖、迁移能力[12];CXCR7而抑制乳腺癌细胞的增殖、侵袭能力[13];靶向作用于Rac1抑制甲状腺乳头状癌细胞的生长[14],本课题组前期研究中也发现而miR-101能靶向调控结直肠癌细胞RACl表达[9]。表明miR-101可能通过靶向调控RAC1调节结直肠癌的生物学行为,参与结直肠癌的发生进展过程。
本研究发现,A组细胞增殖的OD值均高于B、C组,这表明miR-101可能抑制结直肠癌细胞的增殖。Strillaccia 等[11]研究发现,在结肠癌患者的癌组织标本中miR-101表达明显低于其癌旁组织,高表达 miR-101可抑制结肠癌细胞的远处转移。与本研究结果一致。
对于已经发生转移的结直肠癌,放射治疗是重要的治疗方式方式,其效果如何,与肿瘤细胞周期分布密不可分。通常认为G2/M期对放疗最为敏感,G1次之,S期最不敏感。细胞发生G2/M 期阻滞时将无法完成其DNA 损伤修复,从而引起G2/M 期阻滞延长,细胞的增殖能力下降,导致细胞增殖死亡[15,16]。miR-101是否能增强结直肠癌患者对放疗的敏感性,尚有待于进一步研究[17]。本研究发现,B组细胞凋亡率明显高于A、C组,A组细胞凋亡率明显高于C组,差异均具有统计学意义,表明miR-101可能促进结直肠癌细胞的凋亡,且转染过程本身可能导致细胞着损伤,促进细胞凋亡。
综上所述,抑制miR-101表达可促进SW480细胞增殖、阻滞细胞周期于S期、抑制细胞凋亡。干扰miR-101后能够促进结直肠癌细胞SW480的增殖,细胞S期周期阻滞及抑制细胞凋亡。但其具体机制尚有待于今后进一步研究。
[1] Iorio MV,Ferracin M,Liu CG,et al.MicroRNA gene expression deregulation in human breast cancer [J].Cancer Res,2005,65(16):7065-7070.
[2] Yanaihara N,Caplen N,Bowman E,et al.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
[3] Su H,Yang JR,Xu T,et al.MicroRNA-101,down-regulated in hepatocellular carcinoma,promotes apoptosis and suppresses tumorigenicity [J].Cancer Res,2009,69(3):1135-1142.
[4] Yi H,Hua C,Chao WC,et al.Identification of a two-layer regulatory network of proliferation-related microRNAs in hepatoma cells [J].Nucleic Acids Res,2012,40(20):10478-10493.
[5] 刘燕,陆滟霞,周敏,等.稳定过表达miR-101结直肠癌细胞株的建立及其靶基因的鉴定[J].南方医科大学学报,2014,43(7):928-933.
[6] Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer[J].NatRev Cancer,2006 ,6(4):259-269.
[7]Manikandan J,Aarthi JJ,Kumar SD,et al.Oncomirs: the potential role of non-codingmicroRNAs in understanding cancer[J].Bioinformation,2008,2(8):330-334.
[8] Lv P,Zhang P,Li X1,et al.Micro ribonucleic acid(RNA)-101 inhibits cell proliferation and invasion of lung cancer by regulating cyclooxygenase-2[J].Thorac Cancer,2015,6(6):778-784.
[9] Wang HJ,Ruan HJ,He XJ,et al.MicroRNA-101 is down-regulated in gastric cancer and involved in cell migration and invasion[J].Eur J Cancer,2010,46(12):2295-2303.
[10] Chandramouli A,Onyeagucha BC,Mercado-Pimentel ME,et al.MicroRNA-101(miR-101)post-transcriptionally regulates the expression of EP4 receptor in colon cancers[J].Cancer Biol Ther,2012,13(3):175-183.
[11] Strillacci A,Griffoni C,Sansone P,et al.MiR-101 downregulation is involved in cyclooxygenase-2 overexpression in human colon cancer cells[J].Experimental Cell Res,2009,315(8):1439-1447.
[12] Chen MB,Yang L,Lu PH,et al.MicroRNA-101 down-regulates sphingosine kinase 1 in colorectal cancer cells[J].Biochem Biophys Res Commun,2015,463(4):954-960.
[13] Wang J,Yu H,Ye L,et al.Integrated regulatory mechanisms of miRNAs and targeted genes involved in colorectal cancer[J].Int J Clin Exp Pathol,2015,8(1):517-529.
[14] Gupta VK,Park JO,Jaskowiak NT,et al.Combined gene therapy and ionizing radiat ion is a novel approach to treat human esophageal adenocarcinoma[J].Ann Surg Oncol,2002,9(5):500-504.
[15] Xiao JL,Hongyu G,Hai LI,et al.miR-101 inhibits cell proliferation by targeting Rac1 in papillary thyroid carcinoma[J].Biomed Rep,2014,2(1):122-126.
[16] Li JT,Jia LT,Liu NN,et al.MiRNA-101 inhibits breast cancer growth and metastasis by targeting CX chemokine receptor 7[J].Oncotarget,2015,6(31):30818-30830.
[17] Xiaojie L,Hong G,Hai L,et al.miR-101 inhibits cell proliferation by targeting Rac1 in papillary thyroid carcinoma[J].Biomed Rep,2014,2(1):122-126.
国家自然科学基金资助项目(81272758,81302158)。
李学农(E-mail: leexue0@126.com)
10.3969/j.issn.1002-266X.2016.27.012
R782
A
1002-266X(2016)27-0038-03
2016-02-17)
