miR-181c在胶质母细胞瘤组织中的表达变化及其对肿瘤细胞侵袭、迁移能力的影响
2016-08-31田伟张娟王利娜张泰民贾万良高岩马文群
田伟,张娟,王利娜,张泰民,贾万良,高岩,马文群
(1 邯郸市中心医院,河北邯郸056000;2 邯郸市传染病医院;3 邯郸市第二医院)
·论著·
miR-181c在胶质母细胞瘤组织中的表达变化及其对肿瘤细胞侵袭、迁移能力的影响
田伟1,张娟1,王利娜2,张泰民1,贾万良3,高岩1,马文群1
(1 邯郸市中心医院,河北邯郸056000;2 邯郸市传染病医院;3 邯郸市第二医院)
目的观察微小RNA181c(miR-181c)在胶质母细胞瘤(GBM)组织中的表达及其对肿瘤细胞侵袭和迁移的影响。方法选择41例份GBM组织(GBM组)、15例份正常脑组织(对照组),采用实时定量PCR法检测组织中miR-181c表达。取胶质母细胞瘤T98G细胞,分为A、B、C、D组,A、B、C组分别转染过表达的miR-181c、空白对照miRNA、抑制表达的miR-181c,D组为不做任何处理的空白组。转染48 h观察各组肿瘤细胞的侵袭及迁移能力。结果GBM组组织中miR-181c的表达明显低于对照组,P<0.05。转染48 h时B、C、D组细胞侵袭数均多于A组,P<0.05;B、C、D组细胞相对迁移距离均长于A组,P<0.05。结论GBM组织中miR-181c呈低表达;miR-181c低表达与GBM细胞的高侵袭和迁移能力密切相关。
微小RNA181c;胶质瘤;胶质母细胞瘤;细胞迁移;细胞侵袭
胶质瘤是最常见的中枢神经系统恶性肿瘤[1],胶质母细胞瘤(GBM)是其中恶性程度最高的一种,预后极差。有报道称手术切除肿瘤及放、化疗联合治疗的GBM患者的中位生存期仍<15个月[2,3]。高侵袭性和易迁移是GBM术中难以彻底切除、术后容易复发的主要原因[4],但其具体机制目前尚不明确。微小RNA(miRNA)在肿瘤的发生发展中起重要作用重要作用[5~7],miR-181是新发现的一种miRNA。研究[8,9]发现,上调miR-181的表达可抑制肿瘤细胞的增殖、侵袭及迁移。但目前miR-181c在GBM侵袭和迁移的影响尚未见报道。2013年3月~2015年3月我们观察了miR-181c在GBM组织的表达情况,并观察其对肿瘤细胞侵袭和迁移的影响,旨在为GBM的治疗提供新的思路。
1 材料与方法
1.1标本、材料、试剂及仪器人GBM组织标本来自2013年3月~2015年3月邯郸市中心医院保存的GBM标本41例。患者中男21例、女20例,年龄27~63岁;均经病理确诊为GBM;均为初次手术,术前未行放化疗治疗。正常脑组织15例由头部外伤手术内减压获得。标本使用均经患者本人或家属同意,实验过程经邯郸市伦理委员会批准。人GBM细胞株T98G购自中国科学院生物物理研究所,置于含10%胎牛血清、青链霉素双抗的DMEM培养基中,37 ℃、5% CO2的恒温培养箱培养。细胞生长至70%~80%进行传代操作后备用。仪器和试剂:胎牛血清、青链霉素双抗、DMEM培养基购自美国Gibco公司,过表达的miR-181c(miR-181c mimics)、空白对照miRNA(miR-nc)、抑制表达的miR-181c(anti-miR-181c)由上海吉玛生物技术有限公司合成,Lipofectamine 2000 购自美国Invitrogen公司,Olympus IX70显微镜购自日本奥利巴斯影像公司。
1.2miR-181c在人GBM组织及正常脑组织中的表达检测采用实时定量PCR法。取41例份人GBM组织(GBM组)、15例份正常脑组织(对照组),将标本磨碎后置于TRIzol中,按照使用说明书步骤提取总RNA,琼脂糖凝胶电泳检测RNA完整性,应用TaqmanTMmicroRNA进行miRNA反转录,随后TaqMan探针法进行miRNA检测及分析,同时选取U6内参作为对照从而得出miR-181c的相对表达量。
1.3miR-181c对T98G细胞侵袭及迁移的影响观察取适量T98G细胞,分为A、B、C、D组,A、B、C组分别用Lipofectamine 2000试剂转染miR-181c mimics、miR-nc、anti-miR-181c,所有操作均严格按照使用说明书进行;D组为不做任何处理的空白组。采用Transwell法观察细胞的侵袭能力:转染48 h时取各组细胞,胰酶消化后以2×104/孔接种于matrigel-Transwell小室内,小室内采用无血清DMEM培养基进行培养,下层应用10%胎牛血清的DMEM培养基培养。20 h后棉签擦去上层未发生侵袭细胞,甲醇固定后,1 %结晶紫染色数分钟,PBS清洗后显微镜下观察计数侵袭细胞,以侵袭细胞数代表细胞的侵袭能力。采用细胞划痕迁移试验观察细胞的侵袭能力:转染48 h时取各组细胞,胰酶消化后将细胞接种至6孔板,90%融合后,应用10 μL比照直尺进行细胞划线,划线后赤壁采用无血清DMEM培养基进行培养并应用显微镜采集照片,24 h后再次进行图像采集,6孔板内做好标记使每次采集图像为相同视野,应用Image Pro Plus软件进行图像分析,按照细胞相对迁移距离=0 h划痕宽度-24 h划痕宽度/0 h划痕宽度×痕宽度%计算各组的相对迁移距离。实验重复3次,取平均值。

2 结果
2.1两组组织miR-181c表达比较观察组和对照组miRNA181c的相对表达量分别为0.60±0.68、3.34±1.48,观察组与对照组相比,P<0.05。
2.2各组细胞侵袭数及迁移距离比较转染48 h时各组细胞侵袭数及迁移距离比较见表1。转染48 h时各组细胞侵袭情况见图1,各组细胞迁移情况见图2。
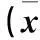
表1 转染48 h时各组细胞侵袭数及迁移距离比较±s)
注:与A组比较,*P<0.01。

图1 各组细胞侵袭情况
3 讨论
目前研究认为MiR-181家族含有8个成熟序列,分别是hsa-miR-181a-5p、hsa-miR-181a-3p、hsa-miR-181a-2-3p、hsa-miR-181b-5p、hsa-miR-181b-3p、hsa-miR-181c-5p、hsa-miR-181c-3p、hsa-miR-181d-5p他们之间的碱基序列差异甚微,常成簇排列在染色体上,协同表达,协同发挥功能。miR-181家族成员的作用机理与其他miRNA成员一样,通过与靶标的mRNA(信使RNA)的3′-UTR碱基互补结合,抑制其翻译功能或降低其稳定性,进而达到精确调控基因表达的作用,既能调控癌基因的表达,又能调控抑癌基因的表达。近年来有关microRNA-181家族的研究十分活跃,并且发现其在多种恶性肿瘤的发生发展中发挥重要作用[8~10]。在肝癌中,Syamal等[11]发现miR-181a对OPN表达具有负调控作用,能通过降低OPN表达而抑制肝癌细胞的黏附侵袭转移功能。Ji等[12]在研究肝细胞癌的肿瘤干细胞时,发现miR-181家族成员可以直接靶向调控细胞分化相关的转录因子如CDX2,以及Wnt信号通路抑制因子NLK的表达,从而维持其肿瘤干细胞特性。Wang等[13]发现TGF-b介导的miR-181b和miR-181d在肝癌组织中表达显著升高,而作为癌症抑制因子靶点的TIMP3表达显著降低。Gao等[14]在肺癌研究中发现miR-181a低表达与患者不良预后显著相关,miR-181a可能成为肺癌的临床诊疗标志物。Zhu等[15]在研究人肺癌的多药耐药时发现miR-181b涉及了多药耐药的形成并且提示其有潜力成为逆转多药耐药的治疗靶标。Wang等[16]在乳腺癌干细胞的研究中发现miR-181通过抑制肿瘤抑制基因ATM的表达,进而促进乳腺癌干细胞的增殖。Pekarsky等[17]在研究慢性B淋巴细胞白血病(B-CLL)时发现白血病相关癌基因TCL1是miR-181的直接调控靶标,miR-181有可能充当慢性B淋巴细胞白血病的治疗药物。Shin等[18]在研究口腔癌细胞中发现miR-181a能逆转肿瘤的恶性行为,并有潜力成为治疗癌症的新型药物。Yang等[19]发现miR-181a及miR-181b与口腔癌淋巴结转移血管侵袭及不良预后等密切相关。

图2 各组细胞划痕实验结果
研究[7]证实,microRNA可以作为评价GBM生物学行为及患者预后的分子生物学标记。Shi等[20]将携带miR-181a及miR-181b基因的质粒表达载体同时转染多种胶质母细胞瘤细胞株,发现两者均能显著抑制所有细胞株的增殖及侵袭转移能力,并能促进凋亡,其中miR-181b的作用比miR-181a更为显著,这些提示miR-181a及miR-181b在胶质瘤发生发展中均充当抑癌基因角色。Li等[21]发现miR-181b在胶质瘤干细胞U87的表达显著低于正常胶质瘤细胞U87,miR-181b过表达可抑制胶质瘤干细胞U87的增殖及其体外成瘤能力,并增加胶质瘤干细胞U87对化疗药物替莫唑胺的敏感性,这些说明miR-181b在胶质瘤干细胞U87的无限增殖中也扮演抑癌基因作用,而且可能在针对胶质瘤干细胞的治疗中充当重要的治疗药物。Radek等[22]在研究多发性胶质母细胞瘤的临床预后时,对肿瘤组织进行miR-181c和miR-21表达水平联合检测,可以预测确诊后6个月内的疾病进展情况,而且特异性达81%,敏感性达92%,说明miR-181c对识别术后早期复发的高危胶质瘤患者具有重要意义。Conti等[23]报道在Ⅱ~Ⅳ期胶质瘤的临床组织标本中,miR-181b表达显著降低,而miR-21和miR-221表达显著升高,并提示miRNA可能在脑胶质瘤的临床分期诊断中发挥重要作用。然而,miR-181c在胶质母细胞瘤中的表达及生物学作用尚不清楚。在本研究中,我们发现与正常脑组织相比,miR-181c在GBM组织中的表达均显著降低,这种差异表达提示miR-181c可能在胶质母细胞瘤中发挥重要的作用。
侵袭和迁移是恶性肿瘤显著地生物学特征,胶质瘤的侵袭和迁移能力是决定患者预后的主要因素[24,25]。影响脑胶质瘤侵袭性生长的因素主要包括:胶质瘤自身的生物学特性、血管生成、胶质瘤细胞所处微环境及胶质瘤与机体免疫系统间的相互作用[4]等。缺氧、代谢、占位效应、趋化、手术刺激等外界因素均可诱导肿瘤脱离瘤体向正常脑组织侵袭[5]。目前研究认为microRNA与肿瘤侵袭的关系十分密切,在肝癌、肺癌、乳腺癌、口腔癌的侵袭转移过程中均发现了存在microRNA的参与[13~17]。在本研究中,我们发现在胶质瘤细胞株T98G中上调miR-181c的表达能够显著抑制胶质瘤细胞株的迁移和侵袭能力。这说明miR-181c能够在影响GBM侵袭性生长中发挥重要的作用。结合既往文献报道,我们推测其可能作用机制为:①miR-181c通过影响TGF-b、Notch等信号通路促进胶质瘤的侵袭性生长;②miR181c可能通过囊泡在肿瘤细胞与基质细胞、免疫细胞间相互传递,从而影响肿瘤微环境导致肿瘤的侵袭性生长。
综上所述,GBM组织中存在miR-181c低表达,miR-181c低表达与GBM细胞的高侵袭和迁移能力密切相关。但其具体作用机制尚有待于进一步研究。
[1] Wen PY,Kesari S.Malignant gliomas in adults[J].N Engl J Med,2008,359(5): 492-507.
[2] Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[3] Stupp R,Hegi ME,Mason WP,et al.Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase Ⅲ study: 5-year analysis of the EORTC-NCIC trial[J].Lancet Oncol,2009,10(5):459-466.
[4] Duan R,Han L,Wang Q,et al.HOXA13 is a potential GBM diagnostic marker and promotes glioma invasion by activating the Wnt and TGF-beta pathways[J].Oncotarget,2015,6(29):27778-27793
[5] Ebrahimi A,Sadroddiny E.MicroRNAs in lung diseases: Recent findings and their pathophysiological implications[J].Pulm Pharmacol Ther,2015,34:55-63.
[6] Garg N,Vijayakumar T,Bakhshinyan D,et al.MicroRNA Regulation of Brain Tumour Initiating Cells in Central Nervous System Tumours[J].Stem Cells Int,2015,2015:141793.
[7] He Y,Lin J,Kong D,et al.Current State of Circulating MicroRNAs as Cancer Biomarkers[J].Clin Chem,2015,61(9):1138-1155.
[8] Lin S,Gregory RI.MicroRNA biogenesis pathways in cancer[J].Nat Rev Cancer,2015,15(6):321-333.
[9] Ohtsuka M,Ling H,Doki Y,et al.MicroRNA Processing and Human Cancer[J].J Clin Med,2015,4(8):1651-1667.
[10] Meng F,Glaser SS,Francis H,et al.Functional analysis of microRNAs in human hepatocellular cancer stem cells[J].J Cell Mol Med,2012,16(1):160-173.
[11] Bhattacharya SD,Garrison J,Guo H,et al.Micro-RNA-181a regulates osteopontin-dependent metastatic function in hepatocellular cancer cell lines[J].Surgery,2010,148(2):291-297.
[12] Ji J,Yamashita T,Budhu A,et al.Identification of microRNA-181 by genome-wide screening as a critical player in EpCAM-positive hepatic cancer stem cells[J].Hepatology,2009,50(2):472-480.
[13] Wang B,Hsu SH,Majumder S,et al.TGFbeta-mediated upregulation of hepatic miR-181b promotes hepatocarcinogenesis by targeting TIMP3[J].Oncogene,2010,29(12):1787-1797.
[14] Gao W,Yu Y,Cao H,et al.Deregulated expression of miR-21,miR-143 and miR-181a in non small cell lung cancer is related to clinicopathologic characteristics or patient prognosis[J].Biomed Pharm,2010,64(6):399-408.
[15] Zhu W,Shan X,Wang T,et al.miR-181b modulates multidrug resistance by targeting BCL2 in human cancer cell lines[J].Int J Cancer,2010,127(11):2520-2529.
[16] Wang Y,Yu Y,Tsuyada A,et al.Transforming growth factor-β regulates the sphere-initiating stem cell-like feature in breast cancer through miRNA-181 and ATM[J].Oncogene,2011,30(12):1470-1480.
[17] Pekarsky Y,Santanam U,Cimmino A,et al.Tcl1 expression in chronic lymphocytic leukemia is regulated by miR-29 and miR-181[J].Cancer Res,2006,66(24):11590-11593.
[18] Shin KH,Bae SD,Hong HS,et al.miR-181a shows tumor suppressive effect against oral squamous cell carcinoma cells by downregulating K-ras[J].Biochem Biophys Res Commun,2011,404(4):896-902.
[19] Yang CC,Hung PS,Wang PW,et al.miR-181 as a putative biomarker for lymph-node metastasis of oral squamous cell carcinoma[J].J Oral Pathol Med,2011,40(5):397-404.
[20] Shi L,Cheng Z,Zhang J,et al.hsa-mir-181a and hsa-mir-181b function as tumor suppressors in human glioma cells[J].Brain Res,2008,1236:185-93.
[21]Li P,Lu X,Wang Y,et al.MiR-181b suppresses proliferation of and reduces chemoresistance to temozolomide in U87 glioma stem cells[J].J Biomed Res,2010,24(6):436-443.
[22] Lakomy R,Sana J,Hankeova S,et al.MiR-195,miR-196b,miR-181c,miR-21 expression levels and O-6-methylguanine-DNA methyltransferase methylation status are associated with clinical outcome in glioblastoma patients[J].Cancer Sci,2011,102(12):2186-2190.
[23] Conti A,Aguennouz M,La Torre D,et al.miR-21 and 221 upregulation and miR-181b downregulation in human grade Ⅱ-Ⅳ astrocytic tumors[J].J Neurooncol,2009,93(3):325-332.
[24] Scribner E,Saut O,Province P,et al.Effects of anti-angiogenesis on glioblastoma growth and migration: model to clinical predictions[J].PLoS One,2014,9(12):e115018.
[25] Thota B,Arimappamagan A,Kandavel T,et al.STAT-1 expression is regulated by IGFBP-3 in malignant glioma cells and is a strong predictor of poor survival in patients with glioblastoma[J].J Neuro Surg,2014,121(2):374-383.
Expression changes of miR-181c in glioblastoma and its effects on invasion and migration of tumor cells
TIAN Wei1,ZHANG Juan,WANG Lina,ZHANG Taimin,JIA Wanliang,GAO Yan,MA Wenqun
(1 Handan Central Hospital,Handan 056000,China)
ObjectiveTo observe the expression changes of microRNA181c(miR-181c)in glioblastoma(GBM)and its effects on invasion and migration of tumor cells.Methodsreal-time PCR was used to detect the miR-181c expression in 41 GBM tissues(GBM group)and 15 normal brain tissues(control group).GBM cell line T98G was divided into four groups: groups A,B,C and D.In the groups A,B and C,the T98G was transfected with miR-181c with overexpression,control miRNA and miR-181c,respectively,but the group D without any treatment.After transfection 48 h,the invasion and migration in each group was investigated.ResultsCompared with the control group,the miR-181c expression was down-regulated in the GBM group,P<0.05.After transfection 48 h,the invasive cells in the groups B,C and D were more than those of the group A,P<0.05.Moreover,cell relative migration distance in the groups B,C and D was also longer than that of the group A,P<0.05.ConclusionThe miR-181c is lowly expressed in GBM tissues,and the low miR-181c expression is closely related with GBM cell invasion and migration.
microRNA181c;glioma;glioblastoma;cell migration;cell invasion
河北省卫生厅青年基金资助项目(20150036)。
田伟(1980-),男,硕士,主要研究方向为脑肿瘤、脑血管病的神经外科治疗。E-mail:tianwei2003happy@163.com
10.3969/j.issn.1002-266X.2016.27.001
R739.41
A
1002-266X(2016)27-0001-04
2016-02-11)
