肝癌患者外周血中循环肿瘤细胞的检测及其应用
2016-08-31马清贾茹张春艳金欣左向华林平徐建明陈水平陈建魁1
马清,贾茹,张春艳,金欣,左向华,林平,徐建明,陈水平,陈建魁1,
(1 安徽医科大学解放军307临床学院,北京100071;2 军事医学科学院附属医院;3 赛特生物公司)
肝癌患者外周血中循环肿瘤细胞的检测及其应用
马清1,2,贾茹2,张春艳2,金欣2,左向华2,林平3,徐建明2,陈水平2,陈建魁1,2
(1 安徽医科大学解放军307临床学院,北京100071;2 军事医学科学院附属医院;3 赛特生物公司)
目的检测肝癌患者外周血中循环肿瘤细胞(CTC),探讨CTC检测在肝癌诊断和治疗监测中的应用价值。方法选择肝癌患者27例纳入肝癌组,另选30例健康体检者为对照组。采集两组外周血,用差减富集技术富集CTC,荧光原位杂交技术选择CTC;采用电化学发光法检测两组血清肿瘤标志物甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原199(CA199)。比较CTC、AFP、CEA、CA199检测诊断肝癌的敏感性、特异性、约登指数。分析CTC检测结果与索拉菲尼靶向治疗效果的关系。结果肝癌组CTC阳性22例(81.5%),对照组均未检出CTC,两组检出率相比,P<0.05。肝癌患者中均检出C亚群肿瘤细胞,肝胆管细胞癌患者检出A、B、C亚群肿瘤细胞。所有CTC阳性患者外周血中均检出多倍体CTC,以三倍体肿瘤细胞数量最多(59.8%)。肝癌组中,AFP阳性17例、CEA阳性10例、CA199阳性11例,对照组分别为2、1、0例。CTC检测诊断肝癌的约登指数均高于三项肿瘤标志物检测(P均<0.05)。肝癌组中10例坚持服用索拉菲尼,8例治疗过程中CTC数量未有明显变化,疗效评价为SD,2例治疗前CTC总数较高患者(>15/7.5 mL)在索拉菲尼治疗1个周期后有明显下降(<5/7.5 mL),但疗效评价也为SD。结论利用差减富集技术可有效检出肝癌患者外周血中的CTC。CTC检测较常用肿瘤标志物检测在肝癌诊断方面更有优势,也有助于评估肝癌患者靶向治疗的效果。
循环肿瘤细胞;肝肿瘤;肝癌;肿瘤标志物
目前肝癌的主要治疗方式包括手术切除、经皮消融、冷冻治疗、经皮肝动脉插管栓塞化疗等[1]。循环肿瘤细胞(CTC)指从肿瘤原发或转移灶脱落进入外周血的肿瘤细胞。CTC检测有实时、无创、便捷等优点,为监测肿瘤发生发展情况提供了新的选择[2]。2013年12月~2015年12月,我们应用差减富集法结合荧光原位杂交技术检测肝癌患者的CTC,并分析CTC检测在肝癌诊断和治疗监测中的应用效能,现报告如下。
1 资料与方法
1.1临床资料肝癌患者27例(肝癌组),男24例、女3例,年龄28~84岁,肝细胞癌24例、肝胆管细胞癌3例,TNM分期Ⅱ期4例、Ⅲ期11例、Ⅳ期12例,11例未行任何治疗、2例行手术切除治疗、11例接受过肝动脉化疗栓塞术。另选30例健康志愿者为对照组,男20例、女10例,年龄31~57岁。两组年龄、性别分布有可比性。
1.2CTC检测及结果判定
1.2.1CTC检测采集两组外周血7.5 mL置于枸橼酸钠抗凝管,混匀,4 h内进行处理。采用差减富集技术,以特殊离心介质快速去除血中红细胞和血浆蛋白,通过耦联抗人白细胞表面抗原组合群的免疫磁微粒去除外周血中的白细胞,从而最大程度地富集外周血中的肿瘤细胞。将免疫荧光染色与染色体原位杂交技术整合,使用CEP8探针杂交肿瘤细胞,有效区分CTC、富集未除尽的白细胞和非血源性肿瘤上皮细胞。
1.2.2结果判定外周血富集后细胞可分为五个亚群:CK+/CD45-/CEP8=2为A亚群(CK阳性的二倍体肿瘤细胞),CK+/CD45-/CEP8≠2为B亚群(CK阳性的非二倍体肿瘤细胞),CK-/CD45-/CEP8≠2为C亚群(CK阴性的非二倍体肿瘤细胞),CK-/CD45-/CEP8=2为D亚群(非肿瘤上皮细胞或CD45未着色的白细胞),CK-/CD45+/CEP8≠2为E亚群(白细胞)。A、B、C亚群判定为CTC。
1.3肿瘤标志物检测采集两组静脉血离心获得血清,采用电化学发光法测定血清AFP、CEA、CA199,其中AFP>5.8 IU/mL为阳性、CEA>4.3 ng/mL为阳性、CA199>27.0 IU/mL为阳性。
1.4靶向治疗方法及疗效评价肝癌组所有患者均口服索拉菲尼400 mg/次,2次/d,每4周为一个治疗周期。除肝癌针对性治疗外,服药过程中可接受其他对症治疗,包括针对药物不良反应的治疗。所有患者每月门诊随访时进行腹部MRI检查。疗效评价参照实体瘤疗效评价标准(RECIST)。
1.5统计学方法采用SPSS17.0统计软件进行统计分析。将患者血清AFP、CEA、CA199、CTC检测结果输入数据库,计算血清AFP、CEA、CA199、CTC检测在肝癌诊断中的灵敏性、特异性,以最大约登指数(灵敏性+特异性-1)评估诊断效能。本研究资料属于偏态分布,定量资料采用秩和检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1CTC检出情况肝癌组CTC阳性22例(肝细胞癌患者19例、肝胆管细胞癌患者3例)、阴性5例,阳性率为81.5%;对照组未检出CTC;两组CTC检出率相比,P<0.05。19例HCC患者均检出C亚群,3例肝胆管细胞癌患者中1例检出A亚群、1例检出B亚群、3例检出C亚群。所有CTC阳性患者外周血中均检出多倍体CTC。在所有检出的肿瘤细胞中,以三倍体肿瘤细胞数量最多(占CTC总数的59.8%)。
2.2CTC、肿瘤标志物检测诊断肝癌的效能比较肝癌组中,AFP阳性17例、CEA阳性10例、CA199阳性11例,对照组分别为2、1、0例。CTC检测诊断肝癌的约登指数均高于三项肿瘤标志物检测(P均<0.05)。见表1。
2.3CTC检测结果与靶向治疗效果的关系肝癌组中10例服用索拉菲尼,8例治疗中CTC数量未有明显变化,疗效评价为SD,2例治疗前CTC总数较高者(>15/7.5 mL)在索拉菲尼治疗1个周期后有明显下降(<5/7.5 mL),但疗效评价也为SD。
3 讨论
肿瘤细胞播散进入血循环是发生远处转移的先决条件,在形成明显的原发灶前,肿瘤细胞或已脱落入血。CTC检测具有创伤性小、安全性高的优点。但CTC在外周血中存在的数目极少,仅为白细胞数量的1/107~1/106。CTC在不断适应外周血微环境的过程中,一部分发生上皮间质转化(EMT),一些肿瘤细胞可出现凋亡和抗原表达减弱。本研究采用免疫磁珠阴性分选技术,通过去除外周血中白细胞从而富集肿瘤细胞,然后进一步通过免疫细胞化学染色(CK18)结合原位杂交技术(FISH法)鉴定肿瘤细胞,使CTC得到最大程度的富集鉴定[3]。
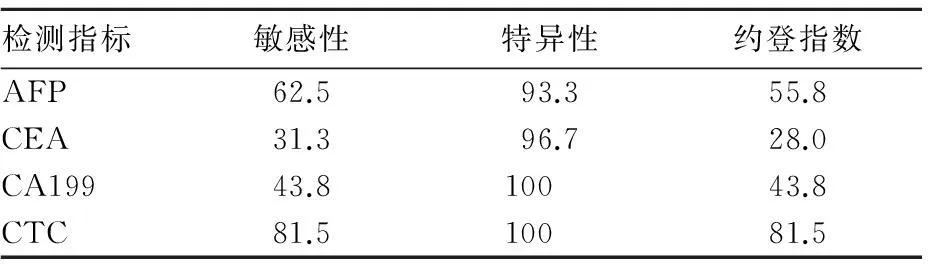
表1 CTC、AFP、CEA、CA199测诊断肝癌的敏感性、特异性、约登指数比较(%)
在对肿瘤组织进行免疫组化染色的过程中发现,正常组织中CK表达从靠近汇管区向肝小叶中央区呈逐渐衰减趋势;而在肝癌组织中,癌细胞和间质内假胆管染色均呈阳性[4]。本研究中仅1例肝胆管细胞癌患者外周血中检出CTC部分CK18染色阳性,19例肝细胞癌患者外周血中的CTC CK18染色均呈阴性。我们认为,虽然CTC来源于原发灶,理论上可代表其细胞的异质性,但在脱落入血过程中发生EMT后细胞表面标志物可发生变化。
肿瘤细胞增殖能力强,有些细胞在化疗后并不表现为凋亡,而是形成多倍体细胞。多倍体肿瘤细胞遗传性状不稳定,对放化疗不敏感,检出多倍体亚克隆肿瘤细胞的患者预后更差[5,6]。本研究结果显示,22例CTC阳性者均检出了多倍体CTC,其中14例检出3倍体亚群细胞,11例检出4倍体亚群细胞,12例检出5倍体及以上多倍体亚群细胞。
血清肿瘤标志物检测以创伤小、敏感性和特异性高、患者易接受而深受临床医生青睐。在肝癌肿瘤标志物中,AFP具有高敏感性,是肝癌诊断的首选血清学指标;CEA是一种广谱肿瘤标志物,用于消化系统肿瘤的诊断;CA199升高也多见于消化系统肿瘤。本研究结果显示,肝癌组AFP阳性17例、CEA阳性10例、CA199阳性11例,对照组分别为2、1、0例。CTC检测诊断肝癌的约登指数均高于三项肿瘤标志物检测,提示CTC在肝癌诊断中的应用效能较好。
索拉菲尼是一种口服小分子靶向药物,作用于Raf/MEK/ERK信号转导通路中的Raf激酶阻断肿瘤细胞增殖[7]。本研究结果显示,8例基线CTC<5/7.5 mL的患者在索拉菲尼治疗过程中,CTC数量未明显变化,但CTC总数始终<5/7.5 mL;2例治疗前CTC总数>15/7.5 mL的患者,在索拉菲尼治疗1个周期后外周血CTC总数降到5/7.5 mL以下,肿瘤病灶长径也有所减小。上述结果提示检测外周血CTC可能有助于评估靶向治疗的效果。
研究[8,9]表明,CTC可预测多种肿瘤患者的无进展生存期和总生存期,并与患者预后有一定关系。有学者[10]认为CTC检测对乳腺癌治疗方案的选择有一定指导作用[11]。然而,本研究入组病例数较少且观察时间有限,若要得出明确结论,还需进行大样本的后续研究。
[1] 许赟.极早期肝癌的治疗现状[J].中国微创外科杂志,2015,15(8): 739-743.
[2] Mu Z,Wang C,Ye Z,et al.Prospective assessment of the prognostic value of circulating tumor cells and their clusters in patients with advanced-stage breast cancer[J].Breast Cancer Res Treat,2015,154(3):563-571.
[3] Ge F,Zhang H,Wang DD,et al.Enhanced detection and comprehensive in situ phenotypic characterization of circulating and disseminatedheteroploid epithelial and glioma tumor cells[J].Oncotarget,2015,6(29):27049-27064.
[4] 李蔚,周慧聪,李继昌,等.细胞角质素CK18和CK19在肝细胞癌组织中的表达[J].世界华人消化杂志,2008,16(7):721-725.
[5] Aly MS,Bahnassy AA,Abdel-Rahman ZN.Investigation of chromosomal aberrations in Egyptian hepatocellular carcinoma patients by fluorescence in situ hybridization[J].Indian J Hum Genet,2010,16(2):87-93.
[6] 王士勇,杨振君,于环,等.多倍体肿瘤细胞的建立及其生物学特性的研究[J].中华肿瘤防治杂志,2008,15(12):886-889.
[7] Federico A,Orditura M,Cotticelli G,et al.Safety and efficacy of sorafenib in patients with advanced hepatocellular carcinoma and Child-Pugh A or B cirrhosis[J].Oncol Lett,2015,9(4):1628-1632.
[8] Jiang ZF,Cristofanilli M,Shao ZM,et al.Circulating tumor cells predict progression-free and overall survival in Chinese patients with metastatic breast cancer,HER2-positive or triple-negative (CBCSG004): a multicenter,double-blind,prospective trial[J].Ann Oncol,2013,24(11):2766-2772.
[9] Poveda A,Kaye SB,McCormack R,et al.Circulating tumor cells predict progression free survival and overall survival in patients with relapsed and recurrent advanced ovarian cancer[J].Gynecol Oncol,2011,122(3):567-572.
[10] Hayashi N,Nakamura S,Yagata H,et al.Chromosome 17 polysomy in circulating tumor cells in patients with metastatic breast cancer: a case series[J].Int J Clin Oncol,2011,16(5):596-600.
[11] Scher HI,Heller G,Molina A,et al.Circulating tumor cell biomarker panel as an individual-level surrogate for survival in metastatic castration-resistant prostate cancer[J].J Clin Oncol,2015,33(12):1348-1355.
Detection and application of circulating tumor cells in peripheral blood of patients with liver cancer
MA Qing1,JIA Ru,ZHANG Chunyan,JIN Xin,ZUO Xianghua,LIN Ping,XU Jianming,CHEN Shuiping,CHEN Jiankui
(1 PLA 307 Clinical College of Anhui Medical University,Beijing 100071,China)
ObjectiveTo observe the circulating tumor cells (CTC) in the peripheral blood of patients with liver cancer and to investigate the application of CTC detection in the early diagnosis and monitoring treatment of liver cancer.MethodsTwenty-seven patients with primary liver cancer were selected as the liver cancer group and 30 healthy person were selected as the control group.The peripheral blood was collected,and we enriched the CTC by subtraction enrichment technology and identified them by fluorescence in situ hybridization (FISH) technique.The serum tumor markers AFP,carcino-embryonic antigen (CEA) and CA199 of the two groups were detected by electrochemiluminescence method.The sensitivity,specificity and youden index of CTC,AFP,CEA and CA199 were comprehensively compared,and the relationship between CTC and therapeutic effect of targeted therapy was analyzed.ResultsCTC was detected in 22 cases of the liver cancer group,while in the control group the number was 0 (P<0.05).C subset of tumor cells was detected in 22 cases of the liver cancer group while there was only 1 case of A subset and 1 case of B subset.Polyploidy tumor cells were all detected in patients with positive CTC,and the triploid took the largest proportion (59.8%).In the liver cancer group,17 cases were positive AFP,10 cases were positive CEA and 11 cases were positive CA199,while the numbers in the control group were respectively 2,1 and 0.The youden index of CTC detection was better than the other three tumor markers in detection and diagnosis (P<0.05).Ten patients in the liver cancer group insisted taking target drugs,the number of CTC was stable in 8 patients,the RECIST was SD.The number of CTC declined (<5/7.5 mL) in 2 patients with high TCT number (>15/7.5 mL) after taking one-week Sorafenib,while the RECIST was also SD.ConclusionsCTC in the peripheral blood of patients with liver cancer could be detected effectively by subtraction enrichment technique.Compared with common tumor markers,the CTC detection shows more advantages,and it could be used to assess the effect of targeted therapy in patients with liver cancer.
circulating tumor cells; liver neoplasms; liver cancer; tumor biomakers
首都临床特色应用研究项目(Z121107005112001);国家高技术研究发展计划项目(2011AA02A111)。
马清(1990-),女,硕士研究生,主要研究方向为免疫学。E-mail:395050029@qq.com
简介:陈建魁(1963-),男,主任医师,主要研究方向为免疫学。E-mail:chenjk307@163.com
10.3969/j.issn.1002-266X.2016.19.006
R735.7
A
1002-266X(2016)19-0019-03
2015-12-24)
