NixCo1-xS2的水热法制备及热电池放电性能
2016-08-31杨坤坤杨少华赵彦龙
杨坤坤, 赵 平, 杨少华, 赵彦龙
(1. 沈阳理工大学环境与化学工程学院, 沈阳 110159;2. 辽宁省特种储备电源工程技术研究中心, 沈阳 110159; 3. 北方特种能源集团西安庆华公司, 西安 710025)
NixCo1-xS2的水热法制备及热电池放电性能
杨坤坤1,2, 赵平1,2, 杨少华1,2, 赵彦龙3
(1. 沈阳理工大学环境与化学工程学院, 沈阳 110159;2. 辽宁省特种储备电源工程技术研究中心, 沈阳 110159; 3. 北方特种能源集团西安庆华公司, 西安 710025)
以氯化镍、硫酸钴、硫代硫酸钠为反应物, 通过水热法合成系列NixCo1-xS2(x=0, 0.1, 0.3, 0.5, 0.7, 0.9, 1.0)粉体材料; 采用X射线衍射光谱仪(XRD)、扫描电子显微镜(SEM)、激光粒度分布仪和差热分析仪(DTA)等对材料进行表征; 采用粉末压片工艺将材料与锂硅合金和LiCl-KCl(MgO)熔盐电解质装配成单体电池, 考察了NixCo1-xS2正极材料中镍、钴的含量对其放电性能的影响. 结果表明, 当x=0.3时, NixCo1-xS2正极材料在100 mA/cm2恒流放电时, 单体电池放电电压可以达到1.899 V, 截止电压为1.5 V时比容量为276.5 mA·h/g, 放电过程中单体电池内阻较低, 放电性能最好.
热电池; 正极材料; 水热合成; NixCo1-xS2
热电池是一种热激活贮备电池, 它是使用电池本身的加热系统将常温下为固体的电解质加热熔融呈离子型导体而进入工作状态并开始放电的一次电池[1], 其工作温度为350~550 ℃, 主要特点是放电速率快, 比功率和比能量高, 贮存寿命长. 作为引信用电池被广泛应用在军用武器上[2]. 过渡金属硫化物具有较正的电极电位, 是较好的热电池正极材料. FeS2是热电池工业中应用最广泛的锂系热电池正极材料, 但FeS2材料自身存在的高内阻和低热稳定性等缺点限制了电池性能的提高[3]. CoS2是一种新型的高功率正极材料, 稳定性比FeS2好, 在低共熔盐中溶解度较小, 导电性较好, 可以降低单体电池的欧姆极化[4,5]. 赵平等[6]在不同pH值条件下通过水热法合成了不同形貌的CoS2, 并比较了其单体热电池放电性能的差异. NiS2与FeS2和CoS2相比, 具有相同的黄铁矿结构, NiS2与CoS2电极过程比FeS2简单, Preto等[7]比较了NiS2, CoS2和FeS2在LiCl-KCl电解质中的电化学性能, 发现三者具有较多相近的电化学性质. Yang等[8]采用水热法制备出NiS2并与天然FeS2进行放电性能比较, 结果表明, NiS2具有较小的极化内阻, 大电流密度下的放电性能比天然FeS2材料好. 林宝山等[9]在不同pH值条件下采用水热法制备出不同形貌的NiS2, 并使用碳纳米管作导电剂, 比较了单体热电池放电性能, 结果表明, 立方体形NiS2的放电性能优于球形和片形NiS2.
随着过渡金属硫化物正极材料研究的发展, 已出现了CuFeS2[10], Fe1-xCoxS2[11]等双金属二硫化物用作热电池正极材料的研究报道. Xiao等[12]研究发现, 镍钴双金属硫化物具有较高的电导率和比CoS2, NiS2更好的氧化还原性能; Xia等[13]制备的NiCo2S4在室温下电阻率为10-3Ω·cm; Jin等[14]研究了NiCo2S4在锂离子电池上的应用; Peng等[15]制备出NiCo2S4-RGO并研究了其电化学性能; Li等[16]制备了NixCo1-xS2/还原氧化石墨烯并探索其在超级电容器上的应用; CoNi2S4和NixCo3-xS4在超级电容器上的应用也有报道[17~20]. 但关于镍钴双金属硫化物用作热电池正极材料的研究报道较少[4].
本文通过调节NiCl2·6H2O和CoSO4·7H2O的摩尔比, 采用水热法合成了镍钴双金属硫化物(NixCo1-xS2)材料并用作热电池的正极材料, 对其放电性能进行了测试, 研究了NixCo1-xS2正极材料中镍、钴的含量对放电性能的影响.
1 实验部分
1.1试剂与仪器
氯化镍(NiCl2·6H2O)、硫酸钴(CoSO4·7H2O)和硫代硫酸钠(Na2S2O3·5H2O)等均为分析纯, 购于天津市大茂化学试剂厂; 盐酸(HCl), 分析纯, 沈阳派尔精细化工公司; 二硫化碳(CS2), 分析纯, 天津市北联精细化学品公司; 无水乙醇(C2H5OH), 分析纯, 天津市富宇精细化工公司; 实验用水为自制蒸馏水. D/max-RB型X射线衍射仪(XRD, 日本理学公司), CuKα辐射源, 靶电压为40 kV, 靶电流为100 mA, 扫描范围10°~90°, 步长为0.02°, 扫描速度为6°/min; S-3400N型扫描电子显微镜(SEM, 日本日立公司); BT-9300ST激光粒度分布仪(丹东市百特仪器有限公司); DTA-100差热分析仪(北京恒久科学仪器厂); LS800S手套箱(成都德力斯实业有限公司, Ar氛围); CT2001A蓝电电池测试系统(武汉蓝电公司).
1.2样品制备
将NiCl2·6H2O和CoSO4·7H2O按不同的Ni/Co摩尔比(1∶9, 3∶7, 1∶1, 7∶3, 9∶1)共取42 mmol, 溶解于350 mL去离子水中, 再加入84 mmol Na2S2O3·5H2O, 搅拌均匀后倒入500 mL内衬聚四氟乙烯的不锈钢水热反应釜中, 置于180 ℃烘箱中反应24 h, 然后将反应釜自然冷却至室温, 滤出釜底沉淀物, 依次用CS2、稀盐酸、乙醇和去离子水清洗2次, 在80 ℃下真空干燥6 h. 所得样品标记为NixCo1-xS2(x= 0.1, 0.3, 0.5, 0.7, 0.9). 作为对比, 分别配制不含氯化镍和不含硫酸钴的溶液, 在相同条件下制备CoS2和NiS2.
1.3LiSi/LiCl-KCl(MgO)/NixCo1-xS2单体电池的组装与性能测试
我们的出发点仍然是从语言表达着手来理解弗雷格的对象,关键在于理解什么是“不带有空位”的表达,即理解弗雷格的专名。但正如达米特所言,“弗雷格从未费心对‘专名’这一范畴做过任何精确的规定”,而是“满足于让专名与其他类型的表达之间的整个区别依赖于直觉认识,仅以最为马虎的考察为向导”。[注]Dummett, Frege, Philosophy of Language, Harper & Row, Publishers, 1973, p. 54. 斯鲁格则大致总结出了识别弗雷格之专名的四个标准:

Fig.1 X-ray diffraction patterns of NixCo1-xS2with different Ni contentsx: a. 0; b. 0.1; c. 0.3; d. 0.5; e. 0.7; f. 0.9; g. 1.0.
分别将NixCo1-xS2各样品、LiCl-KCl共熔盐和 MgO按质量比(7∶2∶1)在玛瑙研钵中混合均匀, 配制成正极材料, 并在真空干燥箱中于120 ℃干燥12 h. 负极采用LiSi合金[含10%(质量分数)KCl], 电解质体系为含适量活性MgO的二元LiCl-KCl共熔盐, 其中MgO作为黏结剂, 抑制电解质在熔融状态下的流动. 采用粉末压片工艺, 在10 MPa压强下将正、负极分别压制成片, 在氩气氛围的手套箱中装配成单体电池. 在恒温450 ℃的管式炉中, 在通入氩气的条件下对单体电池进行100 mA/cm2恒电流放电测试, 放电截止电压0.1 V; 单体电池在以100 mA/cm2恒流放电时, 每40 s施加一次强度为1000 mA/cm2、宽度为1 s的脉冲电流, 根据脉冲前后电压和电流的变化, 计算该单体电池在每次脉冲放电时的内阻(R)[21]:R=-(U1-U2)/(I1-I2)(其中:U1为脉冲前瞬间单体电池电压,U2为脉冲后瞬间单体电池电压,I1为脉冲前瞬间工作电流,I2为脉冲后瞬间工作电流).
2 结果与讨论
2.1NixCo1-xS2材料的XRD分析

2.2NixCo1-xS2材料的SEM和元素分析
图2为水热法制备的NixCo1-xS2材料、CoS2和NiS2的SEM照片. 可见, CoS2的纳米颗粒形状不规则, 有团聚现象;x=0.1时晶粒较小, 晶粒团聚为无规则的粒子团, 样品呈疏松状, 部分颗粒结块较大;x=0.3时颗粒形状无规则, 颗粒表面上分布有更小的颗粒, 颗粒团聚较密集;x=0.5时开始出现块状颗粒, 块状颗粒周围分布有无规则的粒子团;x=0.7时, 颗粒呈块状, 团聚较密集, 其颗粒尺寸约为2 μm;x=0.9时, 纳米颗粒呈球形, 有部分团聚现象, 颗粒大小分布不均匀, 颗粒尺寸范围约1.2~5 μm; NiS2的纳米球状颗粒有团聚现象, 颗粒分布较均匀, 颗粒尺寸范围约3~4 μm.

Fig.2 SEM images of NixCo1-xS2 with different Ni contentsx: (A) 0; (B) 0.1; (C) 0.3; (D) 0.5; (E) 0.7; (F) 0.9; (G) 1.0.

Fig.3 EDX spectra of NixCo1-xS2 with different Ni contentsx: (A) 0; (B) 0.1; (C) 0.3; (D) 0.5; (E) 0.7; (F) 0.9; (G) 1.0.
图3是水热法制备的NixCo1-xS2材料的EDX谱图. 可看出, 材料主元素为Ni, Co, S. 在0.8, 7.0及7.6 keV处出现Co的散射峰, 在0.9, 7.5, 8.3 keV出现Ni的散射峰, 在2.3 keV处出现较强的S的散射峰. 随着Ni含量的增加, EDX谱图中Ni元素的峰逐渐增强, 而Co元素的峰逐渐减弱, S的峰基本保持不变. 图3 (B)~(F)中在0.52 keV处出现O杂质峰, 图3(E)和(G)中出现C杂质峰, 可能是测试过程中有杂质污染所致. 表1列出了用EDX分析得出的各样品的元素质量分数, 产物中的Ni/Co质量比接近Ni/Co投料比.
2.3NixCo1-xS2材料的粒度分析
图4和表2为水热法制备的NixCo1-xS2材料、CoS2和NiS2的粒度分布结果. 由图4和表2可知, 材料整体粒径分布范围x=0.1的样品最小,x=0.9的样品和NiS2粒径分布范围较大, 与材料的SEM照片对比发现, 由于粒子团聚,x=0, 0.3, 0.7样品的整体粒径分布范围相对增大.
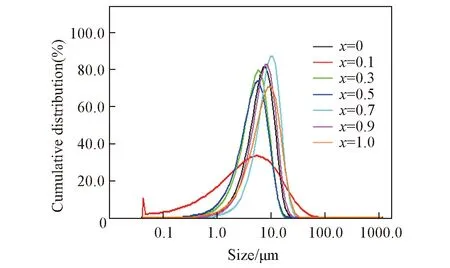
Fig.4 Particle size distributions of NixCo1-xS2 with different Ni contentsTable 2 Particle size distributions of NixCo1-xS2with different Ni contents*

xD10/μmD50/μmD90/μm02.626.1311.010.10.423.5514.810.31.964.738.670.51.714.478.600.73.768.3014.340.92.876.6311.781.02.717.3414.33
*D10:theparticlediameterat10%cumulativevolume;D50:theparticlediameterat50%cumulativevolume;D90:theparticlediameterat90%cumulativevolume.

Fig.5 DTA curves of NixCo1-xS2 with different Ni contents

Fig.6 Discharge curves of LiSi/NixCo1-xS2 single cell with different Ni contents under 450 ℃ at 100 mA/cm2
图5为水热法制备的NixCo1-xS2材料的差热曲线, 测试条件:Ar气氛, 室温~800 ℃, 升温速率10 ℃/min. 从图中可看出, 除NiS2外, 其它各组样品在553~560 ℃范围内均有一个小吸热峰, 对应于含钴杂质的分解;CoS2在656.1~729.2 ℃,NiS2在639~716.6 ℃温度范围内出现较大的吸热峰, 峰值温度分别为707.8和695.5 ℃, 分别对应于CoS2和NiS2的分解过程; x=0.1, 0.3, 0.5, 0.7, 0.9的样品分别在650~738, 613~731.7, 610~724.5, 611~703.9和609~731 ℃温度范围内出现一个较大的吸热峰, 峰值温度分别为718.6, 713.6, 703.1, 669.1, 708.2 ℃, 该峰的产生对应于CoS2和NiS2的分解. 比较发现, 随着Ni含量的增加,NixCo1-xS2材料的分解起始温度有降低的趋势.
2.5热电池单体电池的放电性能对比
2.5.1LiSi/LiCl-KCl(MgO)/NixCo1-xS2的恒电流密度放电测试图6为不同x值的NixCo1-xS2正极材料组装的单体电池在100mA/cm2电流密度下恒电流放电时的放电曲线. 可以看出, 采用不同x值的NixCo1-xS2作正极材料时, 放电曲线发生变化, 各样品组成的单体电池在放电初期均存在电压尖峰, 电压尖峰的产生原因是水热合成过程中产生杂质硫和放电瞬间融化的电解质中锂离子活度的巨大变化[3]. 在放电过程中, 随着活性物质的消耗和还原相的生成, 极化增加, 导致电池电压不断下降, 因放电机理的变化使放电曲线上产生了不同的平台区域. 在LiSi/CoS2单体热电池中,CoS2的电极反应如下[4]:
(1)
(2)
(3)
CoS2的三步还原反应使CoS2的放电曲线整体呈现3个平台. 与LiSi/CoS2体系热电池相比,LiSi/NiS2单体电池的放电过程更复杂, 中间相多,NiS2放电时的还原过程可表示如下:
(4)
利用循环伏安法可以研究熔盐中的还原行为[22]. 文献[7]报道了CoS2和NiS2在LiCl-KCl中相对LiAl的还原电位, 而相对LiSi合金的电位还未见报道. 本实验中CoS2和NiS2的放电平台开始电压与文献[7]中CoS2和NiS2相对LiAl的还原电位接近.NixCo1-xS2材料的放电过程与CoS2和NiS2的还原过程相对应, 两者的放电反应使放电曲线发生变化, 平台电压也发生变化. 观察图中放电曲线可发现,CoS2的放电曲线整体呈现3个平台, 放电起始电压为1.988V, 电压尖峰较大; 电压降至1.773V后, 开始出现第一个放电平台, 平台时间较短, 比容量低, 为132.7mA·h/g; 随着放电过程的进行, 在1.647V放电曲线进入第二平台, 电势较第一平台平稳; 在1.304V开始出现第三平台, 电势较平稳, 放电到1.024V左右, 其放电电压急剧下降. 放电电压截止到1.5和0.1V时, 对应的放电比容量分别为248.7和557.1mA·h/g.
对于NixCo1-xS2材料, 当x=0.1时, 单体电池的放电起始电压为1.997V, 电压尖峰较大, 放电曲线与CoS2相似, 也呈现3个平台, 但第一平台的电压和比容量开始增加, 第一放电平台电压为1.780~1.629V, 较CoS2高约0.007V, 电位平台较CoS2长, 放电比容量158.2mA·h/g; 第二放电平台电压为1.629~1.306V; 第三平台开始于1.306V, 放电到1.044V左右, 其放电电压急剧下降. 放电电压截止到1.5和0.1V时, 对应的放电比容量分别为260.3和577.3mA·h/g.
当x=0.3时, 单体电池的放电曲线整体呈现4个平台, 放电起始电压为1.899V, 电压降至1.787V后, 开始出现第一个放电平台, 放电平台电压范围为1.787~1.649V, 放电过程中电压下降较平缓, 较CoS2高0.014V左右, 放电比容量167.7mA·h/g; 第二放电平台的时间相对较短; 第三放电平台电压为1.572~1.328V; 第四放电平台开始于1.328V, 放电到1.097V左右, 其放电电压急剧下降. 放电电压截止到1.5和0.1V时, 对应的放电比容量分别为276.5和616.4mA·h/g. 因NiS2第一步还原反应的电位较CoS2高[7], 正极材料Ni含量的增加使第一平台电压增加, 因Ni2+和Co2+还原过程的共同进行, 延长了可利用平台, 提高了截止到1.5V时的放电比容量和整体放电比容量.
当x=0.5时, 单体电池的放电曲线整体呈现4个平台, 放电起始电压为1.978V, 第一放电平台电压为1.806~1.584V, 平台电压较高, 但下降速度较快, 放电比容量为175mA·h/g; 第二放电平台电压为1.584~1.354V; 第三放电平台开始于1.354V, 放电到1.141V左右, 其放电电压急剧下降, 并在0.760~0.410V出现一个较小的电压平台. 放电电压截止到1.5和0.1V时, 对应的放电比容量分别为225.9和532.1mA·h/g. 因正极材料中Ni含量的继续增加, 在正极材料的反应中, 第一放电平台放电性能继续提高, 但截止到1.5V时可利用的平台性能开始下降.
当x=0.7时, 单体电池的放电曲线整体呈现3个平台, 平台下降趋势与x=0.5时有明显差异, 其放电起始电压为2.027V, 第一放电平台电压为1.807~1.332V, 电压平台较平缓, 放电时间长, 比容量大, 为297.2mA·h/g; 第二平台开始电压为1.332V, 放电到1.156V左右, 其放电电压急剧下降, 并在0.736~0.413V出现一个较小的电压平台. 放电电压截止到1.5和0.1V时, 对应的放电比容量分别为245.5和527.3mA·h/g. 在该比例的正极材料中, 第一个放电平台下降相比其它组材料平缓, 可能原因是材料主要成分为CoNi2S4, 具有Co2+,Co3+,Ni2+,Ni3+多种价态[18], 其反应机理与NiS2和CoS2明显不同.
当x=0.9时, 单体电池的放电曲线整体呈现5个平台, 放电起始电压为1.983V, 第一放电平台电压为1.814~1.683V, 电压相对较高, 下降较快, 放电比容量为130mA·h/g; 随着放电过程的进行, 开始出现2个小平台, 电压范围分别为1.683~1.555V和1.555~1.336V; 第四平台开始电压为1.336V, 放电到1.130V左右, 电压下降幅度急剧增加, 放电末期出现第五个平台, 电压范围为0.783~0.413V. 放电电压截止到1.5和0.1V时, 对应的放电比容量分别为212.8和490.1mA·h/g.
NiS2的放电起始电压为1.866V, 第一平台电压为1.817~1.665V, 电压较CoS2高, 但放电电位平台较CoS2短, 平台比容量为118.3mA·h/g. 随着放电过程的进行,NiS2放电过程中形成相的电阻较CoS2的大, 电池极化增加,NiS2放电曲线电压开始低于CoS2. 其第二、第三平台较小, 2个平台电压下降速度相近, 在1.331V处开始出现第四平台, 放电到1.150V左右, 其放电电压急剧下降. 放电末期出现一个较小平台, 电压范围为0.778~0.431V. 放电截止到1.5和0.1V时, 对应的放电比容量分别达到187.9和466.2mA·h/g.NiS2在放电过程中电压下降较快, 一方面因为其反应形成相的电导率低; 另一方面是其颗粒较大, 比表面积相对较小, 活性物质与电解质接触面积减小, 使实际工作电流密度较大, 极化增大[23], 导致电压下降较快.
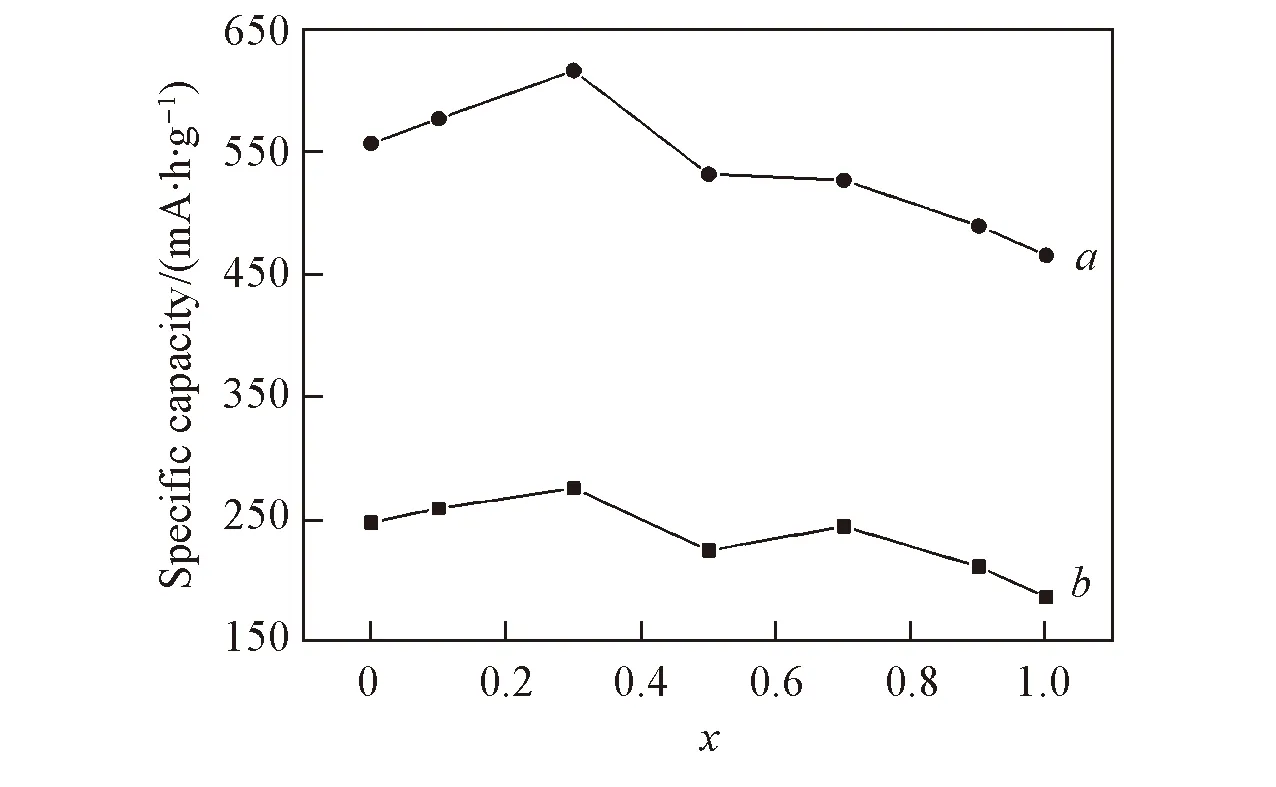
Fig.7 Specific capacity of NixCo1-xS2 with different Ni contents a. Discharged to the cut-off voltage of 0.1 V;b. discharged to the cut-off voltage of 1.5 V.
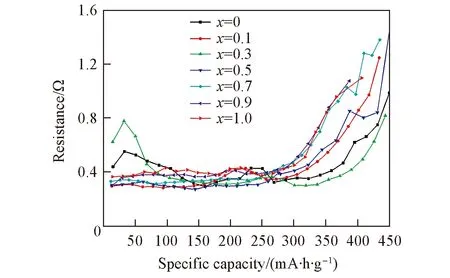
Fig.8 Resistance values of LiSi/NixCo1-xS2 single cell with different Ni contents
图7为放电电压截止到1.5和0.1V时单体电池的放电比容量曲线. 通过比较可以发现,CoS2放电比容量高于NiS2, 当x≤0.3时, 随着Ni含量的增加, 放电平台电压和平台比容量逐渐增加, 当x=0.3时, 单体电池放电性能最好, 截止到1.5和0.1V时放电比容量最大.Ni含量过高时, 单体电池放电比容量下降, 但比NiS2放电性能好. 当Co占主体时, 随着Ni含量的增加, 放电性能会提高, 这主要归因于Ni和Co的协同相互作用提高了材料的电化学反应活性[24]和反应效率, 降低了极化, 提高了放电比容量; 当Ni含量较高时, 平台和放电比容量下降, 是因为NiS2在放电过程中极化增加幅度大于CoS2, 当NiS2占主体时, 正极材料电导率降低, 单体电池内阻增大, 导致放电性能下降. 当x=0.3时单体电池截止到1.5V时的放电比容量相对较高, 2个平台之间过渡趋于平坦, 由此说明以合适的Ni和Co比例进行复合时, 能提升CoS2和NiS2放电性能.
2.5.2单体电池内阻变化曲线图8为不同x值的NixCo1-xS2正极材料组装的单体电池内阻变化曲线. 与图7比较发现, 内阻变化曲线与单体电池放电曲线一致. 在放电过程中随着活性物质的消耗和反应产物的积累, 材料电导率下降, 极化增加, 单体内阻升高, 放电电压不断降低. 随着放电深度增加, 单体电池内阻在放电后期急剧增加, 导致放电曲线急剧下降. 图8只比较了各组单体电池在450mA·h/g前的单体电池内阻变化曲线.
由图8看出, x=0.1, 0.5, 0.7时单体电池在放电前期内阻差别不大, 约为0.3Ω. 当x=0.7时单体电池的内阻增加速度较快. x=0和0.3时单体电池在放电初期内阻较大, 可能原因是CoS2在储存过程中产生CoSO4和S等杂质, 使正极材料的内阻增加[25], 随着反应的进行, 杂质被消耗, 内阻逐渐降低, 在放电后期, x=0.3的正极材料在放电过程中极化相对较小, 单体电池内阻增幅比其它组的低, 其放电电压降小于其它各组, 因此放电平台下降平缓, 放电比容量最大. x=0.9和1.0时单体电池在放电过程中内阻较高, 在后期内阻增加速度较快, 可能原因是材料中Ni含量较多, 其自身导电性比CoS2低而且材料颗粒尺寸较大, 比表面积小, 导致放电过程中极化增加, 内阻增加.
3 结 论
采用水热法合成了不同x值的NixCo1-xS2材料, 并对其热电池放电性能进行研究. 结果表明, 制备的双金属硫化物材料的热分解温度比CoS2和NiS2的低, 材料分解的起始温度随着Ni含量的增加而呈现降低的趋势;Ni含量的增加有利于放电平台电压和放电比容量的提高, 但Ni含量过多时, 较高的内阻极化会影响正极材料放电性能, 当x=0.3时, 单体电池具有最佳的放电性能, 放电过程中内阻增幅相对较小, 截止电压为1.5V时, 放电比容量达到276.5mA·h/g. 说明采用合适Ni,Co比例的NixCo1-xS2作正极材料能提高单体电池的放电性能.
[1]LuR.S.,LiuX.J., Thermal Batteries,NationalDefenseIndustryPress,Beijing, 2005, 80—108(陆瑞生, 刘效疆. 热电池, 北京: 国防工业出版社, 2005, 80—108)
[2]GuidottiR.A.,MassetP.J., Journal of Power Sources, 2006, 161(2), 1443—1449
[3]MassetP.J.,GuidottiR.A., Journal of Power Sources, 2008, 177(2), 595—609
[4]MassetP.J.,GuidottiR.A., Journal of Power Sources, 2008, 178(1), 456—466
[5]LvK., Synthesis of CoS2and Preparation of Thin-film Electrode for Thermal Battery,ShenyangLigongUniversity,Shenyang, 2013(吕坤. 热电池用CoS2的合成及其薄膜电极的制备, 沈阳: 沈阳理工大学, 2013)
[6]ZhaoP.,LvK.,YangS.H.,GaoH., Journal of Functional Materials, 2013, 44(S1), 108—111(赵平, 吕坤, 杨少华, 高虹. 功能材料, 2013, 44(S1), 108—111)
[7]PretoS.K.,TomczukZ.,vonWinbushS.,RocheM.F., J. Electrochem. Soc., 1983, 130(2), 264—273
[8]YangZ.T.,LiuX.J.,CuiY.X., ECS Transactions, 2014, 61(38), 9—14
[9]LinB.S.,CaoX.H.,YangS.H., Journal of Shenyang Ligong University, 2014, 33(2), 26—30(林宝山, 曹晓辉, 杨少华. 沈阳理工大学学报, 2014, 33(2), 26—30)
[10]SwiftG.,LambC., Thermal Battery Cathode Materials and Batteries Including Same,US2010030853A1, 2010-12-09
[11]AwanoA.,HaraguchiK.,YamasakiH., Power Sources Symposium, IEEE 35th International,CherryHill,NewJersey,US, 1992, 219—222
[12]XiaoJ.,WanL.,YangS.,XiaoF.,WangS., Nano Letters, 2014, 14(2), 831—838
[13]XiaC.,LiP.,GandiA.N.,SchwingenschlöglU.,AlshareefH.N., Chemistry of Materials, 2015, 27(19), 6482—6485
[14]JinR.C.,LiuD.M.,LiuC.P.,LiuG., RSC Adv., 2015, 5, 84711—84717
[15]PengS.,LiL.,LiC.,TanH.,CaiR.,YuH.,YanQ., Chem. Commun.(Camb.), 2013, 49(86), 10178—10180
[16]LiG.L.,XuC.L., Carbon, 2015, 90, 44—52
[17]HuQ.,MaW.,LiangG.,NanH.,ZhengX., RSC Adv., 2015, 5, 84974—84979
[18]DuW.M.,WangZ.Y.,ZhuZ.Q.,HuS.,ZhuX.Y.,ShiY.F.,PangH.,QianX.F., Journal of Materials Chemistry A, 2014, 2, 9613—9619
[19]YuL.,ZhangL.,WuH.B.,LouX.W., Angewandte Chemie, 2014, 126(14), 3785—3788
[20]DingR.,GaoH.,ZhangM.Y.,ZhangJ.,ZhangX.T., RSC Adv., 2015, 5(60), 48631—48637
[21]MassetP.,SchoeffertS.,PoinsoJ.Y.,PoignetJ.C., J. Electrochem. Soc., 2005, 152(2),A405—A410
[22]ZhangM.,HanW.,ZhangM.L.,LiY.N.,ZhuF.Y.,XueY., Chem. Res. Chinese Universities, 2014, 30(3), 489—494
[23]YangZ.T.,LiuX.J.,FengX.L.,CuiY.X.,YangX.W., J. Applied Electrochemistry, 2014, 44, 1075—1080
[24]FaberM.S.,LukowskiM.A.,DingQ.,KaiserN.S.,JinS., J. Phys. Chem. C: Nanomater. Interfaces, 2014, 118(37), 21347—21356
[25]NiZ.J., Study on the Properties of Thermal Battery Cathode Material CoS2and CoS2-LVO Composite Materials,HarbinInstituteofTechnology,Harbin, 2014(倪祖君. 热电池正极材料CoS2及CoS2-LVO复合材料性能研究, 哈尔滨: 哈尔滨工业大学, 2014)
(Ed.:S,Z,M)
HydrothermalSynthesisofNixCo1-xS2andItsDischargePerformanceinThermalBatteries
YANGKunkun1,2,ZHAOPing1,2,YANGShaohua1,2*,ZHAOYanlong3
(1. College of Environmental and Chemical Engineering, Shenyang Ligong University, Shenyang 110159, China;2. Special Reserve Battery Engineering and Technology Research Center of Liaoning Province, Shenyang 110159, China;3. Xi’an Qinghua Co., Ltd., North Special Energy Group, Xi’an 710025, China)
NixCo1-xS2(x=0, 0.1, 0.3, 0.5, 0.7, 0.9, 1.0)powderswerepreparedbyhydrothermalmethodusingNiCl2,CoSO4andNa2S2O3andcharacterizedwithX-raydiffractometer(XRD),scanningelectronmicroscope,laserparticlesizedistributionanalyzeranddifferentialthermalanalyser(DTA).AsinglecellwaspreparedwithaNixCo1-xS2cathode,aLiSianodeandaLiCl-KCl(MgO)moltensaltelectrolytebypressed-powerprocess.TheeffectsofNiandCocontentsinNixCo1-xS2cathodematerialsonthedischargeperformanceofthermalbatterywereinvestigated.TheresultssuggestthatthesinglecellcathodematerialwithNi0.3Co0.7S2cathodhasthebestperformanceandtheresistanceisrelativelylow.Thecellvoltagecanreach1.899V,andthespecificcapacitycanreach276.5mA·h/gwithacut-offvoltageof1.5Vataconstantcurrentdensityof100mA/cm2andatemperatureof450 ℃.
Thermalbattery;Cathodematerial;Hydrothermalsynthesis;NixCo1-xS2
2016-03-23. 网络出版日期: 2016-07-19.
O646; O611
A
联系人简介: 杨少华, 男, 博士, 教授, 主要从事新型化学电源研究. E-mail: 1276994969@qq.com
