基于呋喃酚构建2-(4-芳氧苯氧基)丙酰胺及除草活性
2016-08-31杨子辉李贝贝胡艾希
杨子辉, 李贝贝, 叶 姣, 胡艾希
(湖南大学化学化工学院, 长沙410082)
基于呋喃酚构建2-(4-芳氧苯氧基)丙酰胺及除草活性
杨子辉, 李贝贝, 叶姣, 胡艾希
(湖南大学化学化工学院, 长沙410082)
以呋喃酚为原料, 采用2条合成路线制备2种关键中间体2-氨基-1-(2,2-二甲基-7-烷氧基-2,3-二氢苯并呋喃-5-基)乙酮盐酸盐(2)和n-(2,2-二甲基-2,3-苯并呋喃-7-氧基)烷胺(9), 再经2-(4-芳氧苯氧基)丙酰化合成了17种基于呋喃酚的2-(4-芳氧苯氧基)丙酰胺, 其化学结构经核磁共振谱、高分辨率质谱和旋光度确证. 除草活性测试结果表明, 在1500 g/hm2剂量下, 大部分化合物对单子叶杂草马唐(Crabgrass)和稗草(Barnyardgrass)均具有较高的抑制活性. 在化合物4和5中, 有7个化合物对单子叶杂草表现为A级除草活性, 如化合物4a, 4b, 4i, 5a, 5c, 5e和5h对马唐和稗草的抑制率为100%. 初筛结果显示, 在375 g/hm2剂量下, 化合物4a, 4b, 4i, 5e和5h对稗草的茎叶处理抑制率达96%以上.
2-(4-芳氧苯氧基)丙酰胺; 呋喃酚; 除草活性

Fig.1 Structures of compounds A—E
2-(4-芳氧苯氧基)丙酸类化合物是一类选择性抑制植物乙酰辅酶A羧化酶的除草剂[1], 具有高效、低毒、高选择性、对作物安全及易于降解等特点[2]. 目前, 已商品化的2-(4-芳氧苯氧基)丙酸品种达20余个, 如2010年上市的噁唑酰草胺[3]. 近年来通过对2-(4-芳氧苯氧基)丙酸类化合物的研究, 已发现一大批高活性化合物[4~7]. 胡宏平[8]将嘌呤环引入2-(4-芳氧苯氧基)丙酸结构中, 合成的化合物在200 μmol/L浓度下对马唐(Crabgrass)的抑制率为90%. 邹小毛等[9]将吗啉、哌啶和四氢吡咯环引入2-(4-芳氧苯氧基)丙酰胺结构中, 合成了一类水油兼溶的化合物, 其中化合物A在30 g/hm2剂量下, 对马唐和稗草(Barnyardgrass)的抑制率达100%. 李斌[10]设计合成了类似喔草酯结构, 并引入乙醇胺和乙二醇等链桥连接化合物, 其中化合物B在2000 g/hm2剂量下, 对马唐、稗草和百日草抑制率达100%. 施娟娟等[11]基于芳氧苯氧丙酸酯和氰基丙烯酸酯的结构特点, 以乙醇胺为链接基团, 合成的化合物C在100和50 g/hm2剂量下对马唐和稗草均有较好的防除效果. 柳爱平等[12]合成了N-吡啶芳氧苯氧羧酸衍生物, 其中(R,R)-N-(3-氯吡啶-2-基)-N-[2-(4-((3-氟-5-氯吡啶-2-基)氧基)苯氧基)]丙酰基-[2-(4-(3-氟-5-氯吡啶-2-基氧基)苯氧基)]丙酰胺对马唐、稗草和狗尾茎叶处理的抑制率均为100%. 刘祈星等[13,14]设计合成的化合物D在2250 g/hm2的剂量下对马唐及稗草的土壤处理抑制活性均为90%, 其中化合物E活性与炔草酯相当[15]. 化合物A~E的结构如图1所示. 呋喃酚类化合物在农药领域特别是在杀虫和除草方面具有广泛的应用[16~18].
基于农药药效基团呋喃酚, 本文设计合成了(R)-N-[2-(2,2-二甲基-7-烷氧基-2,3-二氢苯并呋喃-5-基)-2-氧代乙基]-2-(4-芳氧苯氧基)丙酰胺(4a~4i). 以呋喃酚为原料, 经醚化、酰化、溴代及氨化得中间体2-氨基-1-(2,2-二甲基-7-烷氧基-2,3-二氢苯并呋喃-5-基)乙酮盐酸盐(2), 中间体2经酰化反应得到化合物4a~4i. 同样基于呋喃酚, 利用中间体衍生化法, 设计合成了(R)-N-[2/3-(2,2-二甲基-2,3-二氢苯并呋喃-7-氧基)乙/丙基]-2-[4-(芳氧苯氧基)]丙酰胺(5a~5h). 以邻苯二甲酸酐为原料, 经取代及溴代反应得中间体N-(δ-溴烷基)邻苯二甲酰亚胺(7), 化合物7与呋喃酚醚化、氨解或肼解得中间体n-(2,2-二甲基-2,3-苯并呋喃-7-氧基)烷胺(9), 再经酰化得化合物5a~5h. 化合物4和5的合成路线见Scheme 1, 并对其进行除草活性测试.
2a: R=Me; 2b: R=Et; 2c: R=n-Pr; 3a: Ar=Ⅰ; 3b: Ar=Ⅱ; 3c: Ar=Ⅲ; 3d: Ar=Ⅳ; 3e: Ar=Ⅴ; 4a:Ar=Ⅰ, R=Me; 4b: Ar=Ⅰ, R=Et; 4c: Ar=Ⅳ, R=Me; 4d: Ar=Ⅳ, R=Et; 4e: Ar=Ⅲ, R=Me; 4f: Ar=Ⅲ, R=Et; 4g: Ar=Ⅱ, R=Me; 4h: Ar=Ⅱ, R=Et; 4i: Ar=Ⅲ, R=n-Pr; 5a: n=2, Ar=Ⅱ; 5b: n=2, Ar=Ⅲ; 5c: n=2, Ar=Ⅰ; 5d: n=2, Ar=Ⅴ; 5e: n=3, Ar=Ⅱ; 5f: n=3, Ar=Ⅲ; 5g: n=3, Ar=Ⅰ; 5h: n=3, Ar=Ⅴ; 6a—9a: n=2; 6b—9b: n=3.

Scheme 1 Synthetic routes of target compounds 4 and 5
1 实验部分
1.1试剂与仪器
水合肼(质量分数80%); 所用溶剂和试剂均为市售分析纯或化学纯.
VARIAN INOVA-400型核磁共振仪(以CDCl3为溶剂, TMS为内标, 美国Varian公司); Bruker Avance 500型核磁共振仪(以CDCl3为溶剂, TMS为内标, 瑞士Bruker公司); Nexus智能型傅里叶变换红外光谱仪(美国Thermo Nicolet公司); MAT 95XP型高分辨质谱仪(美国Thermo公司); RY-1 型熔点仪(天津市天分仪器厂); ZF-2型三用紫外显色仪(上海市安亭电子仪器厂); 薄层层析用硅胶、柱层析硅胶(青岛海洋化工公司).
1.2实验过程
1.2.1中间体1和2的合成参照文献[19~21]方法, 分别以2-溴乙酰基呋喃酚甲醚、2-溴乙酰基呋喃酚乙醚和2-溴乙酰基呋喃酚丙醚为底物合成化合物1a~1c. 化合物1a, m. p. 90~91 ℃(文献值[20]: 90~91 ℃); 化合物1b, m. p. 99~101 ℃(文献值[20]: 98~100 ℃); 化合物1c, m.p. 99~100 ℃(文献值[21]: 99~100 ℃).
化合物2a的合成: 将3.50 g乌洛托品(25 mmol)及40 mL三氯甲烷于45 ℃搅拌溶解, 滴加20 mL溶有化合物1a(6.00 g, 20 mmol)的三氯甲烷溶液, 用TLC监测反应. 反应液经过滤、干燥得7.40 g白色固体. 将上述白色固体加入30 mL乙醇及20.00 g浓盐酸中, 搅拌回流4 h, 趁热过滤, 将滤液冷却析出固体, 经过滤、干燥得白色固体2-氨基-1-(2,2-二甲基-7-甲氧基-2,3-二氢苯并呋喃-5-基)乙酮盐酸盐(2a) 3.70 g, 收率58.6%, m.p. 157~159 ℃.1H NMR(400 MHz, CDCl3),δ: 1.46(s, 6H, 2×CH3), 3.08(s, 2H, ArCH2), 3.82(s, 3H, OCH3), 4.51(d,J=5.2 Hz, 2H, COCH2), 7.40(s, 1H, C6H2), 7.56(s, 1H, C6H2), 8.17(s, 2H, NH2).
化合物2b的合成: 采用与合成化合物2a相同的方法, 仅以化合物1b代替化合物1a, 反应4.5 h, 得白色固体(2,2-二甲基-7-乙氧基-2,3-二氢苯并呋喃-5-基)乙酮盐酸盐(2b) 3.00 g, 收率47.2 %, m. p. 221~223 ℃.1H NMR(500 MHz, CDCl3),δ: 1.34(t, 3H,J=7.0 Hz, CH3), 1.46(s, 6H, 2×CH3), 3.08(s, 2H, ArCH2), 4.12(q, 2H,J=7.0 Hz, OCH2), 4.47(d,J=4.5 Hz, 2H, COCH2), 7.43(s, 1H, C6H2), 7.58(s, 1H, C6H2), 8.51(s, 2H, NH2).
化合物2c的合成: 采用与合成化合物2a相同的方法, 仅以化合物1c代替化合物1a, 反应4.5 h, 得白色固体(2,2-二甲基-7-丙氧基-2,3-二氢苯并呋喃-5-基)乙酮盐酸盐(2c) 3.03 g, 收率52.9 %, m. p. 288~290 ℃.1H NMR(500 MHz, CDCl3),δ: 0.97(t, 3H,J=7.0 Hz, CH3), 1.46(s, 6H, 2×CH3), 1.70~1.77(m, 2H, CH2), 3.08(s, 2H, ArCH2), 4.02(t, 2H,J=7.0 Hz, OCH2), 4.48(d,J=5.5 Hz, 2H, COCH2), 7.42(s, 1H, C6H2), 7.58(s, 1H, C6H2), 8.51(s, 2H, NH2).
1.2.3目标化合物4a~4i的合成将中间体2(2.02×103mmol)、25 mL二氯甲烷及1.46 g(14.45 mmol) 三乙胺混合, 冰浴下逐滴加入化合物3(2.42×103mmol)的二氯甲烷溶液. 再在室温下反应1.0~1.5 h, 将有机层依次用水和饱和食盐水洗涤, 干燥, 脱溶, 经柱层析分离得固体4a~4i.
1.2.4中间体8和9的合成参考文献[23]方法合成化合物8a和9a. 化合物8a, m. p. 114~116 ℃, 收率69.7%(文献值[23]: 113 ℃, 收率71.0%); 化合物9a, m. p. 55~57 ℃, 收率81.4%(文献值[23]: 56 ℃, 收率88.0%);N-(3-溴丙基)邻苯二甲酰亚胺(7b)参照文献[24]方法合成, m. p. 71~73 ℃(文献值[24]: 71~72 ℃).
化合物8b的合成: 取0.164 g(1.0 mmol)呋喃酚、0.276 g(2.0 mmol)K2CO3、催化量聚乙二醇-200(PEG-200)及20 mLN,N-二甲基甲酰胺(DMF)混合, 搅拌, 滴加溶有化合物7b(0.402 g, 1.5 mmol)的DMF溶液, 于70 ℃反应2 h, 冷却, 抽滤, 干燥得淡黄色固体8b 0.29 g, 收率82.8%, m. p. 83~85 ℃.1H NMR(400 MHz, CDCl3),δ: 1.45(s, 6H, 2×CH3), 2.15~2.22(m, 2H, CCH2C), 2.98(s, 2H, CH2), 3.87(t,J=6.8 Hz, 2H, NCH2), 4.11(t,J=6.8 Hz, 2H, OCH2), 6.70~6.73(m, 3H, C6H3), 7.68~7.70(m, 2H, C6H4), 7.81~7.84(m, 2H, C6H4);13C NMR(100 MHz, CDCl3),δ: 28.1, 28.6, 35.5, 43.3, 67.0, 87.3, 114.0, 118.0, 120.3, 123.1, 128.6, 132.3, 133.8, 143.6, 148.1, 168.4.
化合物9b的合成: 取3.51 g(10 mmol)化合物8b及32.3 g(0.53 mol)乙醇胺, 室温下反应9 h后, 倾入冰水中, 二氯甲烷萃取, 再将有机层依次用水和饱和食盐水洗涤3次, 干燥, 脱溶得淡黄色固体9b 1.64 g, 收率79.4%, m.p. 81~83 ℃.1H NMR(400 MHz, CDCl3),δ: 1.49(s, 6H, 2×CH3), 1.93~1.98(m, 2H, CCH2C), 2.93(t,J=6.0 Hz, 2H, CH2N), 3.01(s, 2H, CH2), 4.14(t,J=6.0 Hz, 2H, OCH2), 6.68~6.75(m, 3H, C6H3);13C NMR(100 MHz, CDCl3),δ: 28.4, 32.7 39.2, 43.4, 67.2, 87.3, 113.2, 117.8, 120.3, 128.43, 143.7, 147.8.
1.2.5目标化合物5a~5h的合成将中间体9(0.48 mmol)、0.053 g(0.53 mmol)三乙胺和催化量4-二甲基氨基吡啶(DMAP)混合, 加入20 mL 二氯甲烷, 搅拌, 滴加溶有化合物3(0.576 mmol)的二氯甲烷溶液, 在室温下反应2~3 h, 有机层依次用水和饱和食盐水洗涤, 干燥, 脱溶, 经柱层析[V(石油醚)∶V(乙酸乙酯)=7∶1]得固体化合物5a~5h.
目标化合物4和5的理化数据列于表1. 核磁共振数据列于表2.
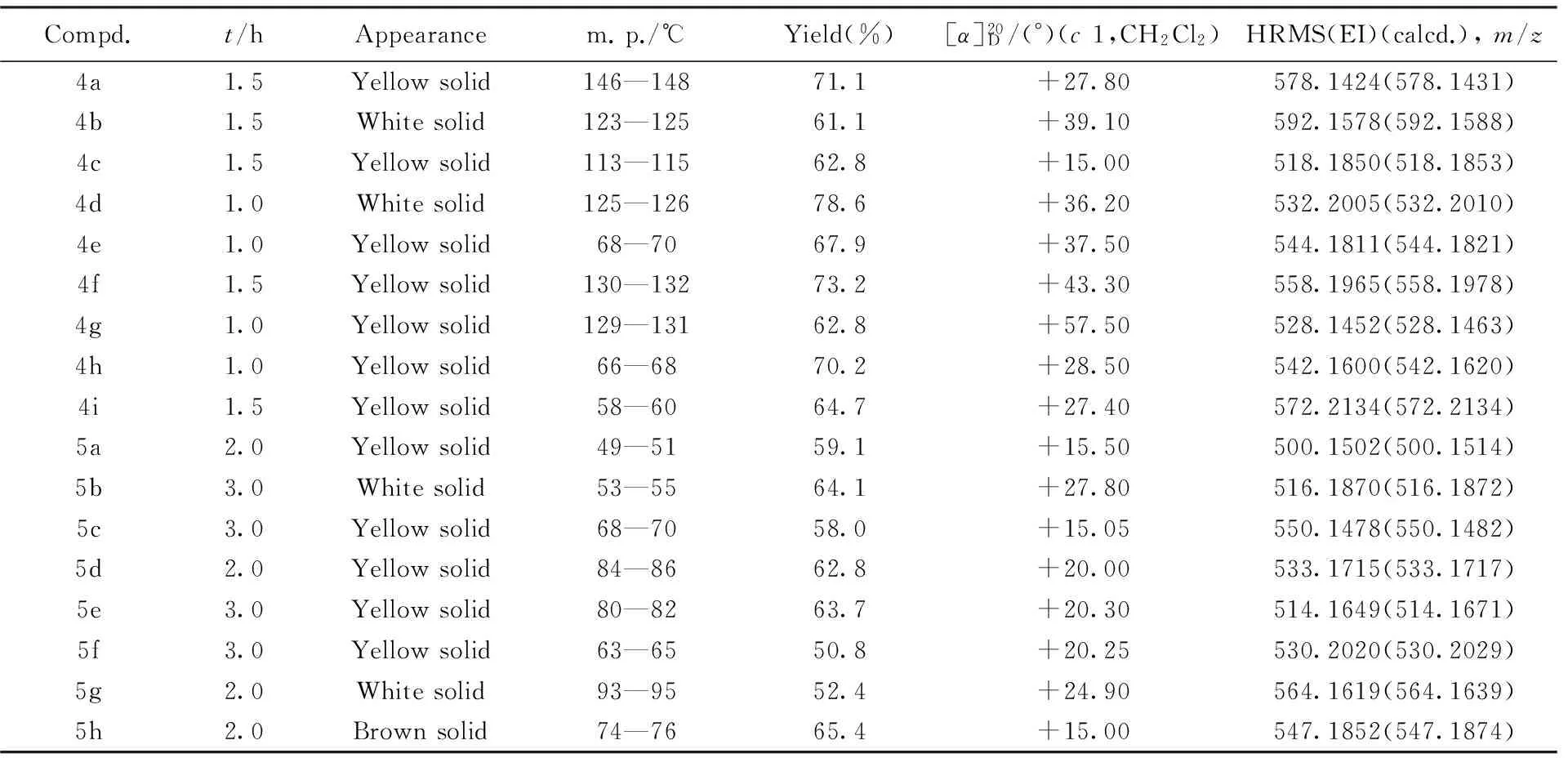
Table 1 Reaction time, appearance, yields, melting points, optical rotations and HRMS data for compounds 4 and 5

Table 2 1H NMR and 13C NMR data for compounds 4 and 5
Continued

Compd.1HNMR(CDCl3),δ*13CNMR(100MHz,CDCl3),δ4e1.55(s,6H,2×CH3),1.64(d,J=6.5Hz,3H,CH3),3.08(s,2H,CH2),3.91(s,3H,OCH3),4.63—4.68(m,1H,CH),4.73—4.78(m,2H,COCH2),6.98(d,J=8.5Hz,1H,C5H3N),7.03(d,J=9.0Hz,2H,C6H4),7.09(d,J=9.0Hz,2H,C6H4),7.41(s,1H,C6H2),7.45(s1H,C6H2),7.60(t,J=4.0Hz,1H,NH),7.87(dd,J1=8.5Hz,J2=2.5Hz,1H,C5H3N),8.42(d,J=2.5Hz,1H,C5H3N)18.7,28.4,42.7,45.5,56.1,75.8,90.1,110.9,111.5,116.7,118.9,122.7,123.1,127.8,128.2,136.7,144.9,145.3,147.6,150.8,152.9,154.7,166.5,172.4,191.84f1.46(t,J=7.0Hz,3H,CH2CH3),1.55(s,6H,2×CH3),1.65(d,J=6.5Hz,3H,CH3),3.07(s,2H,CH2),4.13(q,J=7.0Hz,2H,OCH2),4.63—4.67(m,1H,CH),4.73—4.77(m,2H,COCH2),6.98—7.00(m,1H,C5H3N),6.98(d,J=8.5Hz,1H,C5H3N),7.03(d,J=9.0Hz,2H,C6H4),7.09(d,J=9.0Hz,2H,C6H4),7.41(s,1H,C6H2),7.44(s,1H,C6H2),7.60(t,J=4.0Hz,1H,NH),7.87—7.90(m,1H,C5H3N),8.42(d,J=3.5Hz,1H,C5H3N)14.7,18.8,28.1,42.7,45.5,64.675.8,90.1,111.3,112.5,116.9,118.9,121.4,122.4,122.6,127.7,128.7,136.7,144.0,145.4,147.7,153.1,154.7,165.9,172.4,191.74g1.53(s,6H,2×CH3),1.62(d,J=6.5Hz,3H,CHCH3),3.07(s,2H,CH2),3.90(s,3H,OCH3),4.60—4.65(m,1H,CH),4.71—4.77(m,2H,COCH2),7.00(d,J=9.5Hz,2H,C6H4),7.09(d,J=9.5Hz,2H,C6H4),7.40(s,1H,C6H2),7.44(s,1H,C6H2),7.47(dd,J1=9.0Hz,J2=2.5Hz,1H,C5H2N),7.59(t,J=4.0Hz,1H,NH),7.84(d,J=2.5Hz,1H,C5H2N)18.8,28.1,42.4,45.5,56.1,75.8,89.8,110.8,116.7,118.9,122.5,124.9,125.1,127.8,128.2,140.2,144.7,145.7,147.4,148.3,152.9,154.5,172.3,191.84h1.44(t,J=6.8Hz,3H,CH2CH3),1.53(s,6H,2×CH3),1.62(d,J=6.4Hz,3H,CH3),3.05(s,2H,CH2),4.13(q,J=6.8Hz,2H,OCH2),4.59—4.67(m,1H,CH),4.71—4.77(m,2H,COCH2),7.00(d,J=9.2Hz,2H,C6H4),7.09(d,J=9.2Hz,2H,C6H4),7.40(s,1H,C6H2),7.42(s,1H,C6H26-H),7.47(dd,J1=9.2Hz,J2=2.0Hz,1H,C5H3N),7.61(t,J=4.0Hz,1H,NH),8.42(d,J=2.0Hz,1H,C5H3N)14.7,19.1,28.1,42.7,45.5,64.6,75.8,89.9,112.3,116.7,118.7,122.4,124.9,125.2,127.7,128.5,140.3,144.0,147.4,148.4,151.4,153.2,154.5,172.3,191.74i1.41(t,J=7.5Hz,3H,CH2CH3),1.55(s,6H,2×CH3),1.65(d,J=6.5Hz,3H,CH3),1.82—1.89(m,2H,CH2),3.07(s,2H,ArCH2),4.04(t,J=7.0Hz,2H,OCH2),4.65—4.69(m,1H,CH),4.74—4.79(m,2H,COCH2),6.98(d,J=6.0Hz,1H,C5H3N,6-H),7.04(d,J=8.5Hz,2H,C6H4),7.10(d,J=8.5Hz,2H,C6H4),7.42(s,1H,C6H2),7.45(s,1H,C6H2),7.69(s,1H,NH),7.89(d,J=8.5Hz,1H,C5H3N),8.43(d,J=8.5Hz,1H,C5H3N)10.5,18.5,22.2,28.4,42.4,45.2,70.8,75.6,89.9,105.8,112.6,117.0117.5,118.7,120.1,120.6,121.2,127.5128.2,129.2,143.7,148.7,150.4,151.1,153.3,154.2,171.9,191.75a1.49(s,3H,CH3),1.50(s,3H,CH3),1.58(d,J=6.8Hz,3H,CH3),3.02(s,2H,CH2),3.66—3.72(m,2H,NHCH2),4.08—4.15(m,2H,OCH2),4.66(q,J=6.8Hz,1H,CH),6.69—6.81(m,3H,C6H3),6.94(d,J=8.8Hz,2H,C6H4),7.05(d,J=8.8Hz,2H,C6H4),7.50(dd,J1=8.8Hz,J2=2.0Hz,1H,C5H2N),7.86(d,J=2.0Hz,1H,C5H2N)18.6,28.3,38.9,43.2,68.4,75.8,87.6,114.4,116.6,118.4,120.6,122.2,124.7,125.0,128.7,140.1,143.0,145.6,147.3,148.1,151.1,151.3,172.25b1.48(s,3H,CH3),1.50(s,3H,CH3),1.59(d,J=6.8Hz,3H,CH3),3.02(s,2H,CH2),3.68—3.72(m,2H,NHCH2),4.09—4.15(m,2H,OCH2),4.65—4.70(m,1H,CH),6.71—6.81(m,3H,C6H3),6.89—6.98(m,3H,C6H4,C5H3N),7.04(d,J=8.8Hz,2H,C6H4),7.87(dd,J1=8.8Hz,J2=2.0Hz,1H,C5H2N),8.42(s,1H,C5H2N)18.3,27.7,38.0,42.6,67.9,75.287.0,113.8,116.1,118.0,120.0,121.9,124.4,124.6,128.2,139.5,142.4,145.1,146.7,147.5,147.8,150.6,153.8,171.75c1.49(s,3H,CH3),1.50(s,3H,CH3),1.59(d,J=6.8Hz,3H),3.03(s,2H,CH2),3.65—3.72(m,2H,NHCH2),4.07—4.14(m,2H,OCH2),4.68(q,J=6.8Hz,1H,CH),6.68—6.81(m,3H,C6H3),6.96(d,J=8.8Hz,2H,C6H4),7.05(d,J=8.8Hz,2H,C6H4),7.97(s,1H,C5H2N),8.24(s,1H,C5H2N)18,8,28.1,36.2,43.0,55.7,74.7,88.3,110.1,116.3,116.6,122.5,123.1,124.9,125.3,127.2,128.0,139.8,144.4,146.6,148.2,148.7,154.5,156.0,171.8
Continued

Compd.1HNMR(CDCl3),δ*13CNMR(100MHz,CDCl3),δ5d1.48(s,3H,CH3),1.50(s,3H,CH3),1.61(d,J=6.4Hz,3H,CH3),3.01(s,2H,CH2),3.68—3.72(m,2H,NHCH2),4.10—4.15(m,2H,OCH2),4.67—4.73(m,1H,CH),6.71—6.80(m,3H,C6H3),6.98(d,J=9.2Hz,2H,C6H4),7.15(d,J=9.2Hz,3H,C6H4),7.59(dd,J1=8.8Hz,J2=2.0Hz,1H,quinoxalin-H),7.67(d,J=8.8Hz,1H,quinoxalin-H),8.04(d,J=2.0Hz,1H,quinoxalin-H),8.67(s,1H,quinoxalin-H)19.0.28.0,34.2,43.2,61.2,75.6,87.7,112.7,114.6,116.9,118.7,119.5,120.9,121.0,122.0,122.6,127.9,128.8,130.2,131.1,140.1,144.7,145.7,151.9,157.1,170.05e1.49(s,3H,CH3),1.50(s,3H,CH3),1.58(d,J=6.8Hz,3H,CH3),1.93—2.02(m,2H,CCH2C),3.02(s,2H,CH2),3.48—3.53(m,2H,NHCH2),3.99—4.09(m,2H,OCH2),4.65(q,J=6.8Hz,1H,CH),6.67—6.79(m,3H,C6H3),6.90(d,J=8.8Hz,2H,C6H4),7.06(d,J=8.8Hz,2H,C6H4),7.50(dd,J1=9.2Hz,J2=2.4Hz,1H,C5H2N),7.85(d,J=2.4Hz,1H,C5H2N)13.7,23.0,23.7,31.5,38.0,62.0,70.4,82.1,108.2,111.0,111.8,112.8,115.0,117.2,119.6,119.8,123.3,134.9,138.1,141.8,142.6,143.0,149.1,160.35f1.49(s,3H,CH3),1.50(s,3H,CH3),1.59(d,J=6.8Hz,3H,CH3),1.95—2.04(m,2H,CCH2C),3.02(s,2H,CH2,CH2),3.48—3.53(m,2H,NHCH2),4.00—4.10(m,2H,OCH2),4.63—4.68(m,1H,CH),6.68—6.79(m,3H,C6H3),6.92(d,J=8.4Hz,2H,C6H4),6.99(d,J=8.8Hz,1H,C5H3N),7.05(d,J=8.4Hz,2H,C6H4),7.88(dd,J1=8.8Hz,J2=2.0Hz,1H,C5H3N),8.42(s,1H,C5H3N)18.8,28.2,28.8,35.0,43.4,65.4,73.1,87.3,113.2,115.9,117.8,119.1,120.3,122.7,128.5,133.0,136.3,142.6,143.5,146.8,147.8,149.2,155.3,161.4,172.15g1.49(s,3H,CH3),1.50(s,3H,CH3),1.59(s,J=6.8Hz,3H,CH3),1.94—2.04(m,2H,CCH2C),3.02(s,2H,CH2),3.48—3.53(m,2H,NHCH2),4.00—4.09(m,2H,OCH2),4.65—4.69(m,1H,CH),6.67—6.79(m,3H,C6H3),6.93(d,J=8.8Hz,2H,C6H4),7.06(d,J=8.8Hz,2H,C6H4),7.97(d,J=2.0Hz,1H,C5H2N),8.24(s,1H,C5H2N)19.0,28.3,29.8,36.8,43.4,67.4,75.7,87.5,113.6,116.4,118.1,119.2,120.4,122.8,128.7,136.2,136.3,142.6,142.7,143.4,147.0,147.9,154.8,161.3,172.25h1.49(s,3H,CH3),1.51(s,3H,CH3),1.61(d,J=6.8Hz,3H,CH3),1.97—2.04(m,2H,CCH2C),3.02(s,2H,CH2),3.50—3.55(m,2H,NHCH2),4.03—4.10(m,2H,OCH2),4.66—4.71(m,1H,CH),6.68—6.78(m,3H,C6H3),6.95(d,J=8.8Hz,2H,C6H4),7.17(d,J=8.8Hz,2H,C6H4),7.59(d,J1=8.8Hz,J2=2.0Hz,1H,quinoxa-lin-H),7.67(d,J=8.8Hz,1H,quinoxalin-H),8.06(s,1H,quinoxa-lin-H),8.68(s,1H,quinoxalin-H)19.1,28.5,29.2,39.0,43.4,66.5,75.9,87.4,113.8,114.5,116.5,116.6118.1,120.4,121.2,122.6,127.9,128.8,129.4,131.2,140.2,143.4,146.9,151.0,154.5,158.3,172.2
*1H NMR for compounds 4b—4g and 4i were tested at 500 MHz, others were tested at 400 MHz.
1.3目标化合物的除草活性
采用盆栽法测试了化合物4和5的除草活性. 盆栽法(土壤处理): 在直径8 cm的塑料小杯中放入一定量的土, 再加入一定量的水, 播种后覆盖一定厚度的土壤, 置于花房中培养, 幼苗出土前以塑料覆盖. 每天加定量的清水以保持正常生长. 出苗前进行土壤处理, 处理剂量为1500 g/hm2, 30 d后调查结果, 测定地上部鲜重, 以鲜重抑制百分数来表示药效[25]. 盆栽法(茎叶处理): 在直径8 cm的塑料小杯中放入一定量的土, 再加入一定量的水, 播种15颗发芽的种子于泥土下0.5 cm深, 播种后覆盖一定厚度的土壤, 于花房中培养, 幼苗出土前以塑料覆盖. 出苗后, 每天加定量的清水以保持正常生长. 当幼苗长到一定时期进行茎叶喷洒待测化合物的溶液, 处理剂量为1500 g/hm2, 30 d后调查结果, 测定地上部鲜重, 以鲜重抑制百分数来表示.
2 结果与讨论
2.1中间体2的合成
中间体2的制备有Gabrie反应和Delépine反应两类方法.
Gabrie合成法: 以DMF为溶剂, 将化合物1与邻苯二甲酰亚胺钾盐反应, 得中间体, 再在无水乙醇溶液中用水合肼肼解, 拟得到中间体2, 但由于肼解是碱性条件, 得到的含有氨基和羰基的中间体2可发生自身缩合, 故得不到中间体2.Delépine合成法: 向乌洛托品中滴加溶有化合物1的三氯甲烷溶液, 于45 ℃下反应, 用TLC监测反应. 将反应液过滤, 得到固体; 加入盐酸在乙醇中回流, 得中间体2的盐酸盐, 其稳定性较好.
2.2中间体9的合成
中间体9的制备可选择水合肼或乙醇胺分别进行肼解或氨解2种方法进行(见Scheme 1). 肼解反应速度快, 但与乙醇胺水解法相比, 收率较低, 可能有2种原因: (1) 在肼解过程中生成邻苯二甲酰肼的同时, 还可能生成另一种副产物, 即中间体胺与邻苯二甲酰肼形成的盐难以除去; (2) 肼解反应结束后, 冷却析出白色絮状邻苯二甲酰肼, 在洗涤邻苯二甲酰肼滤饼过程中, 仍有少量产物胺残留于邻苯二甲酰肼固体中.以乙醇胺氨解, 反应温和, 收率较高且乙醇胺毒性小.
2.3目标化合物谱图解析
化合物5a~5h的1H NMR谱中, 由于结构中存在杂环(吡啶和苯并呋喃)的空间位阻, 导致其亚甲基上2个氢原子的化学环境有所差异, 出现同碳耦合, 亚甲基裂分为多重峰. 以化合物5e为例,δ1.93~2.02, 3.48~3.53和 3.99~4.09处有3种亚甲基均裂分为多重峰.
2.4除草活性评价
以噁唑酰草胺(Metamifop)为阳性对照, 对化合物4和5进行了除草活性筛选, 结果列于表3.

Table 3 Herbicidal activities(%) of compounds 4 and 5(1500 g/hm2)
除草普筛结果表明, 在1500 g/hm2剂量下, 目标化合物4对单子叶杂草(马唐和稗草)具有更高的抑制活性, 其中, 化合物4a, 4b和4i对马唐和稗草的茎叶和土壤处理均表现为100%抑制活性, 与对照药噁唑酰草胺(100%)相当; 对双子叶油菜和苋菜防治效果一般, 仅化合物4a对苋菜的茎叶处理抑制率为64.2%. 化合物5在1500 g/hm2剂量下, 对单子叶杂草马唐和稗草具有较强的茎叶和土壤处理防除效果, 且土壤处理活性略优于茎叶处理效果, 如化合物5a, 5e和5h对马唐和稗草的抑制活性(土壤和茎叶处理)与对照药剂噁唑酰草胺(Metamifop)的抑制活性相当. 当Ar为3-氟-5-氯吡啶或喹喔啉时, 对马唐和稗草的抑制活性优于3-氯-5-三氟甲基吡啶基和5-三氟甲基吡啶基, 如化合物5e和5h对马唐的土壤和茎叶处理抑制活性为100%, 而化合物5f在相同剂量下对马唐的土壤和茎叶处理抑制活性分别为77.0%和65.4%; 当侧链桥长n=3时, 对马唐和稗草的茎叶处理抑制活性略优于n=2时, 如化合物5a和5g;n=2时, 对马唐和稗草的土壤处理优于n=3时, 如化合物5b和5f.
选择普筛活性最好的5个化合物进行初筛, 结果列于表4. 由表4可见, 在施药剂量为375 g/hm2时, 化合物4a, 4b, 4i, 5e和5h对稗草的防效较好, 茎叶处理的抑制率>96%.

Table 4 Herbicidal activities(%) of compounds 4a, 4b, 4i, 5e and 5h
2.5构效关系
生物活性数据表明, 化合物结构对除草活性有一定影响, Ar基团的影响较大, 当Ar为3-氯-5-三氟甲基吡啶和3-氟-5-氯吡啶基时, 化合物4中部分化合物的活性优于5-三氟甲基吡啶基和4-氰基-2-氟苯基. 但其呋喃酚环的R基团的影响不大; 对于化合物5, Ar为吡啶环和喹喔啉时, 活性明显优于苯环; 对于化合物5的吡啶环, Ar为3-氟-5-氯吡啶时, 活性优于3-氯-5-三氟甲基吡啶和5-三氟甲基吡啶基. 总体上, Ar基团对活性影响大小顺序为吡啶/喹喔啉>苯. 化合物5的桥长n对活性也有影响, 丙酰胺侧链对活性影响顺序为土壤处理:n=2>n=3; 茎叶处理:n=3>n=2.
综上所述, 基于呋喃酚, 设计合成2个系列共17个2-(4-芳氧苯氧基)丙酰胺衍生物, 其结构经1H NMR,13C NMR, HRMS和旋光度确认. 除草活性测试结果表明, 在1500 g/hm2剂量下, 化合物4和5对单子叶杂草马唐和稗草均有较高的抑制活性. 其中, 化合物4a, 4b和4i对马唐和稗草的茎叶和土壤处理均表现为100%的抑制活性; 化合物5a~5h对马唐和稗草有较好防效, 其中, 化合物5a, 5c, 5e和5h为A级活性, 对马唐和稗草的抑制率为100%. 初筛结果表明, 375 g/hm2剂量下, 化合物4a, 4b, 4i, 5e和5h对稗草的茎叶处理抑制率>96%.
感谢南开大学元素有机化学研究所李永红老师在除草活性方面提供的帮助.
[1]James A. T., Daniel J. P.,J.Agric.FoodChem., 2002 , 50(16), 4554—4566
[2]Moon J. K., Keum Y. S., Hwang E. C.,J.Agric.FoodChem., 2007, 55(14), 5416—5422
[3]Liu Q.X., Liu A.P., Hu A.X., Huang M. Z., Ou X. M., Zhou H.F.,Agrochemicals, 2015, 54(8), 551—558
[4]Kover J., Szilagyi L., Antus S., Tompa J., Gunda T.,Heterocycl.Comm., 2002, 8(3), 237—242
[5]Liu H., Wang H. Q., Liu Z. J.,Bioorganic&MedicinalChemistryLetters, 2007, 17(8), 2203—2209
[6]Huang T. H., Tu H., Aibibu Y. Z., Hou C. J., Zhang A. D.,ARKIVOC, 2010, 2011(2), 1—17
[7]Tajik H., Dadras A., Aghabeygi S.,Chin.Chem.Lett., 2011, 22(5), 535—538
[8]Hu H. P.,SynthesisandBiologicalActivitiesofAPPCompoundsContainingPurineRings, Centural China Normal University, Wuhan, 2009(胡宏平. 含嘌呤环的APP类化合物的合成与生物活性, 武汉: 华中师范大学, 2009)
[9]Zou X. M., Huang C., Li W., Shan P. C., Liu J., Ding H. J., Yang Y. Z., Wang X.,TheSynthesisandApplicationofOilandDissolvedAryloxyphenoxypropanoates, CN103275029A, 2013-09-04(邹小毛, 黄纯, 李伟, 单鹏程, 刘俊, 丁会娟, 杨亚喆, 王鑫. 一种水油兼溶的新型芳氧苯氧丙酸酯类衍生物制备及应用研究, CN103275029A, 2013-09-04)
[10]Li B.,TheSynthesisandHerbicidalActivityofTwoKindsCompoundswithLinkerGroup, Shenyang Chemical Institute, Shenyang, 2005(李斌. 两种除草活性结构链接的化合物的合成与除草活性, 沈阳: 沈阳化工研究院, 2005)
[11]Shi J. J., Diao Y. M.,ModernAgrochemicals, 2007, 6(6), 24—26(施娟娟, 刁亚梅. 现代农药, 2007, 6(6), 24—26)
[12]Liu A. P., Ren Y. G., Lei M. X., Pang H. L., Liu Q.X., Huang L., He L., Han K. Y., Gao G., He L.Y.,TheSynthesisandPreparationofN-pyridineoyl-carbosylicAcidAmideCompounds, CN105315199A, 2016-02-10(柳爱平, 任叶果, 雷满香, 庞怀林, 刘祈星, 黄路, 何莲, 韩魁元, 高岗, 何丽英.N-吡啶芳氧苯氧羧酸衍生物及其制备方法与应用, CN105315199A, 2016-02-10)
[13]Liu Q. X., Huang M. Z., Liu A. P., Nie S. Q., Lei M. X., Ren Y. G., Pei H., He L.Y., Hu L., Hu A. X.,Chin.J.Org.Chem., 2014, 34, 118—125(刘祈星, 黄明智, 柳爱平, 聂思桥, 雷满香, 任叶果, 裴晖, 何丽英, 胡礼, 胡艾希. 有机化学, 2014, 34, 118—125)
[14]Liu Q. X., Huang M. Z., Liu A. P., Hu A.X., Lei M. X., Ren Y.G., Huang L.,Chem.Res.ChineseUniversities, 2016, 32(2), 188—194
[15]Huang L., He H. J., Liu Q. X., Lei M. X., Yu S. Y., Ren Y. G., Ou X. M., Huang M. Z., Liu A.P.,FineChemicalsIntermediates, 2011, 41, 20—23(黄路, 何海军, 刘祈星, 雷满香, 余淑英, 任叶果, 欧晓明, 黄明智, 柳爱平. 精细化工中间体, 2011, 41, 20—23)
[16]Lu L. P.,TheSynthesisandProcessResearchofNovelHerbicideEthofumesate, Zhejiang University of Technology, Hangzhou, 2005(陆利萍. 新型除草剂乙呋草黄的合成和工艺研究开发, 杭州: 浙江工业大学, 2005)
[17]Li Y. L., Miao W. R., Zhou Y. H.,Agrochemicals, 2005, 44(11), 503—505(李彦龙, 苗蔚荣, 周宇涵. 农药, 2005, 44(11), 503—505)
[18]Huang Z. Q., Cui Q. M., Xiong L. X.,J.Agric.FoodChem., 2009, 57(6), 2447—2456
[19]Luo X. F.,TheSyntheticResearchofBenzofuranolandtheSynthesisofThiazoleDerivativesandBiology, Hunan University, Changsha, 2012(罗先福.呋喃酚的合成工艺与其芳氨基噻唑衍生物的合成、表征和生物活性, 长沙: 湖南大学, 2012)
[20]Luo X. F., Hu A. X., Wang Y., Ye J., Wang X. G.., Ou X. M.,Chem.J.ChineseUniversities, 2011, 32(12), 2800—2805(罗先福, 胡艾希, 王宇, 叶姣, 王晓光, 欧晓明. 高等学校化学学报, 2011, 32(12), 2800—2805)
[21]Chen X. D.,StructuralModificationofRotenone,SynthesisofAnaloguesandResearchonBiologicalActivity, Hunan Universtiy, Changsha, 2013)(陈晓东. 鱼藤酮结构改造、类似物合成与生物活性研究, 长沙: 湖南大学, 2013)
[22]Liu Q. X., Hu A. X., Wang X. G., Lei M. X., Ou X. M., Ren Y. G., Huang L., Liu A. P.,Chem.J.ChineseUniversities, 2014, 35(2), 262—269(刘祈星, 胡艾希, 王晓光, 雷满香, 欧晓明, 任叶果, 黄路, 柳爱平. 高等学校化学学报, 2014, 35(2), 262—269)
[23]Stephane C., Nathalie B., Vincent L., Adrian N.T., Francis C., Bernard V.,JournalofMedicinalChemistry, 2007, 50(4), 865—875
[24]Fraschini F., Luigi D. B., Ermanno D.,MethodofSolubilizingMelatonineinWater, US005122535A, 1992-06-16
[25]Wang X. F.,Design,SynthesisandBioassaysofNovel2-Aromaticoxygen-amino-cyanoacylateandCyanoacryamide, Nankai University, Tianjin, 2014(王晓芳. 新型2-芳氧丙烷氨基氰基丙烯酸衍生物的设计, 合成及生物活性研究, 天津: 南开大学, 2014)
(Ed.: P, H, Y, K)
Synthesis and Herbicidal Activity of 2-(4-Arylxoyphenoxy)propionamide Derivatived from Benzofuranol†
YANG Zihui, LI Beibei, YE Jiao, HU Aixi*
(CollegeofChemistryandChemicalEngineering,HunanUniversity,Changsha410082,China)
2-(4-Aryloxyphenoxy) propionamide derivatives were identified as one of the most important herbicides, which inhibited acetyl-CoA carboxylase(ACCase) to restrict fatty acid. Recent years, 2-(4-aryloxyphenoxy) propionamide derivative have developed resistance in varying degrees among weeds. Therefore, resear-ching novel 2-(4-aryloxyphenoxy) propionamide derivatives herbicide is of great importance. Seventeen of 2-(4-aryloxyphenoxy) propionamide derivatives were synthesized by multistep synthetic procedures with two key intermediates 2 and 9, starting from(R)-(+)2-(4-hydroxyphenoxy) propanoic acid and benzofuranol. The intermediate 9 was synthesized fromo-phthalic anhydride and 2-aminoethanolviasubstitution reaction, bromination, etherification and amination. The synthetic reaction condition of intermediates 9 was discussed. The structures of target compounds 4 and 5 were confirmed by1H NMR,13C NMR, HRMS and optical rotation. The bioassay results indicated that most of title compounds possessed a moderate herbicidal activity againstcrabgrassandbarnyardgrassat 1500 g/hm2. The compounds 4a, 4b, 4i, 5e and 5h showed more than 96% activities against thecrabgrassandbarnyardgrassat 375 g/hm2.
† Supported by the National “Twelfth Five-Year” Plan for Science and Technology Support of China(No.2011BAE06B01).
2-(4-Aryloxyphenoxy) propionamide; Benzofuranol; Herbicidal activity
2016-05-12. 网络出版日期: 2016-07-19.
“十二五”国家科技支撑计划项目(批准号: 2011BAE06B01)资助.
O626
A
联系人简介: 胡艾希, 男, 博士, 教授, 博士生导师, 主要从事药物化学研究. E-mail: axhu@hnu.edu.cn
