IC法快速同时测定低分子右旋糖酐氨基酸注射液中EDTA和NaHSO3的含量
2016-08-31余燕梁蔚阳
余燕,梁蔚阳
(广东省药品检验所,广东 广州 510180)
IC法快速同时测定低分子右旋糖酐氨基酸注射液中EDTA和NaHSO3的含量
余燕,梁蔚阳Δ
(广东省药品检验所,广东 广州 510180)
目的建立一种离子色谱抑制电导法,用于快速测定低分子右旋糖酐氨基酸注射液中EDTA和NaHSO3的含量。方法采用Dionex的阴离子交换色谱柱IonPac AS11-HC和IonPac AH11-HC保护柱对样品进行分离,以13 mmol/L的KOH溶液为淋洗液,流速为1.0 mL/min抑制性电导检测器检测。抑制电流为70 mA,电导检测器温度为35 ℃,样品经稀释后直接经自动进样器进样。结果实验表明,EDTA和NaHSO3分别在1.25~20.12、3.86~61.82(g/m范围内线性关系良好(R>0.9990),2者平均回收率分别为100.89%、95.3%。结论该方法准确,简便快速,选择性高,重现性好,可用于低分子右旋糖酐氨基酸注射液中EDTA和NaHSO3的含量的快速同时检测。
离子色谱;低分子右旋糖酐氨基酸注射液;EDTA;NaHSO3
作为一种重要复方制剂,低分子右旋糖酐氨基酸注射液常用于治疗兼有蛋白质缺乏的血容量减少患者。该注射液是由右旋糖酐40和包括色氨酸、亮氨酸、胱氨酸等11种氨基酸制成的灭菌水溶液,因所含色氨酸、胱氨酸性质不稳定,在光照或遇氧化剂条件下易被氧化,故处方中加入了NaHSO3及EDTA二钠(以下简称EDTA)。NaHSO3及EDTA是医药工业中常用的辅料,其中前者为抗氧化剂,后者则可与金属离子形成稳定的水溶性络合物,从而降低右旋糖酐40与金属离子间的氧化反应,提高药物的稳定性。但微过量的NaHSO3可使患者短时间内发生过敏反应,造成肝功能患者转氨酶升高甚至肝坏死[1-2];同样过量的EDTA也会引起患者恶心、头痛、尿急、血液凝固性降低甚至心脏停搏等不良反应[3-6]。因此,对注射用药物中NaHSO3及EDTA辅料的用量控制成为药品质量控制的关键之一。目前NaHSO3及EDTA的测定方法多采用电位滴定法、液相色谱法、气相色谱法等[7-13]。其中电位滴定法选择性差、灵敏度低;液相和气相检测耗时长、检测成本高,不利于批量检测。离子色谱法(IC)具有操作简便、灵敏度高、可同时测定多组分等优点,在医药食品检测行业中得到越来越广泛的重视,如《中国药典》(2010年版)在新增的3个附录中其中就有离子色谱被一二三部附录同时收载。
本文在建立对NaHSO3及EDTA同时检测的IC法基础上,对委托检验样品中2者的含量进行测定,以控制低分子右旋糖酐氨基酸注射液的质量,排除用药安全的潜在隐患。
1 材料与方法
1.1 仪器与试剂 美国Dionex ICS-2000型离子色谱仪(配有EGC Ⅱ KOH自动淋洗液发生器,AS40自动进样器)。试验用水由Mili Pore超纯水机制备,电阻率为18.2MQ·cm。
NaHSO3对照品(购自广州化学试剂厂,批号20110102-2,含量95.12%)、EDTA对照品(购自广州化学试剂厂,批号20110201-1,分子量372.24,含量99.0%)、低分子右旋糖酐氨基酸注射液(由广东韶关丽珠集团利民制药厂送检,批号为1102032及1102038,规格为100 mL)
1.2 方法
1.2.1 色谱柱及色谱条件:阴离子交换色谱柱AS11分析柱:IonPac AS11-HC (4×250 mm),Dionex公司;保护柱:IonPac AH11-HC (4×50 mm),Dionex公司;淋洗液:KOH溶液(13 mmol/L);淋洗液罐:EGCⅡ KOH(序列号090581489019);抑制型电导检测器:ASRS 400 4 mm;抑制电流:70 mA;自动进样器:AS40 Automated Sampler;进样量:25uL;柱温:35 ℃。
1.2.2 储备液、混合对照品溶液及供试品溶液的配置:对照品储备液的配制:精密称取EDTA对照品0.05059g置100 mL量瓶中,加超纯水溶解并稀释至刻度,作为EDTA对照品储备液1;再精密量取1 mL至100 mL量瓶中,加水稀释至刻度。精密称取NaHSO3对照品0.15990g,置100 mL量瓶中,加水溶解并稀释至刻度,作为NaHSO3对照品储备液2。
混合对照品溶液的配制:分别精密量取对照品储备液1、2各1 mL至100 mL量瓶中,用水定量稀释制成每1 mL中分别约含EDTA 5 μg和NaHSO316 μg的溶液作为混合对照品溶液。
供试品溶液的配制:精密量取本品1 mL置50 mL量瓶中,加水定容,经0.45 μm微孔滤膜过滤即得。
1.2.3 线性关系考察:分别取EDTA 和NaHSO3对照品储备液,分别精密量取0.5 mL至200 mL量瓶、0.5 mL至100 mL量瓶、1 mL至100 mL量瓶、2 mL至100 mL量瓶、4 mL至100 mL量瓶;然后分别加水溶解、定量稀释制成每1 mL分别含EDTA 1.25、2.5、5、10、20 μg,以及每1 mL含NaHSO34、8、16、32、64 μg的溶液,分别作为对照品溶液S1、S2、S3、S4、S5。分别以EDTA和NaHSO3的峰面积对浓度进行线性回归。
1.2.4 精密度试验:取其中一批(批号为1102032)的供试品溶液,连续进样6次,计算EDTA和NaHSO3峰面积的RSD。
1.2.5 重复性试验:取批号为1102032同批注射液6份,分别进样,计算峰面积的RSD。
1.2.6 稳定性试验:取批号为1102032含量测定下的样品,放置1、2、4、8、12、24、48h后测定EDTA和NaHSO3峰面积的RSD。
1.2.7 加样回收率试验:精密移取批号为1102032样品0.5 mL至100 mL量瓶中,共9份,平均分成3组,分别加入EDTA对照品储备液和NaHSO3储备液300、500、700 μL。计算EDTA和NaHSO3的回收率、平均回收率和RSD。
1.2.8 检测限试验:将EDTA和NaHSO3对照品储备液按照比例定量稀释,以信噪比(s/n=3)时,测定EDTA和NaHSO3的检测限浓度。
1.2.9 样品测定:取送检的2批样品,量取1 mL至50 mL量瓶中并定容,并依建立的IC检测方法测定。
2 结果
2.1 线性回归方程 经计算EDTA的线性方程为:y=0.0395x-0.0327(R=0.9990);NaHSO3的线性方程为:y=0.1438x-0.3908(R=0.9993)。表明EDTA在1.25~20.03 μg/mL范围内、NaHSO3在3.82~60.84 μg/mL范围内均具有良好的线性关系。
2.2 精密度试验 批号为1102032的供试品溶液,连续进样6次,计算得EDTA和NaHSO3峰面积的RSD分别为0.35%和0.53%。
2.3 重复性试验 批号为1102032同批注射液6份,分别进样后峰面积的RSD为0.89%。
2.4 稳定性试验 批号为1102032含量测定下的样品,在放置1、2、4、8、12、24、48 h后测定结果显示EDTA峰面积的RSD为1.49%、NaHSO3峰面积的RSD为0.87%,表明样品在48 h内稳定。
2.5 加样回收率试验 结果显示,EDTA的回收率为99.4%~102.3%,平均回收率为100.8%,RSD为1.30% ;NaHSO3的回收率为94.2%~96.6%,平均回收率为95.3%,RSD为0.93%。表明该方法测定低分子右旋糖酐氨基酸注射液中NaHSO3和EDTA的含量回收率较好。
2.6 检测限试验 结果显示,EDTA的检测限浓度为0.1 μg/mL,NaHSO3的检测限浓度为0.06 μg/mL。
2.7 样品测定 批号1102032 EDTA的含量为4.6%,NaHSO3的含量为10.2%;批号1102032 EDTA的含量为4.5%,NaHSO3的含量为9.8%。
3 讨论
已有部分文献对不同药物中的EDTA及NaHSO3进行IC检测,如容彦华等[7]以10 mmol/L Na2CO3+1 mmol/L NaHCO3混合溶液为淋洗液,检测卡络磺钠氯化钠注射液中NaHSO3的含量;李恒等[8]以5 mmol/L Na2CO3+1 mmol/L NaHCO3混合溶液为淋洗液测定氨甲环酸注射液中EDTA的含量。笔者发现采用传统的Na2CO3/NaHCO3淋洗液进行分析时,背景电导较高,且EDTA和SO32-峰形较差。由于EDTA峰值和峰面积相对较小,且与相邻的Cl-峰及NO3-峰保留时间非常接近,造成实际检测上的困难;同样SO32-峰与由于氧化产生的少量SO42-峰保留时间也非常接近,区分难度较大。笔者从进样的稳定性、淋洗液成分与配比的优化开展大量试验,最终采用自动精准的在线淋洗液发生器,克服了人工配置淋洗液带来的扰动;并改用电导较低的KOH淋洗液,在保证背景噪声稳定的同时,最大限度降低了背景电导值,检测峰对称性及峰形得以改善,EDTA及SO32-峰的分离度显著提高。见图1。
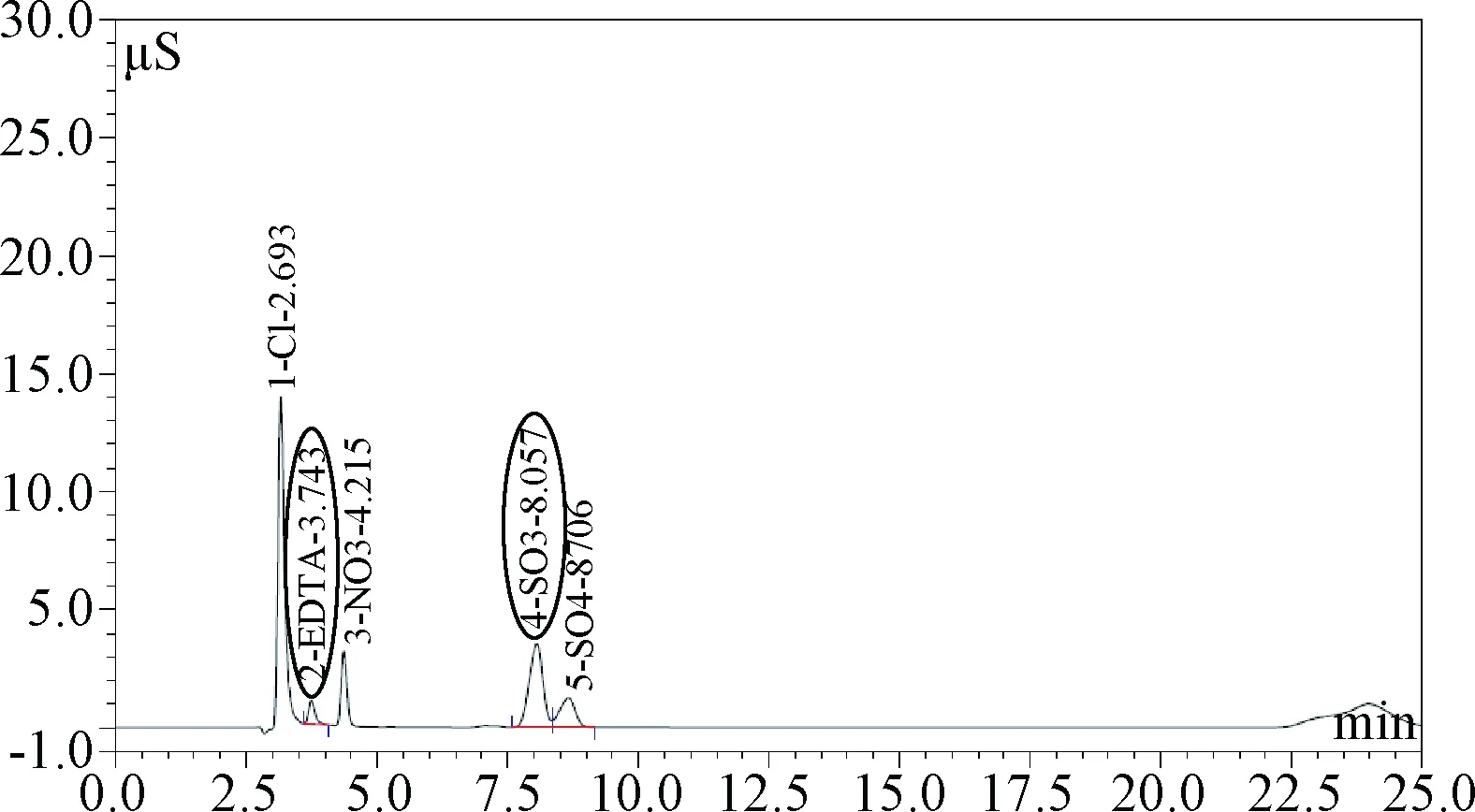
图1 IC同时检测EDTA和NaHSO3Fig.1 Detection of EDTA and NaHSO3 simultaneously
淋洗液浓度是影响阴离子分离效果的另一个重要因素,当淋洗液浓度为4 mmol/L KOH溶液,NaHSO3对应峰与少量由于氧化生成的NaHSO4杂质峰重叠严重,当溶液浓度提高到6~10 mmol/L时,EDTA峰形较差,当KOH淋洗液浓度大于15 mmol/L,EDTA对应峰与Cl-、NO3-等杂质峰重叠严重。经反复摸索,确定最佳淋洗液浓度为13 mmol/L,在该浓度淋洗液下EDTA2-、SO32-、Cl-、SO42-等多种阴离子可良好分离,与其他杂质峰也无显著干扰,能很好的同时对低分子右旋糖酐氨基酸注射液使用的金属离子螯合剂EDTA和抗氧化剂NaHSO3进行监测。
需要指出的是,虽然亚硫酸钠和EDTA作为稳定剂可以保持药品的稳定性在多种注射液中应用,如奥拉西坦注射液、氨甲环酸注射液、硫酸依提米星注射液及中药注射剂,但随之而来的副反应更加需要关注,如有研究表明亚硫酸钠对多种生命物质有影响,与染色体的交联反应可能是副反应的主要原因[14],美国FDA已正式要求厂家明确标出药品中所添加的抗氧化剂含量及临床副作用,更有甚者如欧洲的爱尔兰等国家已禁止含亚硫酸盐的氨基酸溶液在临床上的使用[15]。而我国现有国家标准和行业标准均未有EDTA及NaHSO3的限度控制,且不同企业在实际生产中加入抗氧化剂的量差异较大,从检测方法的可靠性、药品使用的安全性并参考国外相关药品质量控制标准,结合我国现有企业技术工艺水平,笔者推荐以2%和4%作为目前EDTA及NaHSO3辅料控制限值。
[1] 李琉,兰文,王伟姣.IC法测定盐酸多巴酚丁胺注射液中亚硫酸氢钠的含量[J].中南药学,2013,11(1):58-60.
[2] 胡容融.氨基酸输液中抗氧剂亚硫酸盐的控制与测定[J]. 广东药学院学报,2001,17(4):283-284.
[3] 吕蓓蓓,李涛,田静,等.离子色谱法同时测定奥拉西坦注射液中微量EDTA及磷酸根离子[J].药物分析杂志2011,31(5):987-989.
[4] 陈飞东,戴志远.食品中亚硫酸盐测定方法的研究进展[J].食品研究与开发,2006,27(8):139-142.
[5] 黄惠玲,王玉健,卓海华,等.食品中亚硫酸盐的离子色谱法测定[J].分析实验室,2009,28(8):15-17.
[6] 赵常志,郭震,赫春香,等.壳聚糖修饰玻碳电极卷积伏安法测定环境水中的EDTA[J].分析试验室,2003,22(3):38-42.
[7] 容彦华,周桂荣,单玉富,等.IC法测定卡络磺钠氯化钠注射液中NaHSO3的含量[J].药物分析杂志,2011,31(1):160-162.
[8] 李恒,晏菊姣,黄京芳.离子色谱法测定氨甲环酸注射液中EDTA的含量[J].药物分析杂志2012 32(9)1684-1686.
[9] 刘军玲, 张亚中. 离子色谱法测定白花蛇舌草注射液中亚硫酸盐与硫酸盐总量[J].安徽医药, 2013, 17(5):769-770.
[10] 潘广文, 姜振邦, 李仁勇. 离子色谱法检测牙膏中的亚硫酸盐[J].化学分析计量, 2014,23(S1): 38-39.
[11] 邵宏宏, 周向阳, 周秀锦, 等. 离子色谱法测定水产品中亚硫酸盐的含量[J].浙江海洋学院学报(自然科学版),2011, 30(4): 326-330.
[12] 王欣美, 毛秀红, 王柯. 离子色谱法同时测定中药注射剂中亚硫酸盐及枸橼酸含量的研究[J].中国卫生检验,2012, 22(3): 470-472.
[13] 韦敏, 肖亿. 反相高效液相色谱法测定硫酸依替米星滴眼液的含量[J].医学文选, 2006, 25(1): 15-17.
[14] 林娟红, 戚荣平, 姚超英. 离子色谱法测定复方氨基酸注射液中亚硫酸根的含量[J]. 现代科学仪器, 2013, 10(5):110-119.
[15] Shapiro R,Gazit A.Crosslinking of nucleic acids and proteins by bisulfite[J].Adv Exp Med Biol,1997,86A: 633-640.
(编校:吴茜)
DeterminationofsodiumhydrogensulfiteandEDTAindextran40andaminoacidsinjectionbyionchromatography
YU Yan, LIANG Wei-yang
(Guangdong Institute for Drug Control, Guangzhou 510180, China)
ObjectiveTo develop a suppressed conductivity ion chromatography method for the determination of antioxidant sodium bisulfite and EDTA in dextran 40 and amino acids injection.MethodsAn IonPac AS11-HC anion column was used, with 13 mmol/L potassium hydroxide solution as eluent and using suppressed conductivity detector. The current rate was controlled to 1.0 mL/min and electric current was 70 mA. The samples were injected by automatic sampler after diluted.ResultsThe calibration curve for sodium bisulfite was linear in the range of 1.25-20.12 and 3.86-61.82(g/L) respective to antioxidant sodium bisulfite and EDTA(R>0.9990). The average recovery was 100.89% and 95.3%.ConclusionThe method developed was accurate and convenient. It also has the characteristics of high selectivity and good reproducibility. This method is available for the determination of antioxidant sodium bisulfite and EDTA in dextran 40 and amino acids injection.
ion chromatography; dextran 40 and amino acids injection; sodium bisulfite; EDTA
10.3969/j.issn.1005-1678.2016.10.005
广东省科技计划项目(2014A020218011,、2016A040403076);越秀区科技计划项目(2015-PT-004)
余燕,女,硕士,主管药师,研究方向:生检生化,E-mail:494409425@qq.com;梁蔚阳,女,硕士,主任药师,研究方向:生检生化,E-mail:wl_1023@163.com
R453.9
A
