土壤和植物中铅含量测定及分析*
2016-08-30黄周满汤璐尹春燕
黄周满 汤璐 尹春燕
(1.武昌理工学院生命科学学院 武汉 430223; 2.武汉工程大学邮电与信息工程学院化工与材料学部 武汉 430073; 3.华中师范大学化学学院农药与化学生物学教育部重点实验室 武汉 430079)
土壤修复
土壤和植物中铅含量测定及分析*
黄周满1汤璐2尹春燕3
(1.武昌理工学院生命科学学院武汉 430223;2.武汉工程大学邮电与信息工程学院化工与材料学部武汉 430073;3.华中师范大学化学学院农药与化学生物学教育部重点实验室武汉 430079)
采用BCR连续浸提法提取土壤和植物中铅,对土壤中4种不同形态(酸可提取态(BCR1)、可还原态(BCR2)、可氧化态(BCR3)和残渣态)的铅进行了分析,结果表明,土壤中的铅含量呈现如下的趋势:BCR2>BCR3>BCR1;土壤的理化性质,如土壤含水率、pH值、有机质及微生物数量等对铅元素有效态以及铅元素迁移状态都有影响;对作物中铅进行测定,发现作物中铅浓度依次为根>叶>茎;另外土地上覆膜也能促进土壤中的铅元素转化为可供植物直接利用的有效态。
铅污染土壤BCR连续浸提法植物
0 引言
重金属、农药能破坏土壤结构和营养状况,已成为污染土壤的主要污染物[1]。重金属具有长期性和非移动性等特性,土壤被重金属污染后,会对农作物产品和地下水产生次级污染,并通过食物链影响人类健康。土壤中铅(Pb)的质量浓度范围通常为2~200 mg/kg,平均含量约为13~42 mg/kg[2]。铅是蓄积性毒物,可以随血液循环而迁移,随后除少量在肝、脾、肾等组织及红细胞中存留外,大约有90%~95%的铅以稳定的不溶性磷酸铅储存于骨骼系统。
虽然各国在意识到铅污染问题后改用无铅汽油代替铅汽油以期减少铅污染,但是进入土壤中的铅已经富集,外援铅大都停留在土壤表层[3],并在生态系统中传递,一些土壤已经丧失生机。因此,土壤功能修复就显得尤为重要。ROTKITTIKHUN P等研究比较了Vetiveriazizanioides和Thysanolaenamaxima对铅的积累以及它们的生物量,从而选择其中一种用于Bo Ngam铅矿土壤的植物提取修复技术[4]。在了解了土壤特性对重金属含量的影响后,改变土壤的特性,选择超积累和高生物量的植物便可修复土壤的重金属污染,这也是植物吸收重金属的应用。
1 实验部分
实验样品的种植地点是某市一苗圃内。实验将一块土地分成两块,两块土地相连接。在一块土地上直接种植小白菜,另一块土地覆膜后种植小白菜。当小白菜约生长了两个月的时间,采集样品。样品的采集分成植物与土壤两个部分。
1.1土壤理化指标的测定
土壤理化指标主要测定土壤中微生物(血球计数板计数)、有机质(重铬酸钾法)、含水率和烧失量(重量法)及pH值(pH酸度计),测定结果见表1。
1.2植物样品的消解
采集的植物样品洗净后自然风干,继而将植株分为根、茎、叶三部分,分别于105 ℃烘干,碾磨成粉状。采集的土壤根据需要自然风干,以备用。将植物样品分为根、茎、叶三部分,分别消解:称取待消解的植物样品0.25 g于150 mL的锥形瓶中,用几滴去离子水润湿后,加入5 mL的浓硝酸(分析纯),盖上坩埚盖,浸泡过夜。第二天,将坩埚盖倒扣,放于电热板上加热消解,至锥形瓶中的植物样品全部溶解,溶液透明澄清,打开坩埚盖,将瓶中的浓硝酸蒸干,即得白色晶体。将该白色晶体定容至25 mL,贮存于聚乙烯试管中。若消解过程中,直至浓硝酸蒸干,仍未得澄清透明溶液,可补加浓硝酸,再辅以浓硫酸以帮助消解,其余步骤相同,同时做两个空白样。
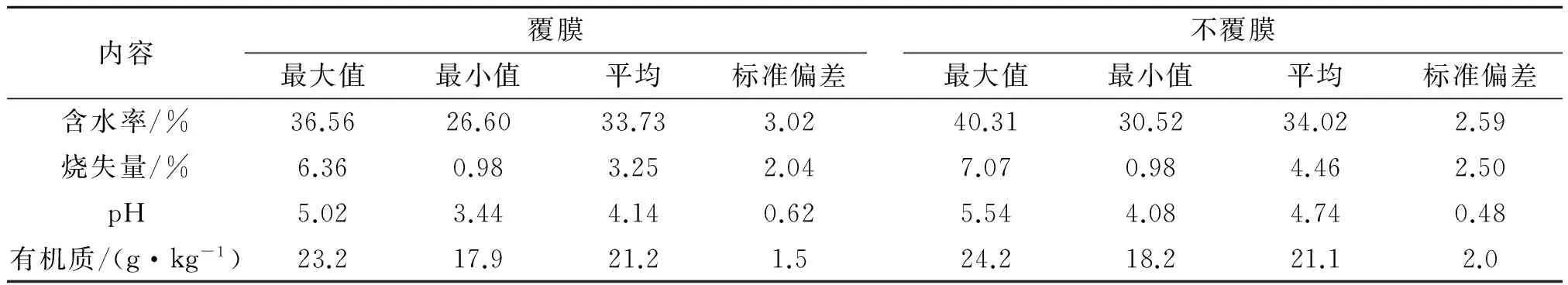
表1 土壤理化指标测定结果
1.3土壤中铅的提取
土壤中铅的提取采用欧共体的BCR连续浸提法。按序号称取0.75 g土壤样品于50 mL的聚乙烯试管中,实验步骤如下。
(1)按照土液质量比1∶40往试管中加入浓度为0.11 mol/L的HAc溶液30 mL,室温下震荡16 h,在2 000 r/min的转速下离心30 min后,取上清液保存。
(2)按照土液质量比1∶40的比例往经过步骤1的含土壤的试管中加入30 mL浓度为0.5 mol/L的盐酸羟胺溶液,室温下震荡16 h,在2 000 r/min的转速下离心30 min后,取上清液保存。剩余试管中的土壤加去离子水洗涤,震荡、离心,弃去上清液。
(3)按照1∶10的比例往试管中加入7.5 mL浓度为8.8 mol/L的H2O2,在85 ℃水浴下恒温,蒸至近干。重复上述操作一次。
(4)按照土液质量比1∶50的比例往试管中加入37.5 mL浓度为1.0 mol/L的乙酸铵溶液,震荡16 h,在2 000 r/min的转速下离心70 min。取上清液保存。
植物体中和土壤中提取的铅样品标上顺序后,用火焰原子吸收分光光度法测定。
2 实验结果及分析
2.1土壤中铅含量
本实验采用欧共体BCR连续浸提法提取土壤中的铅。BCR连续浸提法将土壤中的铅分成4个形态,分别是:酸可提取态(对应BCR第一步,即BCR1)、可还原态(对应BCR第二步,即BCR2)、可氧化态(对应BCR第三步,即BCR3)和残渣态。由实验结果可知,除残渣态外,铅在土壤中可还原态的浓度最高,其次为可氧化态,酸可提取态的含量最低。具体测定结果见表2。
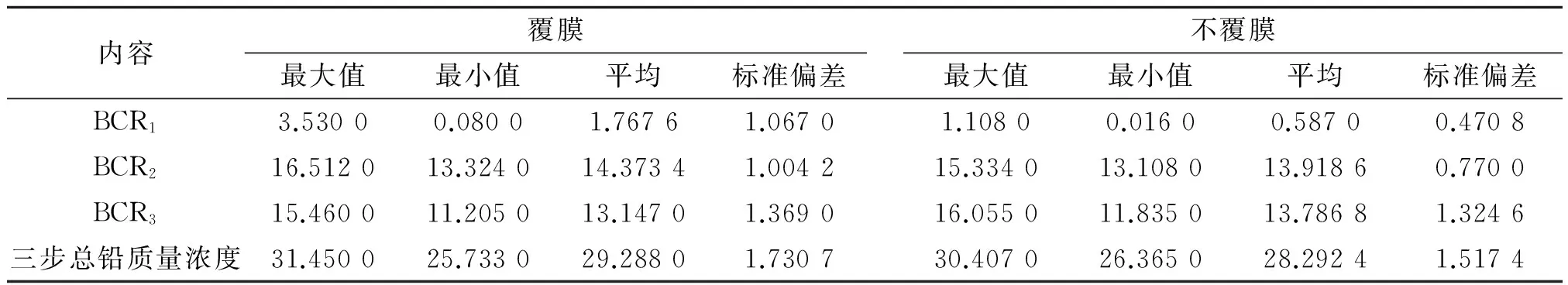
表2 BCR提取的土壤中的铅含量 mg/kg
BCR1提取的铅形态,对应Tessior连续五步提取法中的可交换态和碳酸盐结合态[5],该态是能被植物直接吸收利用,是最有效的形态[6]。由表2可知覆膜与不覆膜之间铅浓度的异同,以及各步提取的铅的异同。覆膜条件下,土壤中的可交换态和碳酸盐结合态远高于不覆膜条件下,前者比后者高3.01倍,由此说明覆膜促进了土壤中的铅转化成能易于被植物吸收的有效态。无论是覆膜还是不覆膜的土壤,BCR2与BCR3两步骤提取的铅浓度相差不多,BCR2中可还原态铅的浓度大小为覆膜>不覆膜,根据表2给出的数据计算可知,两者仅相差1.65%。但是在不覆膜CR3中可氧化态铅的浓度却是不覆膜>覆膜,后者比前着低了4.86%。三步提取的铅的总浓度是覆膜>不覆膜,鉴于同一土壤中铅的含量相同,且没有外源铅进入土壤,因而土壤中的全铅浓度在同一水平,可以推测残渣态的铅浓度应是覆膜<不覆膜。
2.2植物中铅含量
植物中铅测定结果见表3。
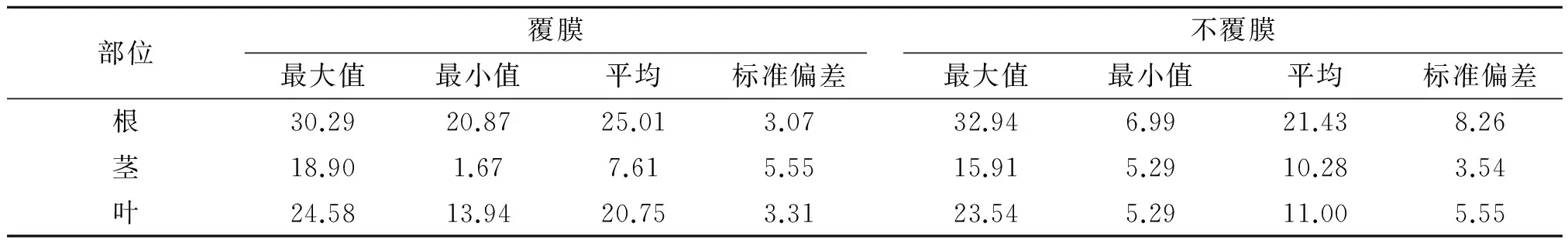
表3 植物根、茎、叶中的铅含量 mg/kg
一般来说,植物中重金属的浓度应按照如下的排列:根>茎>叶。这是因为,植物中重金属的主要来源是土壤,根从土壤中吸收重金属,再运输到茎,继而输送到叶。在运输过程中,总有一部分重金属受到植株生理作用的抑制而滞留,这就会导致了重金属含量根>茎>叶结果,无论是覆膜条件或是不覆膜条件,植株中铅的浓度都呈现如下趋势,即根>叶>茎。分析原因应该是植株通过其叶子从大气中获得并富集铅,以致叶子中铅的浓度大于茎中铅的浓度,并与根中的铅浓度相差无几。再比较覆膜与不覆膜条件下植株各器官内铅浓度的差异,根中铅浓度表现出覆膜>不覆膜,从表2和表3可知,可交换态铅(不覆膜CR1)浓度在覆膜条件下比不覆膜条件下的高,即能够被植物直接吸收利用的铅在覆膜条件下高,因而,覆膜条件下根中的铅也较高。叶中的铅浓度与根中的铅浓度呈现同样的现象,即覆膜>不覆膜,这可能是因为覆膜条件下水分利用率的提高增强了植株的蒸腾作用,使得叶子上的气孔孔径增大,气孔数量增多,从大气中吸收的铅也就多。
3 结语
(1)土壤的理化性质,如含水率、pH值、有机质等,都对铅的有效性有非常重要的影响,进而影响作物中铅的含量。土壤含水率的高低,影响了土壤中水溶态铅和可交换态铅(即酸可提取态)的含量,含水率高,则酸可提取态的有效性好,易与被植物吸收利用。土壤微生物量通过影响土壤中的pH值和有机质间接影响土壤中铅的有效性。覆膜为土壤微生物的生存提供了适宜的温度和水分条件,在覆膜条件下,微生物的生命活动比较强烈,产生的二氧化碳导致了土壤中pH的降低,增强了土壤铅的有效性。
(2)实验采用不覆膜CR连续浸提法提取土壤中的铅,该法将土壤中的铅分为四个形态:酸可提取态(不覆膜CR1)、可还原态(不覆膜CR2)可氧化态(不覆膜CR3)和残渣态。实验结果表明,土壤中的铅含量呈现如下的趋势:不覆膜CR2>不覆膜CR3>不覆膜CR1,残渣态铅没有直接测定,从总铅不变的情况,只能判断残渣态铅覆膜>不覆膜。
(3)植物体中的铅含量,呈现如下趋势:根>叶>茎。植物由根部从土壤中吸收并富集铅,铅再由根部迁移到茎,然后再迁移到叶,而叶还从大气中吸收并富集铅,使得叶中的铅含量高于茎中的铅含量。经过相关性分析计算得知叶中的铅含量与不覆膜CR2提取的铅含量呈正相关,茎中的铅与不覆膜CR3提取的铅呈正相关。
(4)pH值是影响重金属生物地球化学行为的控制因素,土壤pH值愈低,土壤有效态Pb含量愈高,愈有利于植物吸收。土壤低pH值有利于Pb离子通过自由扩散出入根部及自由空间。土壤中的粘土矿物、水合氧化物和有机质都具有一定数量的可变电荷,随着体系pH 值的升高,表面的负电荷增加,因而对重金属离子的吸附能力加强。土壤体系pH值还可影响铅化合物的溶解度及铅络合物的稳定常数,当土壤pH 值较高时,土壤中的铅化合物的溶解度减小,而铅络合物的稳定常数增加。
(5)覆膜能促进土壤中的铅元素转化为可供植物直接利用的有效态,使植物对元素吸收的抗性增强,但不会改变植株的生理效应。
[1]白红娟,肖根林,贾万利,等.光合细菌提高污染土壤中酶活性的研究[J].工业安全与环保,2011,37(6):13-15.
[2]李学垣.土壤化学[M].北京:高等教育出版社,2005.
[3]游芳.蔬菜种植基地土壤中铅的含量与农产品——菠菜铅含量相关性的调查研究[J].科技信息,2010(12):386-390.
[4]RPTKITTIKHUM P,CHAIYARAT R, KRUATRACHUE M, et al. Growth and lead accumulation by the grasses vetiveria zizanioides and thysanolaena maxima in lead-contaminated soil amended with pig manure and fertilerzer: A glasshouse study[J]. Chemosphere,2007,66:45-53.
[5]李非里,刘丛强,宋照亮.土壤中重金属形态的化学分析综述[J].中国环境监测,2005,21(8):21-27.
[6]刘云惠,魏显有,王秀敏,等.土壤中铅镉的化学形态和有效态的提取与分离研究[J].河北农业大学学报,1998,21(4):44-47.
Determination and Analysis of the Lead Content in Soil and Plant
HUANG Zhouman1TANG Lu2YIN Chunyan3
(1.SchoolofLifeScience,WuchangUniversityofTechnologyWuhan430223)
BCR continuous extraction is used to extract the lead in soil and plants and analyze the lead in four different forms (acid extractable state (BCR1), reducible state (BCR2), oxidizable state (BCR3)) and residue state. The results show that the contents of lead in soil show the following trends: BCR2>BCR3>BCR1. The physical and chemical properties of soil, such as soil moisture content, pH, organic matter and microbe content etc. influence the available and transition state of lead. The lead determination in crops shows that lead concentration follows root >leaf>stem. In addition, film can promote the transformation of the lead in soil into the available state which can be used by plants directly.
lead pollutionsoilBCR continuous extractionplants
国家自然科学基金(21502061),湖北省自然科学基金(2015CFB384)。
黄周满,女,1981年生,讲师,硕士,主要从事水污染控制及固体废物处理等研究。
汤璐,女,1980年生,硕士,讲师,主要从事化学分析及检测与无机化工产品研究。
2015-10-26)
