采油废水ABR厌氧处理系统中微生物的群落特征*
2016-08-30刘宇辉刘利王帅章春芳谭自航解庆林
刘宇辉 刘利 王帅 章春芳 谭自航 解庆林
(1.桂林理工大学环境科学与工程学院 广西桂林 541006; 2.贺州学院 广西贺州 542800;3.浙江大学海洋学院 浙江舟山 316021)
水污染治理
采油废水ABR厌氧处理系统中微生物的群落特征*
刘宇辉1刘利2王帅1章春芳3谭自航1解庆林2
(1.桂林理工大学环境科学与工程学院广西桂林 541006;2.贺州学院广西贺州 542800;3.浙江大学海洋学院浙江舟山 316021)
为了了解采油废水ABR厌氧处理系统中起主要作用的微生物种群,利用高通量测序手段分析了北海涠洲岛采油废水处理终端ABR厌氧反应池内的微生物群落特征。结果表明,ABR反应池内活性污泥中的细菌主要是产甲烷菌,主要来源于变形菌门、厚壁菌门、拟杆菌门和热袍菌门。目前已经形成了以产甲烷菌介导的稳定的功能降解菌群。真菌主要来源于三个门类:Ascomycota、Basidiomycota和Zygomycota,对于采油废水中的组分均有一定的降解作用。
采油废水折流式厌氧反应器微生物群落高通量测序
0 引言
采油废水产生于石油生产中的多个环节,包括石油纯化过程中原油脱水产生的废水,海底管线油水置换水以及船舶工作过程中的压载水[1]。采油废水所含成分复杂,不仅含有大量的石油类物质,而且还含有溶解性无机盐、悬浮性固体、硫酸盐、氨以及重金属类物质,属于难处理废水,如果处理不当,就会对周边环境和人体产生危害。
生物法处理采油废水具有经济方便、环境友好等特点,是处理采油废水的关键步骤,其中微生物代谢在处理废水中起了重要作用。北海涠洲终端处理厂废水处理站采用厌氧-好氧串联活性污泥法处理采油废水,已稳定运行10年,处理水量可达1 000 m3/d,出水水质达到国家污水综合排放标准(GB 8978—1996)的一级标准[2]。该处理系统中的ABR反应器采用格室串联结构,可以形成良好的微生物功能分区[3],同时在折流运动过程中,废水中的有机物和厌氧活性污泥充分接触,使部分有机物得以去除[4]。同时,厌氧过程使废水可生化性提高,为进一步的好氧处理提供了保障。为了深入了解厌氧微生物降解废水中污染物的过程,本研究利用高通量测序技术,以采油废水ABR反应池中的活性污泥为研究对象,分析其中细菌、真菌的群落特征,以期了解功能菌群的多样性和分布情况。
1 材料与方法
1.1样品的采集
ABR反应池1个,分7格,水力停留时间36 h,反应池尺寸为21 m×16.6 m×6.5 m,有效容积1 500 m3,设计流量1 000 m3/d,折流区上升区水力负荷1.44 m3/(m2·h),折流口冲击流速1.45 mm/s。采集的样品包括采油废水原水、ABR反应池中的厌氧活性污泥、以及厌氧池出水,来源于广西北海涠洲岛废水处理终端。活性污泥采样点的位置从厌氧池第一格开始,每隔两格采集污泥作为一个样品,每一格的厌氧污泥样品均为多位点多次混合样,共得到3个样品,分别编号A11,A12和A13。
1.2水样检测指标和分析方法
活性污泥基因组DNA的提取采用PowerSoilDNA Isolation Kit试剂盒,提取之前将活性污泥样品进行离心分离,取0.25 g下层沉淀进行DNA的提取。DNA样品的浓度通过Quawell Q5000超微量紫外分光光度计检测[7],同时用质量分数为1%琼脂糖凝胶电泳检测DNA质量,并在Gel DocTMXR+成像仪上显像。
1.3PCR扩增和产物纯化
细菌采用25 μL的反应体系进行PCR扩增,包括Taq PCR Master Mix(2×)12.5 μL,上游引物515 F(带Barcode)(10 μmol/L)1 μL,下游引物806R(带Barcode)(10 μmol/L)1 μL,DNA模板(10 μg/mL)1 μL,双蒸水加至25 μL。PCR反应程序为:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共30个循环。最后72 ℃延伸5 min。
利用真菌引物ITS1(带Barcode)和ITS2(带Barcode)对基因组DNA进行扩增。PCR总反应体系为50 μL,包括 Taq PCR Master Mix(2×) 25 μL、DNA模板(10 μg/mL)1 μL、引物ITS1(10 μmol/L)2 μL、引物ITS2(10 μmol/L)2 μL,双蒸水加至50 μL。反应条件为:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共35个循环。最后72 ℃延伸10 min。
PCR产物使用质量分数为2%的琼脂糖凝胶进行电泳检测,根据PCR产物浓度进行等浓度混样,充分混匀后使用琼脂糖凝胶进行电泳检测。PCR产物纯化后进行高通量测序。
2 结果与讨论
2.1污水厂ABR工艺的处理效果
采油废水原水和厌氧池出水的水质指标如表1所示。采油废水原水经ABR厌氧池处理,COD的去除率达49.79%,可知ABR对于有机污染物有一定的处理效果。石油类质量浓度从91 mg/L下降到56 mg/L,表明将该工艺应用于石油开采行业具有良好前景。TOC和TN的值也明显降低,下降率分别为74.12%和46.72%,说明ABR对于石油烃类和硝酸盐的降解起作用。

表1 原水水质与厌氧池出水水质的比较 mg/L(pH除外)
2.2DNA提取、纯化
DNA用质量分数为1%的琼脂糖凝胶电泳后的电泳结果如图1所示:基因组DNA大小整齐明亮,具有单一条带,大小均大于1 kb,有稍许拖尾,说明可能含有少量蛋白质污染。DNA浓度检测结果显示OD 260/280的值在1.65~1.75之间,均小于1.8,说明确实存在蛋白质污染,经试剂盒纯化后即可去除蛋白质污染。质量浓度在10 ng/μL左右,满足后续PCR的要求。
2.3ABR活性污泥中细菌和真菌的PCR扩增
细菌的PCR扩增结果如图2(a)所示:目的条带大小291 bp,条带单一明亮,无非特异性扩增和引物二聚体。真菌的PCR结果如图2(b)所示:目的条带大小250 bp,条带单一且明亮,无明显拖尾和非特异性扩增。

图1 ABR活性污泥中基因组DNA电泳图
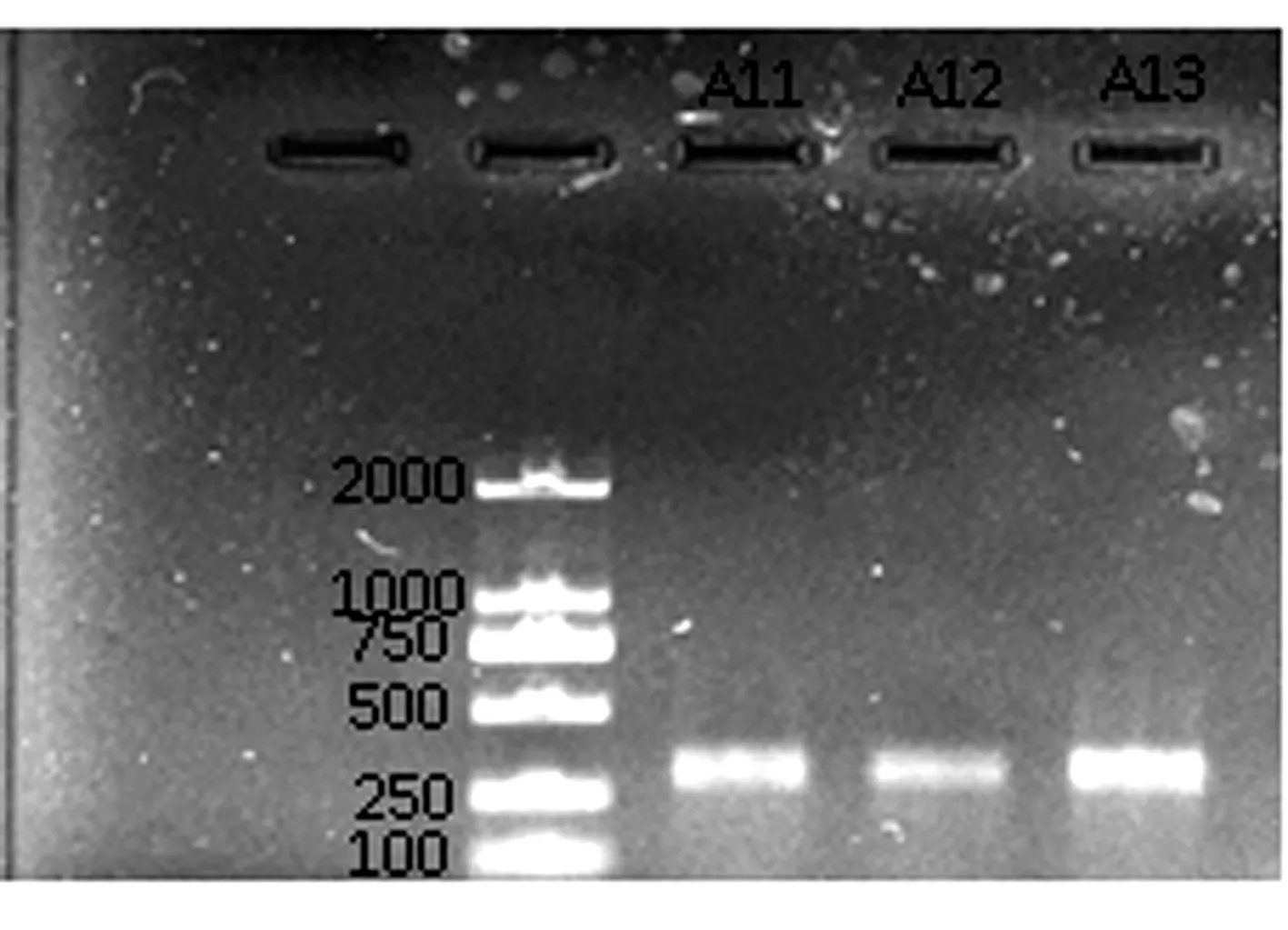
(a)

(b)
2.4采油废水厌氧处理系统中细菌和真菌多样性指数分析
通过高通量测序分析共获得38118条高质量的16S rRNA基因有效序列和41147条真菌ITS序列。活性污泥中细菌和真菌的多样性指数分析如表2所示。本文中OUT数目[8]是通过对微生物的标签基因序列按照97%的相似度进行归类,得出采油废水ABR厌氧处理系统活性污泥中共有259个细菌OTU和268个真菌OTU。ACE和ChaoI分析表明,细菌的OTU丰度高于真菌。而Shannon指数分析[9]表明真菌群落多样性高于细菌。

表2 ABR活性污泥中细菌和真菌的多样性指数分析
2.5采油废水ABR处理系统中细菌的群落结构
ABR活性污泥细菌序列分属于28个门,在门水平上的分类如表3所示。其中变形菌门(Proteobacteria)数量最多,占总丰度的45.9%;其次是厚壁菌门(Firmicutes)占11.6%;另外还有拟杆菌门(Bacteroidetes)8.1%和热袍菌门(Thermotogae)6.2%。从属水平的群落组成上来看(表4),分属于180个属,其中主要的是脱硫弧菌属Desulfovibrio(2.3%)、Thermovirga(1.9%)、海杆菌属Marinobacterium(1.8%)、硫微螺菌属Thiomicrospira(0.7%)和噬甲基菌属Methylophaga(0.7%)。其中海杆菌属Marinobacterium参与多环芳烃降解过程,属于石油烃协同降解细菌,可以有效降解石油烃类[10]。硫微螺菌属Thiomicrospira中含有一些反硝化脱硫菌,是一种可以同步硝酸盐还原和硫氧化能力的功能微生物菌群[11],可应用于采油废水的处理。噬甲基菌属Methylophaga是以甲烷为底物的甲基氧化菌,主要利用核酮糖单磷酸途径中的单碳糖作为碳源[12]。海杆菌属Marinobacterium、噬甲基菌属Methylophaga等大部分细菌属于石油烃协同降解菌,因此ABR池内所发生的生化反应是产甲烷菌所介导的协同底物降解过程[13]。WANG Z L等人[14]发现油田中存在大量的Marinobacterium属的细菌,这与本实验结果中发现Marinobacterium属的细菌吻合。脱硫弧菌属中的硫酸盐还原菌可以将硫酸根离子转化为S2-,可以降解许多难降解的有机物质,在废水处理中应用广泛[15]。但同时,它会产生大量H2S气体,使污水发黑发臭,活性污泥中大量含有硫酸盐还原菌还会抑制产甲烷菌的活性[16],腐蚀管道[17],所以应该控制其在一个合理的水平,以保证厌氧活性污泥中的菌群平衡。DAHLE H等[18-19]从一个北海热油井产出水中分离到1株Thermovirgalienii菌,可以降解蛋白质、单氨基酸和有机酸,说明Thermovirga菌属对于采油废水具有降解作用。
由于采油废水水温一般高于45 ℃,所以必然存在一些代谢速度快、处理效率高的嗜热菌[20]。黎霞等[21]发现1株油藏嗜热厌氧杆菌,可以发酵葡萄糖产生乙醇、乙酸等产物,经鉴定属于Thermoanaerobacter属,而本文研究结果表明Thermoanaerobacter属占0.39%,在ABR池内稳定存在。此外,ABR厌氧池内还含有热单孢菌属(Thermomonas)[22]、Thermosipho、嗜热互营菌属Thermosyntropha、热袍菌属Thermotoga和Thermovirga等属,这些菌的存在是厌氧池持续高温却能稳定运行的原因之一。
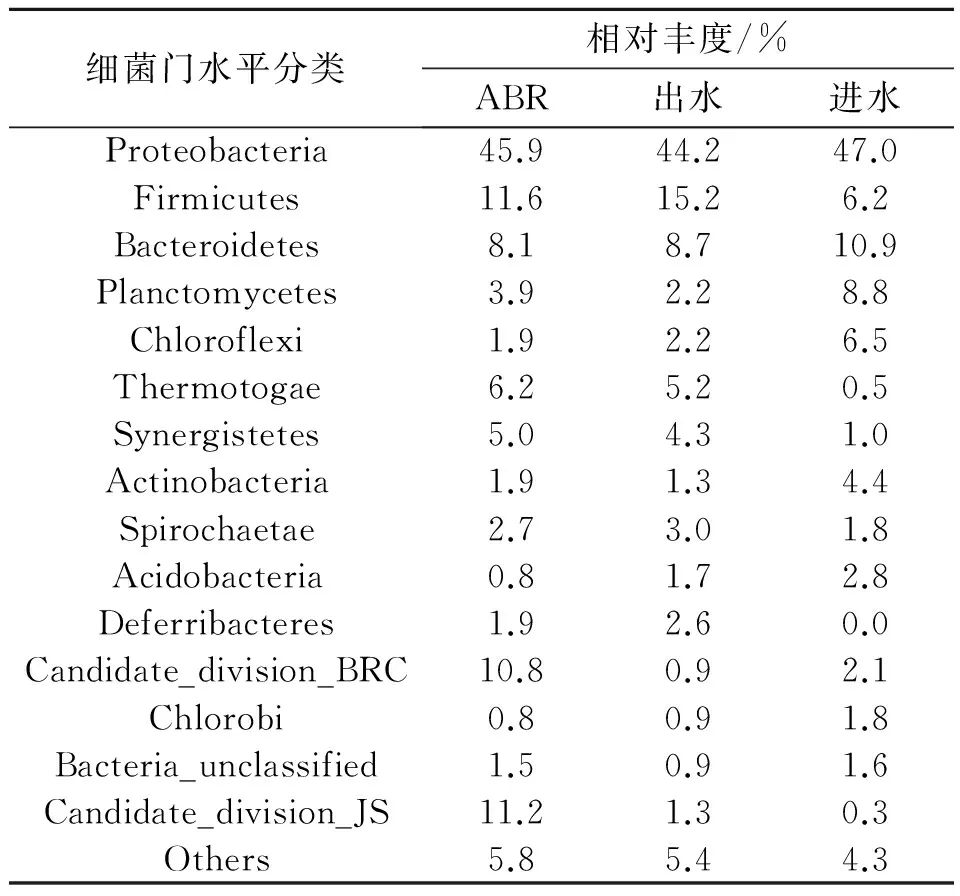
表3 细菌在门水平上的种群结构
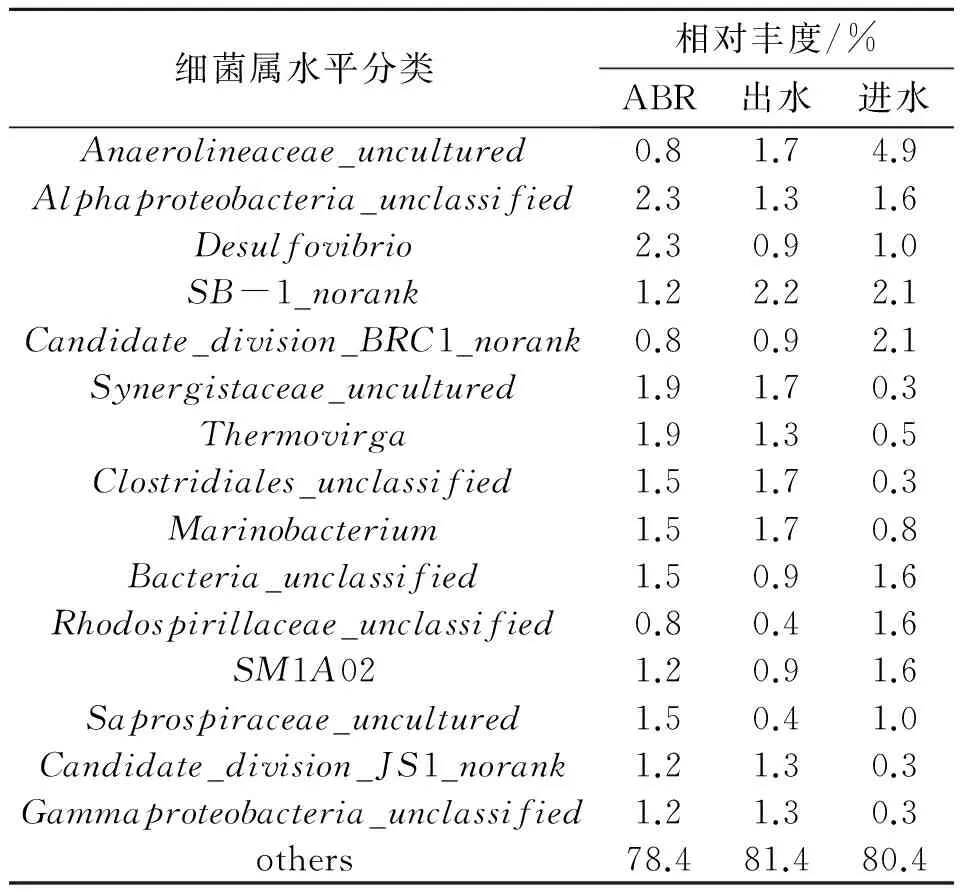
表4 细菌在属水平上的种群结构
2.6采油废水ABR处理系统中真菌的群落结构
真菌的群落结构主要包括3个门类(表5):Ascomycota、Basidiomycota和Zygomycota。其中Ascomycota门丰度最高,占总丰度的62.31%,其次是Basidiomycota为19.4%,丰度最少的是Zygomycota门,只占了3.73%。相比较进水、ABR和出水,发现微生物种类变化不大,只是数量上发生变化。Ascomycota菌随着处理过程逐渐增多,Basidiomycota菌逐渐减少。这与之前王帅等[23]采用PCR-DGGE进行采油废水真菌群落研究的结果一致,均得出Ascomycota门真菌的丰度最高,在整个污泥系统中起主要作用。JIANG S Y等[24]通过研究油页岩矿中真菌的群落结构,发现Ascomycota和Basidiomycota在群落结构中丰度最高。Ascomycota之所以能在采油废水处理中起主要作用,是因为它产生的胞外酶可以将纤维素转化为纤维二糖,然后再分解为葡萄糖,最终将葡萄糖作为营养物质进行新陈代谢作用[25]。在Basidiomycota门中,一些属的真菌不仅可以分解纤维素,还可以分解木质素[26]。这说明Ascomycota和Basidiomycota可以将石油中的某些组分作为营养物质进行新陈代谢,起到降解石油的作用,在含油环境中分布广泛。
真菌在属水平上的多样性(表6)显著高于细菌。除了unclassified外,主要有Aspergillus(曲霉属)、Alternaria(链格孢属)和Cryptococcus(隐球菌属)这几大类。相比较进水、ABR和出水,真菌的种类和数量分布均匀。CONTESINI F J等[27]认为Aspergillus可以作为生物催化剂应用于工业生产中;贾洪柏等[28]从大庆石油污染土壤中筛选到14株石油降解丝状真菌,其中1株属于曲霉属Aspergillus,可以高效降解原油。Cryptococcus属中的菌有一部分为产油脂微生物[29],可以利用葡萄糖储存油脂,目前作为一种新型能源被广泛研究。
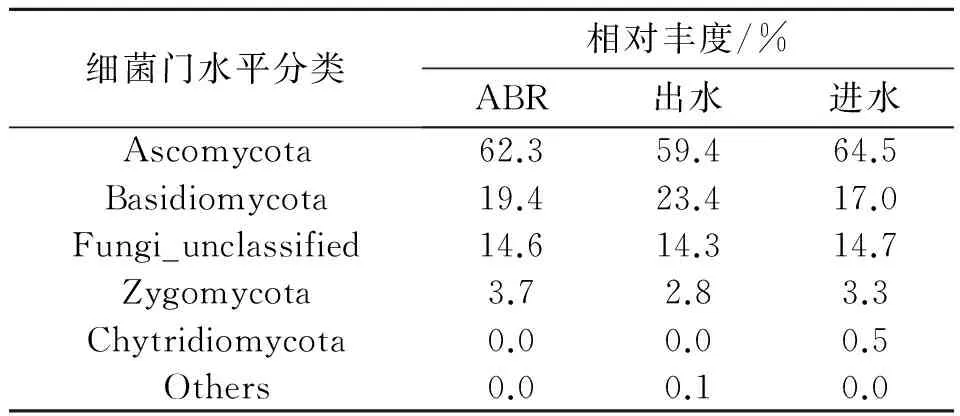
表5 真菌在门水平上的群落结构
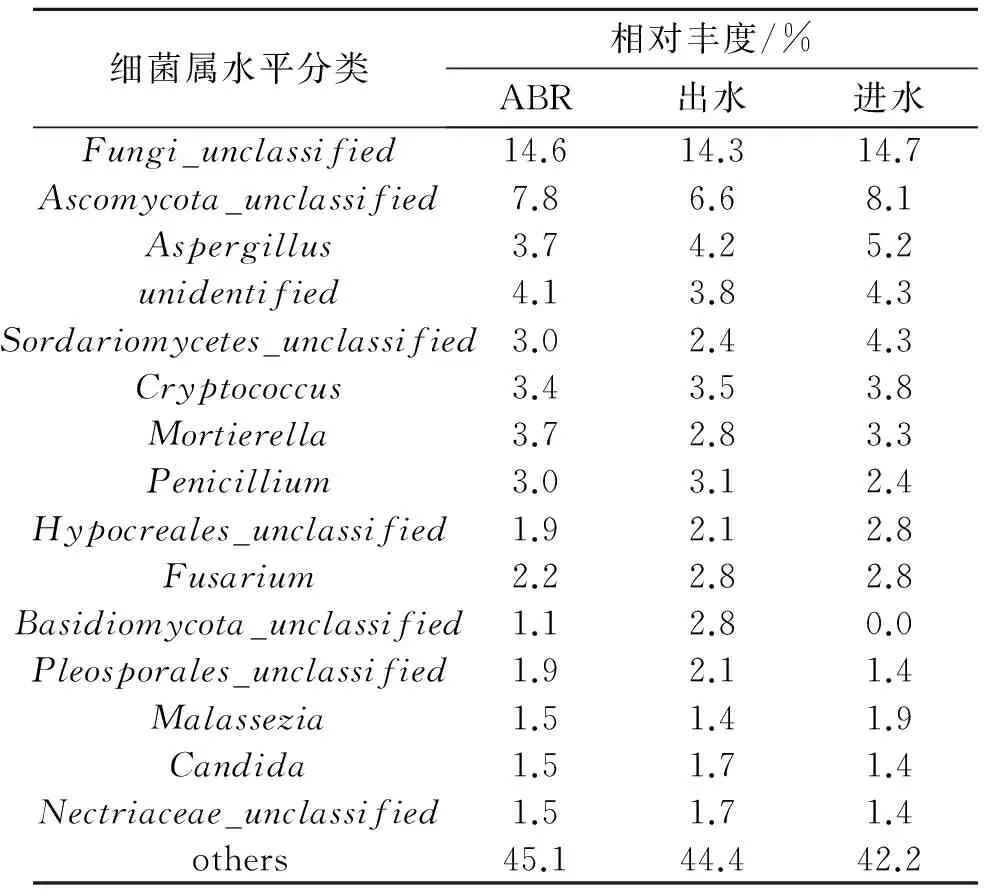
表6 真菌在属水平上的群落结构
3 结语
(1)基于进水和出水水质指标比较,发现COD,BOD5,TOC,TN等指标均有所降低,表明ABR厌氧处理系统对于采油废水的生化处理具有很好的效果和稳定性。
(2)通过对ABR池内活性污泥的细菌和真菌的高通量测序,结果表明,ABR池内细菌主要来自于四个门类,分别是变形菌门、厚壁菌门、拟杆菌门和热袍菌门。这些菌大部分为石油烃协同降解细菌,因此ABR池内所发生的生化反应是产甲烷菌所介导的协同底物降解过程。其次还含有少量的硫酸盐还原菌,导致硫化氢的产生。
(3)ABR池内真菌主要来自Ascomycota,Basidiomycota和Zygomycota门,在采油环境中均有发现。下一步研究希望通过了解ABR不同格室微生物的种群变化,得知ABR池内的微生物功能分区。
[1]张华,张学洪,王敦球,等. ABR+SBR工艺处理高盐采油废水工程[J]. 水处理技术,2008,34(2):89-91.
[2]李艳红,解庆林,游少鸿,等. 高温高盐采油废水的生物处理[J]. 桂林工学院学报,2006,26(2):234-238.
[3]刘然,彭剑峰,宋永会,等. 厌氧折流板反应器(ABR)中微生物种群演替特征[J]. 环境科学研究,2010,23(6):741-747.
[4]鲍立新,李建政,昌盛,等. ABR处理大豆蛋白废水的效能及微生物群落动态分析[J]. 环境科学,2008,29(8):2206-2213.
[6]朱卫东. 应用MultiN/C3000型总有机碳/总氮分析仪测定水中的总氮[J]. 北方环境,2012,27(5):212-213.
[7]F M 奥斯伯. 精编分子生物学实验指南[M]. 北京: 科学出版社,2001.
[8]常秦. 宏基因组数据分析中的统计方法研究[D]. 济南:山东大学,2012.
[9]许晴,张放,许中旗,等. Simpson指数和Shannon-Wiener 指数若干特征的分析及“稀释效应”[J]. 草业科学,2011,28(4):527-531.
[10]许光素,崔志松,郑立,等. 高分子量多环芳烃降解过程中菌种间的相互作用[J]. 应用与环境生物学报,2013,19(4):677-682.
[11]方圆,贺艳妮,杜耀,等. 反硝化脱硫菌的代谢特征及其环境应用研究进展[J]. 环境污染与防治,2015,37(4):84-88.
[12]于丽波,姜丽晶,汤熙翔. 海岸带沉积物环境中甲烷代谢菌的富集培养及混合菌群分析[J]. 台湾海峡,2011,30(3):386-393.
[13]穆剑,匡丽,高迎新,等. 采油废水厌氧处理系统的微生物群落特征[J]. 环境工程学报,2014,8(3):807-814.
[14]WANG Z L, SHU F C, YU G M, et al. The indigenous microbial diversity and enhancement of oil recovery in Qigequan Oilfield of Qinghai[C]// Intelligent Information Technology Application Association. Proceedings of 2011 AASRI Conference on Environmental Management and Engineering(AASRI-EME 2011 V1). Wuhan:American Applied Sciences Research Institute, 2011: 98-101.
[15]刘超奇. 油田硫酸盐还原菌的分离鉴定[D]. 湖北荆州:长江大学,2013.
[16]聂兴利,李会先,郭振英. 硫酸盐还原菌在废水处理中的应用进展[J]. 河北农业科学,2009,13(5):62-64.
[17]STAROSVETSKY D, STAROSVETSKY J, ARMON R, et al. A peculiar cathodic process during iron and steel corrosion in sulfate reducing bacteria (SRB) media[J]. Corrosion Science, 2010,52(4):1536-1540.
[18]DAHLE H, BIRKELAND N. Thermovirga lienii gen. nov., sp nov., a novel moderately thermophilic, anaerobic, amino-acid-degrading bacterium isolated from a North Sea oil well[J]. International Journal of Systematic and Evolutionary Microbiology, 2006,56:1539-1545.
[19]DAHLE H, GARSHOL F, MADSEN M, et al. Microbial community structure analysis of produced water from a high-temperature North Sea oil-field[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2008,93(1):37-49.
[20]贺伟,罗一菁,张忠智,等. 嗜热菌在废水处理中的应用及研究进展[J]. 化学与生物工程,2007,24(5):9-12.
[21]黎霞,承磊,汪卫东,等. 一株油藏嗜热厌氧杆菌的分离、鉴定及代谢产物特征[J]. 微生物学报,2008,48(8):995-1000.
[22]刘兰. 云南腾冲及西藏曲才地热区可培养高温厌氧细菌多样性研究[D]. 昆明:云南大学,2015.
[23]王帅,刘利,解庆林,等. 广西涠洲终端采油废水活性污泥中真菌种群的分析[J]. 北京农业,2014,34(9):238-240.
[24]JIANG S Y, WANG W X, XUE X X,et al. Fungal diversity in major oil-shale mines in China[J]. Fresenius Environmental Bulletin, 2015,24(10):1-9.
[25]LYONS J I, NEWELL S Y, BUCHAN A,et al.Diversity of ascomycete laccase gene sequences in a southeastern US salt marsh[J]. Microbial Ecology, 2003,45(3):270-281.
[26]JOHNSEN K, JACOBSEN C S, TORSVIK V, et al.Pesticide effects on bacterial diversity in agricultural soils-areview[J]. Biology and Fertility of Soils, 2001,33(6):443-453.
[27]CONTESINI F J, LOPES D B, MACEDO G A, et al. Aspergillus sp. lipase: Potential biocatalyst for industrial use[J]. Journal of Molecular Catalysis B: Enzymatic, 2010,67(3):163-171.
[28]贾洪柏,曲丽娜,王秋玉. 降解石油丝状真菌的筛选及其降解特性[J]. 环境科学研究,2013,26(6):678-683.
[29]张杰,张晓东,许海朋,等. Cryptococcus curvatus O3酵母菌培养及产油脂特性[J]. 微生物学通报,2009,36(1):41-45.
Characteristics of Microbial Community in Anaerobic ABR System for Treating Oil-field Wastewater
LIU Yuhui1LIU Li2WANG Shuai1ZHANG Chunfang3TAN Zihang1XIE Qinglin2
(1.CollegeofEnvironmentalScienceandEngineering,GuilinUniversityofTechnologyGuilin,Guangxi541006)
Characteristics of microbial community in an anaerobic ABR system for treating oil-field wastewater are analyzed, in which polymerase chain reaction and high-throughput sequencing methods are used. The results show that the bacteria community in the ABR system is mainly composed of methanogens, including proteobacteria, firmicutes, bacteroidetes and thermotogae. These bacteria are commonly found in methanogenic hydrocarbon degrading environment, suggesting that they can be involved in the degradation of oil-field wastewater. In addition, fungal community including Ascomycota, Basidiomycota, and Zygomycota is abundant in the ABR system and bacteria and fungal in ABR tank can efficiently degradate components of oil-field wastewater.
oil-field wastewateranaerobic baffled reactormicrobial communityhigh-throughput sequencing methods
国家自然科学基金(51168012),国家环境保护环境微生物利用与安全控制重点实验室开放基金资助课题(SMARC2013D009)。
刘宇辉,女, 1992年生,硕士,研究方向水污染控制技术。
2016-03-21)
