桃叶珊瑚苷通过ERβ途径抑制TNF-α诱导的心脏祖细胞凋亡
2016-08-29李春晓李慧影邱丽珍尤星宇
李春晓,李慧影,王 虹,陈 璐,邱丽珍,耿 潇,尤星宇
(天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验培育基地,天津市中药药理学重点实验室,方剂学教育部重点实验室,天津 300193)
桃叶珊瑚苷通过ERβ途径抑制TNF-α诱导的心脏祖细胞凋亡
李春晓,李慧影,王虹,陈璐,邱丽珍,耿潇,尤星宇
(天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验培育基地,天津市中药药理学重点实验室,方剂学教育部重点实验室,天津300193)
doi:10.3969/j.issn.1001-1978.2016.08.008
目的桃叶珊瑚苷(aucubin, AU)是杜仲、车前草、地黄等中草药的有效成分之一。现代药理学研究发现,AU对免疫、心脑血管、神经系统均有保护作用,但其作用机制尚不清楚。课题组前期研究证实AU可激活雌激素受体,提示AU可能通过雌激素信号通路发挥心血管保护作用。近年来越来越多的证据表明,心脏祖细胞(cardiac progenitor cells, CPCs)在心肌缺血组织损伤修复中发挥重要作用。方法为了进一步阐明AU的作用机制,该研究以小鼠CPCs为细胞模型,采用IncuCyte活细胞成像、TUNEL、Western blot、定量PCR等方法探讨了AU对肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)诱导的CPCs凋亡的影响及其作用机制。结果AU可以降低由TNF-α诱导的CPCs凋亡,降低caspase-3蛋白质表达,上调Bcl-2/Bax水平,雌激素受体β(estrogen receptor β,ERβ)抑制剂可阻断AU的抗凋亡作用,同时AU可使ERβ表达升高。结论AU可以抑制由TNF-α诱导的CPCs凋亡,其部分作用机制为ERβ通路的激活。
桃叶珊瑚苷;心脏祖细胞;雌激素受体β;肿瘤坏死因子-α;细胞凋亡;组织损伤修复
缺血性心脏病具有高发病率、高致死率等特点[1],尽管现有的治疗手段如血管成形术、支架及溶栓药物治疗可减轻导致缺血的原因[2],改善供血,但不能修复坏死的心肌。近年来研究表明,心脏干/祖细胞(cardiac stem cells/cardiac progenitor cells, CSCs/CPCs)是心脏自身的多能干细胞,具备特异性心肌分化的潜能,可分化为心肌细胞、内皮细胞及血管平滑肌细胞等多种心脏细胞系[3]。2011年和2012年,Bolli等[4]和Makkar等[5]分别完成一项心脏干细胞治疗缺血性心脏病的I期临床试验:SCIPIO和CADUCEUS试验。试验显示干细胞治疗组左室射血分数明显提高,梗死瘢痕明显减少,局部心脏收缩功能改善,局部收缩期室壁增厚,活力心脏面积增加。试验结果证明移植心脏干细胞治疗缺血性心脏病的安全性,同时表明基于心脏干细胞的再生疗法可能逆转心脏病发作引起的损伤。尽管心脏祖细胞治疗有一定疗效,但也有报道显示[6],心脏干细胞仅能在短期内改善心功能,心肌梗死时,梗死区域缺血缺氧、炎症细胞入侵、诱导移植细胞凋亡,移植后仅1%~10%的细胞存活下来,这极大程度限制了细胞治疗的效果。因此,减少心脏干/祖细胞凋亡,促进其存活至关重要。
桃叶珊瑚苷(aucubin,AU)又称珊瑚木苷,其化学名为β-D-吡喃葡萄糖苷,属环烯醚萜苷类,是杜仲、车前草、地黄等中草药的有效成分之一。现代药理学研究发现,AU具有护肝、抗氧化、抗炎、促干细胞再生等多种药理作用[7-8],对免疫、心脑血管、神经系统均有保护作用,但其对CPCs的作用机制尚不清楚。本实验用TNF-α诱导的细胞凋亡,探讨AU对CPCs凋亡的影响及其机制,为AU防治缺血性心脏病提供新的实验依据。
1 材料与方法
1.1材料
1.1.1细胞小鼠CPCs,由美国西北大学覃刚健教授惠赠。
1.1.2药物与试剂AU购于中新药业;雌二醇(E2)、L-谷氨酰胺、β-巯基乙醇、二甲基亚砜(DMSO)、SDS购于Sigma公司;MPP dihydrochloride、(R,R)-THC购于Tocris公司;mTNF-α购于R&D公司;DMEM/F12购于Hyclone公司;MEM nonessential amino acids、Basic fibroblast growth factor购于Gibco公司;胎牛血清FBS、青链霉素、0.25%胰蛋白酶购于Biological Industries公司;cDNA合成试剂盒(TaqMan®Reverse Transcription Rengents)、RT-PCR试剂盒(SYBR®Select Master Mix)购于Applied Biosystems公司;全蛋白提取试剂盒购于生工公司;In Situ Cell Death Detection Kit,TMR red购于Roche公司;β-actin、Bax、Bcl-2、caspase-3等抗体均购于Cell Signaling Technology公司;CD117抗体购于Miltenyi Biotec公司;CD45、CD31、Flk-1、Ly-6A/E等抗体均购于BD Biosciences公司;CD34抗体购于eBiosciences公司。
1.2方法
1.2.1细胞培养细胞培养所用培养基为CCM完全培养液,基础培养基为DMEM/F12,加入体积分数为10%的FBS(或体积分数为1%的FBS)、2 mmol·L-1L-Glutamine、10 mmol·L-1β-mercaptoethanol、体积分数为1%的MEM nonessential amino acids、5 pg·L-1Basic fibroblast grow factor、体积分数为1%的青链霉素混匀,4℃存放。细胞融合至80%~90%时进行传代。
1.2.2流式细胞术细胞长势良好时,用胰酶进行消化,经计数后取1×106cells/tube进行鉴定,避光加入相应抗体CD117、Sca-1、Flk、CD34、CD45、CD34或iostype各1 test,冰上避光孵育30 min,用4 mL PBS去除未结合抗体后离心,去除上清,加入500 μL PBS重悬上机检测。
1.2.3IncuCyte活细胞成像系统正常培养细胞融合至80%时,以4×103个细胞每孔接种于96孔板中,分为对照组(0.1% DMSO,1% FBS)、正常组(0.1% DMSO)、阳性药组(TNF-α 25 pg·L-1, 10 nmol·L-1E2, 1% FBS)、模型组(TNF-α 25 pg·L-1, 0.1% DMSO, 1% FBS)、给药组(TNF-α 25 pg·L-1, 10 μmol·L-1AU, 1% FBS)、ERα拮抗组(TNF-α 25 pg·L-1, 10 μmol·L-1AU, 100 nmol·L-1MPP,1% FBS)、ERβ拮抗组[TNF-α 25 pg·L-1, 10 μmol·L-1AU, 100 nmol·L-1(R,R)-THC, 1% FBS],共7组,每组6个复孔。培养24 h待细胞贴壁生长良好后,用无血清完全培基血清饥饿24 h,此时按分组加入培养基放入IncuCyte中设置程序,每隔2 h进行拍照统计。用Confluence值作为结果,统计每孔数据进行分析。
1.2.4Western blot正常培养细胞融合至80%时,以3×105个细胞每孔接种于6孔板中,分为对照组(0.1% DMSO, 1% FBS)、模型组(TNF-α 25 pg·L-1, 0.1% DMSO, 1% FBS)、给药组(TNF-α 25 pg·L-1, 10 μmol·L-1AU, 1% FBS),共3组,每组3个复孔。培养24 h待细胞贴壁生长良好后,按分组加入培养基,培养48 h后提取总蛋白。用BCA法进行蛋白浓度测定,取等量蛋白进行SDS-PAGE,半干法转膜,与相应一抗二抗结合反应后,用化学发光法检测抗原抗体结合区带。用凝胶成像分析仪进行电泳条带的拍照与分析。实验中以β-actin为内参,分别检测了Bax、Bcl-2、caspase-3。
2 结果
2.1CPCs的鉴定通过标记CD117、Sca-1、Flk、CD34、CD45、CD34进行流式检测,其中Sca-1的阳性率为98%,其余抗体均显示阴性,最高阳性率为18.8%,提示实验中所使用的细胞为Sca-1+的心脏祖细胞[9](Fig 1)。
2.2AU对CPCs增殖的影响基于以上鉴定结果,首先研究AU对CPCs增殖能力的影响。对照组为1% FBS的完全培养基,给药组加药浓度为10 μmol·L-1,为1% FBS的完全培养基。其中正常组用10% FBS的完全培养基,作为细胞正常增殖的参照,便于对药效进行评估。以细胞密度作为参考指标,24 h后,将3组细胞进行比较发现,3组细胞均能贴壁正常生长,其中对照组细胞密度低于正常组和加药组,且加药组细胞密度低于正常组。从Fig 2中可以看出,AU具有一定的促增殖作用,但作用并不明显(Fig 2)。

Fig 1Identification of CPCs
The CPCs were incubated with CD117, Sca-1, Flk, CD34, CD45 and CD34 antibody respectively.The positive cell rate was analyzed by flow cytometry.

Fig 2 Effect of aucubin on proliferation in ±s,n=3)
CPCs were incubated with 10 μmol·L-1aucubin. The proliferation was analyzed by IncuCyte. Values from three independent experiments.*P<0.05vsDMSO treated cells alone when CPCs were incubated with 10 μmol·L-1aucubin for 24 h.
2.3AU对TNF-α诱导凋亡的影响以上研究发现,AU对细胞增殖的影响并不明显,接下来我们进一步研究其抗凋亡作用。实验中加入TNF-α诱导凋亡,观察其细胞形态。实验以E2作为阳性对照,给药组中加入MPP作为ERα拮抗组,给药组中加入(R,R)-THC作为ERβ拮抗组。
观察细胞形态发现,对照组细胞形态良好,正常组细胞密度较大,形态正常,模型组细胞明显发生形态改变,大部分细胞变圆,体积缩小,呈明显的凋亡特征(P<0.05)。阳性药组可以看出凋亡细胞明显减少(P<0.05),并能进行正常的增殖。给药组细胞状态与阳性药组相当,凋亡细胞明显减少(P<0.05)。MPP为ERα的拮抗剂,(R,R)-THC为ERβ的拮抗剂。ERα拮抗组中给药组的保护作用并未消失,凋亡细胞减少,但ERβ拮抗组中细胞凋亡明显增加(P<0.05),与给药组相比差异具有显著性(Fig 3)。由此可以推断,AU可以抑制TNF-α诱导的凋亡,可能是通过ERβ途径发挥作用。
2.4TUNEL染色进一步证明AU对TNF-α诱导凋亡的影响为了进一步验证AU的抗凋亡作用,本研究利用TUNEL染色更准确地反映细胞凋亡的特征,经TUNEL染色后凋亡细胞显现红色荧光。从Fig 4A中可以看出,对照组基本无荧光信号,模型组中加入TNF-α诱导凋亡后,可以明显看到细胞形态发生皱缩,且红色荧光信号明显变强(P<0.01)。阳性药组中凋亡细胞明显减少(P<0.01),给药组细胞状态与阳性对照组相当,与模型组相比凋亡细胞明显减少(P<0.01)。ERα拮抗组中给药组的保护作用并未消失,凋亡细胞减少,但ERβ拮抗组中细胞凋亡明显增加,明显抑制了AU的保护作用(P<0.01)。由此可以进一步判断,AU可以抑制TNF-α诱导的细胞凋亡,且极有可能是通过ERβ途径发挥作用(Fig 4)。
2.5Western blot检测AU对凋亡相关蛋白的影响确定AU的抗凋亡作用后,本研究对其抗凋亡的机制进行了进一步的探讨,验证了细胞凋亡相关蛋白质水平的变化。结果显示,加入TNF-α诱导凋亡后,细胞中活化的caspase-3蛋白质水平明显上调(P<0.01),Bcl-2/Bax水平明显下调(P<0.01),10 μmol·L-1的AU加药48 h后可以明显降低由TNF-α诱导凋亡引起的caspase-3蛋白质水平的上调(P<0.01)和Bcl-2/Bax水平的下调(P<0.01),差异具有统计学意义,证明AU确实可以在一定程度上抑制细胞凋亡的发生(Fig 5)。


CPCs were incubated with TNF-α(25 pg·L-1) for 69 h in the absence or presence of aucubin(10 μmol·L-1), E2(10 nmol·L-1), MPP(100 nmol·L-1), (R,R)-THC(100 nmol·L-1). A: Images of CPCs at 69 h; B: The apoptosis of CPCs was analyzed by IncuCyte. Values from six independent experiments.*P<0.05 compared with DMSO treated cells alone;#P<0.05 compared with TNF-α (25 pg·L-1) treated cells alone;△P<0.05 compared with TNF-α (25 pg·L-1) and 10 μmol·L-1aucubin treated cells.

Fig 4 Effect of aucubin on TNF-α induced apoptosis in CPCs by ±s,n=6)
CPCs were incubated with TNF-α(25 pg·L-1) for 69 h in the absence or presence of aucubin(10 μmol·L-1), E2(10 nmol·L-1), MPP(100 nmol·L-1), (R,R)-THC(100 nmol·L-1). A: Images of CPCs labeled by TUNEL technology at 69 h; B:Analyzed by IncuCyte. Values from six independent experiments.**P<0.01 compared with DMSO treated cells alone;##P<0.01 compared with TNF-α (25 pg·L-1) treated cells;△△P<0.01 compared with TNF-α (25 pg·L-1) and 10 μmol·L-1aucubin treated cells.
2.6实时定量PCR检测AU对ERα和ERβ表达的影响在上述结果中,初步判定了AU的抗凋亡作用可能是通过ERβ途径发挥作用的,为了进一步对雌激素通路进行验证,本研究对ERα和ERβ的mRNA水平进行了检测。AU对CPCs细胞ERα和ERβ mRNA水平的影响结果见Fig 6。结果显示,加药8 h后,ERα的基因表达水平有所下调,而ERβ的基因表达水平明显上调(P<0.05),差异具有统计学意义,证明AU在发挥抗凋亡作用的同时,激活了ERβ受体,进一步验证了AU的保护作用很可能是通过ERβ相关通路发生的。
3 讨论
随着社会经济发展,高速的生活节奏及不健康的生活方式导致心肌梗死等心血管疾病成为人类死亡的主要原因之一[10]。现代药理学研究发现,在成年个体心脏内存在原始的心脏祖细胞,可以分化为心肌细胞、平滑肌细胞、内皮细胞,直接参与心肌的损伤修复[11-12]。2003年美国FDA就已批准自体骨髓干祖细胞移植治疗心梗性疾病,国内也针对干祖细胞治疗做了大量研究,但是,干祖细胞移植作为诱导心肌再生修复的手段之一,还存在许多不足之处,梗死区域的特殊生理环境,使得移植后仅1%~10%的细胞存活,极大程度限制了祖细胞移植的治疗效果。因此,如何促进祖细胞增殖及抑制祖细胞凋亡也成为了重要的研究方向,在临床上具有重大的研究意义。
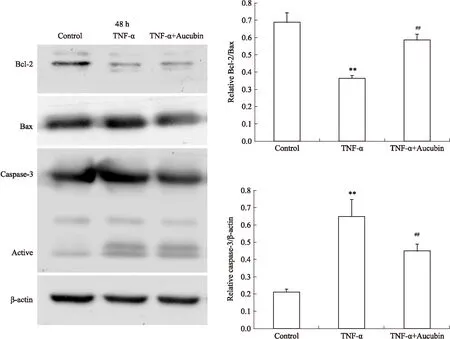

CPCs were pre-incubated with TNF-α(25 pg·L-1) and 10 μmol·L-1aucubin for 48 h. The apoptosis protein expression was analyzed by Western blot. Values from three independent experiments.**P<0.01 compared with DMSO treated cells alone;##P<0.01 compared with TNF-α(25 pg·L-1) treated cells alone.

Fig 6 Effect of aucubin on ERα gene

The genes expression was analyzed by quantitative real time PCR(qRT-PCR). Values from three independent experiments. A: Effect of aucubin on ERα gene expression in CPCs; B: Effect of aucubin on ERβ gene expression in CPCs.*P<0.05 compared with DMSO treated cells alone.
细胞凋亡与多种因素相关,机制较为复杂,其中TNF-α是一种常见的诱导细胞凋亡的因子,是一种由单核巨噬细胞释放的细胞因子,它通过与膜受体TNFR I或TNFR II结合从而发挥生物学作用。先前已有研究证明TNF-α可诱导心肌细胞凋亡,损伤血管内皮细胞,促进动脉粥样硬化的发生发展等[13-14]。我们的实验结果表明,AU可以明显抑制由TNF-α诱导的CPCs凋亡。并且通过对Incucyte结果进行分析可以发现,AU在该浓度下对细胞无毒性,但其并不能明显促进CPCs增殖,进一步证明AU的保护作用是通过抑制细胞凋亡,促进细胞的存活率实现的。上述结果通过TUNEL进一步进行验证,可以进一步证明TNF-α诱导细胞凋亡的作用以及AU抗凋亡的作用。确定AU的抗凋亡作用后,本研究对其抗凋亡的机制进行了进一步的探讨。caspase-3是细胞凋亡过程中最主要的终末剪切酶。Bcl-2可以阻止细胞色素C从线粒体释放到细胞质,从而抑制了细胞凋亡。Bax是与Bcl-2同源的水溶性相关蛋白,是Bcl-2基因家族中的促进细胞凋亡基因,Bax的过度表达可拮抗Bcl-2的保护效应,使细胞趋于死亡[15]。比较Western blot结果,活化的caspase-3蛋白质水平有明显上调,Bcl-2/Bax水平有明显下调,均证明AU可以抑制由TNF-α诱导的细胞凋亡。
本课题组前期研究发现AU可激活雌激素受体[16],具有植物雌激素样作用。为了进一步探讨其抗凋亡作用是否与雌激素受体相关,实验中加入了MPP作为ERα的拮抗剂,(R,R)-THC作为ERβ的拮抗剂。MPP即甲基哌啶吡唑,是ERα选择性拮抗剂,其与ERα的亲和力是ERβ的200倍。(R,R)-THC即四氢大麻酚,是ERβ的选择性拮抗剂,其与ERβ的亲和力是ERα的7倍[17]。由结果可以看出,加入MPP后,其抗凋亡作用并无明显变化,而加入(R,R)-THC后,抗凋亡作用消失。表明AU可通过干预ERβ途径发挥抗凋亡作用。同时,AU使ERβ mRNA表达明显上调,ERα表达有下调趋势。Koehler等[18]发现,ERβ能够以一种浓度依赖的方式抑制ERα作用,可能与本研究结果的机制相同,但还有待进一步验证。
综上所述,桃叶珊瑚苷可以抑制TNF-α诱导的心脏干/祖细胞凋亡,雌激素受体相关信号通路参与其中,并且相比于ERα,ERβ发挥了更加明显的作用。本研究为桃叶珊瑚苷干预心脏干/祖细胞治疗缺血性心脏病的临床应用提供了实验依据。
[1]Zhou M,Wang H,Zhu J,et al.Cause-specific mortality for 240 causes in China during 1990-2013: a systematic subnational analysis for the Global Burden of Disease Study 2013[J].Lancet,2016,387(10015):251-72.
[2]何晓全,刘梅林.中国冠心病防治策略[J]. 中国全科医学,2015, 18(2):239-40.
[2]He X Q,Liu M L.Prevention and control strategy of coronary heart disease in China[J].ChinGenPract,2015,18(2):239-40.
[3]Beltrami A P,Barlucchi L,Torella D,et al.Adult cardiac stem cells are multipotent and support myocardial regeneration[J].Cell,2003,114(6):763-76.
[4]Bolli R,Chugh A R,D′Amario D,et al.Cardiac stem cells in patients with ischaemic cardiomyopathy (SCIPIO): initial results of a randomised phase 1 trial[J].Lancet,2011,378(9806):1847-57.
[5]Makkar R R,Smith R R,Cheng K,et al.Intracoronary cardiosphere-derived cells for heart regeneration after myocardial infarction(CADUCEUS): a prospective, randomised phase 1 trial[J].Lancet,2012, 379(9819):895-904.
[6]Hodgkinson C P,Bareja A,Gomez J A,et al.Emerging concepts in paracrine mechanisms in regenerative cardiovascular medicine and biology[J].CircRes,2016,118(1):95-107.
[7]Chang I M. Liver-protective activities of aucubin derived from traditional oriental medicine[J].ResCommunMolPatholPharmacol,1998,102(2):189-204.
[8]Park K S, Chang I M. Anti-inflammatory activity of aucubin by inhibition of tumor necrosis factor-alpha production in RAW 264.7 cells[J].PlantaMed,2004,70(8):778-9.
[9]Oh H,Bradfute S B,Gallardo T D,et al.Cardiac progenitor cells from adult myocardium: homing, differentiation, and fusion after infarction[J].ProcNatlAcadSciUSA,2003,100(21):12313-8.
[10]米粟,胡卓伟.抑制心肌纤维化促进心肌再生治疗慢性心血管疾病[J]. 生理科学进展,2010,41(5):352-8.
[10]Mi S,Hu Z W.Suppressing myocardial fibrosis to promote myocardial regeneration as a therapeutic strategy for chronic cardiovascular disease[J].ProgPhysiolSci,2010,41(5):352-8.
[11]Ellison G M,Vicinanza C,Smith A J,et al.Adult c-kit(pos) cardiac stem cells are necessary and sufficient for functional cardiac regeneration and repair[J].Cell,2013,154(4):827-42.
[12]Messina E,De Angelis L,Frati G,et al.Isolation and expansion of adult cardiac stem cells from human and murine heart[J].CircRes,2004, 95(9):911-21.
[13]Ceradini D J,Kulkarni A R,Callaghan M J,et al.Progenitor cell trafficking is regulated by hypoxic gradients through HIF-1 induction of SDF-1[J].NatMed,2004, 10(8): 858-64.
[14]朱新红,高美华,于新娟,等. CD59转染细胞Caspase-3和Bcl-2基因的表达[J]. 青岛大学医学院学报, 2009, 45(1): 9-10.
[14]Zhu X H,Gao M H,Yu X J,et al.ExpressionsI of Caspase-3 and Bcl-2 on CD59 transfected cells[J].ActaAcadMedQingdaoUniv,2009,45(1):9-10.
[15]张亚云,林超,孙鑫,等.雌激素介导的 HSP27 在动脉粥样硬化中作用的研究进展[J]. 中国药理学通报,2016,32(2):159-62.
[15]Zhang Y Y,Lin C,Sun X,et al.Research progress of estrogen-mediated HSP27 in atherosclerosis[J].ChinPharmacolBull,2016,32(2):159-62.
[16]Wang H,Li M C,Yang J,et al.Estrogenic properties of six compounds derived from Eucommia ulmoides Oliv. and their differing biological activity through estrogen receptors α and β[J].FoodChem,2011,129(2):408-16.
[17]Shiau A K, Barstad D, Radek J T,et al.Structural characterization of a subtype-selective ligand reveals a novel mode of estrogen receptor antagonism[J].NatStructBiol,2002,9(5): 359-64.
[18]Koehler K F,Helguero L A,Haldosén L A,et al. Reflections on the discovery and significance of estrogen receptor beta[J].EndocrRev,2005,26(3):465-78.
Aucubin inhibited apoptosis of mouse cardiac progenitor cells induced by TNF-α through ERβ pathway
LI Chun-xiao,LI Hui-ying,WANG Hong,CHEN Lu,QIU Li-zhen,GENG Xiao,YOU Xing-yu
(TianjinUniversityofTraditionalChineseMedicine,TianjinStateKeyLaboratoryofModernChineseMedicine,KeyLaboratoryofPharmacologyofTraditionalChineseMedicalFormulae,MinistryofEducation,TianjinUniversityofTraditionalChineseMedicine,TianjinKeyLaboratoryofTraditionalChineseMedicinePharmacology,InstituteofTraditionalChineseMedicine,TianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China)
AimAucubin(AU) is one of the effective ingredients of eucommia, plantain, rehmannia and other herbs.Modern pharmacological studies have shown that AU has protective effects on immunity, cardiovascular and nervous system, but its mechanism is unclear. Previous studies have confirmed that AU can activate estrogen receptor, suggesting that AU may play a role in cardiovascular protection through estrogen signaling pathway. In recent years, more and more evidence showed that cardiac progenitor cells(CPCs) play an important role in the repair of myocardial ischemic injury. MethodsTo further elucidate the mechanism, our study used mouse CPCs as cell model and elucidated the effect of AU on CPCs apoptosis induced by tumor necrosis factor alpha (TNF-α) and its mechanism by IncuCyte live cell imaging, TUNEL staining, Western blot and quantitative PCR. ResultsAU could reduce TNF-α-induced apoptosis of CPCs, decrease the expression of caspase-3 and up-regulate Bcl-2/Bax levels. Estrogen receptor beta(ERβ) antagonist could block the anti-apoptotic effect of AU, and AU treatment was able to increase the expression of ERβ. ConclusionAU could inhibit the apoptosis of CPCs induced by TNF-α, and its mechanism is the activation of ERβ pathway.
aucubin; cardiac progenitor cells; estrogen receptor β; tumor necrosis factor-α; cell apoptosis;tissue injury repair
2016-04-07,
2016-05-10
新世纪优秀人才支持计划(No NCET-13-0935);国家自然科学基金资助项目(No 81173592);国家国际科技合作专项(No 2015DFA30430);长江学者和创新团队发展计划资助项目(No IRT1276)
李春晓(1992-),女,硕士,研究方向:中药心血管药理学,E-mail:1256665378@qq.com;
王虹(1974-),女,博士,研究员,研究方向:中药心血管药理学,通讯作者,E-mail:wanghongsys@126.com
A
1001-1978(2016)08-1068-07
R-332;R284.1;R322.11;R329.24;R329.25;R392.11;R542.2
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.016.html