核酸氧化损伤修复酶MTH1及其抑制剂的研究进展
2016-08-29康从民王晓丽
康从民,王晓丽
(青岛科技大学化工学院,山东 青岛 266042)
核酸氧化损伤修复酶MTH1及其抑制剂的研究进展
康从民,王晓丽
(青岛科技大学化工学院,山东 青岛266042)
doi:10.3969/j.issn.1001-1978.2016.08.003
MTH1酶属于Nudix水解酶,具有清理细胞核苷酸池内氧化嘌呤核苷酸,防止核酸氧化损伤的功能。多项研究表明MTH1酶在神经退行性疾病、抗衰老等,尤其是抗肿瘤方面发挥关键作用,有望成为抗肿瘤药物的新靶标。近年国内外有关MTH1酶抑制剂的研究也逐渐增多,该文概述了MTH1酶的转录和翻译、结构特点、催化机制、应用等各方面信息,特别是对其各类抑制剂的研究现状进行了较为全面的综述。
MTH1酶;嘌呤核苷酸氧化损伤;抗肿瘤靶标;MTH1酶抑制剂;Nudix水解酶;NUDT1
MTH1酶即MutT同源酶1(MutT homolog 1),属于Nudix(nucleoside diphosphate linked to x)水解酶超级家族,是由NUDT1基因表达所得的8-羟基鸟嘌呤核苷酸酶,其国际生物化学联合会酶学委员会编号为EC 3.6.1.55。该酶可将细胞核苷酸池中的氧化嘌呤核苷酸,如8-氧化鸟嘌呤核苷酸(8-oxo-GTP)、2-羟基腺嘌呤脱氧核苷酸(2-OH-dATP)等水解为核苷单磷酸酯和无机焦磷酸盐,阻止氧化嘌呤核苷酸错误的编入DNA或RNA中,从而大大减少由于氧化应激造成的核酸损伤和突变,在维护遗传物质稳定性以及核酸损伤修复机制中起着重要作用[1]。多年研究表明MTH1酶的活性与神经退行性疾病、抗衰老等密切相关,近年Gad等发现该酶在肿瘤的生长、存活、转移过程中发挥重要作用,有望成为新的抗肿瘤靶标。自其抗肿瘤特性发现以来,有关MTH1酶各类抑制剂的研究在国内外也逐渐展开。研究和了解MTH1酶的基因、结构、作用机制、应用研究,特别是其抑制剂的进展等相关知识对于多种疾病特别是肿瘤的治疗具有重要意义。
1 嘌呤核苷酸氧化损伤及其水解酶MTH1
1.1嘌呤核苷酸氧化损伤机体在遭受各种有害刺激时可能会引起体内活性氧自由基(reactive oxygen species,ROS)的积累,过量的ROS可以攻击如核酸、蛋白质、脂质等多种生物分子,形成各种氧化损伤[2]。在核酸的氧化损伤中,嘌呤核苷酸的氧化损伤较为普遍,该损伤可发生在DNA链或RNA链上,也可发生在细胞核苷酸池内。
研究发现,核苷酸池内以自由形式存在的嘌呤核苷酸更容易发生氧化,且氧化产物8-oxo-GTP、2-OH-dATP等是核酸合成过程中的强致突变底物,如在DNA复制过程中可引起G ∶C→T ∶A及A ∶T→C ∶G颠换。在哺乳动物细胞中,相当数量的自发性突变与此有关,因此清理核苷酸池内的氧化嘌呤核苷酸对于维护遗传物质的稳定性至关重要。机体内存在多种酶可以清理核苷酸池内的氧化嘌呤核苷酸,如MTH1(NUDT1)、MTH2(NUDT15)、MTH3(NUDT18)[3],这几种酶均为MutT酶的同源物,其中MTH1酶是最主要的核苷酸池清理酶,尤其对肿瘤细胞的发生和发展至关重要[4],而其他相关酶对于氧化嘌呤核苷酸的活性相对较低,本文主要讨论MTH1酶。
1.2NUDT1基因的转录与翻译NUDT1基因是最先在哺乳动物体内发现的与嘌呤核苷酸氧化修复相关,并研究最为广泛的序列,人源性NUDT1基因位于7p22号染色体上,全长约12 kb,共6个外显子,其中外显子1包括1a与1b两个片段,外显子2包括2a、2b、2c 3个片段。该基因的mRNA初级转录产物经过不同剪接方式可形成具有不同5′端序列的7种mRNA亚型,即1、2A、2B、3A、3B、4A和4B[5]。在这7种亚型的mRNA中,缺少外显子2片段的亚型1是其主要形式,其它6种亚型至少携带外显子2的一个片段,表达水平较低。
1、2A、3A、4A 4种亚型的mRNA可直接编码出156个氨基酸的MTH1d(p18),其相对分子质量为18 ku,而2B、3B、4B型mRNA则能够编译出MTH1a(p26)、MTH1b(p22)、MTH1c(p21)及MTH1d(p18)。这4种酶蛋白具有不同的N端,而其余156个氨基酸均相同。MTH1a(p26)的N端具有线粒体靶向作用,其他3种亚型的N端并未显示相关作用[6]。实验证明,这4种亚型酶水解8-oxo-dGTP与2-OH-dATP的能力相当。人体细胞中MTH1d含量最为丰富,是MTH1酶的主要存在形式,MTH1b和MTH1c的含量约为MTH1d含量的10%,MTH1a不仅含量很低且只存在少数人群中。在人体细胞中,核苷酸池主要存在于细胞质与线粒体中,相对应的MTH1酶也主要分布在线粒体和细胞质内,这种分布反映了功能上的需要。
1.3MTH1酶结构特征
1.3.1蛋白结构目前有关MTH1酶的结构研究主要针对MTH1d展开,其结构具有典型的Nudix模式[7],包括α螺旋、β折叠、L长环区等基本结构单元,蛋白链结构从N端到C端排列为:βA(氨基酸 5~11)、βB(17~22)、L1、αⅠ(44~58)、L2、βC(67~74)、βD(80~87)、L3、βE(102~107)、L4、αⅡ(120~130)、βF(132~139)、βG(146-153),其酶结构如Fig 1所示(PDB ID:3ZR1)。MTH1酶中,5个铰链组成了混合卷曲β折叠,在折叠凸面的残基共同形成一个连续的溶剂可及表面,而凹面部分由αⅡ、L4环区、L1环区占据,这就形成了蛋白的主体结构(Fig 1A)。αI螺旋和2个反向平衡β折叠铰链共同组成的裂叶在βA铰链位置贴近主体结构,在这个裂叶和蛋白主体间形成一个深且狭窄的口袋,这个口袋内壁组成包括αⅡ螺旋、L1环、混合折叠部分,研究表明该口袋正是MTH1酶底物结合口袋(Fig 1B)。
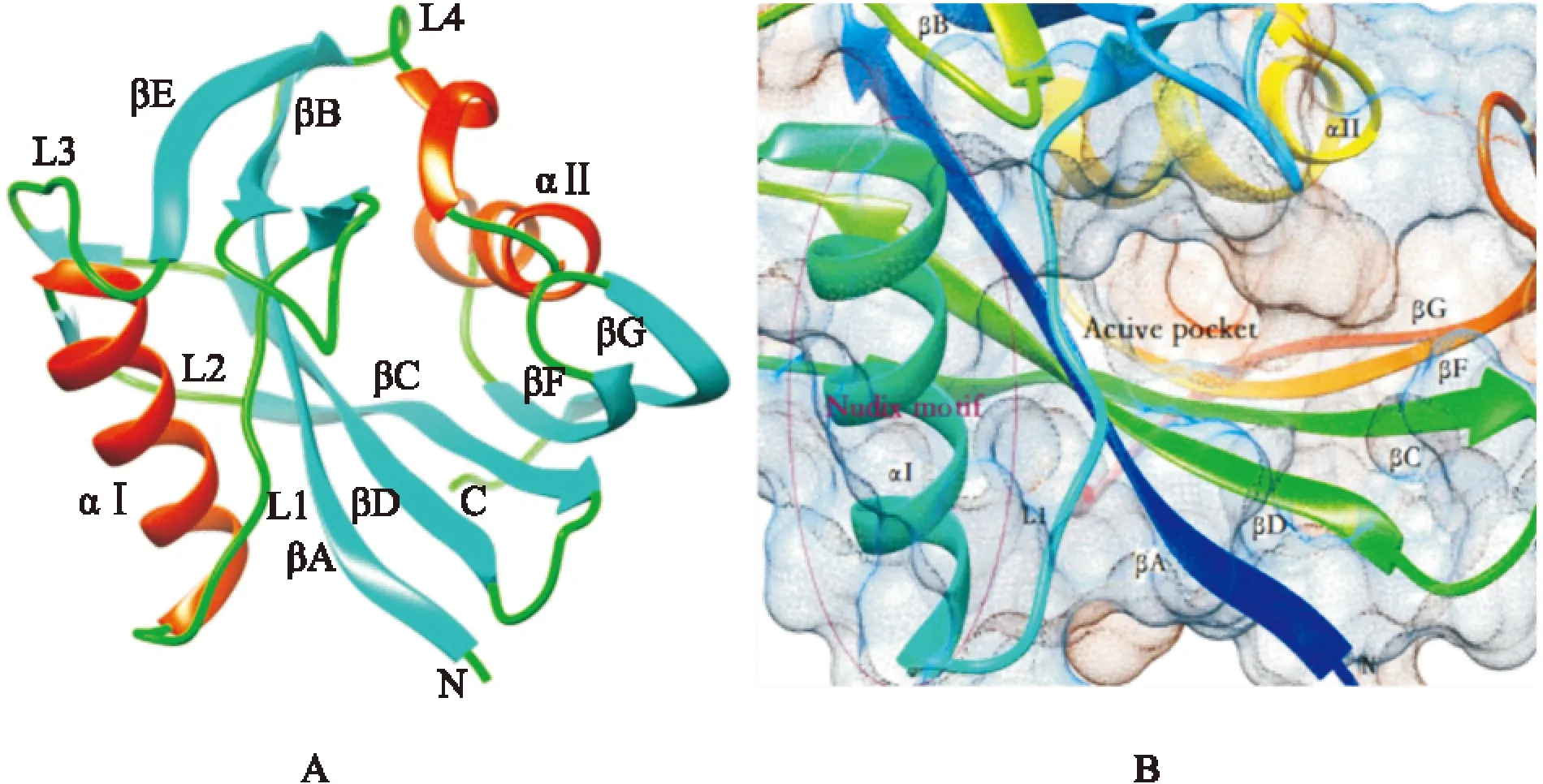
Fig 1 Structural features of MTH1[4]
A:Solution structure of MTH1;B:Active pocket and Nudix-motif of MTH1
1.3.2Nudix模段Nudix水解酶家族分布广泛,存在于多种生物体内,包括多种焦磷酸水解酶,底物多为含核苷二磷酸结构的分子,如核苷酸(d)NTPs、二核苷、核苷酸糖等,主要作用机制是水解磷酸基团之间的酯键。Nudix水解酶的典型折叠方式为α/β/α排列,不同的Nudix酶具有相同的Nudix特征模段,含23个氨基酸(GX5EX7REUXEEXGU,其中U代表大的疏水氨基酸),该模段具有结合金属离子和参与催化位点形成的作用。虽然Nudix水解酶都含有相同的Nudix模段,但不同酶之间具有底物特异性,这是因为Nudix水解酶的底物识别与选择序列的不同[8]。MTH1酶的Nudix模段位于37-59号氨基酸处,主要以α螺旋形式存在(Fig 1B)。
1.4活性中心及其催化机制酶的活性中心主要由两个功能部位组成,即决定酶专一性的结合部位和直接参加催化反应的催化部位。MTH1酶与其他Nudix酶相似,酶底物结合口袋参与底物的识别与固定,Nudix模段则参与酶活性所需Mg2+的结合及其催化磷酸酯键的水解[9]。
MTH1酶底物结合部位主要由Asn33、Asp119、Asp120及其Trp117、Phe27等关键氨基酸残基参与组成。其中如Asn33、Asp119、Asp120残基可与氧化嘌呤碱基关键位点上的氢键供体、氢键受体形成氢键,而残基Trp117与Phe27的芳香环可通过与氧化嘌呤环形成π-π堆积效应,使底物与酶能更稳定地结合[10]。MTH1酶催化部位主要由Nudix模段组成,该模段中有多个氨基酸残基在底物催化过程中不可或缺,如关键残基Glu52、Glu55、Glu56等可在α螺旋上形成一个酸性集群,与模段外Glu100及其相应溶剂水分子共同参与Mg2+的螯合。赖氨酸Lys23在酶与底物如8-oxo-dGTP相互作用中可与α磷酰基发生静电作用,在底物结合与催化水解中起到重要作用,这与同源酶MutT中Lys39的空间位置及其作用相似。此外,还有相应氨基酸如谷氨酸Gly37参与溶剂水分子的去质子化作用,诱导其进攻富电子的β位磷酰基,从而发生亲核取代反应[9]。
1.5MTH1酶活性检测将一定量的MTH1酶、无机焦磷酸酶、底物如8-oxo-dGTP,加入到由Tris-醋酸、NaCl、醋酸镁、Tween 20和二流苏糖醇DTT组成的酶反应缓冲液中。孵育后,加入孔雀石绿溶液终止反应,测定吸光度,计算MTH1酶的活性[11]。该方法的原理是,无机焦磷酸酶催化水解产物焦磷酸盐进一步转化为磷酸盐离子,通过孔雀石绿吸光度分析法,测得溶液中磷酸盐离子的含量,从而测定出酶的催化活性。
1.6MTH1酶的应用研究
1.6.1神经退行性疾病哺乳动物神经干细胞不断增殖,产生大量具有高度代谢活性的神经元,因此产生活性氧较多,神经元受到氧化应激发生氧化损伤的机率大大增加。此外,随着年龄的增长,体内抗氧化修复机制易产生缺陷,使得神经元中核酸氧化损伤累积,从而致使老年性神经退行性疾病的产生[12]。研究发现在帕金森病(PD)、阿尔茨海默病(AD)患者的神经元细胞质和线粒体中氧化核苷酸的蓄积明显增加,与此同时MTH1表达也相应增加。Leon等[13]对小鼠PD模型的研究表明,MTH1可以保护纹状体多巴胺神经元免受核苷酸氧化损伤,尤其是纹状体多巴胺神经元的末梢纤维线粒体DNA的氧化损伤。因此,研究MTH1酶对于寻找PD、AD等各种神经退行性疾病治疗新策略有重要的意义。
1.6.2抗肿瘤靶标特性肿瘤细胞无限增殖、快速分化的特性决定了其代谢速度快、生成活性氧多的特点,破坏了核苷酸池的动态平衡,极易造成DNA损伤和突变的发生,而MTH1酶的存在能够减轻肿瘤细胞快速增生的压力。Hanahan等[14]提出,肿瘤细胞存在许多DNA损伤修复机制的缺陷,基因组不稳定性增加,少数的正常DNA损伤修复机制则成为肿瘤细胞抵抗内/外源性DNA损伤刺激,赖以存活的关键。正常人体细胞中对于不同的DNA氧化损伤有多种修复方式,如碱基切除、核苷酸切除、错配修复等,这些方式相互补充,协同作用,决定了MTH1酶对于肿瘤细胞存活必需,而对正常细胞非必需的特性。
Gad等[11]通过对变异小鼠进行实验,证明了MTH1酶对清除肿瘤相关的dNTP池损伤可能更重要,而且为肿瘤细胞存活所必需。Helleday等[15]也通过使用小分子RNA干扰技术(siRNAs)证明MTH1酶是肿瘤细胞生存所必需的,同时也证明MTH1酶有望成为肿瘤治疗的重要靶标。
1.6.3其它多方面研究MTH1酶在其他方面也有广泛研究,如在流感发生和防御机制中,MTH1酶可通过消除病毒感染引起的细胞氧化应激而起作用[16];在防止细胞老化过程中,MTH1酶通过作用于线粒体DNA中氧化嘌呤核苷酸的修复,有效减缓了细胞的衰老[13];在防止肿瘤发生方面, MTH1酶的作用也很明显,有研究发现,当实验小鼠的MTH1基因被敲除后,DNA与RNA的突变率升高,发生肿瘤的概率会明显增大。此外,MTH1酶曾被阿斯利康制药公司作为Toll-like受体(TLR7)激动剂可能的效应器而进行深入研究,但由于一些关键实验数据的否定,该研究也被迫终止,近期由于MTH1酶的抗肿瘤特性的报道,该公司Kettle项目组又重新对MTH1酶进行了研究[17]。
2 MTH1酶抑制剂
基于MTH1酶抗肿瘤特性的提出,国内外有关其各类抑制剂的研究层出不穷。多项研究表明,肿瘤细胞内MTH1酶的生物活性及表达均高于正常体细胞,在降低肿瘤细胞高氧化应激水平,维持其快速增殖、转移等特性方面发挥重要作用。MTH1酶抑制剂的应用能够增加细胞毒性,加剧肿瘤细胞DNA结构的氧化损伤,从而致使细胞的老化、凋亡。尤其在对氧化应激较为敏感的肿瘤,如三阴乳腺癌的放化疗中,若应用MTH1酶抑制剂进行协同治疗[18],有望达到抑制肿瘤细胞生长繁殖的目的。
2.1吡唑喹啉类衍生物SCH51344SCH51344(结构见Fig 2A)是在RAS突变型肿瘤细胞的表型筛选中得到的选择性小分子抑制剂,可特异性阻断细胞膜边缘波动调节路径,对RAS突变的成纤维细胞进行生长抑制。Huber等[19]最先应用化学蛋白质组学方法鉴定出SCH51344的细胞内主要靶标为MTH1酶。实验数据也表明,在抗恶性细胞增生中MTH1酶是SCH51344的直接靶标。
2.2S-克唑替尼基于对底物与活性位点结构特征的分析,Huber等[19]提出激酶抑制剂靶向MTH1酶的可能性,在对一系列激酶抑制剂进行热转变稳定性分析筛选后,发现c-MET/ALK激酶的双重抑制剂克唑替尼(结构见Fig 2B)显示出高的MTH1酶亲和力,尤其S-型对映体显示出纳摩尔级的MTH1酶抑制活性。此外Huber等[18]应用化学蛋白质组学方法对一系列类S-克唑替尼的氨基杂芳基类化合物进行了MTH1酶抑制活性的测定,并构建了MTH1酶药效团模型[18]。
与该抑制剂有关的国内研究也很多,浙江大学李有勇等[20]应用动力学模拟手段,对克唑替尼的2种对映体与MTH1酶相互作用方式的差异,进行了详细研究。山东师范大学唐波研究组研发的结合MTH1酶探测与抑制为一体的控释系统,应用RT-PCR技术检测MTH1酶转录mRNA的分布与含量,诱导金纳米粒子耀斑封顶的介孔氧化硅纳米平台释放抑制剂S-克唑替尼,这种方法能有效减小身体毒性,且有可能实现少量高效的目标[21]。
2.32-氨基嘧啶类Gad研究组在发现MTH1酶的抗肿瘤靶标特性后,对MTH1酶进行了提纯并筛选了化合物库,发现含有2-氨基嘧啶结构的苗头化合物能有效抑制MTH1酶的催化活性[11,22]。扩大筛选范围后,发现TH287(结构见Fig 2C)是MTH1酶的有效抑制剂,但体内外实验表明,TH287的代谢较快,稳定性差。环丙基取代甲基后得到的TH588在体内外实验中代谢稳定性有所提升,且还保持对MTH1酶的抑制作用。活性实验表明,TH287和TH588能够有选择并高效杀死人骨肉瘤细胞和其他肿瘤细胞系,而对于正常体细胞或未癌变的永生化细胞毒性却很低,这与MTH1酶对正常细胞非必需而对肿瘤细胞必需的研究结果是一致的。安德森肿瘤中心的Petrocchi研究组以2-氨基嘧啶为核心,对TH287和TH588进行了结构优化,得到了一系列显示MTH1酶抑制活性的结构,并公开发表[10]。
2.4松果菊苷松果菊苷(echinacoside,ECH)(见Fig 2D)为苯乙醇苷类化合物,最早从狭叶松果菊根部分离得到,为松果菊的主要活性成分之一。ECH是一个很好的天然抗氧化剂,具有明显的清除活性氧的作用,药理作用主要是抗氧化、保护神经、抗炎、抗肿瘤等。吉林大学邹志华研究组发现松果菊苷对胞外MTH1酶的抑制效果明显,通过噻唑蓝MTT比色实验检测松果菊苷在细胞水平对肿瘤细胞的作用,表明松果菊苷能够明显抑制SW480结肠肿瘤细胞和U2OS人骨肉瘤细胞的生长[23]。
2.5金属络合物抑制剂非常规环金属钌络合物MTH1酶抑制剂(结构见Fig 2E)的开发,源于对核苷酸结合位点相似特征的猜测,菲利普斯大学Streib等[24]基于可替代惰性过渡金属络合物开发了一种制备高活性、高选择性的蛋白激酶ATP拟态抑制剂的方法,由于核苷酸结合位点的相似特征,研究组推测该方法也适用于其他的核苷酸结合蛋白。通过与扩展板上多个蛋白激酶及其他ATP结合蛋白相互作用,证明这种有机金属抑制剂显示纳摩尔级的MTH1酶抑制活性和惊人的特异性,之后该有机金属抑制剂与MTH1酶的结合机制又通过蛋白晶体结构的研究得以证明。
2.6核苷二磷酸类研究发现,2-OH-dADP和8-oxo-dGDP的存在能够强烈抑制MTH1酶的活性,其结构与氧化核苷三磷酸相似,能够竞争MTH1酶结合口袋,但是并不能被酶水解。通过对NDPs和dNDPs进行测试研究,发现dADP、dGDP和GDP对MTH1酶的抑制性较强,但并未达到抑制剂活性要求,而其他NDPs和dNDPs的抑制性则很弱,几乎可以忽略不计。细胞内(d)NDPs的生理浓度远大于氧化嘌呤核苷酸,但这些抑制因素对MTH1酶的影响却很小[25]。以核苷二磷酸类化合物为先导物,进行合理的结构改造和修饰,有望得到更高效的MTH1酶抑制剂。
2.7Kettle的三类抑制剂阿斯利康制药公司曾以MTH1酶作为可能引起免疫反应的关键靶标进行过研究,近来受启发于Helleday 、Huber等有关MTH1酶抗癌特性的研究,Kettle研究组又对MTH1酶及其抑制剂进行了重新研究,通过高通量筛选等手段得到三类高效、高选择性的化合物,分别为大环嘌呤酮衍生物、4-苯氨基-3氨基喹啉类及2-氨基-4-苯基喹唑啉类。经表面等离子共振及细胞热转移分析验证,这些化合物与MTH1酶的相互作用较好,但在小组激酶分析中却并未检测到可观的MTH1酶抑制活性[17],相关研究还有待进行。
3 总结与展望
MTH1酶作为Nudix水解酶家族的一员,在维持细胞核苷酸池稳态方面具有重要作用。早年研究数据表明,在增殖期细胞如神经细胞、胎儿脑组织等代谢较快的细胞中,MTH1酶的活性与表达均较高。近年有研究称MTH1酶在快速繁殖的肿瘤细胞中发挥重要作用,有望成为新的抗肿瘤靶标,并开始一系列选择性抑制剂的研究。本文旨在对MTH1酶各方面,特别是其抑制剂的研究进展进行较为全面的综述。
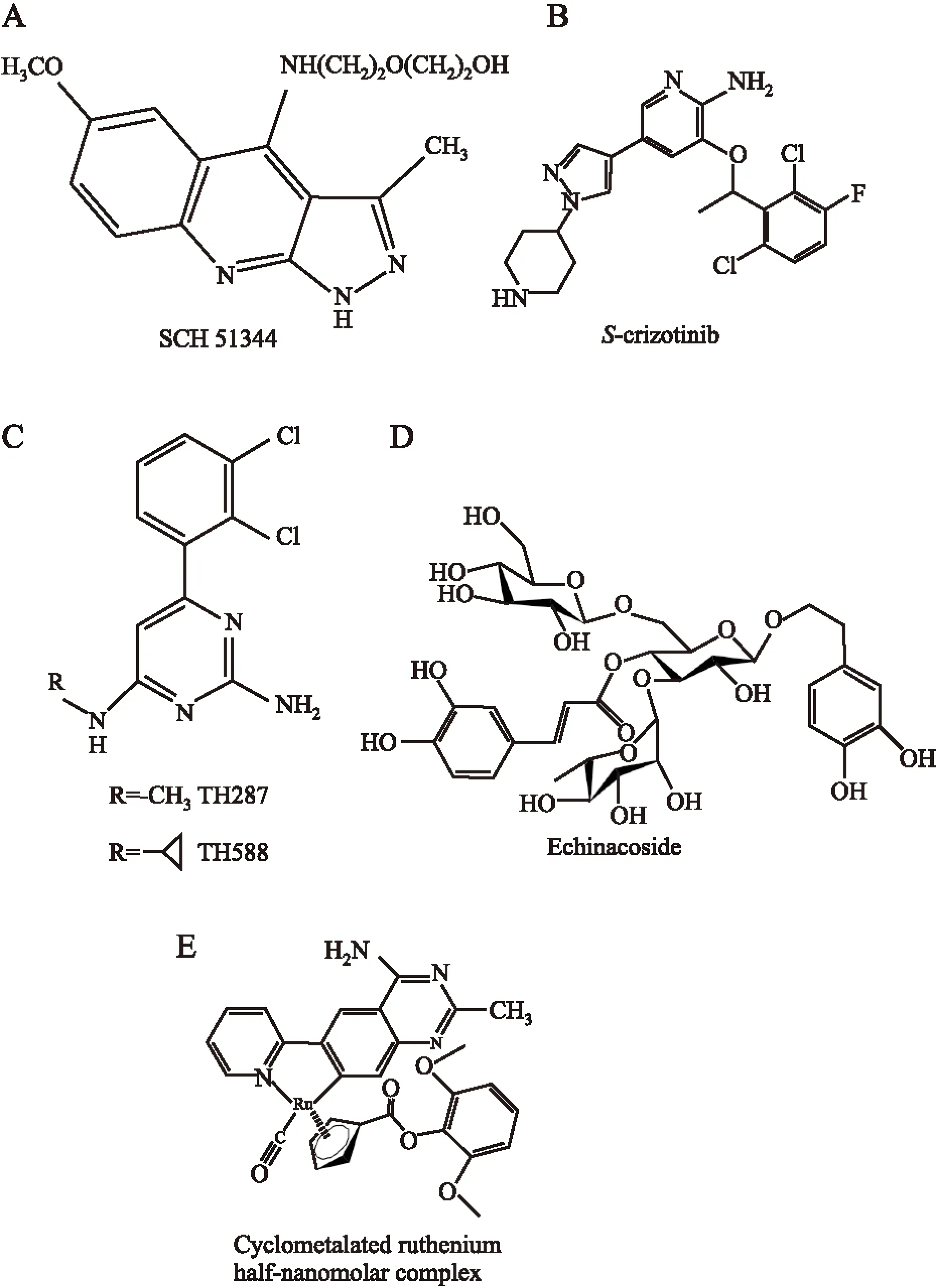
Fig 2 Structure of inhibitors of MTH1
MTH1酶及其抑制剂的研究还存在一系列亟待解决的问题:① 有关MTH1酶的研究尚不全面,如Mg2+的结合,底物选择特异性等的研究;② MTH1酶抑制剂的研发还不够成熟,已知抑制剂的研发多处于临床前阶段,更为高效的活性分子还有待发现;③ MTH1酶作为抗癌靶标,其抑制剂分子可能存在的脱靶效应及其引起的副作用等。深入研究MTH1酶,特别是对其抗肿瘤特性的研究,不仅扩展了该酶的生物学意义,也为肿瘤靶向治疗带来新的策略,高效MTH1酶抑制剂的研发和应用具有广阔的前景。
[1]Dominissini D, He C. Cancer: damage prevention targeted[J].Nature, 2014, 508(7495):191-2.
[2]Zhang Y, Du Y, Le W,et al. Redox control of the survival of healthy and diseased cells[J].AntioxidRedoxSignal, 2011, 15(11):2867-908.
[3]Takagi Y, Setoyama D, Ito R, et al. Human MTH3(NUDT18) protein hydrolyzes oxidized forms of guanosine and deoxyguanosine diphosphates: comparison with MTH1 and MTH2[J].JBiolChem, 2012, 287(25):21541-9.
[4]Svensson L M, Jemth A S, Desroses M, et al. Crystal structure of human MTH1 and the 8-oxo-dGMP product complex[J].FEBSLett, 2011, 585(16):2617-21.
[5]沈颖, 沈培亮, 王旭,等. 靶向 MTH1治疗肿瘤的研究进展[J]. 中国药理学通报, 2015,31(9):1199-201.
[5]Shen Y, Shen P L, Wang X,et al. Progress in treament of cancer targeting MTH1[J].ChinPharmacolBull, 2015,31(9):1199-201.
[6]Sakai Y, Oda H, Yoshimura D, et al. The GT to GC single nucleotide polymorphism at the beginning of an alternative exon 2C of human MTH1 gene confers an amino terminal extension that functions as a mitochondrial targeting signal[J].JMolMed(Berl), 2006, 84(8):660-70.
[7]Carter M, Jemth A S, Hagenkort A, et al. Crystal structure, biochemical and cellular activities demonstrate separate functions of MTH1 and MTH2[J].NatCommun, 2015, 6:7871.
[8]McLennan A G. The Nudix hydrolase superfamily[J].CellMolLifeSci, 2006, 63(2):123-43.
[9]Fujiwara S, Sawada K, Amisaki T. Molecular dynamics study on conformational differences between dGMP and 8-oxo-dGMP: effects of metal ions[J].JMolGraphModel, 2014, 51:158-67.
[10]Petrocchi A, Leo E, Reyna N J, et al. Identification of potent and selective MTH1 inhibitors[J].BioorgMedChemLett, 2016, 26(6):1503-7.
[11]Gad H, Koolmeister T, Jemth A S, et al. MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool[J].Nature, 2014, 508(7495):215-21.
[12]Nunomura A, Hofer T, Moreira P I, et al. RNA oxidation in Alzheimer disease and related neurodegenerative disorders[J].ActaNeuropathol, 2009,118(1):151-66.
[13]Leon J, Sakumi K, Castillo E, et al. 8-Oxoguanine accumulation in mitochondrial DNA causes mitochondrial dysfunction and impairs neuritogenesis in cultured adult mouse cortical neurons under oxidative conditions[J].SciRep, 2016, 6:22086.
[14]Hanahan D, Weinberg R A. Hallmarks of cancer: the next generation[J].Cell, 2011, 144(5):646-74.
[15]Helleday T. Cancer phenotypic lethality, exemplified by the non-essential MTH1 enzyme being required for cancer survival[J].AnnOncol, 2014, 25(7):1253-5.
[16]马红梅, 郑君德, 肖洪广, 等. 流感病毒H1N1感染后宿主细胞MTH1基因表达的研究[J]. 热带医学杂志, 2011, 11(6):617-9.
[16]Ma H M, Zheng J D, Xiao H G,et al. Study on the expression of MTH1 gene in MDCK cells infected by influenzaA virus[J].JTropMed, 2011, 11(6):617-9.
[17]Kettle J G, Alwan H, Bista M, et al. Potent and selective inhibitors of MTH1 probe its role in cancer cell survival[J].JMedChem, 2016, 59(6):2346-61.
[18]Huber K, Superti-Furga G. Aminoheteroaryl compounds as mth1 inhibitors: US 20160015702A1[P]. 2016-1-21.
[19]Huber K V, Salah E, Radic B, et al. Stereospecific targeting of MTH1 by(S)-crizotinib as an anticancer strategy[J].Nature, 2014, 508(7495):222-7.
[20]Sun H, Chen P, Li D, et al. Directly binding rather than induced-fit dominated binding affinity difference in(S)- and(R)-crizotinib bound MTH1[J].JChemTheoryComput, 2016, 12(2):851-60.
[21]Gao W, Cao W, Sun Y, et al. AuNP flares-capped mesoporous silica nanoplatform for MTH1 detection and inhibition[J].Biomaterials, 2015, 69:212-21.
[22]Saleh A, Gökturk C, Warpman-Berglund U, et al. Development and validation of method for TH588 and TH287, potent MTH1 inhibitors and new anti-cancer agents, for pharmacokinetic studies in mice plasma[J].JPharmBiomedAnal, 2015, 104:1-11.
[23]Zou Z, Wang Y, Dong L W, et al. Application of echinacoside in antitumor drugs: CN, 104288170[P]. 2014-10-22.
[24]Streib M, Kraling K, Richter K, et al. An organometallic inhibitor for the human repair enzyme 7,8-dihydro-8-oxoguanosine triphosphatase[J].AngewChemIntEdEngl, 2014, 53(1):305-9.
[25]Bialkowski K, Kasprzak K S. Inhibition of 8-oxo-2′-deoxyguanosine 5′-triphosphate pyrophosphohydrolase(8-oxo-dGTPase) activity of the antimutagenic human MTH1 protein by nucleoside 5′-diphosphates[J].FreeRadicBiolMed, 2003, 35(6):595-602.
Research progress of repair enzyme MTH1 and its inhibitors
KANG Cong-min,WANG Xiao-li
(CollegeofChemicalEngineering,QingdaoUnversityofScienceandTechnology,Qingdao266042,China)
MTH1 enzyme belongs to the family of Nudix hydrolases, which can prevent the oxidative damage of nucleic acid by cleaning up oxidized purine nucleotides.Close relationships were found between the activity of MTH1 and neurodegenerative diseases, anti-aging et al. In recent years, MTH1 has been regarded as a new promising target for cancer treatment, because it plays an essential role in tumor growth, survival, invasion and metastasis. The transcription and translation, structure, catalytic mechanism, detection and application of MTH1 were described, as well as various MTH1 inhibitors.
MTH1 enzyme; purine nucleotides oxidative damage;anticancer target; MTH1 inhibitors; Nudix hydrolases; NUDT1
2016-03-25,
2016-04-20
国家自然科学基金资助项目(No 21072111,21272131)
康从民(1963-),男,博士,教授,博士生导师,研究方向:抗肿瘤药物的设计与合成,通讯作者,E-mail: lvyingtao@qust.edu.cn
A
1001-1978(2016)08-1044-05
R 730.5;R 914.4;R 963;R 979.1
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.006.html