炎症应激通过激活mTOR通路诱导THP-1巨噬细胞泡沫化的实验研究
2016-08-29范忠才
赵 爽,叶 强,李 涛,范忠才
(西南医科大学 1. 附属医院心血管内科、2. 心肌电生理教育部重点实验室,四川 泸州 646000)
炎症应激通过激活mTOR通路诱导THP-1巨噬细胞泡沫化的实验研究
赵爽1,2,叶强1,李涛2,范忠才1
(西南医科大学 1. 附属医院心血管内科、2. 心肌电生理教育部重点实验室,四川 泸州646000)
doi:10.3969/j.issn.1001-1978.2016.08.015
目的研究脂多糖(LPS)诱导的炎症应激是否通过激活mTOR通路,增加SCAP/SREBP2表达,干扰SCAP/SREBP2负反馈调控,增加THP-1巨噬细胞对非修饰低密度脂蛋白胆固醇(LDL)摄取,导致泡沫细胞形成。方法诱导分化成功的THP-1源性巨噬细胞在无血清培养基中培养4 h后,分为对照组(5 mg·L-1LDL)、炎症刺激组(5 mg·L-1LDL+200 μg·L-1LPS)、炎症+雷帕霉素组(5 mg·L-1LDL+200 μg·L-1LPS+10 μg·L-1Rapamycin)。以上各组细胞培养24 h后收获。油红O染色法检测各组细胞内脂质沉积情况,Real-time PCR法检测LDLr、SREBP2、SCAP、S6K1和mTOR mRNA水平, Western blot法检测LDLr、S6K1、mTOR蛋白表达,激光共聚焦法检测SCAP在内质网与高尔基体间的转位情况。结果油红O染色发现,炎症应激增加THP-1巨噬细胞内脂质沉积,雷帕霉素抑制炎症应激诱导的脂质聚积。Real-time PCR检测显示,炎症应激上调THP-1巨噬细胞LDLr、SREBP2、SCAP、S6K1和mTOR mRNA水平(P<0.05),雷帕霉素减少炎症应激诱导的LDLr、SREBP2、SCAP、S6K1和mTOR mRNA水平升高(P<0.05)。Western blot检测发现,炎症应激上调LDLr、S6K1和mTOR蛋白表达(P<0.05),雷帕霉素减少炎症应激诱导的LDLr、S6K1和mTOR 蛋白表达水平升高(P<0.05)。激光共聚焦检测发现,炎症应激增加SCAP/SREBP2从内质网转位到高尔基体,雷帕霉素则抑制炎症应激诱导的SCAP/SREBP2复合物从内质网转位到高尔基体。结论炎症应激通过激活mTOR通路,上调SCAP/SREBP2表达,致SCAP/SREBP2复合体转位至高尔基体异常增加,LDLr表达上调,致使胆固醇聚积于细胞内,泡沫细胞形成。雷帕霉素能够逆转炎症应激诱导mTOR通路激活,减少细胞内胆固醇沉积,提示炎症应激状态下,mTOR可能是泡沫细胞形成的关键通路。
THP-1 巨噬细胞;脂多糖;炎症;LDLr;泡沫细胞;雷帕霉素
动脉硬化性心血管疾病(atherosclerotic cardiovascular disease, ASCVD)是全球发病率和死亡率的主要原因,主要是由动脉粥样硬化导致。目前认为动脉粥样硬化是一种慢性炎症性疾病,包括内皮功能的紊乱、炎症细胞的募集、细胞因子产生以及血管壁的脂质沉积[1]。既往研究认为,动脉硬化与血脂紊乱有关,然而最近研究发现,血脂正常的自身免疫性疾病(如系统性红斑狼疮、类风湿关节炎、肠道炎症性疾病等)患者有严重的动脉粥样硬化,提示慢性炎症在动脉硬化过程中起重要作用[2-4]。
低密度脂蛋白受体(LDLr)是结合血浆来源LDL胆固醇和调节血浆胆固醇水平的主要受体,LDLr活性受细胞内胆固醇浓度的负反馈系统的严密调控[5]。该系统通过调控LDLr 介导的 LDL 摄入以及新生胆固醇合成,确保肝细胞和其他细胞内胆固醇水平稳定。因此,传统观念认为LDLr不参与细胞内胆固醇聚集以及泡沫细胞形成[6-7]。我们前期研究证实,炎症因子如脂多糖(LPS)可通过干扰巨噬细胞上LDLr负反馈调节,上调固醇调节元件结合蛋白-2(SREBP-2)及SREBP裂解激活蛋白(SCAP)的表达,天然LDL通过LDLr被巨噬细胞大量摄入,导致泡沫细胞形成。
雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是哺乳动物细胞合成的一种丝氨酸/苏氨酸蛋白激酶。mTOR有2种细胞复合物形式,mTORC1和mTORC2,目前大多数研究都集中在mTORC1,雷帕霉素是其特异性抑制剂。近来研究发现,mTOR信号通路与SCAP/SREBP2复合物及胆固醇调控有密切联系。 但目前关于炎症应激下mTOR通路与细胞内胆固醇失稳态的关系尚不清楚。本研究探讨LPS诱导的炎症应激是否通过激活mTOR通路,增加SCAP/SREBP2表达,干扰SCAP/SREBP2负反馈调控,增加THP-1巨噬细胞对非修饰低密度脂蛋白胆固醇(LDL)摄取,导致泡沫细胞形成。
1 材料
人单核细胞株(THP-1),由重庆医科大学脂质研究中心提供;细胞生长培养基RPMI 1640培养基、胎牛血清(FCS)购于Hyclone公司;低密度脂蛋白(LDL)购于广州奕源生物有限公司;青霉素、链霉素、小牛血清白蛋白(BSA)、佛波醇酯(PMA)、LPS、二甲基亚砜、四乙酸乙二胺(EDTA)、叔丁基对甲酚(BHT)、雷帕霉素(rapamycin)均购于Sigma;4%多聚甲醛、油红O、苏木精均购于北京索莱宝科技有限公司;总RNA提取试剂盒购于北京天根生化科技有限公司;逆转录试剂盒购于日本Toyobo公司;SYBR Green I PCR Mix购于日本TaKaRa公司;8联光学反应PCR管及光学盖子购于美国Bio-Rad公司;细胞蛋白提取试剂盒购自南京凯基生物技术公司;Bradford试剂购于北京百泰克生物科技有限公司;Anti-LDLr一抗、Anti-S6K1一抗、Anti-mTOR一抗购于美国ABI;鼠抗人Golgi一抗、羊抗兔Fluor(green)488 for SCAP 二抗、羊抗鼠Fluor(Red)594 for Golgi 二抗均购于Molecular Probes。
2 方法
2.1细胞培养及分组THP-1细胞用含20%胎牛血清的RPMI 1640培养液培养,于37℃、5% CO2的细胞培养箱中培养,取对数期细胞进行实验。加佛波醇酯(160 μmol·L-1)于培养液,72 h后待悬浮细胞分化为贴壁生长的巨噬细胞后,用PBS清洗3次,换含抗氧化剂EDTA和BHT无血清培养基培养4 h,将细胞分为3组:① 对照组(5 mg·L-1LDL);② 炎症刺激组(5 mg·L-1LDL+200 μg·L-1LPS);③ 炎症+雷帕霉素组(5 mg·L-1LDL+200 μg·L-1LPS+10 μg·L-1Rapamycin)。以上各组细胞培养24 h后收获。
2.2泡沫细胞鉴定待悬浮细胞分化为贴壁生长的巨噬细胞后,用PBS清洗3次,换含0.2% BSA无血清培养基培养4 h,用冷PBS清洗3次,4%多聚甲醛固定30 min,油红O染色液染色20 min,苏木精复染10 s,自来水冲洗5 min,显微镜下观察并照相。
2.3总RNA提取和Real-time PCR根据试剂盒操作说明提取THP-1巨噬细胞总RNA,反转录为cDNA;cDNA合成后,用SYBR GReen I PCR Master Mix进行荧光定量PCR反应,反应参数:50℃ 2 min,95℃ 5 min,然后40个循环(95℃ 20 s,55℃ 20 s,72℃ 45 s),72℃10 min 后终止。计算公式如下:实验组相对于对照组基因表达水平的倍数=-exp(△△CT),其中△△CT=实验组△CT-对照组△CT,△CT=靶基因CT值-β-actin CT值。引物序列:LDLr上游5′-GATAC CAAGGGCGTGAAGAG-3′,下游 5′-CACCAGCGAGTAGATGTCCA-3′;SREBP2上游5′-CCGCCTGTTCCGATGTACAC-3′, 下游 5′-TGCACATTCAGCCAGGTTCA-3′;SCAP 上游 5′-TCTGACCGCAAACAAGGAG-3′, 下游 5′-CCAGGGAAACACTGAGGACT-3′;mTOR上游 5′-GCCCTCACCTCACAAGACAT-3′,下游5′-GCTCTCTACCCAGCAGAAC-3′;β-actin 上游 5′-CCTGGCACCCACGCACAAT-3′,下游5′-GCCGATCCACACACGGAGTACT-3′。所有引物由上海生物工程技术有限公司设计。
2.4Western blot检测蛋白表达收获细胞,用试剂盒提取蛋白后,定量总蛋白和胞核蛋白浓度,电泳,转膜,5%脱脂牛奶室温下封闭,用相应的一抗4℃孵育过夜,洗涤后换HRP标记二抗室温孵育1 h;最后ECL化学发光试剂A液、B液按1 ∶1混匀,均匀加至膜上,放入成像仪中采集图像,用Quantity One软件分析条带灰度值。
2.5激光共聚焦扫描检测SCAP定位THP-1巨噬细胞经实验处理后培养于24孔板中,经PBS洗涤后,用5%福尔马林生理盐水室温下固定30 min;0.25% TritonX-100处理细胞15 min;1% BSA室温下封闭20 min;加入兔抗人SCAP 一抗(终浓度1 ∶100)和鼠抗人Golgi抗体(终浓度1 ∶100),200 μL每孔,4℃过夜;PBST洗涤后加入羊抗兔Fluor488 for SCAP 二抗(终浓度1 ∶100),室温下孵育1h;经PBST洗涤后,在激光共聚焦显微镜下观察并采集图片。
3 结果
3.1不同干预条件对巨噬细胞内脂质沉积的影响油红O染色初步证实,与对照组比较,炎症刺激组可见明显的脂质沉积。加入雷帕霉素则抑制了细胞内脂质的沉积,见Fig 1。
3.2不同干预条件对巨噬细胞LDLr、SREBP2和SCAP mRNA水平的影响如Fig 2所示,与对照组比较,200 μg·L-1LPS上调了LDLr、SREBP2和SCAP mRNA水平。加入10 μg·L-1Rapamycin后,LDLr、SREBP2和SCAP mRNA水平被明显抑制。
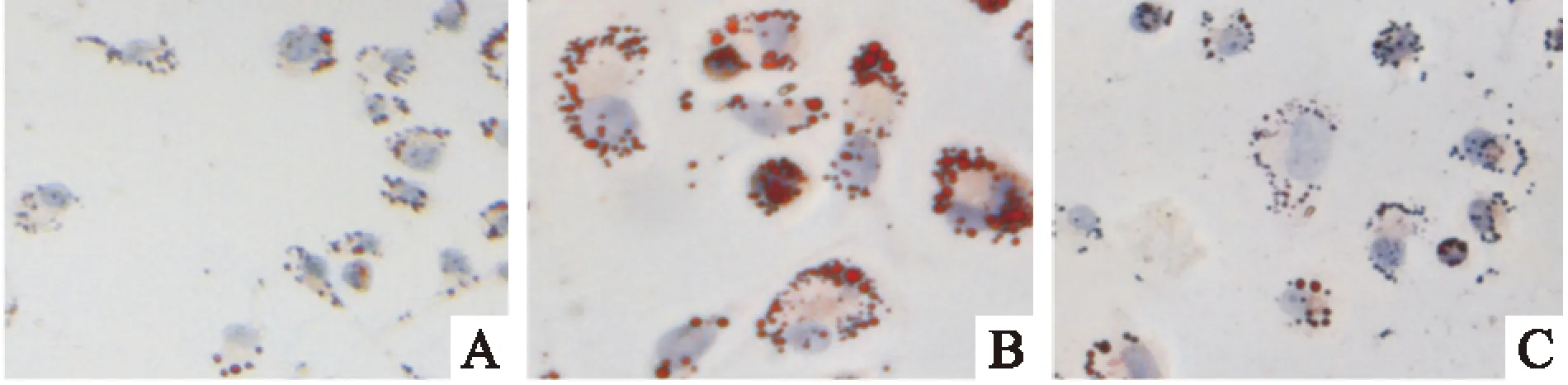
Fig 1 Morphological examination of macrophages with Oil Red O staining(×200)
A:Control;B:LDL+LPS;C:LDL+LPS+Rapamycin
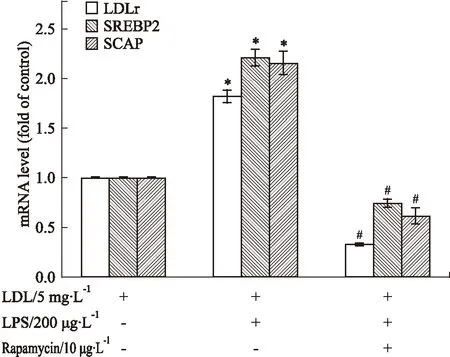
Fig 2 Effect of different conditions on LDLr, SREBP2 and SCAP mRNA levels in macrophages
*P<0.05vscontrol;#P<0.05vsLPS alone
3.3不同干预条件对巨噬细胞S6K1和mTOR mRNA水平的影响200 μg·L-1LPS上调了S6K1和mTOR mRNA水平。而加入10 μg·L-1Rapamycin后,则可明显抑制S6K1和mTOR mRNA水平。见Fig 3。
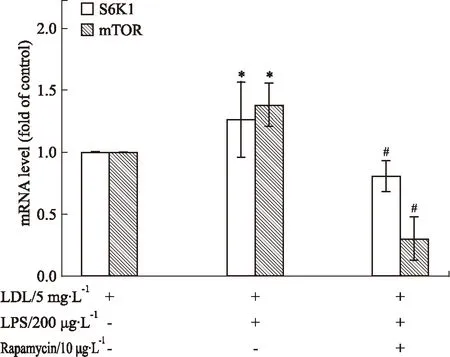
Fig 3 Effect of different conditions on S6K1 and mTOR mRNA levels in macrophages
*P<0.05vscontrol;#P<0.05vsLPS alone
3.4不同干预条件对巨噬细胞LDLr蛋白表达的影响当有200 μg·L-1LPS存在时,上调了LDLr蛋白表达。而加入10 μg·L-1Rapamycin后,则可明显抑制LDLr蛋白表达。见Fig 4。
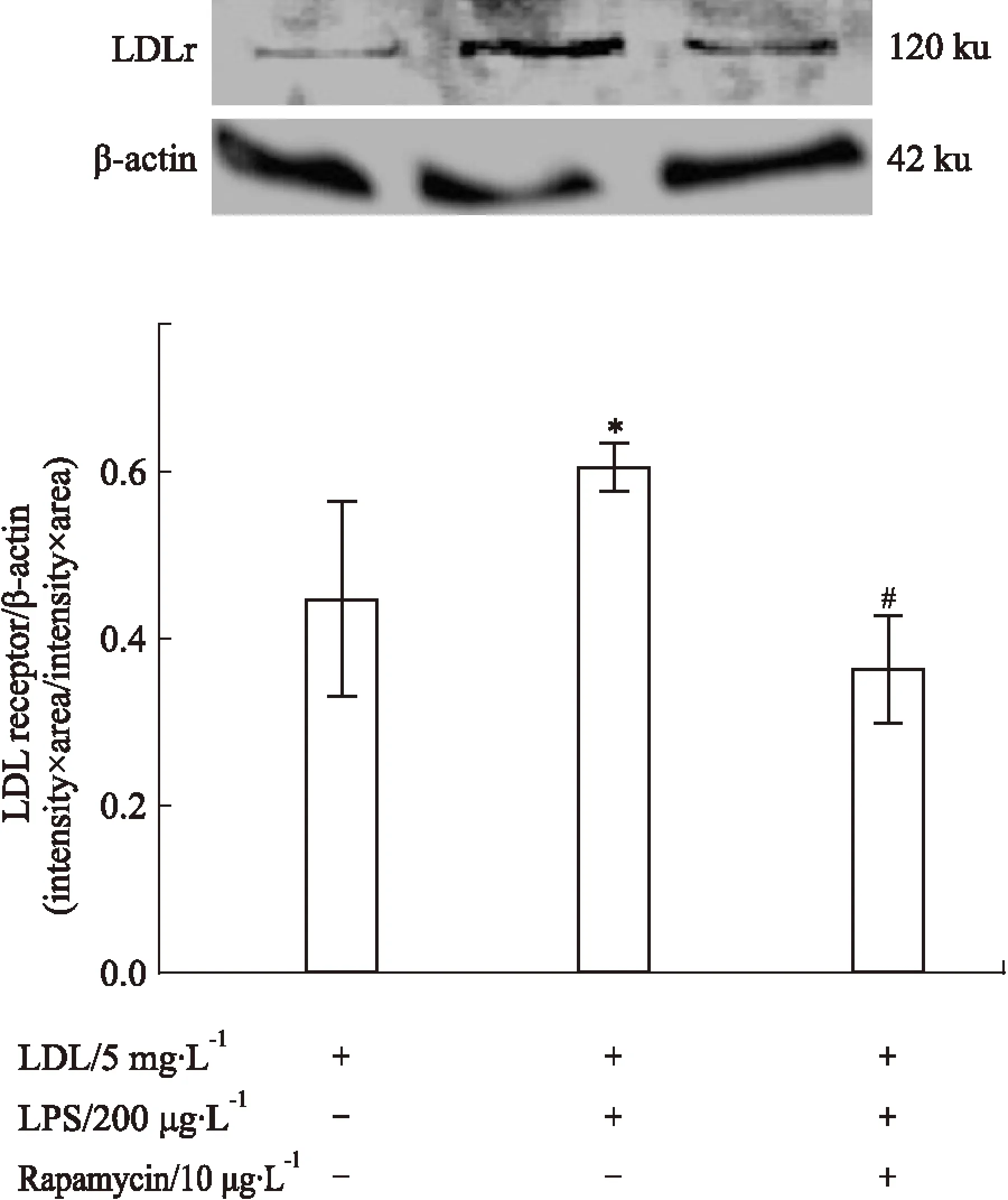
Fig 4 Effect of different conditions on LDLr protein expression in macrophages
*P<0.05vscontrol;#P<0.05vsLPS alone
3.5不同干预条件对巨噬细胞S6K1蛋白表达的影响当有200 μg·L-1LPS存在时,上调了S6K1蛋白表达。而加入10 μg·L-1Rapamycin后,则可明显抑制S6K1蛋白表达。见Fig 5。
3.6不同干预条件对巨噬细胞mTOR蛋白表达的影响如Fig 6所示,当有200 μg·L-1LPS存在时,上调了mTOR蛋白表达。而加入10 μg·L-1Rapamycin后,则可明显抑制mTOR蛋白表达。
3.7激光共聚焦结果用无血清培养基培养巨噬细胞4 h后,分别加入5 mg·L-1LDL、5 mg·L-1LDL+200 μg·L-1LPS、5 mg·L-1LDL+200 μg·L-1LPS+10 μg·L-1Rapamycin处理24 h。用抗人的SCAP抗体和抗高尔基抗体双重染色,在激光共聚焦显微镜下观察(×1 000)。SCAP用绿色表示,高尔基体用红色表示,SCAP和高尔基体的共定位用黄色表示。结果显示,单独加入200 μg·L-1LPS时,SCAP从内质网到高尔基体的转位异常增加;加入10 μg·L-1Rapamycin后,明显抑制SCAP从内质网到高尔基体的转位,见Fig 7。
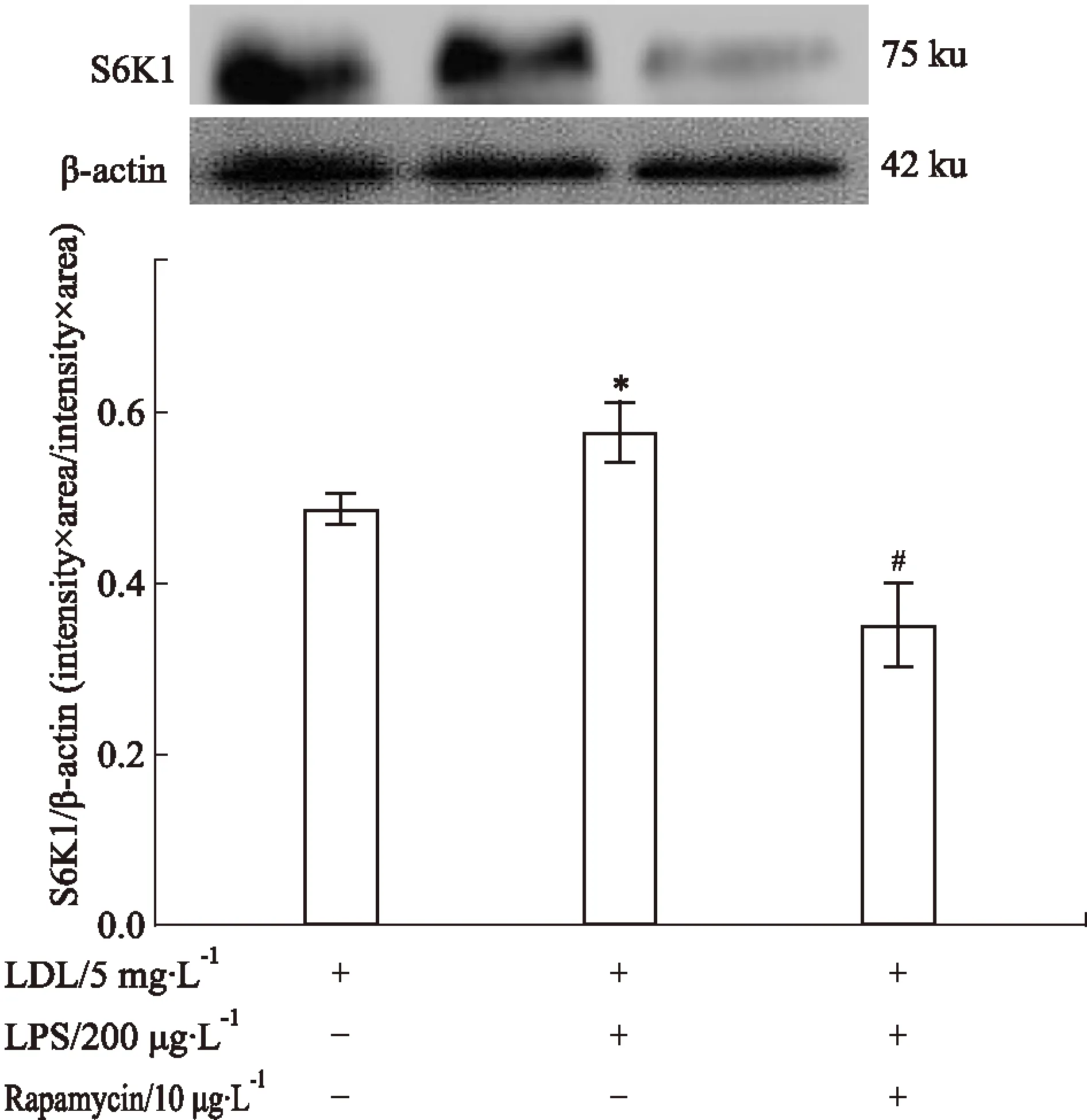
Fig 5 Effect of different conditions on S6K1 protein expression in macrophages
*P<0.05vscontrol;#P<0.05vsLPS alone
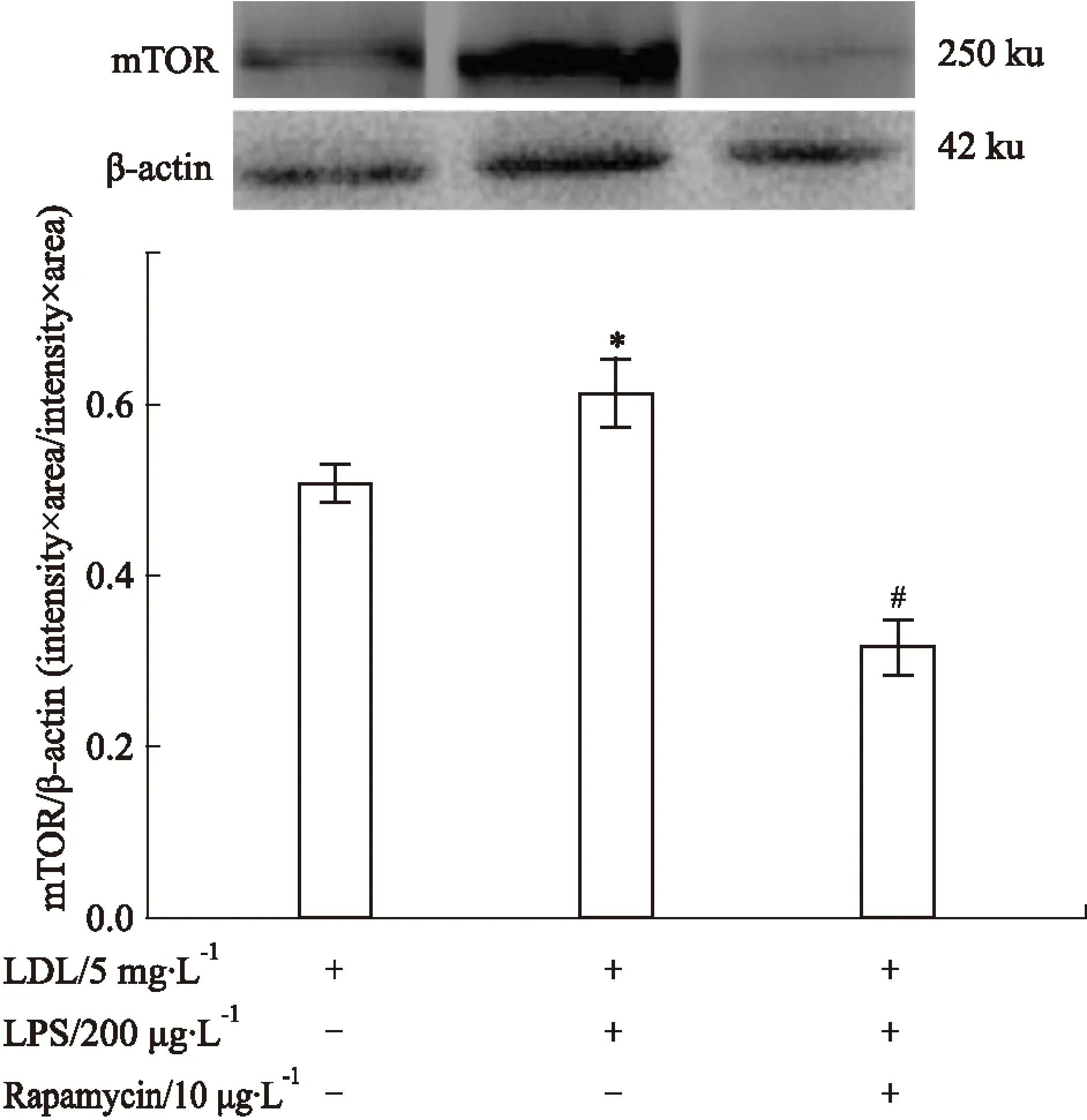
Fig 6 Effect of different conditions on mTOR protein expression in macrophages
*P<0.05vscontrol;#P<0.05vsLPS alone
4 讨论
mTOR是哺乳动物细胞合成的一种丝氨酸/苏氨酸蛋白激酶,有2种细胞复合物形式,mTORC1和mTORC2。目前大多数研究都集中在mTORC1,雷帕霉素是其特异性抑制剂。激活的mTOR 发挥两个方面的功能:一方面,磷酸化其下游区的效应子核糖体蛋白S6 激酶1(S6K1)和真核细胞翻译起始因子4E结合蛋白(4EBP1),从而启动翻译过程,促进细胞生长。第二,生理条件下,S6K1 和4EBP1 与真核细胞启动因子3(elF3)结合,处于无活性状态;在过度生长、炎症、应激等病理条件下,mTOR 与elF3 结合并磷酸化S6K1 和4EBP1,结果是S6K1 和4EBP1 活化,促进了翻译启动和细胞的生长[8]。因此,mTOR 在控制细胞生长及代谢方面起到中心作用。LPS是一种常用炎症刺激物,通过作用于Toll样受体4(TLR-4)通路,进而激活转录因子-核因子κB(NF-κB),其最终生物学效应是肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)合成分泌增加,导致炎症应激状态,故常用于细胞实验[9]。
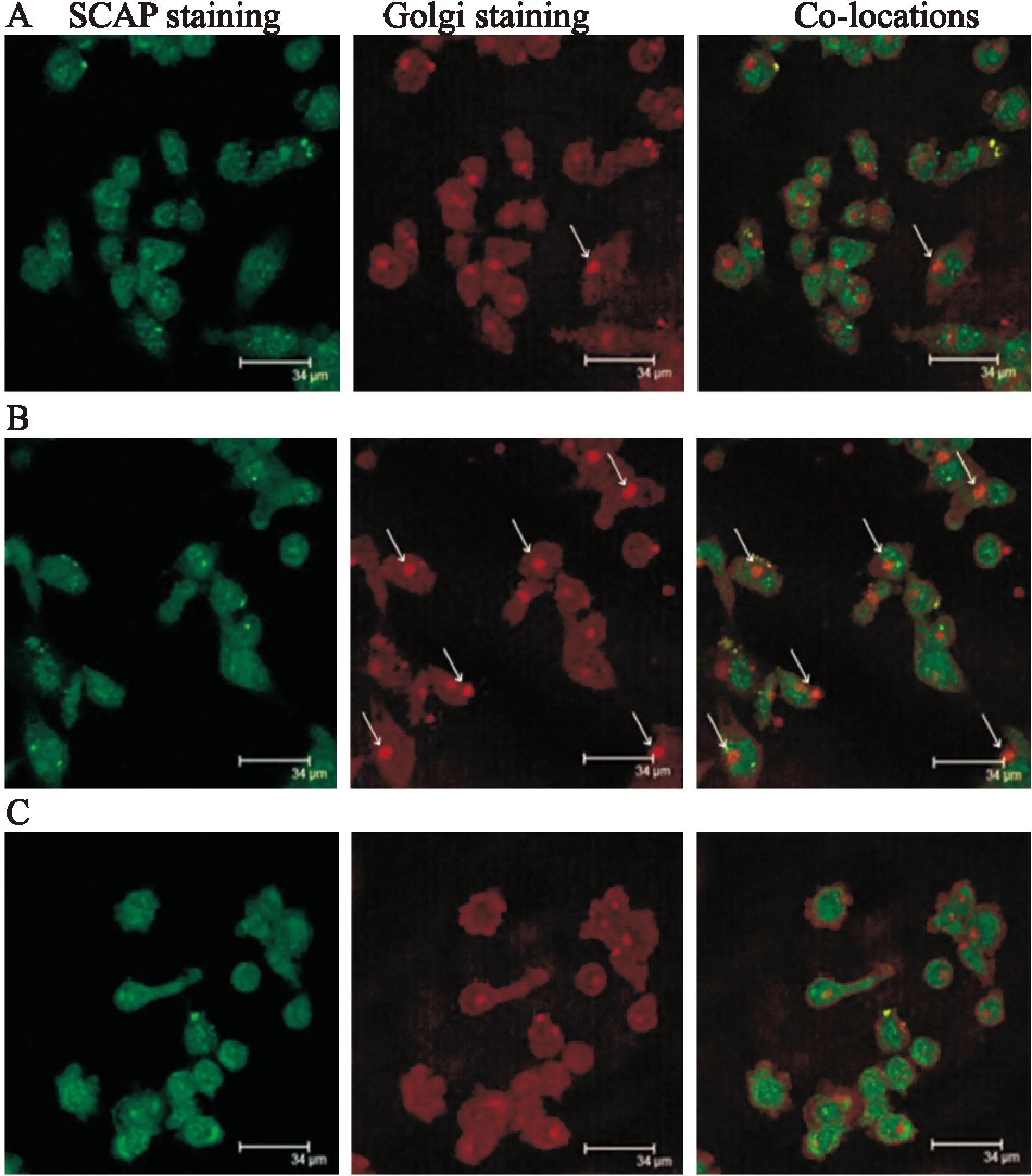
Fig 7 Effect of different conditions on translocation of SCAP-SREBP2 complex from endoplasmic reticulum to the Golgi
A: Control; B: LDL+LPS; C: LDL+LPS+Rapamycin
近来研究发现,mTOR信号通路与SCAP/SREBP2复合物及胆固醇调控有密切联系[10]。研究发现,mTOR的上游调控蛋白之一,磷脂酰肌醇3激酶(PI3K)的特异性抑制剂LY294002可以明显抑制细胞内低胆固醇水平调控的SREBP2从内质网到高尔基体转位,使细胞内胆固醇持续处于低水平;同时,负性表达蛋白激酶B(DN-Akt)质粒转染的CHO细胞内胆固醇也是降低的,激光共聚焦也发现SCAP/SREBP2从内质网到高尔基体转位减少。Porstmann等[11-13]也发现mTOR特异性抑制剂雷帕霉素可以明显抑制SREBP2表达,导致细胞内胆固醇合成减少,细胞生长缓慢。
本实验发现,与对照组比较,LPS明显增加THP-1巨噬细胞组内脂质沉积,雷帕霉素则抑制了炎症组细胞内脂质的沉积(油红O染色证实)。Real-time PCR和Western blot检测发现,炎症LPS应激明显上调THP-1巨噬细胞LDLr mRNA水平和蛋白表达,促进巨噬细胞摄入胆固醇及细胞内胆固醇合成。进一步研究发现,炎症应激上调了细胞内胆固醇敏感期SCAP及其伴随蛋白SREBP2 mRNA水平,这2个蛋白是LDLr的上游调节基因,雷帕霉素抑制SCAP/SREBP2的表达,减少SCAP/SREBP2从内质网到高尔基体的转位,继而减少LDLr表达。我们检测mTOR和其下游调节因子S6K1的mRNA和蛋白表达,结果发现,炎症应激上调THP-1巨噬细胞mTOR和S6K1的mRNA和蛋白表达,提示mTOR信号通路被激活。雷帕霉素明显抑制mTOR和S6K1的mRNA和蛋白表达,继而减少SCAP/SREBP2/LDLr表达及SCAP/SREBP2转位,抑制细胞内脂质堆积,进一步证实炎症应激下THP-1巨噬细胞mTOR通路激活与细胞内脂质超载及泡沫细胞形成有关。我们的实验数据提示,炎症应激可能是动脉粥样硬化的始动因子,在低血脂水平条件下,炎症应激同样可以促进脂质在巨噬细胞内聚积,导致巨噬细胞泡沫化。本实验给予细胞一个低水平的LDL浓度负荷,在炎症应激下却依然造成细胞内大量脂质聚集,这样或许能解释临床上有不少患者血脂正常甚至偏低,仍然有较高的动脉粥样硬化发生率,部分原因可能与炎症应激诱导脂质由血液向组织细胞分布有关[14]。综上所述,在THP-1巨噬细胞,炎症应激通过激活mTOR通路,上调SCAP/SREBP2表达,致SCAP/SREBP2异常转位至高尔基体,上调 LDLr表达,导致细胞内胆固醇聚积,泡沫细胞形成,而雷帕霉素能够逆转炎症应激诱导mTOR通路激活,减少细胞内胆固醇沉积,提示炎症应激状态下mTOR可能是泡沫细胞形成的关键通路。
[1]Tuttolomondo A, Di Raimondo D, Pecoraro R,et al. Atherosclerosis as an inflammatory disease[J].CurrPharmDes, 2012, 18(28): 4266-88.
[2]Tanasescu C, Jurcut C, Caraiola S, et al. Endothelial dysfunction in inflammatory rheumatic diseases[J].RomJInternMed, 2009, 47(2): 103-8.
[3]Libby P,Okamoto Y,Rocha V Z,Folco E. Inflammation in atherosclerosis: transition from theory to practice[J].CircJ,2010, 74(2): 213-20.
[4]Wierda R J, Geutskens S B, Jukema J W, et al. Epigenetics in atherosclerosis and inflammation[J].JCellMolMed, 2010,14(6A):1225-40.
[5]Ruan X Z, Moorhead J F, Varghese Z. Lipid redistribution in renal dysfunction[J].KidneyInt,2008, 74(4): 407-9.
[6]Ye Q, Chen Y, Lei H, et al. Inflammatory stress increases unmodified LDL uptake via LDL receptor: an alternative pathway for macrophage foam-cell fomation[J].InflammRes,2009,58(11): 809-18.
[7]Ye Q,Lei H, Fan Z, et al. Difference in LDL receptor feedback regulation in macrophages and vascular smooth muscle cells: foam cell transformation under inflammatory stress[J].Inflammation,2014,37(2): 555-65.
[8]Hayashi A A, Proud C G. The rapid activation of protein synthesis by growth hormone requires signaling through mTOR[J].AmJPhysiolEndoerinolMetab,2007, 292(6): 1647-55.
[9]石翠格,胡刚,汪海. NF-κB在动脉粥样硬化中的始动作用[J]. 中国药理学通报,2004, 20(4): 382-5.
[9]Shi C G, Hu G, Wang H. Initialization effect of NF-κB on atherosclerosis[J].ChinPharmacolBull, 2004, 20(4):382-5.
[10]Ma K L, Liu J, Wang C X, et al. Activation of mTOR modulates SREBP-2 to induce foam cell formation through increased retinoblastoma protein phosphorylation[J].CardiovascRes,2013, 100(3) : 450-60.
[11]Du X, Kristiana I, Wong J,Brown A J. Involvement of Akt in ER-to-Golgi transport of SCAP/SREBP: a link between a key cell proliferative pathway and membrane synthesis[J].MolBiolCell,2006, 17(6):2735-45.
[12]Porstmann T, Santos C R,Griffiths B,et al. SREBP activity is regulated by mTORC1 and contributes to Akt-dependent cell growth[J].CellMetab,2008, 8(3): 224-36.
[13]Peterson T R,Sengupta S S, Harris T E,et al. mTOR complex 1 regulates lipin 1 localization to control the SREBP pathway[J].Cell,2011, 146(3): 408-20.
[14]Ruan X Z, Varghese Z, Moorhead J F. An update on the lipid nephrotoxicity hypothesis[J].NatRevNephrol,2009, 5(12): 713-21.
Experiment of THP-1 macrophage foam-cell formation through mTOR signal pathway activation induced by inflammatory stress
ZHAO Shuang1,2, YE Qiang1, LI Tao2, FAN Zhong-cai1
(1.DeptofCardiology,theAffiliatedHospitalofSouthwestMedicalUniversity,2.KeyLaboratoryonCardiacElectrophysiologyofEducationMinistry,LuzhoSichuan646000,China)
AimTo investigate if LPS increases the sterol regulatory element binding proteins(SREBPs) cleavage-activating protein(SCAP)-SREBP2 expression by activation of mTOR signal pathway in THP-1 macrophages, upgrading LDLr level, causing foam-cell formation.MethodsTHP-1 macrophages were incubated in serum free medium in the absence of 5 mg·L-1LDL alone, or 5 mg·L-1LDL plus 200 μg·L-1LPS, or 5 mg·L-1LDL plus 200 μg·L-1LPS plus 10 μg·L-1rapamycin. Morphological examination of macrophages was performed with Oil Red O staining. Expression changes of LDLr, SREBP2, SCAP, S6K1 and mTOR mRNA were detected by real time quantitative polymerase chain reaction(PCR). Western blot was used to analyze protein expression changes of LDLr, S6K1 and mTOR. Translocation of SCAP-SREBP2 complex from the endoplasmic reticulum(ER) to the Golgi was determined by confocal microscopy.ResultsLPS enhanced transformation of THP-1 macrophages into foam cells by increased uptake of lipid as evidenced by Oil Red O assay. LPS increased mRNA levels of LDLr,SREBP2,SCAP,S6K1 and mTOR(P<0.05). Rapamycin reduced the mRNA levels of LDLr,SREBP2,SCAP,S6K1 and mTOR induced by LPS(P<0.05). Western blot demonstrated that LPS also caused over-expression of protein of LDLr, S6K1 and mTOR(P<0.05). Rapamycin reduced the expression of protein of LDLr, S6K1 and mTOR induced by LPS(P<0.05). Confocal microscopy demonstrated LPS caused an escape of SCAP-SREBP2 complex from the ER to the Golgi. Rapamycin inhibited the translocation of SCAP-SREBP2 complex from the ER to the Golgi.ConclusionsInflammatory stress increases SCAP/SREBP2 expression by activation of mTOR signal pathway, resulting in an escape of SCAP-SREBP2 complex from the ER to the Golgi, furthermore elevating LDLr expression and causing foam-cell formation. Rapamycin reverses the activation of mTOR signal pathway and decreases lipid deposition in THP-1 macrophages induced by LPS.
THP-1 macrophages; LPS; inflammation; LDLr; foam cells; rapamycin
2016-04-18,
2016-05-10
四川省卫生厅基金项目(No 2011-110335);泸州市科技局基金项目[No 2011-I-S37(6/7)];泸州医学院基金资助项目(No 2010-108);泸州医学院附属医院基金资助项目(No 2011-43)
赵爽(1988-),男,硕士生,住院医师,研究方向:介入心脏病学,E-mail:arronzhao@126.com;
叶强(1978-),男,博士,副教授,研究方向:冠心病、脂质代谢紊乱、心力衰竭,共同第一作者,E-mail:qiangye78@126.com;
A
1001-1978(2016)08-1105-06
R329.24;R364.5; R979.5
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.030.html
范忠才(1965-),男,博士,教授,主任医师,硕士生导师,研究方向:介入心脏病学,通讯作者,E-mail: zhongcai9665@126.com