肺磨玻璃结节临床研究进展
2016-08-27李镭刘丹朱盈盈李为民
李镭 刘丹 朱盈盈 李为民
随着计算机断层扫描(computed tomography,CT),尤其是高分辨薄层CT(high resolution CT,HRCT)的广泛使用,肺部结节的检出率逐年升高。磨玻璃结节(ground-glass nodules, GGNs)为其中的特殊类型,他的出现与肿瘤密切相关,同时常常提示病变处于早期阶段。因此,加强对GGNs的认识可有效地指导随访及治疗,有助于改善肺癌患者预后。
1 概述
GGNs又被称为磨玻璃影(ground-glass opacities,GGOs),指肺内局灶性、结节状、淡薄密度增高影,结节内部原有结构如血管、气道及小叶间隔仍可见[1]。GGNs可分为两大类,其中不含实性成分的为单纯性GGNs(pure GGNs, pGGNs);伴有实性成分、掩盖部分肺纹理的为混合性GGNs(mixed GGNs, mGGNs)或部分实性GGNs(part-solid GGNs)[2]。
GGNs是一种非特异性病变,其形成与含气腔内的局部浸润有关。当肺泡腔或腺泡内存在液体渗出、炎性浸润、出血或新生物时,局部组织密度增高,气体含量减少,即可出现GGNs。GGNs可为良性病变,如局灶性间质纤维化(focal interstitial fibrosis,FIF)、感染、出血、水肿等;可为腺癌浸润前病变,如原位腺癌(adenocarcinomain situ, AIS)、非典型腺瘤样增生(atypical adenomatous hyperplasia, AAH)等;也可为恶性病变,如微浸润性腺癌(minimally invasive adenocarcinoma, MIA)、浸润性腺癌(invasive adenocarcinoma, IA)等[3,4]。
2 GGNs与肺癌相关性研究
既往多项研究关注GGNs在肺癌中所占比例,但由于纳入人群基线情况的差异,目前尚无一致结论。总体而言,与实性结节相比,GGNs与肺癌的关系更为密切。尤其是mGGNs的出现,常常高度提示肺腺癌。而就肺鳞癌而言,除少数个案报道提出GGNs最终被确诊为鳞癌外[5,6],其余研究均证实GGNs与肺鳞癌无直接相关性[7,8]。
Henschke等[9]回顾性纳入了233例低剂量CT发现的肺结节,44例(19%)为GGNs,其中15例诊断为肺癌,其恶性构成比为34.1%;而实性结节仅7%为肺癌。进一步研究发现,上述肺结节中pGGNs及mGGNs的恶性构成比分别为18%(5/28)、63%(10/16),后者远高于前者(P<0.05)。该结论在后续多项研究中被证实:Cho等[10]对330例已接受手术治疗的GGNs患者进行研究发现,其恶性构成比为95.2%(314/330),其中AIS占12.1%(n=38),MIA占20.1%(n=63),IA占67.8%(n=213);在Heo等[11]的研究中,90%(45/50)GGNs被诊断为肺癌。Yamaguchi等[12]回顾性纳入了33例手术患者、共47例pGGNs进入研究,分析发现高达41例(87.2%)结节病理诊断为腺癌。此外,在Kim等[13]的研究中49例pGGNs被纳入,随访1个月无变化;分析发现40例(81.6%)被诊断为肺癌,分别为细支气管肺泡癌(broncholoalveolar cell carcinoma, BAC)(n=36)、以BAC为主的腺癌(n=4)。
3 GGNs与肺腺癌病理分型、影像学特征的相关性研究
2011年,国际肿瘤研究协会(International Association for the Study of Lung Cancer, IASLC)、美国胸科协会(American Thoracic Society, ATS)以及欧洲呼吸学会(European Respiratory Society, ERS)对肺腺癌的分型制订了新的标准[14]。多项研究发现根据该分型标准,各亚型与GGNs的不同影像学表现具有明显相关性。
AAH在CT上通常表现为直径<5 mm的pGGNs,极少数情况下直径可达1 cm-2 cm[15,16]。在Oda等[17]的研究中,单因素及多因素分析均证实圆球形pGGNs与AAH相关(OR=0.059,P<0.001; OR=0.125,P=0.042)。非粘液性AIS一般为直径>5 mm的pGGNs,部分病例由于内部结构崩解也可表现为mGGNs[18]。粘液性AIS较为少见,多为孤立性实性结节[14]。手术切除后,AIS的疾病相关生存率可达100%[13]。
MIA是IASLC/ATS/ERS分类标准中新增的类型,目前相关研究较少。由于间质浸润深度≤5 mm,非粘液性MIA通常表现为pGGNs或含有极少量实性成分的mGGNs[19]。粘液性MIA更为罕见,通常表现为实性为主的结节[14]。在Zhang等[20]的研究中,MIA被证实多为较大的、分叶或边缘不规则的mGGNs,且实性成分直径多大于5 mm。MIA预后佳,手术切除后疾病相关生存也可达100%[14]。
实性为主型IA表现为实性结节,边缘多光滑[21]。贴壁状为主型IA多为实性结节或以实性为主的pGGNs,极少数可表现为mGGNs[22];其亚实性成分为贴壁生长的细胞,而实性成分则为浸润性病变;多分布在外周,边缘常不清楚[21]。Lim等[23]研究发现,支气管气相(P=0.012)、结节直径(cutoff=16.4 mm,P=0.032)以及结节质量(cutoff=0.472,P=0.040)等因素可有效鉴别IA与AIS、MIA。其他种类的IA多表现为实性结节或以实性成分为主的mGGNs,且其预后普遍较贴壁状为主型差。
此外,既往研究多采用Noguich分型标准[24]进行病理分型,其病理影像学特征与上述研究结果一致。
4 GGNs影像学特征与肺癌的相关性研究
GGNs的发现依赖于体检筛查。既往筛查手段主要为胸部X光,但由于GGNs密度较低,胸片上常常较难发现,易发生漏诊。近年来,随着胸部CT、特别是HRCT的广泛使用,对GGNs的诊断得到了大幅提升。
4.1 GGNs大小与肺癌 Cho等[10]的研究发现,良性GGNs的直径(15.1±9.3)mm明显小于恶性GGNs(20.3±11.0)mm,较大直径是恶性病变的独立危险因素(OR=1.086;95%CI: 1.001-1.178;P=0.047)。Heo等[11]的研究也得到了一致结论,良性与恶性GGNs的最大径分别为(11±3)mm、(19±9)mm(P<0.05)。但在Fan等[25]的研究中,对82例GGNs进行统计分析发现:良性GGNs的最大径(23.3±7.1)mm与恶性GGNs(23.6±7.3)mm无明显差异;Lee等[26]纳入96例GGNs研究发现:最大径>10 mm的GGNs与最大径≤10 mm的GGNs恶性构成比相近(50%vs51.2%)。造成不同结论的原因可能为纳入人群存在差异:前两项研究纳入标准为手术切除的GGNs,对于术前明确诊断的GGNs予以排除,其恶性构成比分别为95.2%及90.0%;而后两项研究纳入标准为CT筛查发现的GGNs,确诊方式包括手术、活检及临床诊断,恶性构成比分别为74.3%、51.0%,明显低于前者。
4.2 实性成分的比例与肺癌 既往研究证实:mGGNs恶性程度较pGGNs高,但关于实性成分比例与恶性程度的关系,不同研究间存在差异。在Matsuguma等[27]的研究中,根据实性成分比例,GGNs被分为了I度(0%)、II度(1%-25%)、III度(26%-50%)、IV度(51%-75%)、V度(76%-100%),结果表明实性成分增多是淋巴结转移的独立危险因素(OR=4.87; 95%CI: 1.51-15.77),实性成分比例越高,肺癌侵袭能力越强。Lee等[26]纳入18例GGNs,采用类似分度标准,将GGNs分为1度(≤25%,n=6)、2度(26%-50%,n=4)、3度(51%-75%,n=5)、4度(>75%,n=3),其恶性构成比(83%, 100%, 100%,100%)无明显差别。
4.3 GGNs边缘及内部征象与肺癌 一项纳入82例GGNs的研究发现,分叶征(14.3vs83.6,P<0.001)、短毛刺征(4.8vs34.4,P=0.008)、长毛刺征(0.0vs29.5,P=0.004)、边界不清(66.7vs1.6,P<0.001、不规则边缘(33.3vs93.4,P<0.001)、含气征(14.3vs59.0,P<0.001)、胸膜凹陷征(4.8vs70.5,P<0.001)、血管集束征(4.8vs36.1,P=0.006)等均提示恶性病变[25]。Heo等[11]的研究也发现,在50例GGNs患者中空泡征和不规则边缘仅见于恶性GGNs。上述结论被Lee等[28]的研究证实:恶性pGGNs、恶性mGGNs出现分叶征的比例明显高于良性(63.6%vs8.0%,P<0.05; 94.4%vs62.5%,P<0.05),且分叶征是恶性病变的独立危险因素(OR=13.769,P=0.016;OR=10.200,P=0.024)。
但在另一项纳入53例pGGNs的研究中,Kim等[13]将GGNs的边缘分为光滑、毛刺、分叶及毛刺伴分叶,分析发现边缘特征与GGNs的恶性程度无明显相关性。
5 GGNs与PET/CT的相关性研究
正电子发射-计算机断层扫描(positron emission tomography-computed tomography, PET/CT)是鉴别肺结节良恶性的重要手段,他结合了CT及FDG-PET两种检查方式,其中前者可检出形态结构改变,而后者提供细胞生长、代谢等功能学信息。一般情况下,肿瘤细胞对氟[18F]脱氧葡萄糖(18F- fluorodeoxyglucose,18F-FDG)摄取率高,在PET/CT中表现为SUV值(maximum standardized uptake value, SUVmax)增高。多项研究发现,SUV值的改变有助于鉴别肺结节良恶性。Lowe等[29]证实:SUV值>2.5可诊断恶性肺结节,其敏感度、特异度分别为92%、90%。但对于GGNs而言,由于其生长代谢不活跃,PET/CT较易出现假阴性。Chun等[30]对68例GGNs研究发现:恶性pGGNs与良性pGGNs相比,SUV值接近[(0.64±0.19), range 0.43-0.96; (0.74±0.28), range 0.32-1.00],差异无统计学意义(P=0.37);而恶性mGGNs与良性mGGNs相比,前者SUV值[(1.26±0.71), range 0.32-2.6; (2.00±1.18),range 0.48-5.60]较小,差异有统计学意义(P=0.018)。Tsushima等[31]的研究发现:良性GGNs的平均SUV值及最大SUV值明显高于恶性GGNs(P<0.001),且SUV>1.5用于诊断良性病变的敏感度、特异度、准确度分别为100.0%、96.4%、100.0%。但Chiu等[32]的研究发现:最大SUV值在良恶性GGNs间无明显差异。上述研究表明PET/CT在鉴别GGNs良恶性方面并非首选。此外,GGNs通常不伴随淋巴结转移及远处转移,降低了PET/CT诊断恶性病变的敏感度。
6 GGNs的自然生长史
研究GGNs的自然生长史对于指导GGNs的随访、治疗具有重要意义。GGNs生长较实性结节缓慢[33],且与多种因素有关[34-36];体积倍增时间是反映结节自然生长状况的重要指标,关于GGNs的平均倍增时间目前仍不明确,但大量研究证实体积、密度的改变在结节随访中均有重要意义。在Matsuguma等[37]的研究中共纳入178例GGNs,其中pGGNs 98例,mGGNs 76例,中位随访时间为29(1-136)个月,定义直径增长2 mm及以上为结节生长;在pGGNs中,2年生长率及5年生长率分别为13%、23%;而在mGGNs中,分别为38%、55%。Kobayashi等[38]采用相同标准定义结节生长,对120例GGNs进行观察,中位随访时间为4.2年,共观察到34例(28.3%)结节生长;进一步分析发现:吸烟史、结节直径1.1 cm-3.0 cm(vs直径≤1 cm)是结节生长的独立危险因素。该结论与Lee等[36]研究一致:在136例pGGNs、77例mGGNs中,pGGNs≥10 mm及mGGNs≥8 mm均提示结节增长较快。此外,另一项纳入125例GGNs的研究亦证实:结节大小、肺癌病史是GGNs生长的独立危险因素[39]。上述研究均表明:GGNs实性成分比例、直径大小、肺癌病史等因素均与结节生长有关。
此外,Eguchi等[40]的研究证实结节CT值也可影响GGNs的生长。通过HRCT随访124例pGGNs患者,中位随访时间为57.0个月,其中64例(51.6%)直径增大,其平均CT值较直径不变的结节高[(-602.9±90.7)HUvs(-705.7±77.7)HU,P<0.000,1];同时,CT值≥-670 HU的pGGNs更易出现直径增大(P<0.000,1)。
在GGNs中,pGGNs是生长速度最为缓慢的类型,即使随访2年未见体积改变,仍不能完全排除恶性病变的可能。Chang等[41]使用低剂量CT对122例pGGNs进行随访,中位随访时间为59个月,结果显示:仅12例pGGNs(9.8%)体积增大,其中位体积倍增时间为769天,病理诊断证实其中11例为早期肺癌。在另一项研究[12]中,共89例pGGNs患者纳入随访;其中仅8例患者结节直径增大,3例CT值升高,其中位生长时间为20.6个月。
7 GGNs的分子病理特征
随着生物靶向治疗的进展,越来越多的研究开始着眼于肺癌相关的驱动基因,加强其管理、监测变得极为迫切。肺腺癌中较为常见的驱动基因包括EGFR、ALK、KRAS、ROS1、HER2、p53等,其中EGFR、ALK在GGNs中的研究较多。
不同驱动基因阳性率在不同群体中差异较大。Kobayashi等的研究[42]纳入104例GGNs,其中75%(78/104)检出驱动基因,EGFR、KRAS、ALK、HER2阳性率分别为64%、4%、3%及4%。在另一项纳入35例患者、60例GGNs的研究中,Wu等[43]通过手术标本检测了EGFR、HER2、KRAS、BRAF、EML4-ALK、ROS1等基因,仅6例患者驱动基因改变情况一致。
既往研究发现驱动基因阳性率与腺癌分型、实性成分比例、结节直径等因素有关。EGFR阳性者多为MIA/IA,阴性者多为AAH/AIS[42];且其21外显子缺失在贴壁状为主型IA中更为常见[44]。同时,Yang等[45]的研究证实EGFR突变与GGNs的直径及体积密切相关。但关于实性成分比例与驱动基因的关系,目前尚无一致结论。Takatoshi等[46]的研究发现EGFR突变率在pGGNs、mGGNs中分别为36%、45%,而p53突变在pGGNs(n=14)中均为阴性,在mGGNs(n=11)中存在6例(55%)阳性;这与Wang等[47]的结论一致,他们发现在212例Ia期肺癌患者中,实性成分比例越高,EGFR及KRAS突变率越高;而Yang等[45]则指出EGFR/KRAS突变、EML4-ALK融合在GGNs、实性结节中频率相当。该论点有待后续大样本量的高质量研究证实。
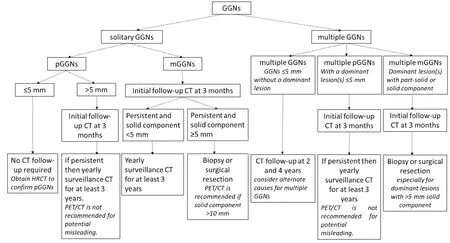
图1 GGNs诊治流程建议Fig 1 Suggested guideline for management of GGNs. CT: computed tomography; HRCT: high resolution CT; GGNs: ground-glass nodules; pGGNs:pure GGNs; PET/CT: positron emission tomography/computed tomography.
驱动基因的改变还与结节进展状况密切相关,既往多项研究均已证实EGFR突变与结节生长具有相关性。Kobayashi等的研究[42]发现EGFR阳性的GGNs在随访过程中体积有增长(P<0.01),而阴性者结节体积无明显改变(P<0.01);这一结论与Takatoshi等[46]的研究一致。
8 GGNs诊治流程
美国Fleischner学会[48]综合IASLC、ATS及ERS的内容,对GGNs的诊治流程提出了建议。
GGNs为肺结节的一种特殊类型,其基因突变、生长代谢等均与其他肺结节不同。GGNs对于肺腺癌具有高度提示作用,合理应用HRCT及PET/CT等手段有助于早期发现肺癌,改善预后。
