MAGE-C2在肺腺癌中的表达及临床意义
2016-08-27郭康刘梦实徐萍李红梅
郭康 刘梦实 徐萍 李红梅
肺癌是世界范围内最常见的肿瘤之一,而且其发病死亡率居首位[1],是威胁人类生命健康的主要恶性肿瘤。其中肺腺癌的发病率逐年升高,已经跃居肺癌发病率首位[2]。研究[2]证实,早期诊断和治疗是提高肺癌患者生存率的关键。肿瘤标志物因其检测方便、成本低等优点可广泛用于肺癌的筛查,对肺癌早期诊断、组织学分型、预后判断及疗效评价等方面有重要价值[3]。肿瘤睾丸抗原(cancer-testis antigen, CTA)是一类新的肿瘤标志物,在多种肿瘤中存在表达,而在正常组织中仅表达于睾丸和胎盘组织[4]。黑色素抗原C2(melanoma antigen-C2,MAGE-C2)是CTA的一种,最初发现于黑色素瘤细胞,后被证实在多种肿瘤中存在表达[5,6],而其在肺腺癌中的研究却很少。本实验通过荧光定量PCR(realtime fluorescence quantitative PCR, RTFQ-PCR)及Western blot方法检测MAGE-C2 mRNA及蛋白在肺腺癌中的表达情况,并分析其与肺腺癌临床病理特征及总生存率之间的关系,以期望发现一种新的肺腺癌标志物。
1 资料与方法
1.1 病例资料 选取青岛大学附属医院胸外科2010年3月-2011年3月肺腺癌患者87例,分别取肺腺癌组织及癌旁组织10 g剪碎后储存于-80 ℃备用。癌旁组织取自癌组织旁5 cm以外的组织。所有患者均为接受过放化疗,并均已经病理诊断证实,且无其他恶性疾病及自身免疫性疾病。临床分期采用国际肿瘤-淋巴结-转移(tumor-nodemetastasis, TNM)分期方法。
1.2 总RNA提取和cDNA合成 取冰冻肺腺癌组织及癌旁组织各50 mg-100 mg,利用RNAsimple Total RNA Kit提取总RNA,利用超微量核酸蛋白检测仪检测RNA纯度。再利用FastQuant RT Kit(with gDNase)进行cDNA合成。所有试剂盒均为天根科技有限公司提供,具体操作均按说明书进行。
1.3 荧光定量PCR检测 使用上述合成的cDNA为模板,利用SuperReal PreMix Plus(SYBR Green)试剂盒进行荧光定量PCR检测。所使用MAGE-C2上游引物为:5’-AAAGTCA GCACAGCAGAGGAG-3’,下游引物为:5’-TCTTCAGGA GCAGCAGGTAAA-3’。先95 ℃预变性15 min,再与荧光定量PCR仪(Bio-Rad仪器)内扩增40个循环(95 ℃变性10 s,55 ℃退火20 s,72 ℃延伸20 s),然后进行融解曲线分析。所有试剂盒均为天根科技有限公司提供,具体操作按说明书进行[7]。
1.4 Western blot检测 将冻存的组织标本取出称重,每100 mg加入500 μL蛋白裂解液,置于匀浆器中研磨,冰上裂解30 min,离心(12,000 r/min)收集上清液,使用BCA法测定蛋白浓度。将蛋白于10%聚丙烯酰胺凝胶电泳分离,电转膜1.5 h,5%BSA封闭1 h后,分别加入MAGE-C2兔抗人单克隆抗体(1:1,000)及GAPDH小鼠抗人单克隆抗体(1:1,000),4 ℃孵育过夜漂洗,加二抗(1:2,000)室温孵育1 h后加发光试剂,暗室曝光显示条带[8]。
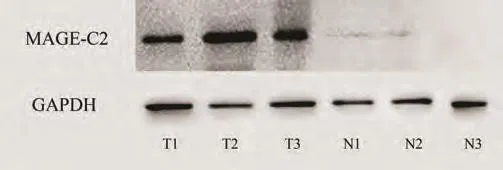
图1 Western blot检测MACE-C2蛋白在肺腺癌及癌旁组织中的表达情况Fig 1 Expression of MAGE-C2 protein was detected in lung adenocarcinoma and adjacent non-cancerous tissue by Western bolt.MAGE-C2: melanoma antigen-C2.
1.5 随访 对87例患者进行长期随访,随访时间从诊断日期开始至最终观察日期或死亡日期。记录患者的总生存时间。
1.6 统计学方法 所有数据采用SPSS 19.0统计学软件进行分析。计量资料以Mean±SD表示,采用t检验;计数资料采用χ2检验;生存分析采用Kaplan-Meier法及Cox风险比例回归模型,以P<0.05为差异有统计学意义。
2 结果
2.1 MAGE-C2 mRNA在肺腺癌及癌旁组织中的表达 超微量核酸蛋白检测仪检测RNA纯度,选取A260/A280的比值在1.8到2.1之间的样本用于合成cDNA。荧光定量PCR结果显示MAGE-C2 mRNA在肺腺癌组织存在表达(53/87,60.9%),而在癌旁组织中无表达。
2.2 MAGE-C2蛋白在肺腺癌及癌旁组织中的表达 Western blot结果与荧光定量PCR检测结果一致,在肺腺癌组织中检测到MAGE-C2蛋白的表达(53/87, 60.9%)(图1),而在癌旁组织中无表达。
2.3 MAGE-C2 mRNA及蛋白表达与肺腺癌临床病例特征之间的关系 将MAGE-C2 mRNA及蛋白表达情况与肺腺癌患者的临床病理资料结合进行分析。我们发现,MAGE-C2 mRNA及蛋白表达阳性组与表达阴性组之间在临床分期、是否转移、分化程度方面存在统计学差异(P<0.05)(表1);在MAGE-C2 mRNA表达阳性组中,晚期、低分化、转移组的表达量明显高于早期、高/中分化、无转移组(P<0.05)(图2);但与患者的年龄、性别、吸烟史之间无明显相关性(P>0.05)(表1)。
2.4 MAGE-C2 mRNA与患者预后之间的关系 通过对87例随访数据进行Kaplan-Meier法生存分析,我们发现MAGE-C2 mRNA及蛋白表达阳性组与表达阴性组之间在总生存期上存在明显差异(Log-rank=7.541,P<0.05)(图3)。利用Cox风险比例回归模型对87例患者的7个因素进行分析,这7个因素分别为:年龄、性别、吸烟史、分化程度、临床分期、是否转移、MAGE-C2表达,结果发现,临床分期、是否转移、MAGE-C2表达分别为肺腺癌预后不良的独立因素。MAGE-C2 mRNA及蛋白高表达对患者总生存期产生不利影响(RR=2.813, 95%CI 1.714-4.616,P=0.017)(表2),并可能与临床分期、是否转移间存在协同作用。
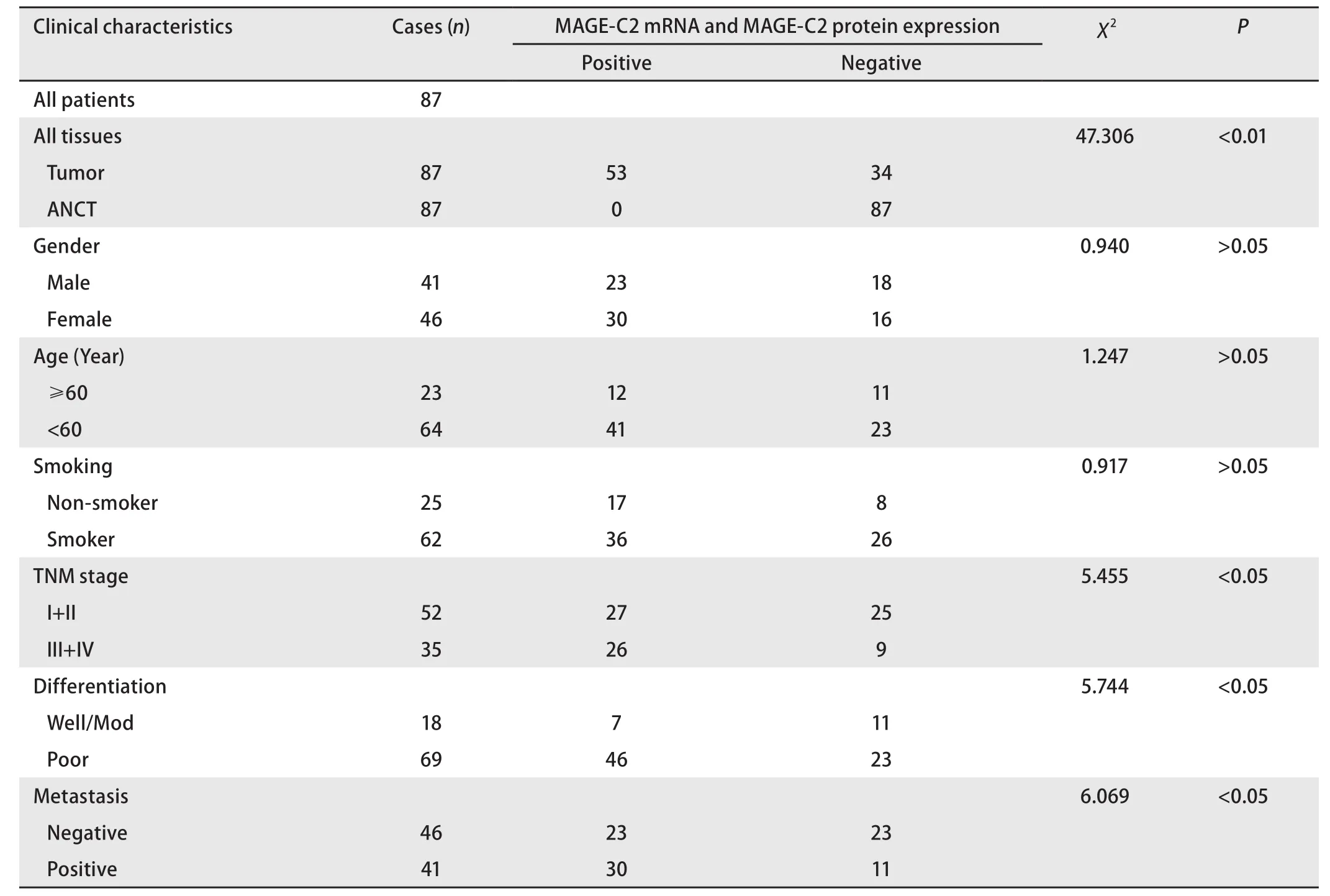
表1 MAGE-C2 mRNA及蛋白表达情况与临床病理特征的关系Tab 1 Relationship between expression level of MAGE-C2 mRNA and protein and clinical characteristics of patients
3 讨论
CTA抗原基因编码的肿瘤抗原能在多种肿瘤组织中表达,但在正常组织中仅限于睾丸和胎盘组织,但是睾丸不表达人类白细胞抗原(human leukocyte antigen,HLA),因此不会在体内产生相应抗体[9,10]。Jassim等[11]的研究发现CTA的异位表达能引发人体的免疫反应,在血液中产生相应抗体,这为CTA在早期肿瘤诊断方面的应用提供了依据[12]。另外,由于CTA这种免疫原性及表达限制性,CTA在肿瘤的诊断及免疫治疗方面存在巨大的潜在价值。
MAGE-C2是CTA家族中的一员,可在肿瘤细胞的胞质内被降解成九肽或十肽,然后作为抗原表位,与细胞内的HLA分子结合后呈递到细胞膜[13],从而诱导机体免疫系统产生相应抗体。在本研究中,我们检测了87例肺腺癌患者癌组织及癌旁组织中MAGE-C2 mRNA及蛋白的表达情况,结果发现,MAGE-C2 mRNA及蛋白表达于多数肺腺癌组织中(53/87, 60.9%),而在癌旁组织中未检测到MAGE-C2 mRNA及蛋白的表达。因此,MAGE-C2有潜力作为一种新型的肺腺癌标志物,其在血清中产生的特异性抗体可广泛用于肺癌的筛查。另外,通过分析MAGE-C2 mRNA及蛋白的表达情况与肺腺癌临床病理特征之间的关系,我们发现,MAGE-C2 mRNA及蛋白的表达阳性组与表达阴性组在肺腺癌的临床分期、是否转移及分化程度方面存在明显统计学差异(P<0.05),并且在晚期、低分化、转移组的表达量明显高于早期、高/中分化、无转移组。这一结果提示,MAGE-C2的高表达可能对肿瘤细胞的分化、转移有促进作用,其具体机制有待进一步研究。
利用Cox风险比例回归模型及Kaplan-Meier法对随访数据进行生存分析后,我们发现,MAGE-C2的高表达同临床分期、是否转移一样,为肺腺癌不良预后的独立因素。MAGE-C2表达越高,预后相对越差。因此,我们认为,MAGE-C2不仅可以用于肺腺癌的诊断,而且可
以作为肺腺癌不良预后的指标。另外,由于其特殊的免疫原性及表达限制性,MAGE-C2可能作为肺腺癌免疫治疗的靶点。体外培养能结合MAGE-C2的细胞毒性T淋巴细胞,进而特异性杀伤体内肿瘤细胞,而不对正常组织造成损害,减少了肿瘤治疗的副反应[14]。同时,阻断MAGE-C2相关的信号转导途径[15],可能达到延缓肿瘤转移、改善患者的预后目的。相信此方面的研究将会对肿瘤的临床治疗产生重大影响。
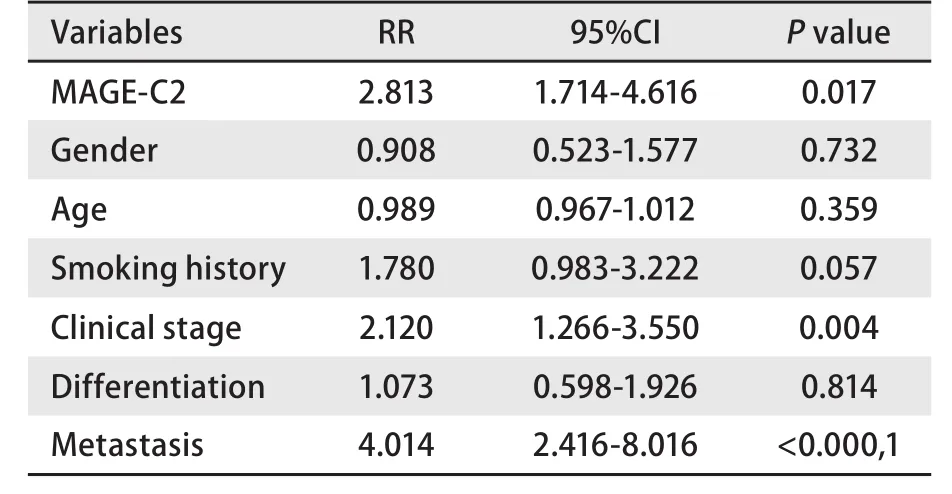
表2 肺腺癌预后因素的Cox风险回归模型分析Tab 2 Cox multivariate analysis of prognostic factors of lung adenocarcinoma
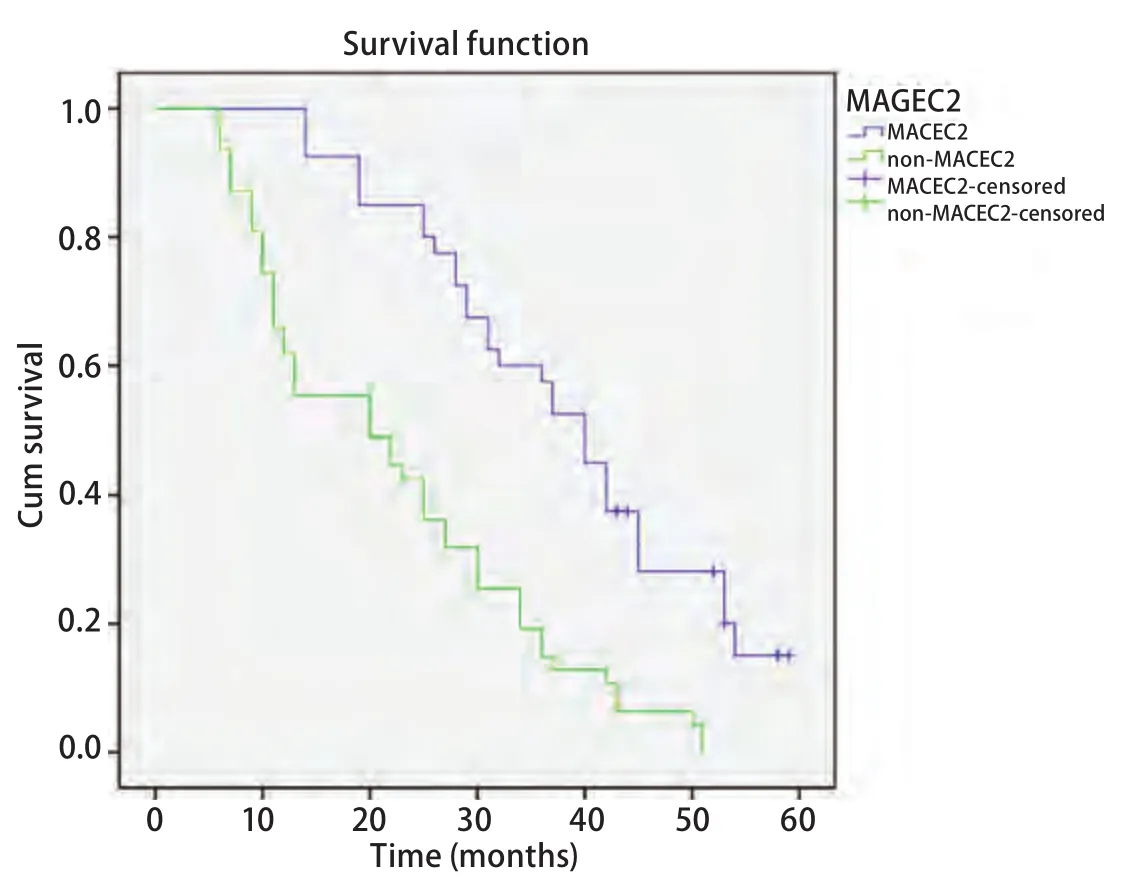
图3 MAGE-C2 mRNA及蛋白的表达情况与肺腺癌患者总生存率之间的关系(Kaplan-Meier法)Fig 3 Relationship between expression of MAGE-C2 mRNA and protein and overall survival rate of lung adenocarcinoma patients (Kaplan-Meier method)
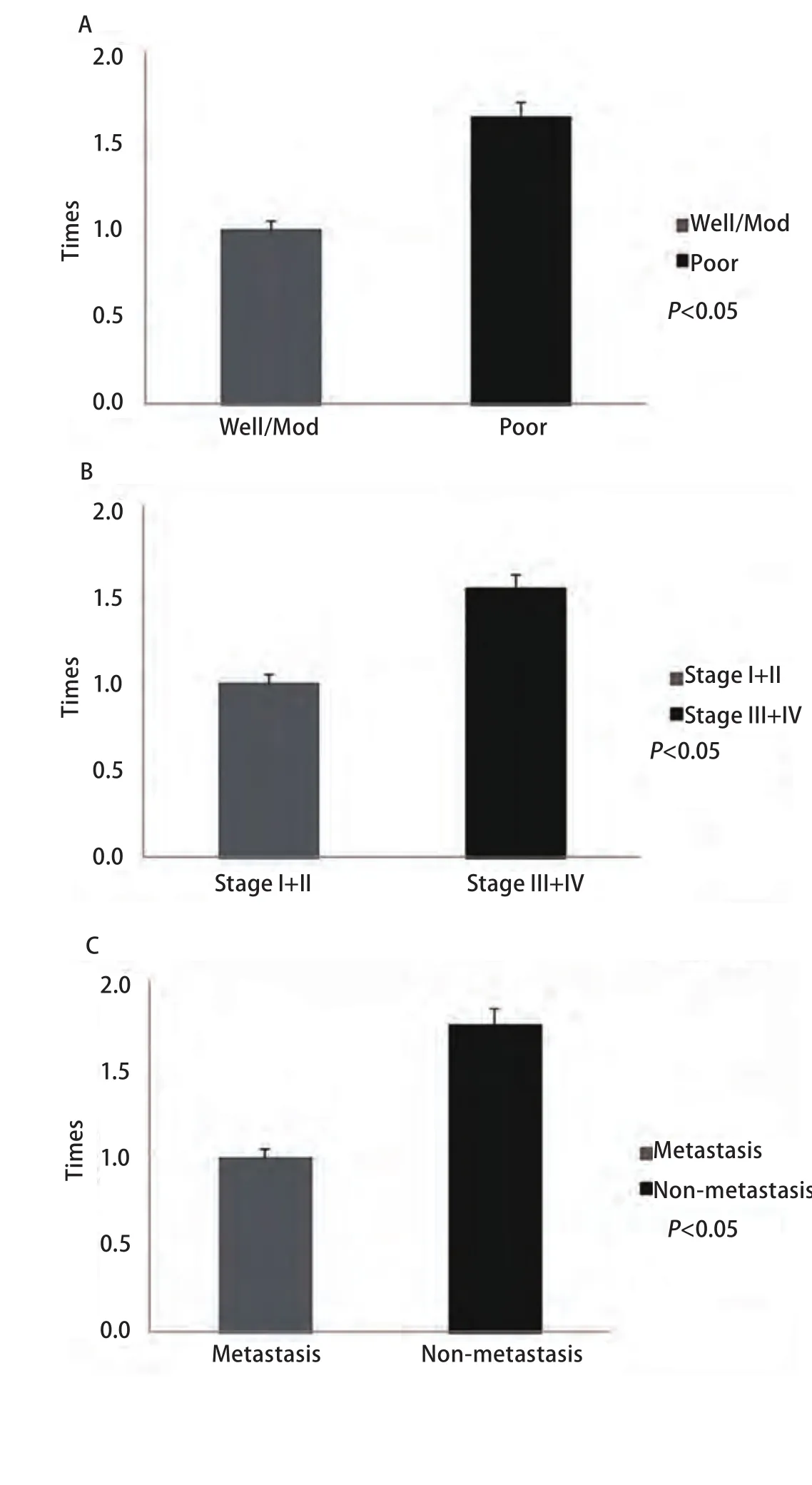
图2 荧光定量PCR检测MAGE-C2 mRNA在肺腺癌中的表达情况。A:MAGE-C2 mRNA在高/中分化组和低分化组的表达情况(以高/中分化组为标准,低分组的荧光表达量);B:MAGE-C2 mRNA在(I期+II期)组和(III期+IV期)组的表达情况(以I期+II期组为标准,III期+IV期组的荧光表达量);C:MAGE-C2 mRNA在转移组和无转移组的表达情况(以无转移组为标准,转移组的荧光表达量)。Fig 2 Expression of MAGE-C2 mRNA was detected in lung adenocarcinoma by realtime fluorescent quantitative PCR. A:MAGE-C2 mRNA expression in well/mod differentiation group and poor differentiation group (Compared to well/mod differentiation group, expression of MAGE-C2 mRNA in poor differentiation group); B: MAGE-C2 mRNA expression in stage I+II group and stage III+IV group (Compared to stage I+II group, expression of MAGE-C2 mRNA in stage III+IV group); C: MAGE-C2 mRNA expression in metastasis group and non-metastasis group (Compared to metastasis group, expression of MAGE-C2 mRNA in non-metastasis group).
总体来看,本研究成功证实了MAGE-C2在肺腺癌组织中存在高表达,并与肺腺癌的临床分期、是否转移及分化程度相关,对患者的总生存期有不良影响。这表明,MAGE-C2可作为一种肺腺癌诊断及预后标志物,并可作为免疫治疗靶点,在临床应用中存在巨大潜力。
