分子印迹-电化学发光技术研究进展
2016-08-26谭学才李晓宇
张 慧,谭学才,严 军,刘 敏,李晓宇,陈 晓
(广西民族大学 化学化工学院,广西高校食品安全与药物分析化学重点实验室,广西林产化学与工程重点实验室,广西 南宁 530008)
分子印迹-电化学发光技术研究进展
张慧,谭学才*,严军,刘敏,李晓宇,陈晓
(广西民族大学化学化工学院,广西高校食品安全与药物分析化学重点实验室,广西林产化学与工程重点实验室,广西南宁530008)
分子印迹-电化学发光技术具有分子印迹技术的高选择性及电化学发光技术的高灵敏性,以及发光易于调控、稳定性好、便于微型化和仪器操作简单等优点,已被广泛地应用于重金属检测、免疫传感技术、基因传感技术、酶传感技术、食品安全与药物分析等领域。该文结合本实验室的研究工作介绍了分子印迹电化学发光传感器的原理和构建思路。在此基础上,着重介绍了分子印迹电化学发光技术在食品安全与药物分析中的应用,并对其今后的研究趋势进行了展望。
分子印迹;电化学发光;食品安全与药物分析;综述
电化学发光(Electrochemiluminescence,ECL)又称电致化学发光,是将电化学与化学发光相结合的技术,是化学发光的一门分支学科。20世纪20年代末,Dufford等[1]和Harvey[2]发现电解某些物质可产生发光现象,自此敲开了电化学发光技术的大门。在此后的30年,由于科技水平低下,电化学发光技术并未取得突飞猛进的发展。直至60年代以后,随着电子技术及集成电路的迅速发展,科学家们成功研制了高灵敏度的传感器和高性能的脉冲信号发生器等仪器。这些仪器装置的出现大大促进了电化学发光技术的发展,电化学发光的应用领域也随之拓宽到药物分析、免疫分析和生物物质的活性分析等方面。电化学发光技术具有仪器较简单、快速、灵敏度高、线性范围宽等优点。但单一的ECL用于检测含有复杂基质的样品时,对目标分析物的选择性较差,需对样品进行预处理,耗费了大量的时间成本。分子印迹聚合物是一种对目标分子具有特异性识别的物质,具有制备简单、兼容性及稳定性好、选择性高等特点[3]。将分子印迹聚合物与高灵敏度的电化学发光传感器相结合,可弥补分子印迹聚合物缺乏信号传导,以及电化学发光技术对目标分析物选择性较差的不足,所制备的分子印迹-电化学发光传感器[4-6]兼具分子印迹技术的特异选择性及电化学发光传感器的高灵敏度等优点,已成为传感、分离等领域的研究热点。当前国内外对分子印迹-电化学发光的研究状况可概括如下:①改进修饰电极以增强发光强度[7-8](纳米、量子点等增敏材料的使用);②寻找固定发光试剂的新方法及新的发光试剂[9-10];③改进分子印迹膜性能[11-12](功能单体、交联剂、洗脱剂等选择);④寻找更广阔的应用范围(如生物免疫[13])。本文主要论述了分子印迹-电化学发光传感器的研究进展。
1 分子印迹技术及电化学发光
1.1分子印迹技术
分子印迹技术(Molecularly imprinted technology,MIT) 又称分子烙印技术,其模板分子与功能单体接触时通过共价键、非共价键(氢键、范德华力等)相互作用而产生结合位点,这些位点具有选择性识别的作用[14]。分子印迹聚合物(MIP)的合成步骤通常为:首先模板分子与功能单体通过可逆的共价键或非共价键结合方式形成复合物,加入交联剂进行共聚形成聚合物,使功能单体上的功能基在空间定向和空间排列上固定;再用化学或物理方法洗去模板分子,得到具有一定形状和大小的孔穴以及准确空间排列的功能基团的MIP[15](如图1所示)。
因分子印迹与功能单体之间作用力的不同可将分子印迹分为4类:①预组装法(共价键作用);②自组装法(非共价键);③共价键与非共价键作用杂化;④金属螯合作用。由于MIP具有构效预定性、特异识别性和选择性,稳定性高,可在酸、碱、有机溶剂、高温、高压等苛刻环境中使用,且造价低,因此被广泛应用于农残检测[16-20]、临床药物分析[21-23]、 痕量金属元素分析[24-25]、 固相萃取[26-28]和色谱分离[29]等研究领域。本实验室近年来着重研究了分子印迹在食品安全与药物分析方面的应用,并以广西特有松香改良的马来松香丙烯酸乙二醇酯(EGMRA)为改性交联剂,取得了一些研究成果[16-19]。刘力等[21]在玻碳电极表面,以EGMRA为交联剂,奎宁为模板分子,甲基丙烯酸为功能单体,用自由基聚合方法制得高选择性和高灵敏度的分子印迹膜,测得奎宁检出限为2.0×10-8mol/L,线性范围为8.0×10-7~2.6×10-4mol/L。谭学才等[16]运用金纳米掺杂石墨烯(rGO@Au)对电极进行修饰,以克百威为模板分子,甲基丙烯酸为功能单体制得克百威分子印迹传感器,将其应用于蔬菜中克百威的检测,其线性范围为5.0×10-8~ 2.0×10-5mol/L,检出限为2.0×10-8mol/L,回收率为97.7%~110.6%,相对标准偏差≤4.6%,优于其他检测方法。谭学才等[18]又以EGMRA为交联剂,用石墨烯对电极进行修饰后,在电极表面覆盖分子印迹膜,将其应用于辛硫磷农药残留检测,并与其他传感器方法进行对比(表1),结果发现该方法的线性范围较宽,灵敏度较高。

表1 辛硫磷的检测方法对比
随着各类科学技术的进步,分子印迹技术仍在不断提高并在各领域得到了更加广泛的应用。但仍存在电流效率和检测灵敏度较低等诸多问题,尚需进一步解决。
1.2电化学发光分析法
电化学发光(ECL)分析法是指将一定的电压施加在电极上,使电极表面产生一些电生物质,这些电生物质之间或产物与体系中的某种组分发生电子传递,产生激发态物质,激发态物质回到基态时产生发光,捕捉并记录发光强度,进而实现对物质进行定量分析的一种方法[32]。ECL可以避免化学发光体系试剂不稳定的问题,其中包括一些重要的体系(如联吡啶钌-ECL和鲁米诺-ECL)。国内外均有较多综述文献[33-35]对电化学发光分析的研究状况进行概述。ECL的反应机理主要有以下两种方式:
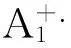
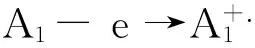



红荧烯(RUB)体系是湮灭电化学发光的典型体系,其机理如下:
RUB-e →RUB+.(红荧烯在阳极氧化)
RUB+e →RUB-.(红荧烯在阴极还原)
RUB+.+RUB-.→RUB*+RUB(发生湮灭反应生成激发态)
RUB*→RUB+hν(回到基态)
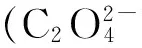

TPrA-e→TPrA+.→TPrA.+H+(还原)


随着纳米增敏材料在电极修饰方面的应用,电化学发光的灵敏度也在不断提高,其应用更加广泛,但其在选择性、发光试剂的固定、新型发光剂的合成等方面有待进一步发展。近几年,本实验室针对电化学发光在药物分析方面进行了研究。李焘等[37]在盐酸氯丙嗪对联吡啶钌电化学发光的增敏作用基础之上,以石墨烯/Nafion 复合膜修饰的玻碳电极为工作电极,建立了一种直接测定盐酸氯丙嗪的电化学发光新方法,其线性范围为8.0×10-5~1.2×10-4mol/L(r=0.998 8),检出限(S/N=3)为4.0×10-7mol/L。李晓宇等[9]用二氧化硅包裹三联吡啶钌将发光剂进行固定,用来检测咖啡因,取得了较宽的检测范围(5.0×10-9~2.0×10-5mol·L-1)和较低的检出限(1.3×10-9mol·L-1)。在此基础上作者进一步构建了3D石墨烯/CdSeTe/SiO2@Ru的传感器[38],并用于叶酸的检测,检出限为3.6×10-12mol/L,线性范围为1.0×10-11~1.0×10-6mol/L,用于实际叶酸药片检测的回收率为95.0% ~97.5%。
2 分子印迹-电化学发光(MIP-ECL)传感器的构建
近年来,随着生命科学、生物化工、合成药物等的迅猛发展,分析化学也在高速发展。目前分析的关键问题为对复杂体系中痕量成分的分离和检测,而样品前处理在分析过程中至关重要,直接关系到分析结果的精密度和准确度。MIP中含有与模板分子空间构型和功能基团相匹配的空穴,因此表现出对模板分子高度的识别性能。 将此技术运用到电化学发光分析中,利用分子印迹聚合物对目标分子的选择性识别和捕获能力,将目标分子分离并吸附在分子印迹聚合物上,之后进行电化学发光检测[39]。通过将分子印迹与电化学发光互补的优点相结合,建立了一种新型的分子印迹-电化学发光技术,解决了分子印迹技术灵敏度较低和电化学发光分析选择性差的固有缺点。表2为分子印迹-电化学发光与其他方法测定异烟肼的对比,可以看出,分子印迹-电化学发光具有线性范围较宽、检出限较低等优势。在 MIP-ECL制备及应用的过程中,分子印迹电化学传感器的构建至关重要,它直接影响到样品检测的准确度、稳定性等性能。
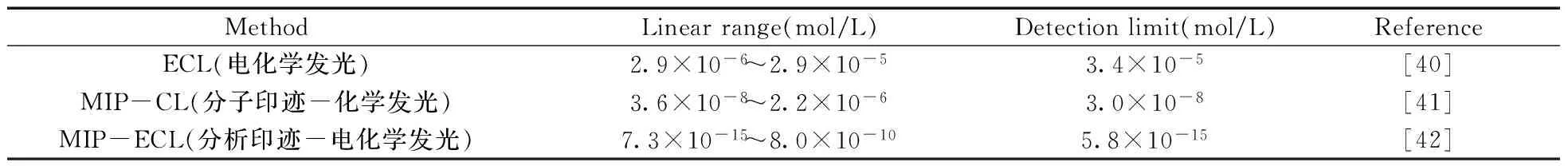
表2 分子印迹-电化学发光与其他方法测定异烟肼的对比
根据样品检测中的操作步骤不同,将分子印迹-电化学发光传感器的构建分为两种:一种是先将MIP 作为固相萃取的吸附剂对样品进行除杂、净化等处理(步骤如图2),再将处理好的样品用电化学发光传感器进行检测。另一种是分子印迹聚合膜涂在传感器的表面,将分析物的固相萃取与电化学发光检测合二为一,只需一步即可完成对目标物的分析。
根据发光体系的形态不同,还可将分子印迹-电化学发光传感器构建分为:①如果发光体系为液相,首先在电极表面以目标物为模板制备分子印迹膜,制备该膜需选择合适的体系(传统体系、自组装体系、MIP粒子镶嵌体系、电聚合体系和溶胶-凝胶体系)以及交联剂,洗脱剂及时间选择、支持电解质及其浓度选择、底液pH值的选择均十分重要;然后将制得的分子印迹传感器置于发光剂溶液中用电化学发光技术对目标物进行检测。②如果发光体系为固相,需在电极表面将发光剂固定(固定方法有LB膜法、分子自组装法、Nafion膜法、溶胶-凝胶法、电极表面固定三联吡啶钌、其它方法等),然后对该电极进一步修饰,将以目标分子为模板制得的分子印迹膜修饰在电极表面。
3 分子印迹-电化学发光(MIP-ECL)技术的应用
近年来,分子印迹及生物传感器技术的研究成果越来越成熟,促进了MIP-ECL传感器的蓬勃发展,其应用领域也拓宽到检测痕量农药[43-49]、药物[50-57]、赤霉素A3[58]、免疫[59]、氨基酸[60]和无机金属离子[61]、赭曲霉毒A[62]等领域。表3为MIP-ECL在食品安全与药物分析中的部分应用。
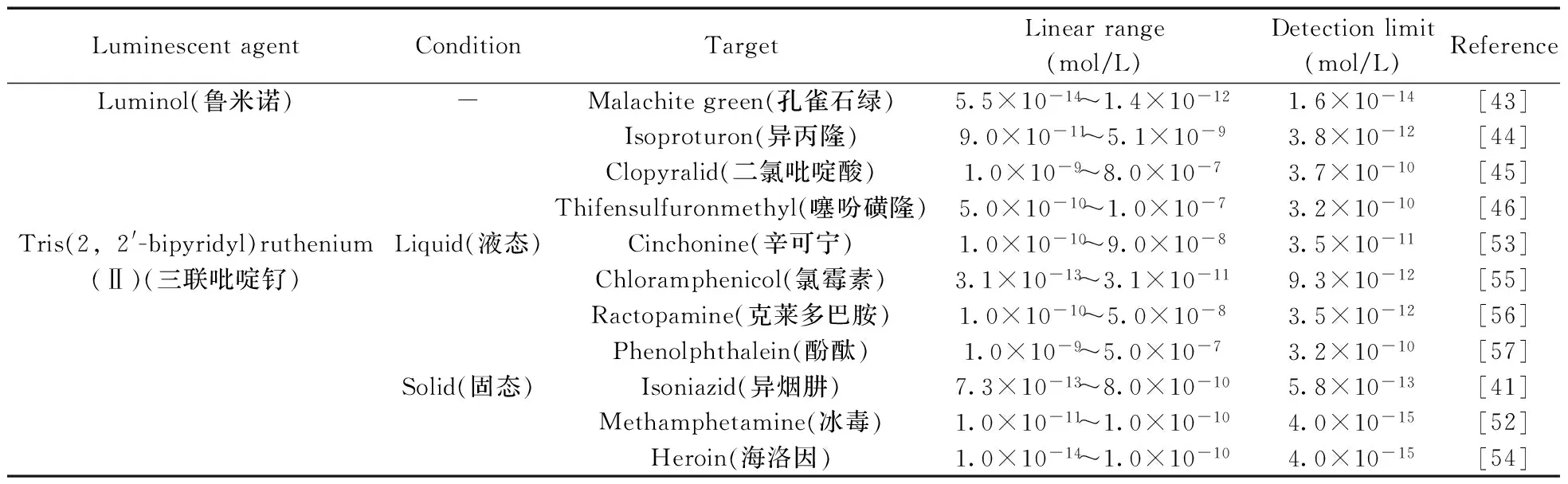
表3 分子印迹-电化学发光传感器的应用
3.1食品安全检测中的应用
食品安全一直是大众及媒体关注的热点,也是食品科学研究的重点,食品安全与人类健康息息相关,同时农药残留以及非法添加工业色素又是食品安全检测的重中之重。因此,建立快速有效的检测食品中残留农药、色素等的方法已成为研究热点。目前较多采用鲁米诺(Luminol) 与H2O2在碱性介质中进行电化学发光反应,以实现食品中农药、色素的检测。
Guo等[43]利用抑制电化学发光法结合分子印迹固相萃取技术定量测定了鱼体内的孔雀石绿(MG),在最佳实验条件下,ECL猝灭强度与MG浓度的对数在5.5×10-14~1.4×10-12mol/L范围内呈良好的线性关系,检出限为1.6×10-14mol/L。该方法以MIPs作为固相萃取材料,而MISPE又可有效地选择和萃取鱼体内的MG。通过与2,3-二氯-5,6-氰基-1,4-苯醌的氧化反应,将无色孔雀石绿(LMG)转换为MG,此方法可成功检测到鱼体内的MG残留量,同时为MG对鲁米诺的猝灭作用提供了理论支持。
Li等[44]为检测异丙隆(IPU)构建了新型MIP-ECL传感器。该传感器基于IPU与葡萄糖氧化酶示踪的IPU(GOD-IPU)之间的竞争反应。竞争反应完成后,残余的GOD-IPU生成H2O2,在MIP表面与鲁米诺反应产生发光信号。当样品中GOD-IPU被IPU替代时,ECL发光强度将会减小。该方法对IPU的检测范围为9.0×10-10~5.1×10-9mol/L,检出限为3.78×10-12mol/L,检测水样时的回收率为98.5%~102.1%,可有效应用于水样中异丙隆的检测。
Li等[45]在MIP基础上构建了新型示踪分析法,基于ECL的“门控”系统测定模板分子二氯吡啶酸,在玻碳电极表面通过电聚合完成MIP-ECL的构建。模板的洗脱和再结合过程如同门的开关,该门的开关控制着通过孔腔及电极表面反应的物质的量。ECL在鲁米诺-H2O2体系中完成,二氯吡啶酸的浓度范围为1.0×10-9~8.0×10-7mol/L,检出限为3.7×10-10mol/L,用该传感器检测蔬菜中的二氯吡啶酸,回收率为97.9%~102.9%。
Li等[46]报道了选择性识别噻吩磺隆的核壳印迹纳米-电化学发光方法。核壳印迹纳米颗粒是以噻吩磺隆(IFM)为模板分子,由甲基丙烯酰氧基丙基三甲氧基硅烷修饰的二氧化硅纳米粒子在电极表面聚合而成,ECL传感器则是由核壳印迹纳米颗粒/壳聚糖复合材料在玻碳电极表面电沉积制得,最后将二氧化硅从复合材料中洗去,研究传感器存在IFM模板分子的印迹膜、不存在IFM模板分子的非印迹膜时的电化学和鲁米诺的电化学发光行为。结果表明,该传感器具有灵敏度高、检测速度快、特异性识别和稳定性好等优势,对IFM的检测浓度范围为5.0×10-10~1.0×10-7mol/L,检出限为3.2×10-10mol/L,可作为磺酰脲类除草剂有效的检测方法。
3.2药物分析中的应用

3.2.1液态型发光体系液态型发光体系是指将发光试剂溶于溶剂中进行检测,该方法操作简单,但发光试剂用量较多。辛可宁和辛可尼丁为非对映异构体抗疟药物,对辛可宁的选择性识别及有效分离对于药物分析十分重要[50]。魏小平等[53]将辛可宁作为模板分子、十二烷基硫醇作为功能单体,在Fe3O4@Au纳米粒子表面进行自组装得到辛可宁分子印迹膜,制得了新型磁性粒子-分子印迹电化学发光传感器。最佳条件下,辛可宁的线性范围为1.0×10-10~9.0×10-8mol/L,检出限为3.5×10-11mol/L。随后将其用于血清样品的检测,回收率为98.8%~104.7%。

Wang等[56]通过三联吡啶钌-二丁基乙醇胺体系的ECL在玻碳电极上的猝灭检测RAC,基于ECL信号变化,同时分子印迹聚合物被合成搅拌棒吸附萃取的涂层,建立了猪肉中RAC的检测方法。该方法的线性范围为1.0×10-10~5.0×10-8mol/L,检出限为3.5×10-12mol/L,用于实际样品的检测,回收率为99.7%~115.0%,RSD 小于5%。
Guo等[57]将ECL的抑制法结合MISPE用于测定新型研发药物、减肥食品以及人血浆中酚酞的含量。结果显示,酚酞可强烈抑制三联吡啶钌-二丁基乙醇胺体系的ECL信号,采用MIP合成固相萃取吸附剂,MISPE用于酚酞的选择性提取和纯化,在优化条件下,ECL猝灭强度与酚酞浓度在1.0×10-9~5.0×10-7mol/L范围呈线性关系,检出限为3.2×10-10mol/L。
Wu 等[42]在三联吡啶钌-金纳米修饰的多壁碳纳米管复合材料和分子印迹聚合物的基础之上,构建了选择性识别检测异烟肼的MIP-ECL传感器。MIP以异烟肼为模板分子,通过丙烯酰胺和N,N′-亚甲基双丙烯酰胺电聚合制备。在最优实验条件下,异烟肼的浓度范围为7.3×10-13~8.0×10-10mol/L,检出限为5.8×10-13mol/L,RSD为3.8%。结果表明,该传感器可成功应用于人类尿液和药物样品中异烟肼的检测。该方法采用具有增敏作用的电沉积金纳米修饰电极,方法的检出限较低,线性范围较宽。


3.3生物分析中的应用
Li等[58]将分子印迹-电化学发光用于赤霉素A3(GA3)的检测,该传感器基于GA3和罗丹明B标记的GA3(RhB-GA3)竞争性结合分子印迹膜。经过竞争结合后,在MIP上残留的RhB-GA3进行电氧化,产生氧化罗丹明B,显著增强了鲁米诺较弱的ECL信号,但当GA3替换掉RhB-GA3后,ECL信号减弱。该传感器的灵敏度高、选择性好、响应范围宽、精度好、响应速度快,用于GA3的检测,其线性范围为1.00× 10-11~3.00× 10-9mol/L,检出限为3.45 × 10-12mol/L。
Zhou等[59]运用“三明治”电化学发光免疫法结合磁性分子印迹聚合物(MIP)的捕获探针结合面和表位印迹技术,建立了人类免疫缺陷病毒1型抗体(抗HIV-1)检测的新方法。该方法以抗原缀合辣根过氧化物酶(HRP HIV-1)为标记物,3-氨基苯硼酸(APBA)为功能单体和交联剂,将人免疫球蛋白G(HIgG)涂覆于聚合硅酸盐的磁性氧化铁纳米颗粒(Fe3O4@SiO2)的表面,用1%十二烷基硫酸钠(SDS)洗脱掉HIgG制得亲水分子印迹聚合物(MIP)膜,之后再吸附HIV-1抗原和辣根过氧化物酶(HRP HIV-1)为标记物的抗原,制得传感器。该研究可为HIV感染患者的早期诊断提供一个低成本、简单和灵敏的方法。
4 展 望
近年来,分子印迹电化学发光方法得到了较快发展,但因其起步较晚,故研究报道相对较少,尚有大量工作需开展。目前发展趋势主要有:①适配体的高速发展促进其更多地应用于生物传感器;②寻找新的共反应剂,以扩大其应用领域及提高灵敏度;③仪器微型化,使仪器朝着手提式发展,如生物医学的医疗点设备和用于环境调查研究的野外仪器;④ECL发光剂的发展使多参数分析、单分子检测成为可能;⑤ECL成像仪器及发光二极管等的进一步发展使灵敏度等进一步提高;⑥MIP交联剂、洗脱剂、增敏材料的合成与发展,体现了MIP还有较大的发展空间;⑦MIP-ECL在更多新领域得到应用,其独特的优势以及相关通用仪器的商业化和需求量的增大,使之在生物免疫、临床诊断、生化防御、药物筛选、食品安全、环境监控等领域有了更广泛的应用。随着科技的进步和研究的深入,MIP-ECL广泛的应用及相关领域的发展将会促进其进入一个动态发展的研究领域[63-66]。
[1]Dufford R T,Nightingale D,Gaddum L W.J.Am.Chem.Soc.,1927,49(8):1858-1864.
[2]Harvey N.J.Phys.Chem.,1929,33(10):1456-1459.
[3]Yu H C,Huang X Y,Tan X C,Lei F H,Mao H J.J.Instrum.Anal.(余会成,黄学艺,谭学才,雷福厚,毛慧娟.分析测试学报),2014,33(7):752-757.
[4]Jiang X,Ding W,Luan C.Can.J.Chem.,2013,91(8):656-661.
[5]Zhou J,Gan N,Hu F T,Li T H,Zhou H K,Li X,Zheng L.Sens.ActuatorsB,2013,186:300-307.
[6]Chen S H,Li A M,Zhang L Z,Gong J M.Anal.Chim.Acta,2015,896:68-77.
[7]Hu Q,Tan X C,Wu J W,Li X Y,Yu H C,Lei F H,Huang Z Y.Chin.J.Anal.Lab.(胡琪,谭学才,吴佳雯,李晓宇,于会成,雷福厚,黄在银.分析试验室),2015,34(3):294-254.
[8]Della C L,Zanarini S,Perciaccante R,Marzocchi E,Valenti G J.Phys.Chem.C,2010,114(8):3653-3658.[9]Li X Y,Tan X C,Yan J,Hu Q,Wu J W,Zhang H,Chen X.Chin.J.Anal.Lab.(李晓宇,谭学才,严军,胡琪,吴佳雯,张慧,陈晓.分析试验室),2015,30(10):1127-1131.
[10]Wang Y F,Song J,Guan J N,Li X,Zhong H.Mater.Rev.(王宇峰,宋娟,关建宁,李鑫,仲慧.材料导报),2011,25(5):51-54.
[11]Wang L,Tan X C,Gong Q,Liu L,Zhao D D,Lei F H,Huang Z Y.Chin.J.Anal.Lab.(王琳,谭学才,龚琦,刘力,赵丹丹,雷福厚,黄在银.分析试验室),2012,31(6):16-19.
[12]Sun X L,Zhang L J,Zhang H X,Qian H,Zhang Y Z,Tang L L,Li Z J.J.Agric.FoodChem.,2014,62(20):4552-4557.
[13]Feng X B,Gan N,Zhou J,Li T H,Cao Y T,Hu F T,Yu H W,Jiang Q L.Electrochim.Acta,2014,139:127-136.
[14]Tan T W.MolecularImprintingTechnologyandApplication.2nd ed.Beijing:Chemical Industry Press(谭天伟.分子印迹技术及应用.2版.北京:化学工业出版社),2010.
[15]Chen Z Q,Li J P,Zhang X H,Jiang F Y.J.Instrum.Anal.(陈志强,李建平,张学洪,蒋复阳.分析测试学报),2010,29(1):97-104.
[16]Tan X C,Hu Q,Wu J W,Li X Y,Li P F,Yu H C,Li X Y,Lei F H.Sens.ActuatorsB,2015,220:216-221.
[17]Tan X C,Wu J W,Hu Q,Li X Y,Li P F,Yu H C,Li X Y,Lei F H.Chin.J.Anal.Chem.(谭学才,吴佳雯,胡琪,李晓宇,李鹏飞,于会成,李晓燕,雷福厚.分析化学),2015,43(3):387-393.
[18]Tan X C,Wu J,Hu Q,Li X Y,Li P F,Yu H C,Li X Y,Lei F H.Anal.Methods,2015,7(11):4786-4792.
[19]Hu Q,Tan X C,Wu J W,Li X Y,Li P F,Yu H C,Li X Y,Lei F H.J.Instrum.Anal.(胡琪,谭学才,吴佳雯,李晓宇,李鹏飞,于会成,李晓燕,雷福厚.分析测试学报),2015,34(3):328-334.
[20]Du X W,She Y X,Li T F,Zhang Y X,Liu G Y,Wang J,Wang S S,Jin F,Jin M J,Shao H,Zheng L F,Cao W Q.J.Instrum.Anal.(杜欣蔚,佘永新,李腾飞,张艳欣,刘广洋,王静,王珊珊,金芬,金茂俊,邵华,郑鹭飞,曹维强.分析测试学报),2015,34(7):755-761.
[21]Liu L,Tan X,Fang X,Sun Y,Lei F,Huang Z.Electroanalysis,2012,24(7):1647-1654.
[22]Kupai J,Huszthy P,Szekely G.ACSAppl.Mater.Interfaces,2015,7(18):9516-9525.
[23]Zhou X,Wang A,Yu C,Wu S,Shen J.ACSAppl.Mater.Interfaces,2015,7(22):11741-11747.
[24]Muratsugu S,Tada M.AccountsChem.Res.,2012,46(2):300-311.
[25]Taguchi Y,Takano E,Takeuchi T.Langmuir,2012,28(17):7083-7088.
[26]Liu S T,Yan H Y,Wang M Y,Wang L H.J.Agric.FoodChem.,2013,61(49):11974-11980.
[27]Yang Y J,Yu J L,Yin J,Shao B,Zhang J.J.Agric.FoodChem.,2014,62(46):11130-11137.
[28]Yan H Y,Cheng X L,Yang G L.J.Agric.FoodChem.,2012,60(22):5524-5531.
[29]Cheong W J,Yang S H,Ali F.J.Sep.Sci.,2013,36(3):609-628.
[30]Yang Y H,Guo M M,Yang M H,Wang Z J,Shan G L,Yu R Q.Int.J.Environ.Anal.Chem.,2005,85(3):163-175.
[31]Lu X X,Bai H P,Ruan Q,Yang M H,Yang G M,Tan L,Yang Y H.Int.J.Environ.Anal.Chem.,2008,88(11):813-824.[32]Li Y,Zhang C X.NorthwestPharm.J.(李延,张成孝.西北药学杂志),2006,21(1):45-47.
[33]Li H J,Han S,Hu L Z,Xu B G.Chin.J.Anal.Chem.(李海娟,韩双,胡连哲,徐宝国.分析化学),2009,37(11):1557-1565.
[34]Hu L Z,Xu G B.Chem.Soc.Rev.,2010,39(8):3275-3304.
[35]Li S P,Guan H M,Xu G B,Tong Y J.Chin.J.Anal.Chem.,2015,43(2):294-299.
[36]Kalyuzhny G,Buda M,McNeill J,Barbara P,Bard A J.J.Am.Chem.Soc.,2003,125(20):6272-6283.
[37]Li T,Tan X C,Hu Q,Wu J W,Fang X X,Liu S G,Yu H C,Huang Z Y.J.Instrum.Anal.(李焘,谭学才,胡琪,吴佳雯,方晓雪,刘绍刚,余会成,黄在银.分析测试学报),2014,33(2):212-216.
[38]Li X Y,Tan X C,Yan J W,Hu Q,Wu J W,Zhang H,Chen X.J.Electrochim.Acta,2016,(187):433-441.
[39]Zhang H G,Lü J R,He Y H,Du J X.ActaChim.Sin.(张红鸽,吕九如,何云华,杜建修.化学学报),2005,63(3):210-214.
[40]Guo Y,Zhang Z X,Zheng X W.Chin.J.Spectrosc.Lab.(郭颖,张知侠,郑行望.光谱实验室),2011,28(1):247-250.
[41]Chen X H,Du J X.ActaChim.Sin.(陈晓惠,杜建修.化学学报),2010,69(6):745-751.
[42]Wu B W,Wang Z H,Xue Z H,Zhou X B,Du J H,Liu X H,Lu X Q.Analyst,2012,137(16):3644-3652.
[43]Guo Z Y,Gai P P,Hao T T,Duan J,Wang S.J.Agric.FoodChem.,2011,59(10):5257-5262.
[44]Li S H,Tao H L,Li J P.Electroanalysis,2012,24(7):1664-1670.
[45]Li X,Li J P,Yin W L,Zhang L M.J.SolidStateElectrochem.,2014,18(7):1815-1822.
[46]Li H F,Xie C G,Fu X C.Sens.ActuatorsB,2013,181:858-866.
[47]Li Y Q,Luo Y,Yang L L,Cheng H,Huang W Y,Li L J.J.Instrum.Anal.(李彦青,罗应,杨兰兰,程昊,黄文艺,李利军.分析测试学报),2015,34(2):210-215.
[48]Zhang L M,Wei X P,Wei Y X,Li J P,Zeng Y.Chin.J.Anal.Chem.(张连明,魏小平,韦衍溪,李建平,曾英.分析化学),2014,42(11):1580-1585.
[49]Yu J C C,Lai E P C.ACSSymposiumSeries.Oxford University Press,2009,1031:277-292.
[50]Liu B F.GuangzhouChem.Ind.(刘邦夫.广州化工),2012,40(16):76-78.
[51]Chen W C,Unnikrishnan B,Chen S M.Int.J.Electrochem.Sci.,2012,7:9138-9149.
[52]Han C,Shang Z,Zhang H,Song Q J.Anal.Methods,2013,5(21):6064-6070.
[53]Wei X P,Tan Y J,Li J P.Chin.J.Anal.Chem.(魏小平,谭艳季,李建平.分析化学),2015,43(3):424-428.[54]Shang Z Y,Han C F,Song Q J.Chin.J.Anal.Chem.(商哲一,韩超峰,宋启军.分析化学),2014,42(6):904-908.
[55]Hao T T,Xie W T,Li Q F,Guo Z Y.Chin.J.Anal.Lab.(郝婷婷,谢文婷,李琴芬,郭智勇.分析试验室),2012,2:29.
[56]Wang S,Wei J,Hao T T,Guo Z Y.J.Electroanal.Chem.,2012,664:146-151.
[57]Guo Z Y,Hao T T,Shi L L,Gai P P,Duan J,Wang S,Gan N.FoodChem.,2012,132(2):1092-1097.
[58]Li J,Li S,Wei X,Tao H L,Pan H C.Anal.Chem.,2012,84(22):9951-9955.
[59]Zhou J,Gan N,Li T,Hu F T,Wang L H,Lei Z.Biosens.Bioelectron.,2014,54:199-206.
[60]Ding Z Y,Li C Y,Song Q J.Chin.J.Anal.Chem.(丁照云,李春阳,宋启军.分析化学),2015,41(10):1543-1548.[61]Li J,Ma F,Wei X,Fu C,Pan H C.Anal.Chim.Acta,2015,871:51-56.
[62]Wang Q,Chen M,Zhang H,Wen W,Zhang X H,Wang S F.Sens.ActuatorsB,2016,222:264-269.
[63]Hu L Z,Xu G B.Chem.Soc.Rev.,2010,39(8):3275-3304.
[64]Shen X T,Xu C G,Ye L.Ind.Eng.Chem.Res.,2012,52(39):13890-13899.
[65]Lofgreen J E,Ozin G A.Chem.Soc.Rev.,2014,43(3):911-933.
[66]Wang L,Kang T F,Zhang J J,Lu L P,Cheng S Y.J.Instrum.Anal.(王玲,康天放,张晶晶,鲁理平,程水源.分析测试学报),2015,34(5):552-557.
Recent Advances in Molecular Imprinting-Electrochemiluminescence Technology
ZHANG Hui,TAN Xue-cai*,YAN Jun,LIU Min,LI Xiao-yu,CHEN Xiao
(School of Chemistry and Chemical Engineering,Guangxi University for Nationalities,Key Laboratory of Guangxi Colleges and Universities for Food Safety and Pharmaceutical Analytical Chemistry,Guangxi Key Laboratory of Chemistry and Engineering of Forest Products,Nanning530008,China)
Molecularly imprinted electrochemiluminescence sensors combine the specific recognition ability and predetermined selectivity properties of molecularly imprinted polymer with the high sensitivity of electrochemiluminescence technology.In addition,these sensors exhibited a high maneuverability for luminescence signal from the reactions with good reproducibility,long-term stability and easy operation,which have received a great deal of attention in applications of pharmaceutical analysis,heavy metal ion detection,immune biosensors,gene biosensos,enzymatic biosensors,toxic pesticide residue detection and food safety monitoring.The preparation mechanism and construction thinking of the sensors are summaried in this review.Moreover,the applications on food safety and drugs detection of molecular imprinted polymer electrochemiluminescence sensors are highlighted,and the development trend of molecular imprinted polymer electrochemiluminescence sensors is revealed.
molecular imprinting;electrochemiluminescence;food safety and drug analysis;review
2015-10-24;
2015-12-17
国家自然科学基金项目(21365004,21065001);广西自然科学基金重点项目(2013GXNSFDA019006);广西教育厅科研基金重点项目(2013ZD019);广西高等学校高水平创新团队及卓越学者资助计划(桂教人[2014]7号);广西民族大学研究生创新基金项目(GXUN-chx2014096)
谭学才,博士,教授,研究方向:电分析化学,Tel:0771-3260558,E-mail:gxunxctan@126.com
doi:10.3969/j.issn.1004-4957.2016.06.026
O657.1;F767.2
A
1004-4957(2016)06-0769-08
综述
