低聚苯酰胺蛋白质α-螺旋模拟物的合成
2016-08-25周孝湖赵斯祺林雨霖
任 扬,周孝湖,赵斯祺,林雨霖,汪 翔,徐 海
(中南大学化学化工学院,湖南 长沙 410083)
低聚苯酰胺蛋白质α-螺旋模拟物的合成
任扬,周孝湖,赵斯祺,林雨霖,汪翔,徐海
(中南大学化学化工学院,湖南长沙410083)
非肽小分子α-螺旋模拟物的设计与合成是蛋白质相互作用抑制剂研发的一个重要方向。该方法通过设计、合成有机小分子化合物来模拟蛋白质相互作用界面热点区域(hot-spot)的α-螺旋结构。利用模拟物与相应蛋白质结合,从而阻断特定蛋白质-蛋白质之间的相互作用,最终达到治疗相应疾病的目的。本文以低聚苯酰胺为骨架,设计、合成了以阿司匹林为母体的蛋白质α-螺旋模拟物。
低聚苯酰胺;α-螺旋;模拟物;阿司匹林
蛋白质是生物体的重要组成部分,参与了绝大多数的生命活动和细胞进程。蛋白质-蛋白质相互作用(PPIs)对正常细胞功能的发挥起着至关重要的作用,调节着多种多样的细胞过程,如细胞生长、信号传导、细胞凋亡等[1-4]。因此,很多疾病,如癌症、艾滋病、帕金森综合症等都和特定蛋白质-蛋白质之间的相互作用有着密不可分的关系[5-6]。目前,蛋白质-蛋白质相互作用已日益成为一系列疾病的重要靶标。靶向蛋白质-蛋白质相互作用抑制剂的开发已经成为相关药物研发的一个重要方向[7-8]。Clackson等[9]通过对蛋白质相互作用进行详细的热力学分析和突变研究发现,虽然蛋白质相互作用界面面积较大,但是在蛋白质相互作用界面处的少数氨基酸残基对蛋白质的结合起到了至关重要的作用。这些关键位置的氨基酸残基贡献了大部分的结合自由能。这些位置被称之为蛋白质相互作用的“热点区域”(hot-spot)[10-12]。
本文设计合成了以阿司匹林为母体低聚苯酰胺为骨架的非肽小分子α-螺旋模拟物来模拟蛋白质的“热点区域”。阿司匹林,又名乙酰水杨酸,是一种水杨酸药物,它是世界上使用最广泛的药物之一,最初是由化学家霍夫曼合成的,德国拜耳公司在1899年正式生产该药物[13],并随着医学科学的发展以及对阿斯匹林药理学作用的机理认识的进一步加深,阿司匹林在临床上应用越来越广泛[14]。水杨酸的羟基处于羧基的2号位,如果将其羟基取代,便可制备大量带不同侧链的中间体并可广泛运用于三聚酰胺骨架的α-螺旋模拟物,使这些结构类似水杨酸的中间体不仅可发挥与阿司匹林类似的作用还可以模拟蛋白质的相关性质。
1 α-螺旋模拟物的合成
1.1化合物1的合成
在反应瓶中加入4-硝基-2-羟基苯甲酸甲酯(1 g,5.07 mmol),无水碳酸钾(0.7 g,5.07 mmol),DMF(100 mL),正溴丁烷(1.03 g,7.6 mmol)90 ℃下氮气保护反应12 h。反应完毕后,抽滤。向滤液中加入150 mL乙酸乙酯。将混合液用水洗(3×200 mL),分出乙酸乙酯层,用无水硫酸钠干燥。减压蒸出溶剂。粗产物以石油醚/二氯甲烷=3:1的洗脱剂进行柱层析。得目标产物,黄色油状液体(0.83 g),产率为65%。1H NMR (400 MHz, CDCl3) δ 7.88 (d,J=8.2 Hz, 1H), 7.84~7.78 (m, 2H), 4.14 (t,J=6.4 Hz, 2H), 3.93 (s, 3H), 1.90~1.83 (m, 2H), 1.55 (dd,J=15.0, 7.5 Hz, 2H), 1.00 (t,J=7.4 Hz, 3H)。 HRMS: calcd. for C12H15NNaO5276.0848 [M+Na]+; found 276.0738。
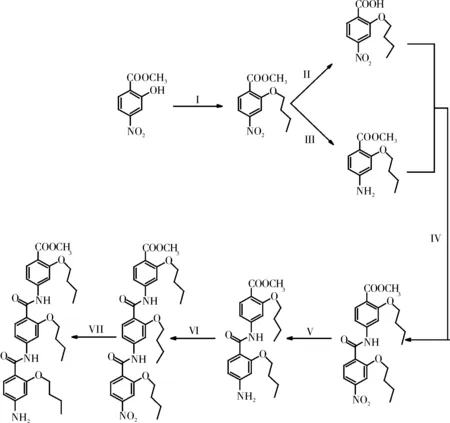
图1 苯环2-取代α-螺旋模拟物的合成
1.2化合物2的合成
将化合物1(1 g,3.95mmol)溶于120 mL四氢呋喃中,称取氢氧化锂(0.28 g,11.85 mmol)溶于120 mL水。将氢氧化锂水溶液倒入溶有化合物1的四氢呋喃溶液中,室温下搅拌反应5 h。反应完后,减压蒸出四氢呋喃。残余液用二氯甲烷洗(3×60 mL)。分出水层,滴加稀盐酸至pH=3。用二氯甲烷萃取至水溶液澄清。萃取液用无水硫酸钠干燥。减压蒸出溶剂得目标产物,浅黄色固体(0.86 g),产率为91%。
1H NMR (400 MHz, CDCl3) δ 10.89 (s, 1H), 8.33 (d,J=8.6 Hz, 1H), 7.95 (dd,J=8.6, 2.1 Hz, 1H), 7.91 (d,J=2.0 Hz, 1H), 4.36 (t,J=6.5 Hz, 2H), 1.97 (tt,J=13.0, 6.5 Hz, 2H), 1.63~1.52 (m, 2H), 1.04 (t,J=7.4 Hz, 3H)。 HRMS: calcd. for C11H13NNaO5262.0691[M+Na]+; found 262.0587。
1.3化合物3的合成
将化合物1(1 g,3.95 mmol)溶于150 mL四氢呋喃中,加入0.2 g 5%Pd/C,通入氢气,45 ℃下搅拌反应5 h。反应完后抽滤,减压抽出溶剂。得目的产物灰白色固体(0.86 g),产率为98%。
1H NMR (400 MHz, CDCl3) δ 7.72 (d,J=8.4 Hz, 1H), 6.28~6.14 (m, 2H), 4.24 (s, 2H), 3.94 (t,J=6.5 Hz, 2H), 3.81 (s, 3H), 1.85~1.73 (m, 2H), 1.58~1.45 (m, 2H), 0.96 (t,J=7.4 Hz, 3H)。 HRMS: calcd. for C12H17NNaO3246.1106 [M+Na]+; found 246.1040。
1.4化合物4的合成
取化合物2(1 g,4.18 mmol)溶于120 mL二氯甲烷中。加入2-氯-1-甲基吡啶鎓碘(CMPI,3.2 g,12.55 mmol),三乙胺(1.26 g,12.55 mmol)。50 ℃下氮气保护搅拌反应10 min。取化合物3 (0.93 g,4.18 mmol)溶于适量二氯甲烷中。将溶液注入反应瓶中,继续反应5 h。反应完成后减压蒸出二氯甲烷。剩余物以石油醚/二氯甲烷=1:1的洗脱剂进行柱层析。得目标产物浅黄色固体(1.26 g),产率为68%。
1H NMR (400 MHz, CDCl3) δ 10.08 (s, 1H), 8.54~8.38 (m, 1H), 8.03~7.94 (m, 1H), 7.90 (s, 1H), 7.89~7.80 (m, 2H), 6.85 (dd,J=8.4, 1.9 Hz, 1H), 4.36 (t,J=6.1 Hz, 2H), 4.12 (t,J=6.2 Hz, 2H), 3.90 (s, 3H), 2.12~2.00 (m, 2H), 1.92~1.82 (m, 2H), 1.67 (dt,J=15.2, 7.5 Hz, 2H), 1.57 (dt,J=14.7, 7.5 Hz, 2H), 1.09 (t,J=7.4 Hz, 3H), 1.02 (t,J=7.4 Hz, 3H)。13C NMR (101 MHz, CDCl3) δ 166.1, 161.4, 160.2, 156.8, 150.6, 142.6, 133.7, 132.8, 126.6, 116.2, 115.7, 110.6, 107.7, 104.7, 70.3, 68.7, 51.8, 31.2, 31.1, 19.3, 19.2, 13.8, 13.7。 HRMS: calcd. for C23H29N2O7445.1975 [M+H]+; found 445.1831。
1.5化合物5的合成
合成和分离方法与化合物3相同。得目标产物灰白色固体,产率为97%。
1H NMR (400 MHz, CDCl3) δ 10.11 (s, 1H), 8.11 (d,J=8.5 Hz, 1H), 7.89 (d,J=1.6 Hz, 1H), 7.83 (d,J=8.5 Hz, 1H), 6.79 (dd,J=8.5, 1.9 Hz, 1H), 6.51 (d,J=8.6 Hz, 1H), 6.37 (s, 1H), 4.16 (t,J=6.4 Hz, 2H), 4.11 (t,J=6.5 Hz, 2H), 3.89 (s, 3H), 2.02~1.92 (m, 2H), 1.90~1.81 (m, 2H), 1.66~1.51 (m, 4H), 1.08~1.03 (m, 3H), 1.03~0.95 (m, 3H)。13C NMR (101 MHz, CDCl3) δ 166.3, 163.7, 160.3, 158.5, 144.0, 134.1, 132.7, 114.3, 112.1, 110.3, 108.7, 104.3, 98.7, 69.0, 68.6, 51.6, 31.3, 31.2, 30.3, 19.4, 19.2, 13.8, 13.8. HRMS: calcd. for C23H31N2O5415.2233 [M+H]+; found 415.2143。
1.6化合物6的合成
合成方法与化合物4的合成方法相同。反应完后以石油醚/二氯甲烷=1:5进行柱层析。得目标产物浅黄色固体,产率为70%。
1H NMR (400 MHz, CDCl3) δ 10.22 (s, 1H), 10.16 (s, 1H), 8.47 (d,J=8.7 Hz, 1H), 8.28 (d,J=8.5 Hz, 1H), 8.15 (d,J=1.8 Hz, 1H), 7.99 (dd,J=8.7, 2.0 Hz, 1H), 7.91 (d,J=2.0 Hz, 1H), 7.88 (d,J=1.8 Hz, 1H), 7.84 (d,J=8.5 Hz, 1H), 6.83 (td,J=8.6, 1.9 Hz, 2H), 4.37 (t,J=6.5 Hz, 2H), 4.32 (t,J=6.5 Hz, 2H), 4.13 (t,J=6.5 Hz, 2H), 3.88 (s, 3H), 2.12~2.00 (m, 4H), 1.91-1.83 (m, 2H), 1.66 (dt,J=15.1, 7.6 Hz, 4H), 1.57 (dt,J=14.7, 7.4 Hz, 2H), 1.10 (dd,J=15.8, 7.5 Hz, 6H), 1.02 (t,J=7.4 Hz, 3H)。13C NMR (126 MHz, CDCl3) δ 166.2, 163.0, 161.5, 160.3, 157.9, 156.9, 150.7, 143.5, 142.7, 133.6, 133.0, 132.7, 126.4, 117.1, 116.2, 114.9, 112.0, 110.5, 107.8, 104.5, 104.1, 70.4, 69.4, 68.6, 51.6, 31.3, 31.2, 31.0, 19.4, 19.3, 19.2, 13.8, 13.8, 13.7。 HRMS: calcd. for C34H42N3O9636.2921[M+H]+; found 636.3737。
1.7化合物7的合成
合成和分离方法与化合物3相同。得目标产物灰白色固体,产率为98%。
1H NMR (400 MHz, CDCl3) δ 10.26 (s, 1H), 10.19 (s, 1H), 8.21 (t,J=8.0 Hz, 2H), 8.07 (d,J=8.5 Hz, 1H), 7.87 (s, 1H), 7.83 (d,J=8.5 Hz, 1H), 6.86~6.80 (m, 1H), 6.71 (d,J=8.6 Hz, 1H), 6.41 (d,J=8.5 Hz, 1H), 6.25 (s, 1H), 4.28 (t,J=6.4 Hz, 2H), 4.12 (dt,J=13.0, 6.4 Hz, 4H), 3.87 (s, 3H), 1.99 (dd,J=10.9, 8.0 Hz, 4H), 1.90~1.81 (m, 2H), 1.58 (ddd,J=20.5, 15.0, 7.5 Hz, 6H), 1.43 (s, 2H), 1.08~1.02 (m, 6H), 0.99 (t,J=7.4 Hz, 3H)。13C NMR (101 MHz, CDCl3) δ 166.3, 164.0, 163.4, 160.3, 158.6, 158.0, 144.1, 143.8, 134.1, 132.7, 132.7, 115.6, 114.5, 111.6, 110.5, 104.4, 103.7, 69.2, 69.0, 68.6, 51.6, 31.4, 31.3, 31.2, 30.3, 29.7, 19.4, 19.4, 19.2, 13.8, 13.8, 13.7。 HRMS: calcd. for C34H43N3NaO7628.2999 [M+Na]+; found 629.3015。
2 结果与讨论
在α-螺旋模拟物的合成过程中有几点需要特别注意的。首先是以乙酸叔丁酯为侧链的单体水解步骤中需要注意反应时间不能太长,否则侧链上的叔丁酯基也会水解掉,使得产率降低。同时,LiOH的量也不能加太多。一般使用3倍当量的LiOH溶于等体积的THF和水的混合溶剂中,室温下搅拌反应3~5 h即可。反应产率一般在30%左右。而其他侧链的单体进行水解时可适量多加些LiOH,其反应的产率一般可达80%。
其次,各种α-螺旋模拟物单体和二聚物上硝基还原为氨基的反应需要注意尽量选用大一些的容器。我们一般选用1000 mL或者500 mL的圆底烧瓶。因为大的容器可使反应液与氢气的接触面积更大,可缩短反应时间。同时,溶剂不用加太多。另外,在开反应时要用氢气将反应瓶中的空气置换掉,因为氢气的密度比空气小,如果不置换掉空气氢气就不能充分地与反应液面接触,从而会降低反应产率,延长反应时间。反应时还要使氢气具有一定的压力。我们在进行这步反应过程中还尝试了一些其他的方法,比如以SnCl2·2H2O为还原剂,乙酸乙酯为溶剂反应以及在Pd/C催化下用水合肼还原。其中,以SnCl2·2H2O为还原剂的反应后处理较为麻烦,且产物胺在乙酸乙酯中的溶解度很小,后处理过程中产物损失很大。用水合肼还原时有副产物产生,可能是水合肼与原料中的甲酯基反应生成酰肼。
酰胺缩合反应是α-螺旋模拟物合成的关键步骤。常用的酰胺缩合反应的缩合剂有DCC/DMAP,EDCI/HOBT,HATU,PyBOP等,同时也可以使用酰氯法。本章中我们通过对多种缩合剂进行比较最终选择了CMPI(向山试剂)作为缩合剂。向山试剂作为缩合剂反应条件温和,操作简单,价格便宜而且一般可以获得较高的反应产率。
3 结 论
在本文中,我们以向山试剂作为缩合剂,通过酰胺缩合反应合成了苯环2-位取代的蛋白质α-螺旋模拟物。三聚α-螺旋模拟物的苯环2-位上连接的取代基,可通过形成五元环的分子内氢键维持分子构象的相对稳定和使得取代基具有相对稳定的空间取向。我们对这些合成的α-螺旋模拟物进行了氢谱、碳谱以及质谱的表征,对合成过程中需要注意的问题进行了讨论,相信蛋白质α-螺旋模拟物会随着研究者的不断深入研究,将会挖掘出其独特的生物化学性质而得到更广泛的应用。
[1]Gavin A C, Bosche M, Krause R, et al. Functional organization of the yeast proteome by systematic analysis of protein complexes[J]. Nature, 2002, 415(6868): 141-147.
[2]Barnard A, Miles J A, Burslem G M, et al. Multivalent helix mimetics for PPI-inhibition[J]. Organic & Biomolecular Chemistry, 2015, 13(1): 258-264.
[3]Thompson S, Vallinayagam R, Adler M J, et al. Double-sided α-helix mimetics[J]. Tetrahedron, 2012, 68(23): 4501-4505.
[4]Jochim A L, Arora P S. Assessment of helical interfaces in protein-protein interactions[J]. Molecular BioSystems, 2009, 5(9): 924-926.
[5]Davis J M, Tsou L K, Hamilton A D. Synthetic non-peptide mimetics of α-helices[J]. Chemical Society Reviews, 2007, 36(2): 326-334.
[6]Cummings C G, Hamilton A D. Disrupting protein-protein interactions with non-peptidic, small molecule a-helix mimetics[J]. Current Opinion in Chemical Biology, 2010, 14(3): 341-346.
[7]Peczuh M W, Hamilton A D. Peptide and protein recognition by designed molecules[J]. Chemical Reviews, 2000, 100(7): 2479-2494.
[8]Rodriguez J M, Nevola L, Ross N T, et al. Synthetic inhibitors of extended helix-protein interactions based on a piphenyl 4,4′-dicarboxamide scaffold[J]. ChemBioChem, 2009, 10(5): 829-833.
[9]Clackson T, Ultsch M H, Wells J A. Structural and functional analysis of the 1:1 growth hormone: Receptor complex reveals the molecular basis for receptor affinity.[J]. Journal of Molecular Biology, 1998, 277(5): 1111-1128.
[10]Bullock B N, Jochim A L, Arora P S. Assessing helical protein interfaces for inhibitor design[J]. Journal of the American Chemical Society, 2011, 133(36): 14220-14223.
[11]Reichmann D, Rahat O, Cohen M, et al. The molecular architecture of protein-protein binding sites[J]. Current Opinion in Structural Biology, 2007, 17(1): 67-76.
[12]Block P, Weskamp N, Wolf A, et al. Strategies to search and design stabilizers of protein-protein interactions: A feasibility study[J]. Proteins: Structure, Function, and Bioinformatics, 2007, 68(1): 170-186.
[13]王庆莲. 阿司匹林的应用及其不良反应[J]. 中国临床医生, 2000, 28(8): 34-35.
[14]肖新荣,刘传湘,汪敏,等. 硫酸氢钠催化合成阿司匹林的研究[J]. 精细化工中间体, 2002, 32(6): 42-43.
Synthesis of Protein α-helix Mimetics Based on Oligobenzamides
REN Yang, ZHOU Xiao-hu, ZHAO Si-qi, LIN Yu-lin, WANG Xiang, XU Hai
(College of Chemistry and Chemical Engineering, Central South University, Hunan Changsha 410083, China)
Design and synthesis of small molecule α-helix mimetics as an important and promising method to develop inhibitors of protein-protein interactions has received tremendous interest in recent years. This approach means simulating α-helix structure of the protein interaction interface hotspots using a series of small organic molecules. By the competitive binding of mimetics and protein complexes, scientist may screen out some α-helix mimetics which have the capable of blocking specific protein-protein interactions, and ultimately achieve the purpose of the corresponding disease treatment. The design and synthesis of 2-O-alkylated α-helix mimetics were studied based on oligobenzamides made aspirin as precusor.
oligoamides; α-helix; mimetics; aspirin
任扬(1992-),男,研究生,研究方向为有机大分子化合物的合成。
徐海(1978-),男,副教授,研究方向为有机光电功能材料的合成制备。
O625.5
A
1001-9677(2016)014-0088-03
