烟草根系分泌物酚酸类物质的鉴定及其对根际微生物的影响
2016-08-24刘艳霞蔡刘体石俊雄
刘艳霞, 李 想, 蔡刘体, 张 恒, 石俊雄
(贵州省烟草科学研究院,贵阳 550000)
烟草根系分泌物酚酸类物质的鉴定及其对根际微生物的影响
刘艳霞, 李 想, 蔡刘体, 张 恒, 石俊雄*
(贵州省烟草科学研究院,贵阳 550000)
【目的】烟草连作已导致土传病害发生、烟株生长受抑制、产量下降和品质恶化等问题。烟株对自身及土壤微生物产生的化感作用,是烟草产生连作障碍的一个重要原因,其中化感物质中的根系分泌物是烟株与土壤微生物间相互作用的重要物质,探索烟草根系分泌物对根际微生物生长的影响是生物防控烟草青枯病的理论依据。【方法】本文利用超高效液相色谱串联四级杆飞行时间质谱(UPLC-Q-TOF/MS)技术,分离、鉴定烟草根系分泌物中主要酚酸类物质的种类和含量; 通过添加外源酚酸类物质,研究在液体培养基中烟草根系分泌物中的主要酚酸类物质对病原菌及拮抗菌的影响,并在土壤中添加鉴定出的主要酚酸类物质; 通过土壤培育试验,研究其对土壤微生物多样性和数量变化,特别是对烟草青枯病菌及其拮抗菌生长的影响。【结果】1)烟草根系分泌物粗提物对病原菌(茄科劳尔氏菌)生长的促进率为16.8%,对拮抗菌(短短芽孢杆菌)的生长抑制率达到29.4%; 2)UPLC-Q-TOF/MS检测根系分泌物中主要酚酸类物质为苯甲酸和3-苯丙酸,含量分别为0.25μg/g干根重和1.15μg/g干根重; 3)液体培养外源添加低浓度的苯甲酸(≤ 2μg/L)和3-苯丙酸(≤ 3μg/L)促进病原菌和拮抗菌的生长; 4μg/L的苯甲酸对病原菌生长抑制作用不显著,对拮抗菌生长的抑制率达到90.2%,6μg/L的 3-苯丙酸对病原菌的生长具有促进作用,对拮抗菌的生长抑制率达到81.1%,外源高浓度苯甲酸(≥4μg/L)和3-苯丙酸(≥ 7μg/L)抑制病原菌与拮抗菌的成长; 4)土壤中添加3μg/kg土的苯甲酸时,土壤中病原菌的数量增加12.3%,而拮抗菌的数量减少21.0%,土壤细菌、放线菌和真菌的数量分别降低37.5%,41.9%和55.6%; 3-苯丙酸浓度达到8μg/kg土时,拮抗菌生长量减少14.5%,对病原菌没有显著影响,土壤细菌、放线菌和真菌的数量分别降低69.9%,57.2%和80.7%; 5)土壤添加4μg/kg的苯甲酸和7μg/kg的3-苯丙酸后,土壤微生物Shannon指数、Simpson指数、McIntosh指数显著下降,分别仅为对照的57.7%、94.1%、88.1%和97.6% 73.3%、80.0%。【结论】烟草根系分泌物粗提物促进病原菌生长抑制拮抗菌生长,根系分泌物中酚酸类物质主要为苯甲酸和3-苯丙酸,液体培养中4μg/L的苯甲酸或6μg/L的 3-苯丙酸浓度是对病原菌生长抑制不明显但显著抑制拮抗菌生长的分界点,土壤外源添加3μg/kg的苯甲酸或8μg/kg的3-苯丙酸时,是土壤增加病原菌减少拮抗菌数量的分界点,同时土壤微生物功能多样性显著下降,病原菌对根系分泌物中苯甲酸和3-苯丙酸的利用优于拮抗菌,这也是烟草长期连作引起青枯病暴发流行的机理之一。
烟草根系分泌物; 病原菌; 拮抗菌; 根际微生物; 土壤微生物群落功能多样性
soilmicrobialfunctionaldiversity
烟草作物的气候性较强,对地理环境和栽培条件要求较高,因此烟草种植有明显的地域性特点,在贵州省甚至全国烟叶生产中,连作现象非常普遍。单一作物连作导致根系分泌物在土壤中不断积累,从而对作物和土壤微生物产生化感作用[1]。酚酸类物质是根系分泌物中非常重要的化感物质,对植物的自毒作用也是导致连作障碍发生的重要因素[2]。前期研究通过GC、HPLC、GC/MS等分离鉴定手段己经得到了多种酚类化感物质,如氢氰酸、苯甲酸、肉桂酸和皂角昔等物质都对土壤微生物生长起抑制作用或促进病原菌的生长繁殖[3],从而诱导土传性病害的发生。本研究表明,长期连作一种作物会导致根际形成单一的土壤环境,根系分泌物作为土壤中的碳、氮物质,为病原菌生长繁殖提供营养,同时也抑制了一些根际有益微生物的生长,从而在土壤中形成一种不平衡的微生态环境,导致土传病害的暴发流行[4-5]。近年来,对于根系分泌物的研究主要侧重在小麦[6]、水稻[7]、西瓜[8]和黄瓜[9]等作物上,而对烟草根系分泌物相关研究较少。且现有研究主要集中在烟草根系粗提物的极性分离,以及不同极性的根系粗提物对烟苗生长、土壤酶活性等的影响[10]。
本研究通过鉴定、分析烟草根系分泌物中主要酚酸类物质种类和含量,研究根系分泌物对烟草青枯病菌、拮抗菌生长及根际微生物多样性的影响,旨在探索根系分泌物与烟草连作后造成的烟草青枯病害暴发的相关性。
1 材料与方法
1.1烟草青枯病菌茄科劳尔氏菌及其拮抗菌的分离、筛选与鉴定
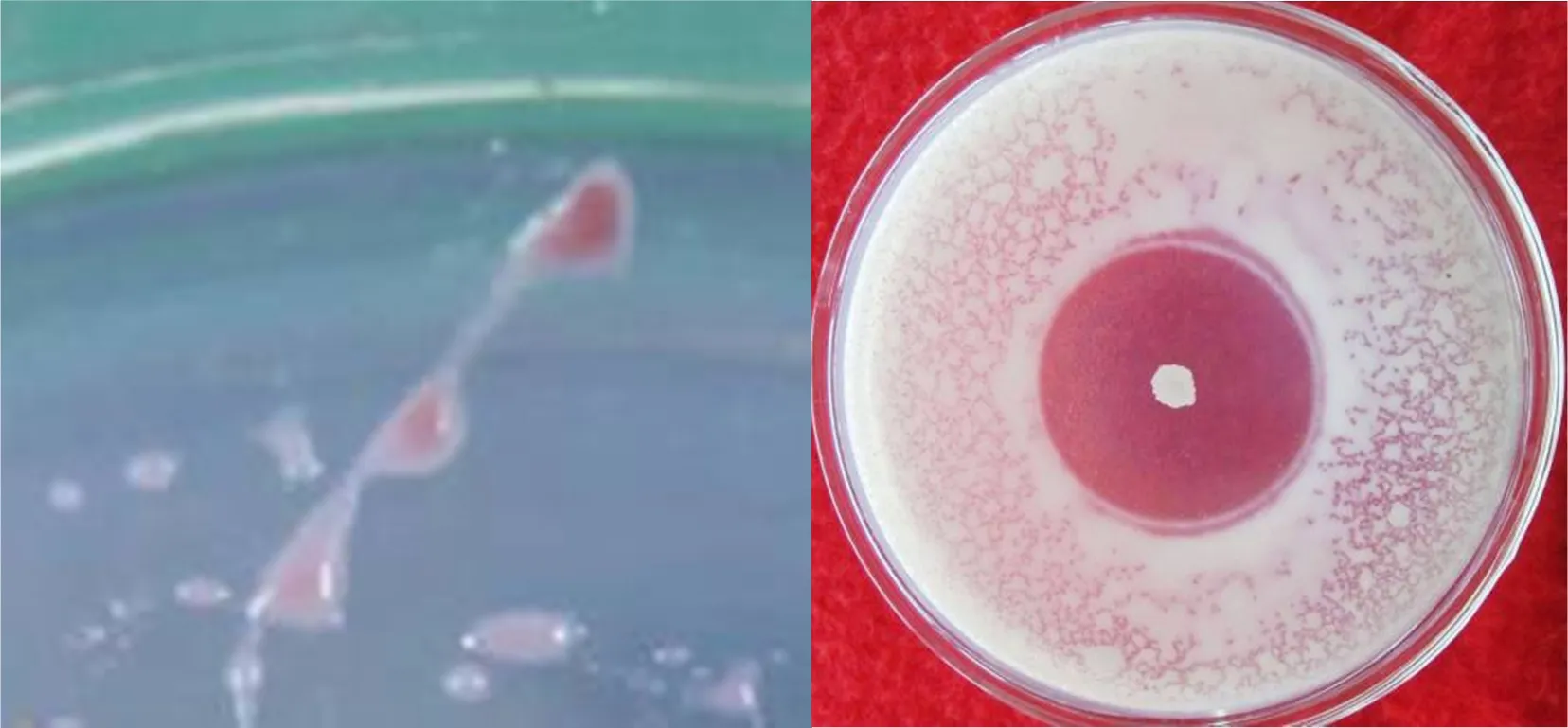
图1 共培养法观测Ralstonia solanacearum(左)、拮抗菌Brevibacillus brevis(右)的菌落形态Fig.1 The colony morphology of R. solanacearum (left) and the antagonist (right) tested by co-cultureing R. solanacearum.


在培育45d后,先用自来水冲洗烟苗根系5次,再用去离子水冲洗5次。烟草根系浸泡在6L超纯水中于恒温恒湿人工气候室中培育36h,期间用电磁泵向水中补充氧气以维持烟株正常生长。根系分泌物收集液经0.45μm微孔过滤膜过滤后立即冻干浓缩并保存于-20℃条件下。根系分泌物冻干粉末溶解于灭菌去离子水中,分别配成0.01g/mL用于生物测定及1g/mL用于成分分析。总碳和总氮含量由Elementar元素分析仪测定(VarioELcube,德国),经测定,根系分泌物母液粗提物中总碳含量为38.94%,总氮含量为4.62%。
1.3烟草根系分泌物对病原菌与拮抗菌生长的影响
茄科劳尔氏菌在改良的Kelman’sTTC琼脂培养基(10g葡萄糖、5g蛋白胨、3g牛肉浸粉和0.5g酵母粉,定容至1L水中,pH调节至7.0)上培养[19],筛选到的拮抗菌在牛肉膏蛋白胨培养基上培养[20]。每种微生物各设置两个处理,共4个处理: 1)茄科劳尔氏菌在改良后的Kelman’sTTC培养基上培养(CKR); 2)茄科劳尔氏菌在1 ∶1 (v∶v) 改良后的Kelman’sTTC培养基和0.01g/mL,rootDW根系分泌物溶液中培养(RR); 3)拮抗菌短短芽孢杆菌在牛肉膏蛋白胨培养基上培养(CKB); 4)拮抗菌短短芽孢杆菌在1 ∶1 (v∶v) 牛肉膏蛋白胨培养基和0.01g/mL,rootDW根系分泌物溶液中培养(RB)。所有处理于30℃、170r/m培养48h。茄科劳尔氏菌与拮抗菌的生长速率通过分光光度计对OD600进行测定。
根系分泌物对微生物生长速率的影响=[(ROD600-CKOD600)/CKOD600]×100%式中: ROD600表示在1 ∶1 (v∶v)培养基和0.01g/mL,rootDW根系分泌物溶液中培养后微生物OD600值; CKOD600表示微生物直接在培养基中培养后的OD600值。
1.4UPLC-Q-TOF/MS分析酚酸标准品和根系分泌物中的酚酸类物质
五倍子酸、原儿茶酸、2,5-二羟基苯甲酸、4-羟基苯甲酸和4-羟基苯甲醛从AlfaAesar公司购买 (WardHill,MA,USA),香草酸、对香豆酸、紫丁香酸、阿魏酸、苯甲酸、3-苯丙酸和肉桂酸购自Sigma-Aldrich公司(Steinem,Germany)。通过对比标准品和根系分泌物中主要物质的出峰时间和峰面积鉴定根系分泌物中主要酚酸类物质及其含量[21],并通过分析质谱图,确定各组分的分子组成。前期用半制备高效液相色谱仪(Aglient1200, 德国)分离根系分泌物中主要酚酸类物质,分离度较好(图2)。两个主要色谱峰出现在保留时间60min和60.5min,与标准品峰图比对后,初步确定这两个峰分别为苯甲酸和3-苯丙酸(图2)。

图2 酚酸标准品(左)和烟草根系分泌物(右)液相色谱图Fig.2. HPLC chromatograms of standard phenolic acids (left) and tobacco root exudates (right)
[注(Note): 1—五倍子酸Gallicacid; 2—原儿茶酸Protocatechuicacid; 3—2,5-二羟基苯甲酸2, 5-dihydroxybenzoicacid; 4—4-羟基苯甲酸4-hydroxybenzoicacid; 5—4-羟基苯甲醛4-hydroxybenzaldehyde; 6—香草酸Vanillicacid; 7—对香豆酸P-coumaricacid; 8—紫丁香酸Syringicacid; 9—阿魏酸Ferulicacid; 10—苯甲酸Benzoicacid; 11—3-苯丙酸3-phenylpropanoicacid; 12—肉桂酸Cinnamicacid.]


1.5外源添加酚酸类物质对病原菌和拮抗菌生长的影响
将UPLC-Q-TOF/MS中分离、鉴定的主要酚酸类物质以外源添加的方式研究其对烟草青枯病菌和拮抗菌生长的影响。15μg苯甲酸溶解于60℃灭菌后的去离子水中,作为母液1。0、1.0、2.0、3.0、4.0、5.0和10.0μg/L浓度的苯甲酸溶液分别由母液1稀释获得; 0.3mg3-苯丙酸溶于10mL灭菌后去离子水中,作为母液2。0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0μg/L浓度的3-苯丙酸分别由母液2稀释获得。研究不同浓度的苯甲酸溶液和3-苯丙酸溶液对青枯病病原菌和拮抗菌生长的影响方法同上。每处理重复5次。
1.6添加外源酚酸类物质对土壤病原菌和拮抗菌数量的影响
从青枯病发病严重的大田采集土壤并接种拮抗菌,在贵州省烟草科学研究院实验室中进行土壤培育实验。将分离、鉴定的根系分泌物中主要酚酸类物质以外源添加的方式施加于土壤中,苯甲酸浓度调整至3、4和5μg/kg土,3-苯丙酸浓度调整至6、7和8μg/kg土,向土壤中接种灭菌去离子水为对照,每处理5次重复。将土壤置于恒温培养箱中在28℃和60% 相对湿度下培养3d。用荧光定量PCR法测定土壤中病原菌和拮抗菌的数量[14]。
1.7添加外源酚酸类物质对土壤根际微生物的影响

根际土壤微生物功能多样性用BiologEcoPlate系统 (BiologInc.HaywardCal.USA)通过比较31种碳源利用情况测定[22]。土壤悬液在4℃、3000×g转速下离心5min,然后用0.85%的NaCl溶液稀释100倍。土壤稀释液接种于EcoPlates,在Biolog恒温(25℃)培养箱中暗培养72h。EcoPlates上每孔颜色变化度为OD值与对照OD值之差[23]。微生物活性用微孔板平均颜色变化度(AWCD)值表示,Shannon指数、Simpson指数和McIntosh指数表征土壤微生物功能多样性。
ShannonIndex=-∑PilnPi

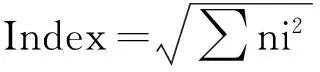
式中,Pi=Ai/Atotal;ni=Ai;N=Atotal;A代表590nm处吸光度。
1.8数据处理
试验数据采用MicrosoftExcel2003进行处理,显著性分析采用SPSSBaseVer.13.0统计软件 (SPSS,IL,Chicago,USA),LSD、Duncan新复极差法进行多重比较(P≤0.05)。
2 结果与分析
2.1烟草根系分泌物粗提物对病原菌与拮抗菌生长的影响
根系分泌物溶液能够显著促进病原菌(茄科劳尔氏菌)的生长,同时对拮抗菌(短短芽孢杆菌)生长具有抑制作用。从表1可以看出,与对照相比,添加根系分泌物母液粗提物后促进了病原菌生长,增幅达到16.8%,对拮抗菌的生长抑制率达到29.4%。2.2根系分泌物中主要酚酸类物质鉴定与含量测定
目前根据酚酸的峰面积,只鉴定出两种含量较高的酚酸类物质,其他峰有待于进一步鉴定。在酚酸标准品液相色谱图中,苯甲酸和3-苯丙酸的出峰时间分别为10.11min和12.92min,通过对比根系分泌物和酚酸标准品液相色谱图的出峰时间,在根系分泌物UPLC色谱图中10.10min和12.92min处分别为苯甲酸和3-苯丙酸(图3)。从表2可以看出,在负离子模式下,从根系分泌物中分离鉴定出的两种主要物质m/z分别为121.0289和149.0599,与理论值分别相差1.0和4.0ppm,验证两种物质分别为苯甲酸和3-苯丙酸。经过UPLC峰面积对比,苯甲酸在烟草根系分泌物中的含量为0.25μg/g干根重,3-苯丙酸在烟草根系分泌物中的含量为1.15μg/g干根重。
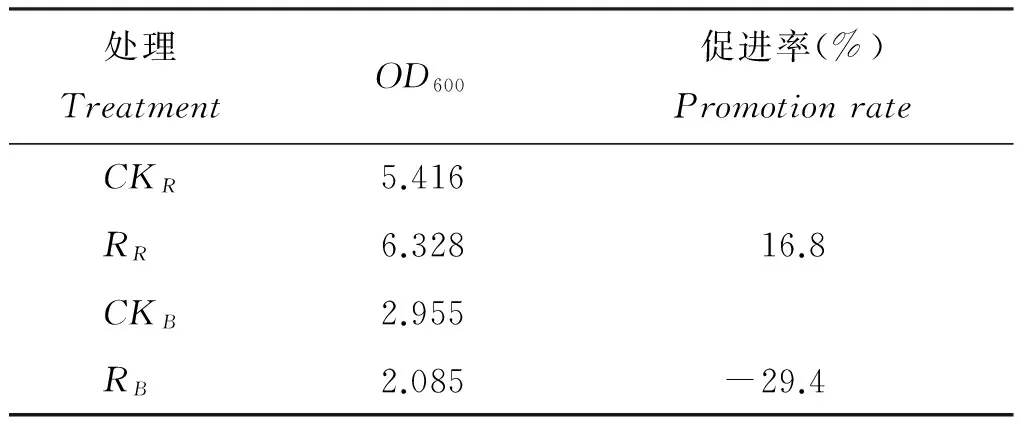
表1 烟草根系分泌物对病原菌和拮抗菌生长的影响

图3 酚酸标准品(上)和烟草根系分泌物(下)UPLC色谱图Fig.3 UPLC of standard phenolic acids (upper) and substances in tobacco root exudates (lower)

峰号PeakNo.负离子模式Negativeionmode检测值(m/z)Obs.mass化学式Chemicalformula理论值(m/z)Theor.massΔm(ppm)鉴定化合物Tentativeassignment1149.0599C9H10O2149.06034.03-phenylpropanoicacid2121.0289C7H6O2121.02901.0Benzoicacid
2.3添加外源苯甲酸和3-苯丙酸对液体培养病原菌和拮抗菌的影响
当外源添加苯甲酸浓度≤3μg/L时,苯甲酸能促进病原菌(茄科劳尔氏菌)的生长,分别比对照处理增加了5.9%(1μg/L)、5.2%(2μg/L)和2.6%(3μg/L); 外源添加4μg/L浓度苯甲酸时,病原菌浓度与对照处理之间无显著差异; 超过5μg/L浓度苯甲酸时,病原菌生长受到明显抑制(表3); 当外源添加苯甲酸小于等于2μg/L时促进拮抗菌(短短芽孢杆菌)的生长,促进率随苯甲酸溶液浓度的增加而减小; 当苯甲酸浓度超过2μg/L后拮抗菌的生长受到抑制,对拮抗菌生长的抑制率达到16.6%(3μg/L)和90.2%(4μg/L),超过5μg/L后拮抗菌几乎无法生长。5μg/L浓度的苯甲酸溶液对茄科劳尔氏菌和短短芽孢杆菌的抑制作用分别达到99.7%和99.9%。病原菌和拮抗菌在10μg/L的苯甲酸溶液中完全不能生长。
当外源添加3-苯丙酸浓度小于等于6μg/L时,病原菌的生长得到促进,分别比对照处理增加10.6%(1μg/L)、10.1%(2μg/L)、8.4%(3μg/L)、6.7%(4μg/L)、5.2%(5μg/L)和1.3%(6μg/L),超过8μg/L浓度时,病原菌的生长受到显著影响,几乎不生长(表3)。当外源添加3-苯丙酸浓度小于等于3μg/L时,促进拮抗菌的生长,分别比对照处理增加4.2%(1μg/L)、1.3%(2μg/L)和1.2%(3μg/L),超过4μg/L时拮抗菌生长受到抑制,分别比对照处理减少31.1%(4μg/L)和37.7%(5μg/L); 7μg/L浓度的3-苯丙酸对拮抗菌的生长具有强烈的抑制作用,拮抗菌几乎都不能存活。
2.4添加外源酚酸类物质对土壤病原菌和拮抗菌数量的影响

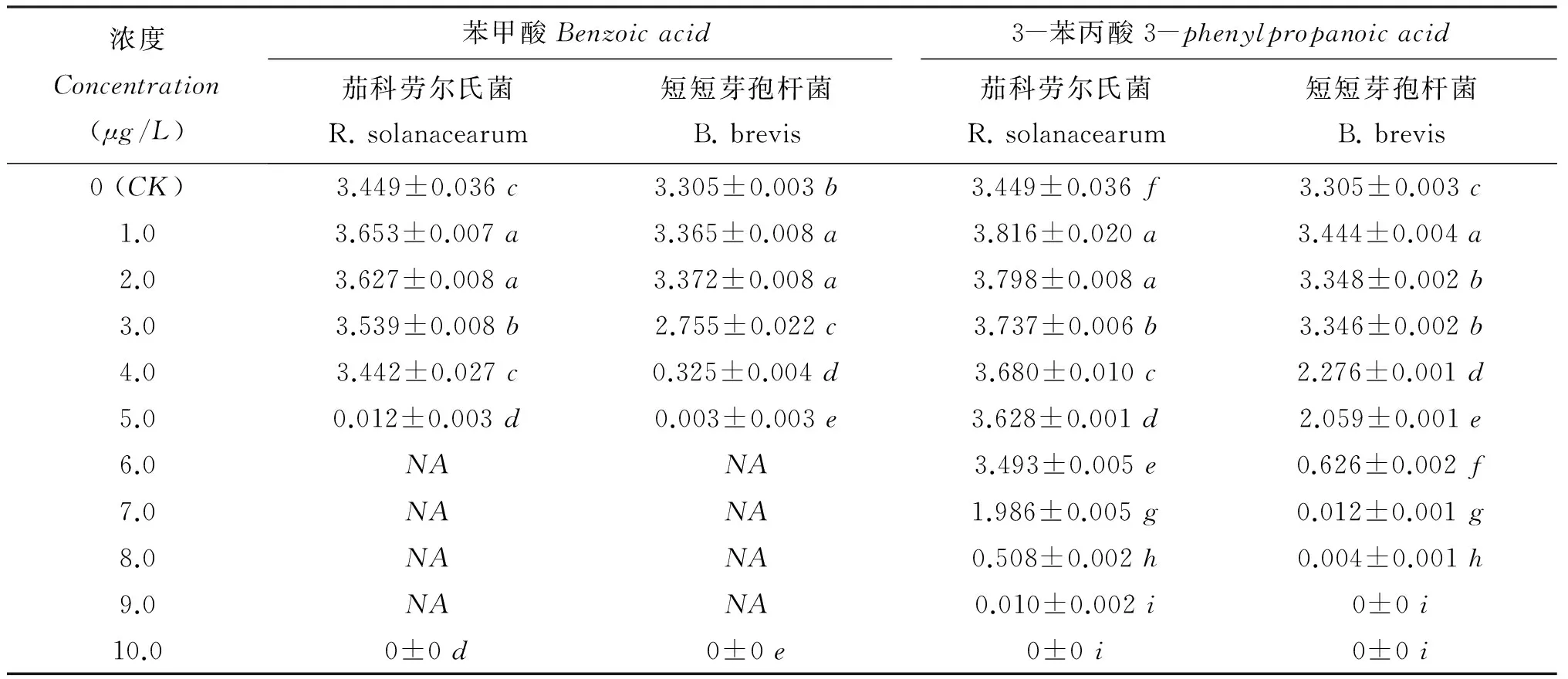
表3 不同浓度苯甲酸和3-苯丙酸对病原菌和拮抗菌生长的影响(OD600)
注(Note):NA—未得到的数据Meansnotavailable. 同列数据后不同字母表示处理间差异达5%显著水平Valuesfollowedbydifferentlettersinacolumnaresignificantamongtreatmentsatthe5%level.
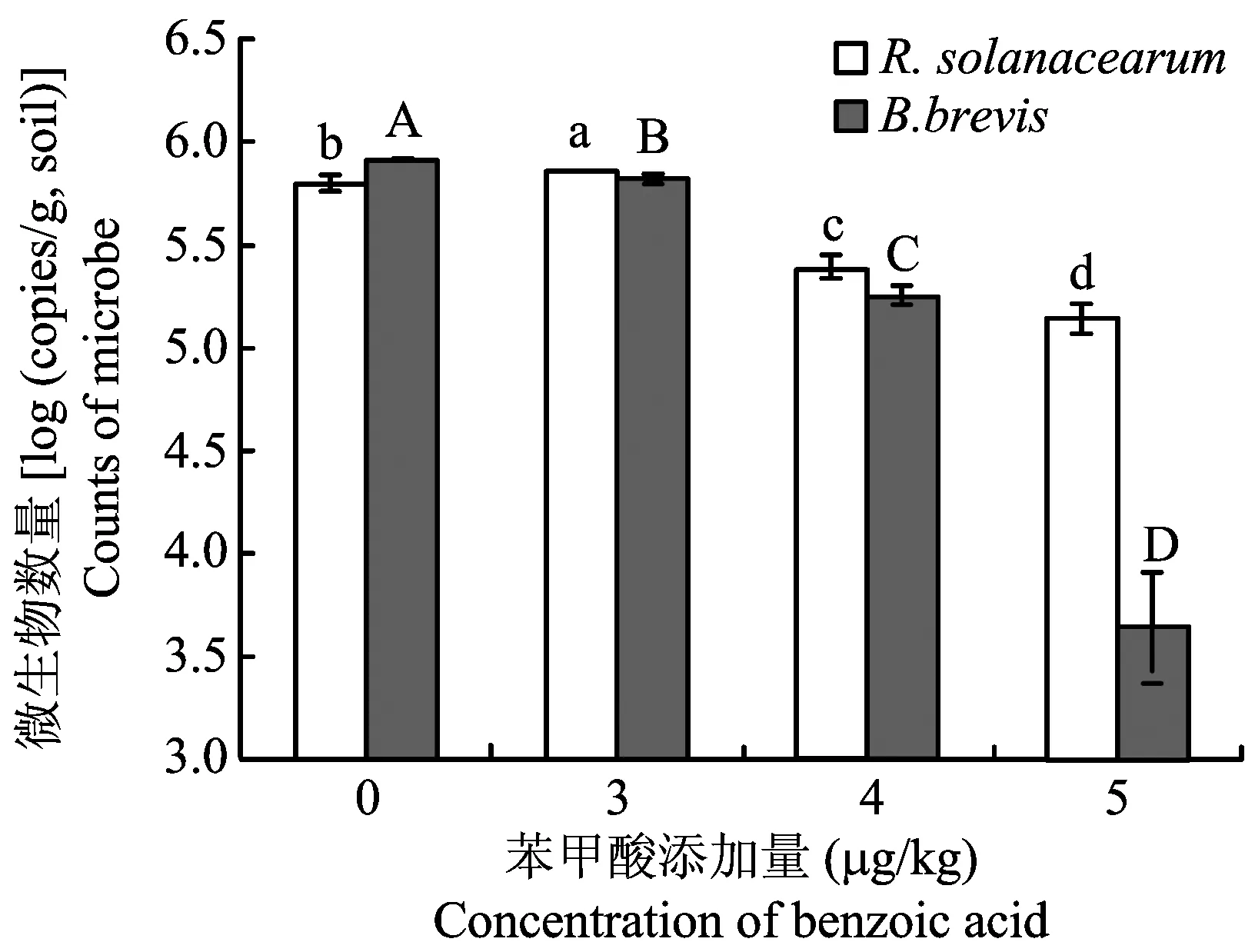
图4 添加外源苯甲酸对土壤病原菌和拮抗菌数量的影响Fig.4. The effect of exogenous benzoic acid on the population of R. solanacearum and B. brevis
[注(Note): 柱上不同小写字母表示病原菌处理间差异达5%显著水平,不同大写字母表示拮抗菌处理间差异达5% 显著水平Differentsmalllettersabovethebarsmeansignificantatthe5%levelsamongtreatmentsofpathogen,andcapitallettersmeansignificantatthe5%levelsamongtreatmentsofantagonist.]
2.5添加外源苯甲酸和3-苯丙酸对土壤根际可培养微生物数量和微生物群落功能多样性的影响
4μg/kg的苯甲酸和8μg/kg的3-苯丙酸显著降低土壤微生物数量(表4、表5)。当苯甲酸的浓度为4μg/kg、5μg/kg时,土壤细菌、放线菌和真菌的数量分别降低85.2、92.6%、60.7, 76.9%和86.2、92.2%。随着3-苯丙酸浓度的增加,尽管土壤微生物数量稍有下降趋势,但处理间无显著差异。当3-苯丙酸浓度达到8μg/kg时,与对照相比,土壤微生物数量显著下降。4μg/kg的苯甲酸或7μg/kg的3-苯丙酸是土壤微生物多样性和均匀度显著下降的转折点,添加4μg/kg的苯甲酸土壤Shannon指数、Simpson指数和McIntosh指数分别仅为对照的57.6%、88.1%和73.3%,添加7μg/kg的3-苯丙酸土壤Shannon指数、Simpson指数和McIntosh指数分别仅为对照的94.1%、97.6%和80.1%。
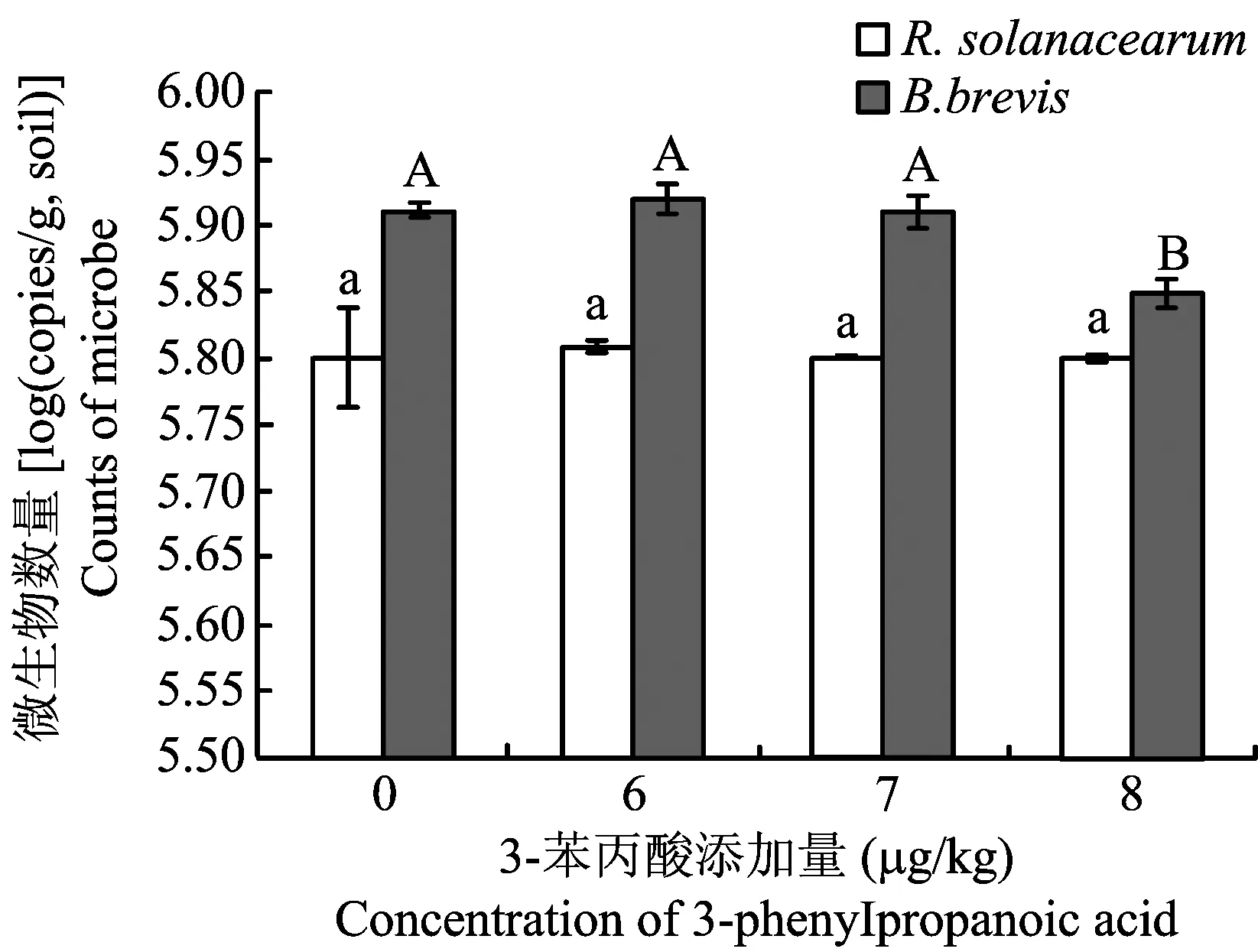
图5 添加外源3-苯丙酸对土壤病原菌和拮抗菌数量的影响Fig.5. The effect of exogenous 3-phenylpropanoic acid on the population of R. solanacearum and B. brevis
[注(Note): 柱上不同小写字母表示病原菌处理间差异达5%显著水平,不同大写字母表示拮抗菌处理间差异达5%显著水平Differentsmalllettersabovethebarsmeansignificantatthe5%levelamongtreatmentsofpathogen,andcapitallettersmeansignificantatthe5%levelamongtreatmentsofantagonist.]
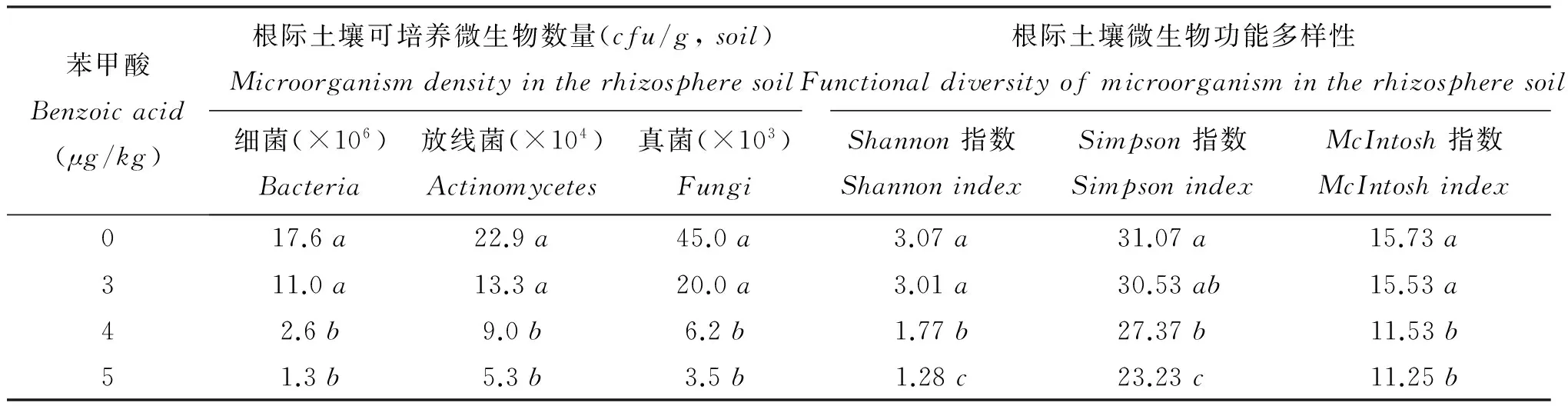
表4 添加外源苯甲酸后土壤细菌、放线菌和真菌的数量和微生物群落功能多样性
注(Note): 同列数据后不同字母表示处理间差异达5%显著水平Valuesfollowedbydifferentlettersinacolumnaresignificantamongtreatmentsatthe5%level.
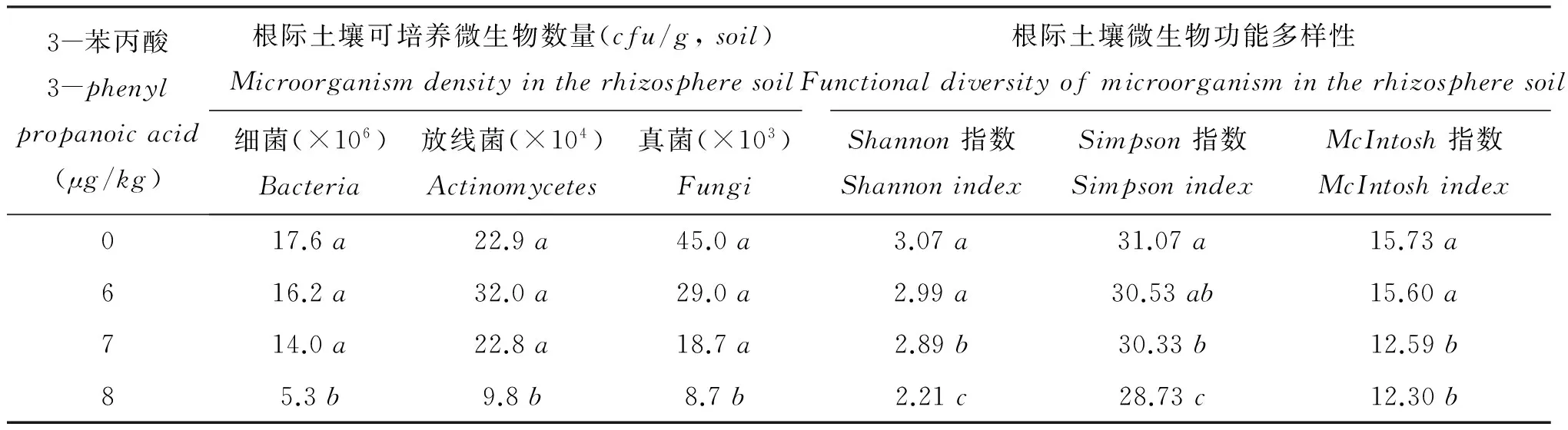
表5 添加外源3-苯丙酸后土壤细菌、放线菌和真菌的数量和微生物群落功能多样性
注(Note): 同列数据后不同字母表示处理间差异达5%显著水平Valuesfollowedbydifferentlettersinacolumnaresignificantamongtreatmentsatthe5%level.
3 讨论
近年来研究表明,化感物质不但引起作物自毒作用,同样会导致病害的暴发流行[24]。目前,研究烟草根系分泌物的种类和含量,以及主要酚酸类物质对根际微生物特别是对土传病害病原菌和拮抗菌生长影响方面的系统研究还较少,并主要集中在根系粗提物的极性分离,以及不同极性的根系粗提物对烟苗生长、土壤酶活性等的影响方面[8]。植物赖以生存的土壤中聚集着大量微生物,其中既有有益微生物,也有病原微生物。根系分泌物中丰富的糖类、氨基酸类、有机酸及酚酸等物质,为植物根际土壤微生物的生长和繁殖提供了充足的营养,同时也影响着土壤微生物的种类、数量及其在植物根际的分布。研究发现,不同土壤微生物在根际的定殖受根系分泌物的影响而表现出明显的根际效应[25-26]。而且,根系分泌物还对根际微生物的生长和发育产生影响。韩雪等[5]研究不同黄瓜品种的根系分泌物对黄瓜枯萎病菌孢子萌发、菌丝生长及病原菌生物量的影响时发现,抗枯萎病黄瓜品种的根系分泌物对上述指标均有明显的抑制作用,而感病品种则相反。韩丽梅等[27]研究大豆连作土壤中有机物对大豆根腐病菌的影响时发现,土壤中酚酸组分对尖孢镰刀菌等三种病菌的生长多表现出显著的促进作用; 同时,根系分泌物中的有机酸与酚酸类物质使连作土壤理化特性改变,引发根际土壤pH值降低,也对根际土壤微生物种群结构的变化产生较大影响,因此长期连作导致土传病害的暴发流行[28]。根系分泌物中的酚类与酚酸类物质在作物自毒现象和连作障碍中扮演非常重要的角色,多种酚酸类物质对植物的生长发育都起到抑制的作用[29-31]。本试验以烟草根系分泌物中的酚酸类物质为主要研究对象,在烟草根系分泌物中分离、筛选鉴定到两种主要酚酸类物质(苯甲酸和3-苯丙酸),补充了烟草根系分泌物已有的关于其他酚酸类物质的研究内容。
不同浓度的酚酸对微生物生长繁殖起着不同的作用。马瑞霞等研究[32]指出,当反式-阿魏酸的浓度分别达到5.149, 2.575和0.257mmol/L时,枯草芽孢杆菌(Bacillus subtilis)的生长和反硝化作用受到显著影响; 而当苯甲酸的浓度为4.09 和8.189mmol/L时,枯草芽孢杆菌生长得到显著促进。高欣欣等[33]分离并鉴定烤烟根系分泌物中存在苯甲酸、肉桂酸、反丁烯二酸和琥珀酸等,并分析测定了这些酚酸类物质对烟草种子和出芽的化感作用,研究表明,苯甲酸能够显著抑制烟苗的生长、种子萌发及烟叶品质,浓度越高抑制作用越强。本试验探索了不同种类、不同浓度的酚酸类物质对病原菌和两株拮抗菌生长的影响,结果表明,低浓度的苯甲酸和3-苯丙酸能够促进病原菌和拮抗菌的生长,而高浓度则同时抑制这两种微生物的生长。另外,苯甲酸对病原菌的抑制浓度大于拮抗菌,这可能是由于不同微生物对酚酸类物质浓度的响应不同造成的; 谭秀梅等[34]的研究也得到类似的结果,即随着外源物质浓度的升高,土壤微生物数量具有先增加后降低的趋势。Qu等[35]研究表明,2,4-二叔丁基苯酚和香草酸的加入对微生物量同样存在低浓度促进、高浓度抑制的作用。郝文雅等[36]发现西瓜根系分泌物能够增加尖孢镰刀菌(Fusarium oxysporumf.sp.niveum)孢子萌发的数量,并增强其繁殖能力。本试验中计算得到根系分泌物中的苯甲酸含量为0.25μg/g干根重,而在田间实际生产中,正常的烟株旺长期的根干重约为12g左右[37],即每株烟旺长期的苯甲酸分泌量约为3μg/kg根际土。试验结果中3μg/kg的苯甲酸对土壤中的病原菌生长具有促进作用,但对拮抗菌的生长却起到抑制作用,表明田间实际生产中,烟株正常分泌的苯甲酸对病原菌具有正向趋向作用,而对拮抗菌却具有排斥作用。3-苯丙酸在烟草根系分泌物中的含量为1.15μg/g干根重,每株烟旺长期的3-苯丙酸分泌量为13.8μg/kg,超出试验中设置的最大量8μg/kg的3-苯丙酸,可能会同时抑制土壤中的病原菌和拮抗菌的生长。根系分泌物中含有多种物质,可能会对浓度较高的某一种物质具有缓冲性,而单一添加3-苯丙酸时,这种缓冲作用消失,有可能造成比理论分界点偏低的现象。
在本研究中,4μg/kg的苯甲酸或8μg/kg的3-苯丙酸可以显著减少土壤微生物包括细菌、放线菌和真菌的数量。根际微生物的活性与根系分泌物的种类和数量密切相关,根系分泌物对根际土壤中的微生物种类及数量有着特异性和非特异性的影响,在多数情况下,根系分泌物对根际微生物的影响是非特异性的,它对微生物物趋向有着诱导的作用。革兰氏阴性无芽孢细菌会受到根系分泌物的诱导向根际聚集[38]。Sushma[39]的研究表明,根际促生菌荧光假单胞杆菌(Pseudomonas fluorescens)会受到番茄根系分泌物中主要成分柠檬酸和苹果酸的诱导定殖,即趋化现象。本试验中的茄科劳尔氏菌属于革兰氏无芽孢细菌,而拮抗菌Brevibacillus brevis为革兰氏阳性菌,因此,烟草根系分泌物对病原菌的诱导性远远大于对拮抗菌的诱导性,使得病原菌比拮抗菌更易定殖在烟株根际。
根系分泌物对根际土壤的微生物多样性和丰富度作用显著[40],根系分泌物调节并决定着根系与土壤微生物间的生物、化学、物理等相关关系,在根系-微生物互作过程中起着至关重要的作用[41-42]。化感作用通过改变根际土壤中微生物的数量和群落结构间接影响微生态平衡[43-44],调控病原菌的生长与致病性。特定的根系分泌物决定着土壤中主要的微生物群落种类,在连作条件下,土壤微生物群落多样性降低,有益微生物减少甚至灭亡,病原微生物增加[9]。柯文辉[45]认为在烟草连作障碍土壤中存在化感自毒物质,随着这些自毒物质逐渐积累,可以显著降低土壤微生物群落多样性,增加病原微生物数量,破坏土壤微生态系统的平衡,降低根系的代谢活动及营养元素的有效性,最终导致烟叶产量和质量下降。本试验中当苯甲酸的浓度为4μg/kg、5μg/kg时,土壤细菌、放线菌和真菌的数量分别降低了85.2%、92.6%,60.7%和76.9%、 86.2%、92.2%。在一定浓度下,随着3-苯丙酸浓度的增加,尽管土壤微生物浓度稍有下降趋势,但处理间无显著差异。当3-苯丙酸浓度达到8μg/kg时,与对照相比,土壤微生物数量显著下降。土壤的微生物活性分别由Shannon指数、Simpson指数和McIntosh指数表征,反映土壤微生物功能多样性。4μg/kg的苯甲酸或7μg/kg的3-苯丙酸是土壤微生物多样性和均匀度显著下降的转折点。当土壤中接种低浓度的苯甲酸和3-苯丙酸时,土壤微生物对BiologECO板中的底物利用率较高。与液体培养基不同的是,土壤能够缓冲酚酸类物质对微生物的抑制作用。因此,土壤接种苯甲酸和3-苯丙酸后对土壤微生物生长的抑制浓度略大于液体培养基。
4 结论
通过UPLC-Q-TOF/MS,在烟草根系分泌物中分离、筛选到两种主要酚酸类物质为苯甲酸和3-苯丙酸; 液体培养条件下,对茄科劳尔氏菌具有促进作用的酚酸浓度分别为3μg/L苯甲酸和6μg/L3-苯丙酸,显著高于对拮抗菌短短芽孢杆菌有促进作用的酚酸浓度; 土壤外源添加3μg/kg的苯甲酸或8μg/kg的3-苯丙酸时,土壤病原菌数量增加而拮抗菌数量减少,同时土壤微生物功能多样性降低; 与拮抗菌相比,烟草青枯病病原菌可以更好地利用烟草根系分泌物中的酚酸类物质,从而比拮抗菌更易定殖于烟株根际,这可能是连作障碍造成土传病害暴发流行的机理之一。
[1]WeirT,ParkSW,VivancoJ.Biochemicalandphysiologicalmechanismsmediatedbyallelochemicals[J].CurrentOpinioninPlantBiology, 2004, 7: 472-479.
[2]YeJQ,YeSF,ZhangMF, et al.Effectsofrootexudatesandaqueousrootextractsofcucumber(Cucumis sativusL.)andallelochemicals,onphotosynthesisandantioxidantenzymesincucumber[J].BiochemicalSystematicsandEcology, 2003, 31(1): 129-139.
[3]WuHW,HaigT,PratleyJ.Allelochemicalsinwheat(Triticum aestivumL.):Variationofphenolicacidsinshoottissues[J].JournalofChemicalEcology, 2001, 27(1): 125-135.
[4]RuanW,LiuM,PanJ, et al.Effectofoilcakesonthegrowthofcucumber(Cucumis sativusL.)undercontinuouscroppingsystemanditsmechanism[J].ScientiaAgriculturaSinica, 2003, 36(12): 1519-1524.
[5]韩雪, 吴凤芝, 潘凯. 根系分泌物与土传病害关系之研究综述[J]. 中国农学通报, 2006, 22(2): 316-318.
HanX,WuFZ,PanK.Reviewontherelationbetweentherootexudatesandsoil-spreaddisease[J].ChineseAgriculturalScienceBulletin, 2006, 22(2): 316-318.
[6]WuHW,HaigT,PratleyJ.Allelochemicalsinwheat(Triticum aestivuml.):Cultivardifferenceintheexudationofphenolicacids[J].JournalofAgriculturalandFoodChemistry, 2001, 49(88): 3742-3745.
[7]HaoW,RenL,RanW, et al.AlleopathiceffectsofrootexudatesfromwatermelonandriceplantsonFusarium oxysporumf.Sp. Niveum [J].PlantandSoil, 2010, 336: 485-497.
[8]WuH,RazaW,LiuD, et al.AllelopathicimpactofartificiallyappliedcoumarinonFusarium oxysporumf.Sp. Niveum [J].WorldJournalofMicrobiologyandBiotechnology, 2008, 24: 1297-1304.
[9]ChenL,YangX,RazaW, et al. Trichoderma harzianumsqr-t037rapidlydegradesallelochemicalsinrhizospheresofcontinuouslycroppedcucumbers[J].AppliedMicrobiologyandBiotechnology, 2011, 89: 1653-1663.
[10]郭亚利, 李明海, 吴洪田, 等. 烤烟根系分泌物对烤烟幼苗生长和养分吸收的影响[J]. 植物营养与肥料学报, 2007, 13(3): 458-463.
GuoYL,LiMH,WuHT, et al.Effectsofrootexudatesongrowthandnutrientsuptakeoftobaccoseedlings[J].PlantNutritionandFeritlizerScience, 2007, 13(3): 458-463.
[11]EnglerbrechtMC.Modificationofasemi-selectivemediumfortheisolationandquantificationofPseudomonas solanacearum [J].ACIARBacterialWiltNewsletter, 1994, 10: 3-5.
[12]KochR. ÜberdenaugenblicklichenStandderbakteriologischenCholeradiagnose(inGerman) [J].ZeitschriftfürHygieneundInfectionskrankheiten, 1893, 14: 319-333.
[13]HervasA,LandaB,DatnoffLE, et al.EffectsofcommercialandindigenousmicroorganismsonFusariumwiltdevelopmentinchickpea[J].BiologicalControl, 1998, 13: 166-176.
[14]LiuY,ShiJ,FengY, et al.Tobaccobacterialwiltcanbebiologicallycontrolledbytheapplicaitonofantagonisticstrainsincombinationwithorganicfertilizer[J].BiologyandFertilityofSoils, 2013, 49: 447-464.
[15]ZhangH,YuZ,HuangQ, et al.Isolation,identificationandcharacterizationofphytoplankton-lyticbacteriumCH-22againstMicrocystis aeruginosa [J].Limnologica, 2011, 41: 70-77.
[16]CartwrightDK,SpurrHWJ.BiologicalcontrolofPhytophthora parasiticavar. Nicotianaeontobaccoseedlingswithnon-pathogenicbinucleateRhizoctoniafungi[J].SoilBiologyandBiochemistry, 1998, 30: 1879-1884.
[17]HoaglandDR,ArnonDI.Thewater-culturemethodforgrowingplantswithoutsoil[M].Berkley:UniversityofCaliforniaAgriculturalExperimentStationCircular, 1950. 39.
[18]ArnonDI,StoutPR.Theessentialityofcertainelementsinminutequantityforplantswithspecialreferencetocopper[J].PlantPhysiology, 1939, 14: 371-375.
[19]FrenchEB,GutarraL,AleyP, et al.Culturemediaforralstoniasolanacearumisolation,identification,andmaintenace[J].Fitopatologia, 1995, 30(3): 126-130.
[20]赵斌, 何绍江. 几种常用培养基的配制方法[M]. 北京: 科学出版社, 2002. 85-88.
ZhaoB,HeSJ.Severalcommonculturemedia[M].Beijing:SciencePress, 2002. 85-88.
[21]BanwartWL,PorterPM,GranatoTC, et al.HPLCseparationandwavelengtharearatiosofmorethan50phenolicacidsandflavonoids[J].JournalofChemicalEcology, 1985, 11: 383-395.
[22]BissettA,RichardsonAE,BakerG, et al.Long-termlanduseeffectsonsoilmicrobialcommunitystructureandfunction[J].AppliedSoilEcology, 2011, 51: 66-78.
[23]GarlandJL,MillsAL.Classificationandcharacterizationofheterotrophicmicrobialcommunitiesonthebasisofpatternsofcommunity-levelsole-carbon-sourceutilization[J].AppliedandEnvironmentalMicrobiology, 1991, 57: 2351-2359.
[24]陈志杰, 梁银丽, 张锋, 等. 温室土壤连作对黄瓜主要病害的影响[J]. 中国生态农业学报, 2008, 16(1): 71-74.
ChenZJ,LiangYL,ZhangF, et al.Effectofdifferentcropsuccessionsonmaindiseasedevelopmentincucmberundersunlitgreenhouse[J].ChineseJournalofEco-Agriculture, 2008, 16(1): 71-74.
[25]陈宏宇, 李晓鸣, 王敬国. 抗病性不同大豆品种根面及根际微生物区系的变化Ι. 非连作大豆(正茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报, 2005, 11(6): 804-809.
ChenHY,LiXM,WangJG.ChangeofmicrofloraintherhizosplaneandrhizosphereofdifferentdiseaseresistancesoybeancultivarsΙ.Changeofmicrofloraintherhizoplaneandrhizosphereofsoybeanundernormalrotationcroppingcondition[J].PlantNutritionandFertilizerScience, 2005, 11(6): 804-809.
[26]陈宏宇, 李晓鸣, 王敬国. 抗病性不同大豆品种根面及根际微生物区系的变化Π. 连作大豆(重茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报, 2006, 12(1): 104-108.
ChenHY,LiXM,WangJG.ChangeofmicrofloraintherhizosplaneandrhizosphereofdifferentdiseaseresistancesoybeancultivarsΠ.Changeofmicrofloraintherhizoplaneandrhizosphereofsoybean[J].PlantNutritionandFertilizerScience, 2006, 12(1): 104-108.
[27]韩丽梅, 鞠会艳, 王旭明. 大豆连作土壤有机化合物对大豆根腐病菌生长的影响[J]. 大豆科学, 2004, 23(1): 36-40.
HanLM,JuHY,WangXM.Influenceoftheorganiccompoundsincontinuouscroppingsoybeanonpathogenicofrootrot[J].SoybeanScience, 2004, 23(1): 36-40.
[28]李琼芳. 不同连作年限麦冬根际微生物区系动态研究[J]. 土壤通报, 2006, 37(3): 563-565.
LiQF.Dynamicsofthemicrobialflorainthelirioperhizosphereandoutrhizosphereduringcontinuouscroppingyears[J].ChineseJournalofSoilScience, 2006, 37(3): 563-565.
[29]PerezP.Rootexudatesofwildoats:Allelopathiceffectonspringwheat[J].Phytochemistry, 1991, 30(7): 2199-2202.
[30]TangC,YongC.Collectionandindentificationofallelopathiccompoundsfromtheundisturbedrootsystemofbigaltalimpograss(Hemarthria altissima) [J].PlantPhysiology, 1982, 69: 155-160.
[31]WangTSC,YangTK,ChuangTT.Soilphenoicacidsasplantgrowthinhibitors[J].SoilScience, 1967, 103(44): 239-246.
[32]马瑞霞, 冯怡, 李萱. 化感物质对枯草芽孢杆菌(Bacillus subtilis)在厌氧条件下的生长及反硝化作用的影响[J]. 生态学报, 2000, 20: 452-457.
MaRX,FengY,LiX.EffectsofallelochemicalsongrowthofBacillus subtilisanditsdenitrificationunderanaerobiccondition[J].ActaEcologicaSinica, 2000, 20: 452-457.
[33]高欣欣, 于会泳, 张继光, 等. 烤烟根系分泌物的分离鉴定及对种子萌发的影响[J]. 中国烟草科学, 2012, 33(3): 87-91.
GaoXX,YuHY,ZhangJG, et al.Identificationofchemicalcompositionsofrootexudatesfromflue-curedtobaccoandtheirinfluencetoseedgermination[J].ChineseTobaccoScience, 2012, 33(3): 87-91.
[34]谭秀梅, 王华田, 孔令刚, 等. 杨树人工林连作土壤中酚酸积累规律及对土壤微生物的影响[J]. 山东大学学报(理学版), 2008, 43(1): 14-19.
TanXM,WangHT,KongLY, et al.Accumulationofphenolicacidsinsoilofacontinuouscroppingpolarplantationandtheireffectsonsoilmicrobes[J].JournalofShandongUniversity(NaturalScience), 2008, 43(1): 14-19.
[35]QuXH,WangJG.Effectofamendmentswithdifferentphenolicacidsonsoilmicrobialbiomass,activity,andcommunitydiversity[J].AppliedSoilEcology, 2008, 39: 172-179.
[36]郝文雅, 冉炜, 沈其荣, 任丽轩. 西瓜、水稻根分泌物及酚酸类物质对西瓜专化型尖孢镰刀菌的影响[J]. 中国农业科学, 2010, 43(12): 2443-2452.
HaoWY,RanW,ShenQR,RenLX.Effectsofrootexudatesfromwatermelon,riceplantsandphenolicacidsonFusarium oxysporumf.sp. niveum [J].ScientaAgriculturaSinica, 2010, 43(12): 2443-2452.
[37]曾宇, 叶协锋, 符云鹏, 等. 施加腐熟小麦秸秆对土壤容重及烤烟根系生长的影响[J]. 中国烟草学报, 2014, 20(3): 68-72.
ZengY,YeXF,FuYP, et al.Effectoffertilizingrottenwheatstrawonsoilbulkdensityandrootgrowthofflue-curedtobacco[J].ActaTabacariaSinica, 2014, 20(3): 68-72.
[38]LiuF,WenX.Progressinralationshipbetweenrootexudatesandrhizosphericmicroorganism[J].FoodandDrug, 2006, 8(9): 37-40.
[39]SushmaGS.Chemotacticresponseofplant-growth-promotingbacteriatowardsrootsofvesicular-arbuscularmycorrhizaltomatoplants[J].FEMSMicrobiologyEcology, 2003, 45(3): 219-227.
[40]NayyarA,HamelC,LafondG, et al.Soilmicrobialquality
associatedwithyieldreductionincontinuous-pea[J].AppliedSoilEcology, 2009, 43: 115-121.
[41]BaisHP,WeirTL,PerryLG, et al.Theroleofrootexudates
inrhizosphereinteractionswithplantsandotherorganisms[J].AnnualReviewofPlantBiology, 2006, 57: 233-266.
[42]BroecklingCD,BrozAK,BergelsonJ, et al.Rootexudatesregulatesoilfungalcommunitycompositionanddiversity[J].AppledandEnvironmentalMicrobiology, 2008, 74: 738-744.
[43]KongC,WangP,GuY, et al.Fateandimpactonmicroorganismsofriceallelochemicalsinpaddysoil[J].JournalofAgriculturalandFoodChemistry, 2008, 56: 5043-5049.
[44]WuF,WangX.Effectofp-hydroxybenzoicandcinnamicacids
onsoilfungi(Fusarium oxysporumf.sp. Cucumerinim)growthandmicrobialpopulation[J].AllelopathyJournal, 2006, 18: 129-140.
[45]柯文辉. 烟草连作障碍的根际微生态研究[D]. 福州: 福建农林大学硕士学位论文, 2009.
KeWH.Studiesonrhizospheremicro-ecologyoftobaccosuccessivecroppingobstacle[D].Fuzhou:MSThesisofFujianAgricultureandForestryUniversity, 2009.
Identificationofphenolicacidsintobaccorootexudatesandtheirroleinthegrowthofrhizospheremicroorganisms
LIUYan-xia,LIXiang,CAILiu-ti,ZHANGHeng,SHIJun-xiong﹡
(Guizhou Academy of Tobacco Science, Guiyang 550000, China)
【Objectives】Tobaccocontinuousmono-croppinghascausedveryseriousproblems,includingsoil-bornediseaseoutbreak,tobaccogrowthsuppression,yieldreductionandqualitydecline.Allelopathycomesfromtobaccoandsoilmicroorganismsmaybeoneofthemostimportantreasonsleadingtomono-croppingobstacle.Tobaccorootexudates(TRE)playakeyroleintheplant-microorganisminteractionsintherhizosphere.Itisofgreatimportancetoexploreeffectoftobaccorootexudatesonrhizospheremicroorganisms. 【Methods】Inthisstudy,themainphenolicacidswerescreenedandidentifiedbytheUPLC-Q-TOF/MSmethod,andtheircontentsintobaccorootexudateswereevaluated.EffectofidentifiedphenolicacidsfromTREinliqiudmediumonpathogenanditsantagonistwasinvestigatedbyapplyingexogenousphenolicacids.Besides,thesoilwasaddedwiththeidentifiedphenolicacidsandculturedfor3d.Afterthat,therhizospheremicrobialdiversitiesandcounts,especiallythepopulationofpathogenRalstonia solanacearumanditsantagonistBrevibacillus brevisinthesoilweremeasured. 【Results】 1)Thetobaccorootexudatespromotethegrowthofpathogenby16.8%andsuppressthegrowthofantagonistby29.4%. 2)TwophenolicacidsarescreenedandidentifiedbyUPLC-Q-TOF/MSwiththeconcentrationsof0.25μg/gand1.15μg/gdryroot,respectively. 3)Whentheexogenousphenolicacidswereaddedtotheculturemedia,lowconcentrationsofbenzoicacid(≤2μg/L)and3-phenylpropanoicacid(≤3μg/L)promotethegrowthofthepathogenandantagonist,andthe4μg/LbenzoicaciddoesnotsignificantlyaffectR. solanacearum,whereasthepopulationofantagonistisdecreasedby90.2%.The6μg/L3-phenylpropanoicacidpromotesthegrowthofthepathogenwhileinhibitsthegrowthofantagonistby81.1%.Highconcentrationsofbenzoicacid(≥ 4μg/L)and3-phenylpropanoicacid(≥ 7μg/L)significantlysuppressthepathogenandantagonist. 4)Whenthesoilisappliedwiththe3μg/kgbenzoicacid,thepathogencountwasincreasedby12.3%whiletheantagonistpopulationisdecreasedby21.0%.Besides,thepopulationsofsoilbacteria,actinomycetesandfungiaredeclinedby37.5%,41.9%and55.6%,respectively.The8μg/kg3-phenylpropanoicacidsignificantlysuppressestheantagonistgrowthby14.5%,anddoesnotsignificantlyaffectthepathogen.Soilbacteria,actinomycetesandfungiaredecreasedby69.9%, 57.2%and80.7%,respectivelyunderthisconcentrationof3-phenylpropanoicacid. 5)Afterthe4μg/kgbenzoicacidor7μg/kg3-phenylpropanoicacidapplicationtothesoil,theShannonindex,SimpsonindexandMcIntoshindexaresignificantlydeclinedto57.7%, 88.1%, 73.3%and94.1%, 97.6%, 80.0%ofCK. 【Conclusions】Thetobaccorootexudatespromotethepathogengrowthwhereassuppresstheantagonistgrowth.Themainphenolicacidsintobaccorootexudatesarebenzoicacidand3-phenylpropanoicacid.The4μg/Lexogenousbenzoicacidor6μg/Lexogenous3-phenylpropanoicacidaretheboundaryconcentrations,whichdonotsignificantlysuppressthegrowthofpathogenbutinhibitstheantagonist.Whenbenzoicacidand3-phenylpropanoicacidareappliedtothesoil,thegrowthofpathogenispromoted,whiletheantagonistpopulationandtherhizo-microbialfunctionaldiversityaresignificantlyreducedunderthe3μg/kgbenzoicacidor8μg/kg3-phenylpropanoicacid.Pathogencouldsurviveundertheconditionoftobaccorootexudates,ratherthanantagonist.Thismaybeanexplanationoftobaccobacterialwiltoutbreakresultedfrommono-croppingobstacle.Keywords:tobaccorootexudates;pathogen;antagonist;rhizospheremicroorganism;
2014-10-28接受日期: 2014-12-30网络出版日期: 2015-07-21
国家自然科学基金(41461068); 公益性行业(农业)科研专项(201103004); 中国烟草总公司重点项目(110201002019); 贵州省烟草总公司重点项目(201410); 贵州省科学技术基金项目(黔科合J字[2013]2197号和2198号)资助。
刘艳霞(1982—),女,河北张家口人,博士,副研究员,主要从事植物营养、土壤微生物区系分析等研究。
E-mail:liuyanxia306@163.com。*通信作者E-mail:sjx2196@163.com
S572.01;S154.37
A
1008-505X(2016)02-0418-11
