干旱胁迫下硅对番茄叶片光合荧光特性的影响
2016-08-24曹逼力李炜蔷
曹逼力, 李炜蔷, 徐 坤
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东果蔬优质高效生产协同创新中心,山东泰安 271018)
干旱胁迫下硅对番茄叶片光合荧光特性的影响
曹逼力, 李炜蔷, 徐 坤*
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东果蔬优质高效生产协同创新中心,山东泰安 271018)
【目的】研究干旱胁迫下不同硅水平对水培番茄(Lycopersicon esculentum)叶片气体交换参数和叶绿素荧光参数的影响,为番茄生产合理增施硅肥提供理论依据。【方法】以“金棚1号”番茄为试验材料,采用Hoagland营养液进行了水培试验。聚乙二醇(PEG-6000)模拟干旱条件进行预处理,筛选出适于本研究的PEG-6000干旱胁迫水平为1%; 之后以Na2SiO3·9H2O为硅源,以不添加PEG-6000和Na2SiO3·9H2O的Hoagland营养液为CK0,研究了1%PEG-6000模拟干旱胁迫条件下,Hoagland营养液中分别添加Na2SiO3·9H2O0(CK)、0.6(T1)、1.2(T2)、1.8(T3)mmol/L,对番茄幼苗叶片色素含量、水分状况、气体交换参数及叶绿素荧光参数的影响。【结果】随干旱胁迫时间延长,不同硅水平处理的番茄叶片相对含水量(RWC)、光合色素含量、净光合速率(Pn)、气孔导度(Gs)、最大光化学效率(Fv/Fm)、实际光化学效率(ΦPSⅡ)、光化学淬灭系数(qP)等均持续下降,非光化学淬灭系数(NPQ)逐渐上升,气孔限制值(Ls)先升高后降低,细胞间隙二氧化碳浓度(Ci)先降低后升高,但不同硅水平处理番茄叶片相关参数降低或升高的幅度存在显著差异。在处理第12d时,0.6、1.2mmol/L硅水平处理的番茄叶片RWC较不施硅对照(CK)分别提高18.03%、30.25%,叶绿素含量分别增加64.56%、88.24%,Pn分别增加48.78%、131.71%,ΦPSⅡ分别增加31.68%、62.70%,qP分别增加18.92%、40.54%,NPQ则分别降低9.54%、13.35%。但1.8mmol/L的硅水平处理12d时相关参数除NPQ外,均较对照(CK)显著降低,如叶片RWC、叶绿素含量、Pn、ΦPSⅡ和qP分别降低了17.53%、21.79%、21.95%、10.16% 和5.41%。【结论】 1%PEG-6000模拟干旱胁迫条件下,Hoagland营养液添加1.2mmol/LNa2SiO3·9H2O显著改善了番茄叶片的水分状况,降低了光合色素的降解,提高了叶片色素光化学效率,减轻了光抑制程度,有利于维持较高的光合速率。
番茄; 模拟干旱; 硅; 光合参数; 荧光参数
硅可提高植物对干旱[1]、盐渍[2-3]、重金属[4]及病虫害[5-6]等生物、非生物胁迫的抵御能力[7],被认定为植物的有益元素[8]。水稻是典型的喜硅作物,干旱胁迫条件下加硅可提高水稻叶片叶绿素含量、净光合速率及水分利用效率,增加植株生物量[9],玉米上也有类似的研究结论[10]。干旱条件下小麦施硅有利于维持较高的叶片水分含量,增加气孔导度,增强光合速率[11]。硅还可提高干旱胁迫下黄瓜叶片含水量,减缓叶绿素的降解,从而维持较高的净光合速率[12],并有效提高干旱胁迫下草莓植株的相对生长速率和光合色素含量[13]。硅可改善开心果叶片的水分状况,保护叶片PSII活性,提高最大光化学效率Fv/Fm和实际光化学效率ΦPSII,增强开心果对干旱的耐受性[14]。
番茄(Lycopersicon esculentum)是世界广泛栽培的主要蔬菜之一,因吸硅速率低于吸水速率曾一度被认为是拒硅植物[15]。但梁永超等[16]研究表明,施硅番茄植株茎叶硅含量显著高于不施硅对照,Nikolic等[17]研究认为,番茄硅吸收进程与外界硅水平密切相关,且根部皮层主要以被动扩散方式进行硅的吸收。笔者前文[18]研究也证明,添加适量水平的外源硅,可显著促进番茄幼苗的生长,提高水分利用效率,但关于干旱胁迫下番茄对硅的生理响应特性尚未见报道。为此,本试验研究了聚乙二醇(PEG-6000)模拟干旱条件下,不同硅水平对番茄幼苗气体交换参数和叶绿素荧光参数的影响,以期揭示硅缓解番茄幼苗干旱胁迫的生理机制,为番茄生产合理增施硅肥提供理论依据。
1 材料与方法
1.1试验设计

1.2测定项目与方法

1.2.3 叶片色素及光合参数测定选取幼苗上数第3片展开功能叶,用CIRAS-1型便携式光合仪(英国PP-Systems公司)测定净光合速率(Pn)、气孔导度(Gs)、细胞间隙CO2浓度(Ci)等参数[20]。光合参数测定完成后,剪取叶片,以丙酮提取后比色测定叶片色素含量[21]。
1.2.4 叶片叶绿素荧光参数测定选取幼苗上数第3片展开功能叶,采用Hansatech公司生产的FMS-2型便携脉冲调制式荧光测定仪测定。测定前叶片暗适应20min,在Fv/Fm模式下,先照射0.12μmol/(m2·s)的弱检测光,测定初始荧光Fo,再照射4000μmol/(m2·s)的饱和脉冲光,测定最大荧光Fm,计算Fv/Fm=1-Fo/Fm; 在作用光照射后,依次采用检测光和饱和脉冲光分别照射,测定光适应下最大荧光Fm′,计算NPQ=Fm/Fm′ -1; 关闭作用光后,立即照射1.67μmol/(m2·s)的远红光,测定稳态荧光Fs及光适应下初始荧光Fo,计算qP=(Fm′-Fs)/(Fm′ -Fo′),ΦPSⅡ=1-Fs/Fm′[20]。
2 结果与分析
2.1番茄幼苗在不同水平PEG-6000胁迫下的旱害症状表现
表1表明,随PEG-6000水平的升高,各级旱害症状出现的时间均显著缩短,而在同一PEG-6000胁迫水平下,较高级别旱害症状表现的时间显著延长,如在0.5%PEG-6000胁迫条件下,培养25d才表现出轻度旱害症状,而在4%PEG-6000胁迫条件下,仅培养4d即表现出轻度旱害症状,7d即表现出重度旱害症状。随PEG-6000胁迫水平的升高和胁迫时间的延长,番茄幼苗的旱害指数迅速增加,如胁迫10d时,0.5%、1.0%、2.0%、3.0%、4.0%PEG-6000处理的番茄幼苗旱害指数分别为0、28.7、66.7、93.3和100,而在1.0%PEG-6000胁迫5d、10d、15d、20d时,其旱害指数分别为0、28.7、76.7和100。为便于进行相关试验,本研究选取1%PEG-6000为模拟干旱胁迫水平,从而既保证有适度的胁迫效果,又有较长的胁迫持续时间。
2.2硅对干旱胁迫下番茄叶片光合色素的影响
图1显示,CK0番茄叶片叶绿素含量无显著变化,而CK、T1、T2、T3则均随胁迫时间的延长显著降低,但各处理降幅有显著差异,胁迫3d时,分别较CK0降低了35.10%、13.81%、10.56%和22.57%,胁迫12d时,则分别降低了67.06%、45.80%、38.00%和74.24%。类胡萝卜素含量的变化趋势与叶绿素不同,干旱胁迫初期,T2、T1类胡萝卜素含量升高,之后虽有所降低,但降幅较小,而CK、T3则在胁迫过程中持续降低,胁迫12d时,CK、T1、T2、T3分别比CK0降低了52.52%、10.68%、1.23%和45.10%。表明适量施硅可减缓干旱胁迫引起的番茄幼苗叶片色素降解,但硅浓度过高、过低,则缓解效应均显著降低。

表1 不同浓度PEG-6000在处理不同时间形成的干旱胁迫等级和番茄幼苗曝露于不同浓度 PEG-6000溶液不同时间的干旱胁迫指数
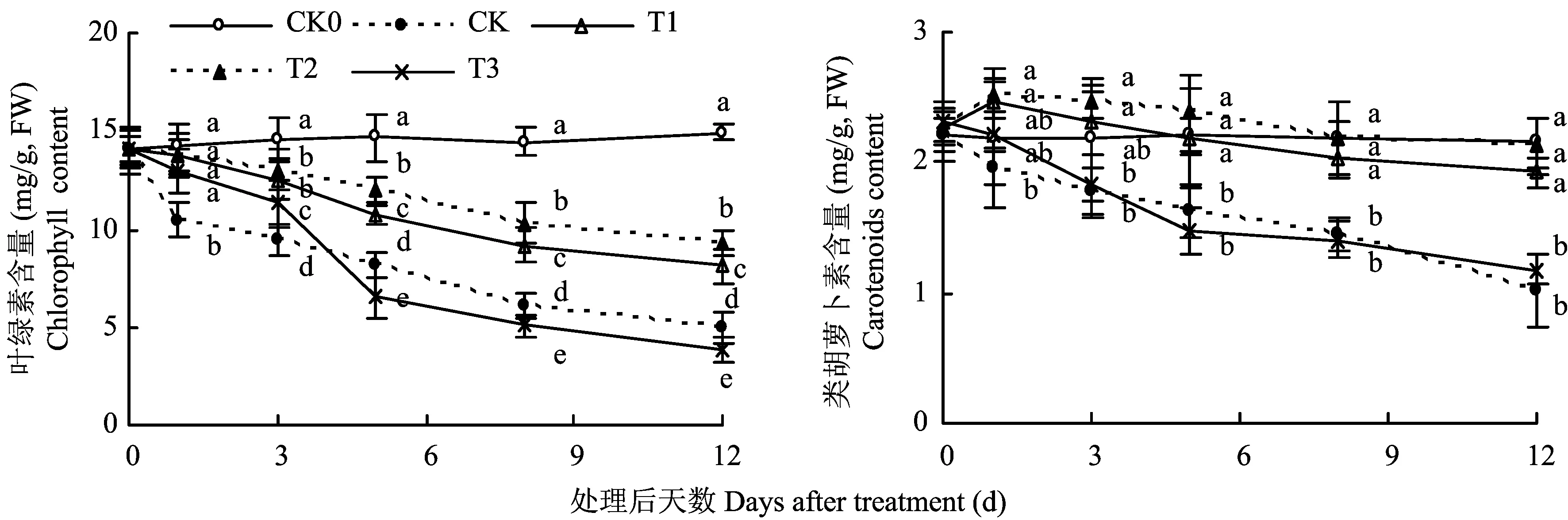
图1 不同硅水平对番茄叶片光合色素的影响Fig.1 Effect of different silicon levels on photosynthetic pigments of tomato leaves
2.3硅对干旱胁迫下番茄叶片水分状况的影响
图2显示,随处理时间延长,PEG-6000模拟干旱处理的番茄叶片RWC均呈逐渐降低的趋势,但T1、T2较CK降幅显著减小,而T3则较CK显著增加,如处理12d时,CK0的RWC为82.93%,而CK、T1、T2、T3分别为49.26%、58.14%、64.16%、40.62%。叶片水分自然饱和亏的变化与RWC相反,表明适宜浓度的硅含量有利于保持番茄叶片的水分,但硅浓度过高则加速了番茄叶片的失水。
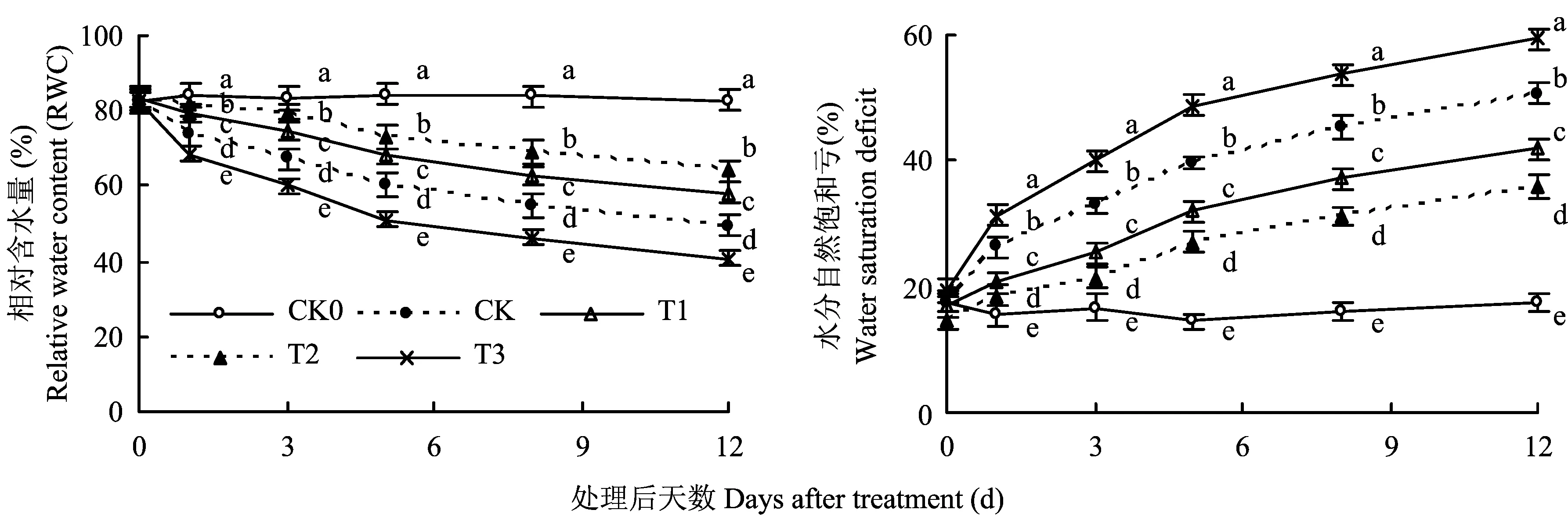
图2 不同硅水平对番茄叶片水分状况的影响Fig. 2 Effect of different silicon levels on water status of tomato leaves
2.4硅对干旱胁迫下番茄叶片光合参数的影响
从图3可看出,干旱胁迫使番茄叶片Pn显著降低,但不同硅水平处理的Pn降幅显著不同,如干旱胁迫3d时,CK和T1、T2、T3分别比CK0降低了17.25%、9.00%、3.96%和25.71%; 随胁迫时间的延长,各胁迫处理叶片Pn迅速降低,如胁迫8d时,CK、T1、T2、T3的Pn分别比CK0降低了50.51%、39.09%、27.66%、56.22%,T1、T2分别比CK高23.08%、46.15%,T3则较CK低11.54%。各处理Gs的变化与Pn基本一致,而Ci在干旱胁迫初期均迅速降低,但CK、T1、T3在胁迫1d达最低值后即快速升高,而T2则在胁迫3d后升高,Ls的变化与Ci相反。

图3 不同硅水平对番茄叶片光合参数的影响Fig.3 Effect of different silicon levels on photosynthetic parameters of tomato leaves
2.5硅对干旱胁迫下番茄叶片叶绿素荧光参数的影响
图4表明,干旱胁迫导致番茄叶片Fv/Fm降低,但胁迫初期降幅较小,至胁迫5d后降幅加快,而适宜浓度的硅处理可缓解Fv/Fm的下降,如处理5d时,尽管CK、T1、T2、T3的Fv/Fm较CK0分别降低了11.21%、8.78%、4.29%、13.63%,但T1、T2分别较CK高2.73%、7.79%,而T3则较CK低2.73%。ΦPSⅡ的变化规律与Fv/Fm相似,但处理间的差异较Fv/Fm加大。图4还表明,干旱胁迫显著降低了番茄叶片光化学猝灭,增加了非光化学猝灭,表明干旱胁迫严重限制了光合电子的传递速度,而适当浓度的硅则可在一定程度上维持光合电子的传递,表现为qP的增加及NPQ的降低。如干旱胁迫处理5d时,T1、T2的qP分别比CK高14.58%、25%,NPQ则分别低13.83%、21.21%,而硅浓度较高的T3则无效果。
3 讨论
番茄对硅的吸收途径,被动扩散吸收和运载体介导的主动排斥共存[17],增施外源硅可促进番茄植株对硅的吸收积累,提高植株各器官硅含量[18]。由于硅能够在植物非生理活性部位沉积形成“硅-角双层”结构,减少水分散失[22],显著降低番茄叶片的蒸腾速率[18]。本试验适量硅处理有效维持了番茄叶片的水分含量,减缓了因水分胁迫引发的Gs降低,从而保障叶肉光合细胞内外CO2的交换,这在干旱胁迫初期表现得尤为典型,但随着胁迫时间的延长,尽管适宜水平硅处理番茄叶片的Gs仍较高,但Ci却较低,这与硅可增强Rubisco羧化酶活性[],从而促进了光合暗反应有关,因此,适量硅处理的番茄叶片气孔限制值在干旱胁迫初期低于未施硅处理,而胁迫后期则相反,表明适量施硅既保证了干旱胁迫早期叶肉细胞内部的CO2供应,又防止了干旱胁迫后期叶肉细胞光合活性的过度降低,从而使番茄叶片Pn整体上均以适量施硅处理显著高于未施硅处理。
适量施硅处理番茄叶片光合速率较高,与硅显著抑制了干旱胁迫导致的叶绿素和类胡萝卜素等叶绿体色素的降解有关[12]。已有报道施硅可有效保护盐胁迫下大麦叶片叶绿体膜的完整性[2],显著提高干旱胁迫条件下小麦幼苗叶片叶绿素含量[24]。较高的叶绿体色素含量可促进光能的捕获和传递[25],类胡萝卜素既传递光能,又能在强光下保护叶绿体[26],从而提高干旱胁迫下植物叶片色素的光化学效率[27]。本试验番茄干旱胁迫过程中,适量硅水平处理的叶片Fv/Fm、ΦPSⅡ、qP显著高于未施硅处理,表明施硅减轻了光合系统的破坏。因为研究过程中发现,随着干旱胁迫时间的延长,不仅NPQ持续增加,Fo亦上升,但1.2mmol/L硅处理番茄叶片Fo的上升时间延迟,表明适量硅水平可有效缓解干旱胁迫对光合机构的破坏,维持光合电子传递,进而增强了光合作用。
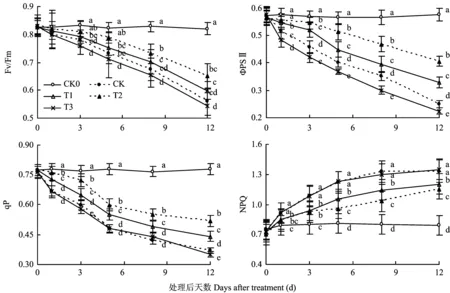
图4 不同硅水平对番茄叶片荧光参数的影响Fig.4 Effect of different silicon levels on Fluorescence parameters of tomato leaves
4 结论
1%PEG-6000模拟干旱12d内,Hoagland营养液添加1.2mmol/L的硅(NaSiO3·9H2O)可显著改善水培番茄叶片水分状况,抑制光合色素降解,提高叶片色素光化学效率,减轻光抑制程度,同时增强光合暗反应能力,从而有利于维持较高的光合速率。
[1]GongH,ChenK,ChenG, et al.Effectsofsiliconongrowthofwheatunderdrought[J].JournalofPlantNutrition, 2003, 26(5): 1055-1063.
[2]LiangY.Effectofsilicononleafultrastructure,chlorophyllcontentandphotosyntheticactivityofbarleyundersaltstress[J].Pedosphere, 1997, 8(4): 289-296.
[3]ZhuZ,WeiG,LiJ,etal.Siliconalleviatessaltstressandincreasesantioxidantenzymesactivityinleavesofsalt-stressedcucumber(Cucumis sativusL.)[J].PlantScience, 2004, 167(3): 527-533.
[4]NeumannD,ZurNiedenU.Siliconandheavymetaltoleranceofhigherplants[J].Phytochemistry, 2001, 56(7): 685-692.
[5]宁东峰 梁永超. 硅调节植物抗病性的机理: 进展与展望[J]. 植物营养与肥料学报, 2014, 20(5): 1281-1288.
NingDF,LiangYC,Silicon-mediatedplantdiseaseresistance:advanceandperspectives[J].JournalofPlantNutritionandFertilizer, 2014, 20(5): 1281-1288.
[6]KvedarasOL,KeepingMG.SiliconimpedesstalkpenetrationbytheborerEldana saccharinainsugarcane[J].EntomologiaExperimentalisetApplicata, 2007, 125(1): 103-110.
[7]GaoD,ChenJN,CaiKZ,LuoSM.Distributionandabsorptionofsiliconinplantanditsroleinplantdiseaseresistanceunderenvironmentalstress[J].ActaEcologicaSinica, 2010, 30(10): 2745-2753.
[8]Pilon-SmitsEAH,QuinnCF,TapkenW, et al.Physiologicalfunctionsofbeneficialelements[J].CurrentOpinioninPlantBiology, 2009, 12(3): 267-274.
[9]陈伟, 蔡昆争, 陈基宁. 硅和干旱胁迫对水稻叶片光合特性和矿质养分吸收的影响[J]. 生态学报, 2012, 32(8): 2620-2628.
ChenW,CaiKZ,ChenJN.Effectsofsiliconapplicationanddroughtstessonphotosythetictraitsandmineralnutreintabsorptionofriceleaves[J].ActaEcologicaSinica, 2012, 32(8): 2620-2628.
[10]李清芳, 马成仓, 尚启亮. 干旱胁迫下硅对玉米光合作用和保护酶的影响[J]. 应用生态学报, 2007, 18(3): 531-536.
LiQF,MaCC,ShangQL.Effectsofsilicononphotosynthesisandantioxidativeenzymesofmaizeunderdroughtstress[J].ChineseJournalofAppliedEcology, 2007, 18(3): 531-536.
[11]GongH,ChenK.Theregulatoryroleofsilicononwaterrelations,photosyntheticgasexchange,andcarboxylationactivitiesofwheatleavesinfielddroughtconditions[J].ActaPhysiologiaePlantarum, 2012, 34(4): 1589-1594.
[12]MaCC,LiQF,GaoYB,XinTR.Effectsofsiliconapplicationondroughtresistanceofcucumberplants[J].SoilScienceandPlantNutrition, 2004, 50(5): 623-632.
[13]王耀晶, 马聪, 张薇, 刘鸣达. 干旱胁迫下硅对草莓生长及生理特性的影响[J]. 核农学报, 2013, 27(5): 703-707.
WangYJ,MaC,ZhangW,LiuMD.Effectsofsilicononstrawberrygrowthandphysiologicalcharacteristicsunderdroughtstress[J].JournalofNuclearAgriculturalSciences, 2013, 27(5): 703-707.
[14]HabibiG,HajibolandR.Alleviationofdroughtstressbysiliconsupplementationinpistachio(Pistacia veraL.)plants[J].FoliaHorticulturae, 2013, 25(1): 21-29.
[15]TakahashiE,MaJF,MiyakeY.Thepossibilityofsiliconasanessentialelementforhigherplants[J].CommentsonAgriculturalandFoodChemistry, 1990, 2(2), 99-122.
[16]梁永超, 陈兴华, 马同生, 等. 硅对番茄生长, 产量与品质的影响[J]. 江苏农业科学, 1993, (4): 48-50.
LiangYC,ChenXH,MaTS, et al.Effectofsiliconongrowth,yieldandqualityoftomato[J].JiangsuAgriculturalSciences, 1993, (4): 48-50.
[17]NikolicM,NikolicN,LiangY, et al.Germanium-68asanadequatetracerforsilicontransportinplantscharacterizationofsiliconuptakeindifferentcropspecies[J].PlantPhysiology, 2007, 143(1):495-503.
[18]曹逼力, 徐坤, 石健, 等. 硅对番茄生长及光合作用与蒸腾作用的影响[J]. 植物营养与肥料学报, 2013, 19(2): 354-360.
CaoBL,XuK,ShiJ, et al.Effectsofsiliconongrowth,photosynthesisandtranspirationoftomato[J].PlantNutritionandFertilizerScience, 2013, 19(2):354-360.
[19]赵秀明, 王飞, 韩明玉, 等. 新引进苹果矮化中间砧木的抗旱性评价[J]. 干旱地区农业研究, 2012, 30(4): 105-112.
ZhaoXM,WangF,HanMY, et al.Evaluationondroughtresistanceofintroducedcultivarsofappledwarfrootstocks[J].AgriculturalResearchintheAridAreas, 2012, 30(4): 105-112.
[20]梁芳, 郑成淑, 孙宪芝, 王文莉. 低温弱光胁迫及恢复对切花菊光合作用和叶绿素荧光参数的影响[J]. 应用生态学报, 2010, 21(1): 29-35.
LiangF,ZhengCS,SunXZ,WangWL.Effectsoflowtemperatureandweaklightstressanditsreccoveryonthephotosynthesisandchlorophyllfluresceneparementsofcutflowerchrysanthemum[J].ChineseJournalofAppliedEcology, 2010, 21(1): 29-35.
[21]赵世杰, 史国安, 董新纯.植物生理学实验指导[M]. 中国农业科学技术出版社, 2002.
ZhaoSJ,ShiGA,DongXC.Techniquesofplantphysiologicalexperiment[J].Beijing:ChineseAgriculturalScienceandTechnologyPress, 2002.
[22]梁永超, 张永春, 马同生. 植物的硅素营养[J]. 土壤学进展, 1993, 21(3): 7-14.
LiangYC,ZhangYC,MaTS.Siliconnutritionofplant[J].ProgressofSoilScience, 1993, 21(3): 7-14.
[23]ZhaoP,GuW,WuS, et al.SiliconenhancesthegrowthofPhaeodactylum tricornutumBohlinundergreenlightandlowtemperature[J].ScientificReports, 2014, 4: 1-10
[24]丁燕芳, 梁永超, 朱佳, 李兆君. 硅对干旱胁迫下小麦幼苗生长及光合参数的影响[J]. 植物营养与肥料学报, 2007, 13(3): 471-478.
DingYF,LiangYC,ZhuJ,LiZJ.Effectsofsilicononplantgrowth,photosyntheticparamentersandsolublesugarcontentinleavesofwheatunderdroughtstress[J].PlantNutritionandFertilizerScience, 2007, 13(3): 471-478.
[25]孙小玲, 许岳飞, 马鲁沂, 周禾. 植株叶片的光合色素构成对遮阴的响应[J]. 植物生态学报, 2010, 34(8): 989-999.
SunXL,XuYF,MaLY,ZhouH.Areviewofacclimationofphotosyntheticpigmentcompositioninplantleavestoshadeenvironment[J].ChineseJournalofPlantEcology, 2010, 34(8): 989-999.
[26]陶俊, 张上隆, 安新民, 赵智中. 光照对柑橘果皮类胡萝卜素和色泽形成的影响[J]. 应用生态学报, 2003, 14(11): 1833-1836.
TaoJ,ZhangSL,AnXM,ZhaoZZ.Effectsoflightoncarotenoidbiosynthesisandcolorformationofcitrusfruitpeel[J].ChineseJournalofAppliedEcology, 2003, 14(11): 1833-1836.
[27]ChenW,YaoX,CaiK,ChenJN.Siliconalleviatesdroughtstressofriceplantsbyimprovingplantwaterstatus,photosynthesisandmineralnutrientabsorption[J].BiologicalTraceElementResearch, 2011, 142(1): 67-76.
Effectsofsilicononphotosyntheticandfluorescencecharacteristicsoftomatoleavesunderdroughtstress
CAOBi-li,LIWei-qiang,XUKun*
(College of Horticulture Science and Engineering,Shandong Agricultural University,State Key Laboratory of Crop Biology,Key Laboratory of Biology and Genetic Improvement of Horticultural Crops in Huang-Huai Region,Ministry of Agriculture,Shandong Collaborative Innovation Center of Fruit & Vegetable Quality and Efficient Production,Tai’an 271018,Shandong,China)
【Objectives】Thestudyoftheeffectofdifferentsiliconsupplementlevelsonthephysiologicalparametersandthegrowthoftomato(Lycopersicon esculentum)seedlingsexposuretodroughtstresswillprovideatheoreticalbasisforunderstandingthemechanismofdroughtstressalleviationwithSi.【Methods】Tomato(Lycopersicon esculentum)cultivar‘jinpeng.1#’wasusedastestedmaterial,andahydroponicculturebasedonHoaglandsolutionwithdifferentsiliconlevelswasconducted.Droughtstresswassimulatedbyadditionof1%polyethyleneglycol(PEG-6000)forthisexperiment.Na2SiO3·9H2Owasusedasthesiliconsource, 0(CK), 0.6(T1), 1.2(T2), 1.8(T3)mmol/LofNa2SiO3·9H2OwerecontainedintheHoaglandsolutionplus1%PEG-6000,andnoneofPEGandNa2SiO3·9H2OwasCK0.Thepigmentcontentoftomatoseedlings,waterstatus,gasexchangeparametersandchlorophyllfluorescenceparameterswereinvestigated. 【Results】ComparedwithCK0,therelativewatercontent(RWC),thephotosyntheticpigments,netphotosyntheticrate(Pn),stomatalconductance(Gs),maximumphotochemicalefficiency(Fv/Fm),actualphotochemicalefficiency(ΦPSⅡ),andphotochemicalquenching(qP)oftomatoseedlingstreatedwithdifferentsiliconlevelsallshowedsteadilydecliningwithextensionofdroughttime,exceptnon-photochemicalquenching(NPQ).Thestomatallimitationvalue(Ls)firstincreasedandafterwardsdecreased.However,theintercellularcarbondioxideconcentration(Ci)firstdecreasedandafterwardsincreased.Thedifferencesinboththeincreasingamplitudeanddeclinerangeoftheaboveparametersweresignificantamongthetreatmentsexposuredtodifferentsiliconconcentrations.Incontrasttotomatoplantwithoutsilicon(CK),intreatmentsofSi0.6and1.2mmol/Lontheday12,theincrementsinRWCwere18.03%and30.25%,inthechlorophyllcontentwere64.56%, 88.24%,inPnwere48.78%, 131.71%,inΦPSwere31.68%, 62.70%,inqPwere18.92%, 40.54%,andNPQweredecreasedby9.54%, 13.35%,respectively.WhileintreatmentofSi1.8mmol/L,thecorrespondingparametersweresignificantlylowerthanCK,exceptNPQ.ThedecrementsinRWC,chlorophyllcontent,Pn,ΦPSⅡandqPwererespectively17.53%, 21.79%, 21.95%, 10.16%and5.41%. 【Conclusions】Under1%ofPEG-6000droughtstress,theadditionofsilicon1.2mmol/LintheHoaglandsolutioncouldsignificantlyimprovethewaterstatusoftomatoleaves,reducethedegradationofphotosyntheticpigment,improvephotochemicalefficiencyintheleavespigment,andreducephotoinhibition.Consequently,thetomatoseedlingsareabletomaintainhighphotosyntheticrateandregulargrowthof‘jinpeng1#’tomato.
tomato;simulatingdrought;silicon;photosyntheticparameters;fluorescenceparameters
2014-11-06接受日期: 2015-06-13网络出版日期: 2015-07-24
山东省现代农业产业技术体系专项资金(SDAIT-02-022-05)资助。
曹逼力(1985—),女,山东临沂人,博士研究生,主要从事蔬菜栽培生理方面的研究。E-mail:superus@sdau.edu.cn
Tel: 0538-8241783,E-mail:xukun@sdau.edu.cn
S641.2;S606+.2
A
1008-505X(2016)02-0495-07
