水稻土和菜田添加碳氮后的气态产物排放动态
2016-08-24王海飞朱高荻魏欢欢何彦芳巨晓棠
刘 燕, 王海飞, 朱高荻, 魏欢欢, 何彦芳, 高 兵, 苏 芳, 巨晓棠
(中国农业大学资源与环境学院,北京 100193; 环境保护部环境工程评估中心,北京 100012)
水稻土和菜田添加碳氮后的气态产物排放动态
刘 燕, 王海飞, 朱高荻, 魏欢欢, 何彦芳, 高 兵, 苏 芳, 巨晓棠*
(中国农业大学资源与环境学院,北京 100193; 环境保护部环境工程评估中心,北京 100012)

菜地和稻田; N2O排放; 硝化作用; 反硝化作用

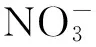
本研究选取长江中游金井河小流域的典型酸性红壤、不同土地利用方式的菜地和稻田土壤为研究对象,采用全自动连续在线培养体系(Robot系统),在控制温度和土壤水分条件下,设置不同碳氮添加处理,探明金井河小流域不同土地利用方式下N2O及其他气体的产生机制、影响因素,为制定不同土地利用方式温室气体减排措施提供理论依据。
1 材料与方法
1.1土壤样品采集点概况

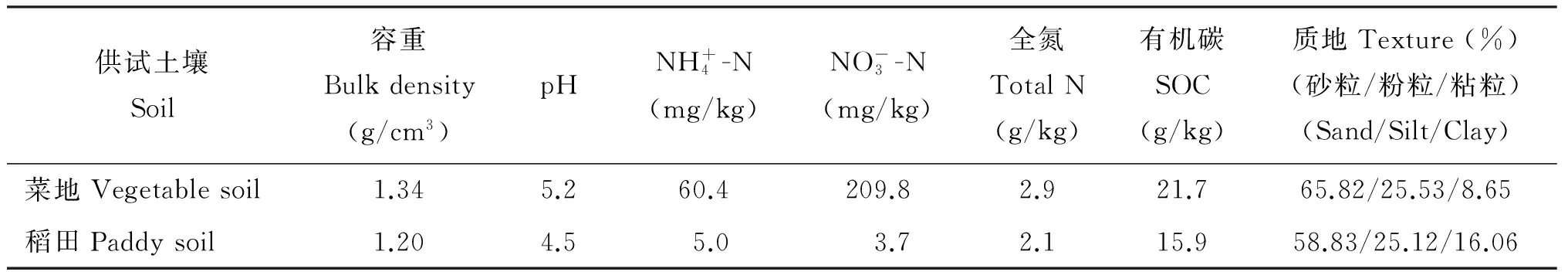
表1 供试土壤部分基本性质
1.2试验设计与方法
试验1: 菜田和稻田好气培养。设不施氮对照(CK)、添加铵态氮 40 mg/kg (AN)、AN+1%硝化抑制剂(AN+NI)、添加硝态氮40 mg/kg (NN)、NN+1%葡萄糖(NN+C)、缺氧条件下NN+1%葡萄糖(NN+C-O2)6个处理,每个处理3次重复,随机排列。
试验2: 稻田土壤淹水培养。设不施氮对照(CK)、AN、AN+NI、AN+1%秸秆(AN+C)、缺氧条件下AN+1%的葡萄糖(AN+C-O2)、NN、NN+C、缺氧条件下NN+C-O28个处理,每个处理3次重复,随机排列。
铵态氮采用硫酸铵,硝态氮采用硝酸钙,硝化抑制剂为二甲基吡唑磷酸盐(DMPP),碳源为葡萄糖和晚稻秸秆。秸秆用球磨仪磨至0.15 mm后混入土壤,全碳含量为324.0 g/kg,全氮含量为12.0 g/kg。两个试验均采用全自动在线培养检测体系(Robot系统)培养测定,培养温度设为20℃,土壤水分含量设置在70%WFPS (土壤孔隙含水量,Water filled pore space),培养周期为15天。
将采集的0—20 cm新鲜土壤样品过2 mm筛,捡出可见石头、植物根系和残渣,储藏在4℃冰箱中,试验前在恒温培养室(20℃)内预培养一周。随后进行正式培养试验,将去离子水或肥料溶液装入50 mL小喷壶并均匀喷洒于试验土壤中(试验2的AN+C处理是先将稻田秸秆与土壤混合均匀,再将肥料溶液喷洒至上),取混合后的新鲜土样(试验1相当于烘干土20 g; 试验2相当于烘干土10 g,使水土比为2 ∶1)装入120 mL的血清瓶中。用橡胶塞和铝环将瓶口密封。用充气抽真空清洗系统(帅恩科技,北京)抽真空后,充满He,反复冲洗3次。对于好气培养处理,在最后一次抽真空后向其中注入氦气和氧气的混合气体,氧浓度为21%。最后用装少量水的注射器平衡瓶内的气压。随后放在20℃的恒温水浴中,启动监测系统,在计算机中设定各参数并编写程序语言,由全自动在线培养体系(Robot系统,挪威生命科学大学研发)自动进样[16],测定瓶内N2O、O2、CO2、NO、CH4和N2的浓度,仪器测定原理见1.3。按照试验要求,试验1监测了O2、NO、N2O和CH4四种气体,试验2监测了O2、NO、N2O、CH4和N2五种气体。在此期间Robot系统每8 h持续测定记录相关气体浓度的变化情况。
1.3气体的采集和测定
Robot系统是由顶空自动采样器(CTC GC-Pal)、双向旋转蠕动泵(Gilson Minipuls 3)、气相色谱仪(Agilent GC 7890A,美国)、氮氧化物分析仪(TAPI Model 200E)、恒温水浴槽、及计算机(PC)等构成,其中气相色谱内安装有3个检测器(ECD、TCD、FID)和4根分离柱(填充柱和毛细柱各2根),能够分离和测定N2O(ECD、TCD)、N2(TCD)、O2(TCD)和CH4(FID),而NO是由氮氧化物分析仪测定[16]。具体的测定原理为: PC程序(Python)命令自动采样器与双向蠕动泵每8小时采集血清瓶顶空气体并实现气压补充(注入相等体积的He),Python程序确保自动采样器以圆形环路轨迹在血清瓶橡胶塞的不同位置采气,从而最小化N2的泄漏。在蠕动泵的配合下自动采样器从采集瓶中采集1 mL气体(同时补充1 mL氦气),送至气相色谱和氮氧化物分析仪中分析测定,每针气体分析时间为5.5 min。同时Python程序在PC文件中自动记录相关数据,所有气体被程序存于独立的文件夹中。试验结束后,运用Robot系统专门的程序软件和数据表格,自动分析气体浓度,采用Robot标准表格换算为气体的累积排放量,具体算法见1.5。每次试验除了样品外,还设置六个标气瓶(两个He瓶、高标N2O瓶、低标N2O瓶、NO标气瓶和空气瓶)测定气体渗透率、稀释效应及定量气体。关于该系统更详细介绍可参考Molstad 等[16]发表的文献,包括用具体试验验证仪器精密度、灵敏度等特征。
1.4土壤样品测定
试验均在加入碳氮等物质后随即和第15天测定土壤无机氮和含水量。称取混匀的新鲜土壤样品12.00 g(试验1)或6.00 g(试验2)于振荡瓶中,加入50 mL(试验1)或25 mL(试验2)1 mol/L的优级纯KCl溶液,在180 r/min下振荡1 h,用定性无铵滤纸将滤液过滤至10 mL 的离心管中,保存在-20℃冰箱中,用三通道连续流动分析仪(AA3)测定滤液中的硝态氮和铵态氮含量,同时测定土壤含水量。
1.5数据处理和统计分析
采用Microsoft Excel 2010进行数据处理,SPSS17.0进行P<0.05水平的显著性检验(检验各处理气态产物累积排放量和无机氮浓度变化的差异性)和Sigmaplot12.5(Systat Software Inc,印度班加罗尔)绘图。
Robot标准表格涉及系统气体渗透率和稀释效应计算。稀释比例(Df)算法有两种: 一是以采样次数为横坐标(X),以积分面积为纵坐标(Y)作图,用Y=AeBX进行拟合,1-eB为每次稀释的降低比例(每次回注He后浓度较回注前浓度的降低比例,即(A-AeB)/A); 二是分别计算[(Yn-Yn-1)/Yn-1],取平均值作为稀释损失(1-eB)。气体渗透率(Lf)算法是在测得Df之后,以Y0=Y0measured为起点依次计算(Yn-Yn-1)-Yn-1×(1-eB)=Lf,计算得Lf均值用于后续计算。此计算值为120 mL血清瓶内的气体渗透浓度,后续样品浓度计算时需要纠正血清瓶顶空体积(Lf×120/Vhs)。采用Robot标准表格换算所得的气体累积排放量为实际浓度,需要在实测浓度的基础上计算,计算公式: Yn实际=Yn实测+稀释浓度损失(=Yn-1实测×Df)-Lf。其中稀释浓度损失与上一实测浓度(Yn-1实测)有关; Df和Lf均需进行体积纠正(Lf×120/Vhs; Df×120/Vhs)。由Robot标准表格换算所得气体累积排放量单位是ppmv,根据公式F=[M×C×(V-m/ρb)×10-3]/(Vm×m)将单位换算为mg/kg,其中F为气体累积排放量(mg/kg),M为气体摩尔质量(g/mol),C为瓶中气体累积排放量(ppmv),V为血清瓶体积120 mL,m为瓶内干土重量(g),ρb为土壤容重(g/cm3),Vm为气体摩尔体积,标准状况下为22.4 L/mol。本文的气体累积排放量是指培养期间培养瓶顶空累积量,包括了开始上机前很短时间已经累积的气体量。通过抽真空注氦气过程尽量除尽瓶中本身存在的大量氮气,但是由于抽洗过程本身的误差导致每个瓶中N2残留量不尽相同,为了消除重复间因起始量不同引起的误差,在计算时减去起始的残留量。其他气体在抽真空注氦气过程中已经归为零,现在图上不是零的原因为: 从抽真空注氦气过程到最后的上机测定,培养瓶大约经过了3 h产生的气体量,但这些不会影响各种气体产生动态和机制。
2 结果与分析
2.1菜地土壤好气培养气态产物动态及N2O产生机制
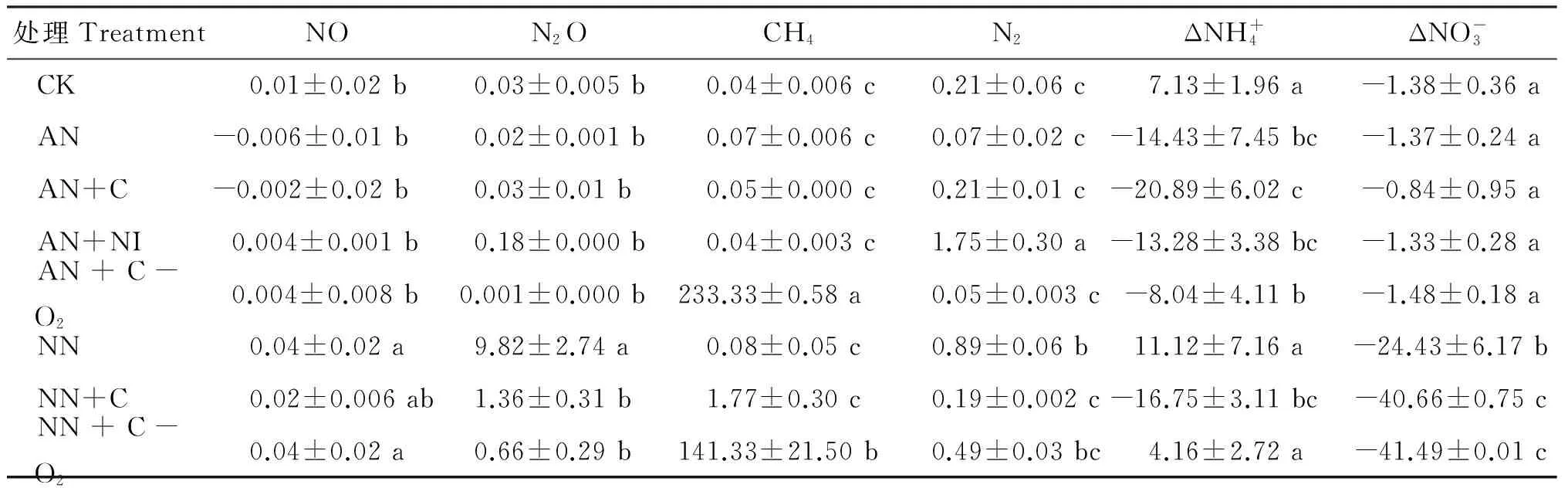
试验1菜地不同碳氮添加气态产物动态和累积排放量如图1和表2所示。铵态氮(AN)添加后N2O排放量是添加硝态氮(NN)排放量的十多倍,说明硝化作用对N2O的贡献较大。添加铵态氮+硝化抑制剂DMPP(AN+NI)后,N2O的排放量降低到对照水平,表明DMPP对酸性红壤N2O有显著抑制作用。由图1还可看出,添加硝态氮(NN)后,培养前期有少量N2O释放,对应NO减少,可能与NO被还原为N2O的反硝化过程有关。添加硝态氮+葡萄糖(NN+C)后,随着培养时间的延长,在氧气几乎耗尽的同时伴随有N2O及NO大量排放和累积。由表2可看出,N2O和NO累积排放量较其他处理有显著差异,说明此时反硝化作用占主导。在硝态氮+葡萄糖同时厌氧(NN+C-O2)处理条件下,由于提供了充足碳源和厌氧环境,先出现一个小的NO累积峰(截图所示),随即出现N2O的累积排放峰,N2O排放减少后可能是N2的大量排放,这很好的响应了反硝化的趋势,此时各气体累积排放量与其他处理都有显著差异。从培养前后土壤无机氮的变化可进一步证明反硝化作用的发生(图2)。这说明酸性红壤菜地受到低碳、缺水的影响,平常状况下抑制了反硝化作用的发生。该处理在培养后期随着土壤中的O2被耗尽,出现完全厌氧条件,伴随CH4的累积排放峰,此时硝态氮含量几乎为零。
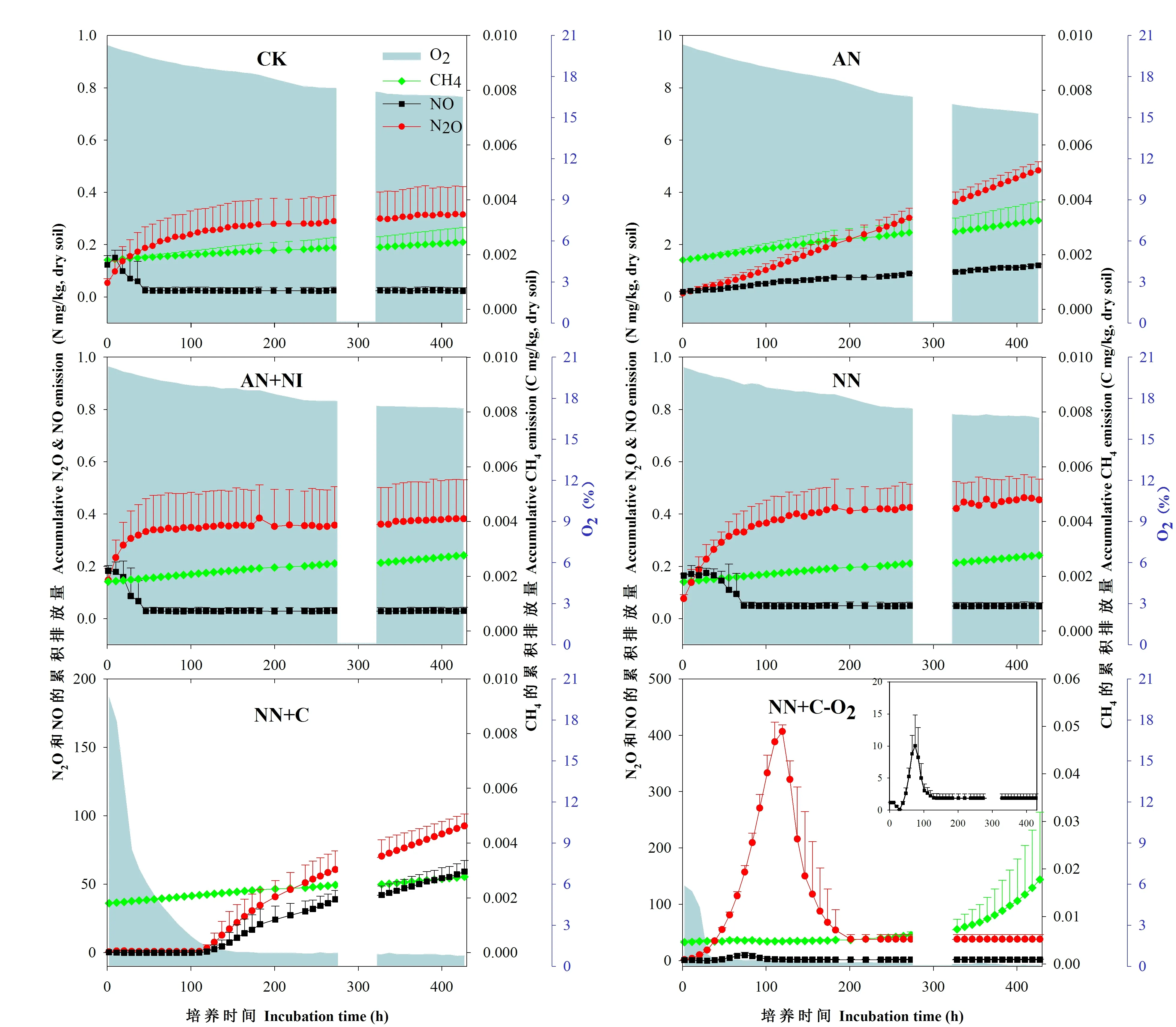
图1 菜地各处理N2O、NO、CH4累积排放量和O2浓度随时间的变化Fig.1 The variation of accumulated N2O, NO, CH4 emissions and O2 concentration in different treatments in vegetable soil
从菜地各处理培养前后无机氮的变化看(图2),CK、AN、NN和AN+NI处理无机氮略有增加,可能是有机氮的矿化引起。NN+C处理无机氮总含量有所降低,可能是转化为气态产物损失,也可能是被微生物固持。NN+C-O2处理总的无机氮含量明显降低,并且主要成分为铵态氮,这主要是反硝化作用的强烈发生导致的。
2.2稻田好气条件下土壤气态产物动态及N2O产生机制
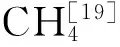
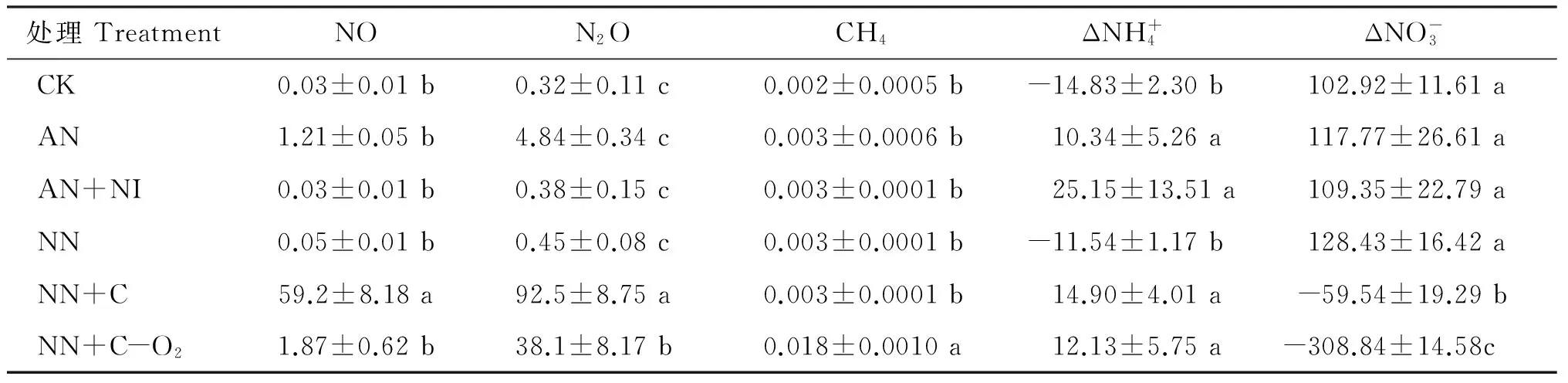
表2 菜地各处理气体累积排放量及培养前后无机氮变化量(mg/kg)
注(Note): 数据为3个重复的平均值±标准误差Data in the table are average of triplicates±standard error; Δ表示在培养阶段末期无机氮浓度与加入碳氮底物后培养初期的浓度之差Δ represents the difference of inorganic nitrogen concentration at the end of the incubation period and its concentration in the initial incubation period with carbon and nitrogen substrates being added; 不同小写字母表示两个处理间差异显著Different small letters indicate significant difference (P<0.05)
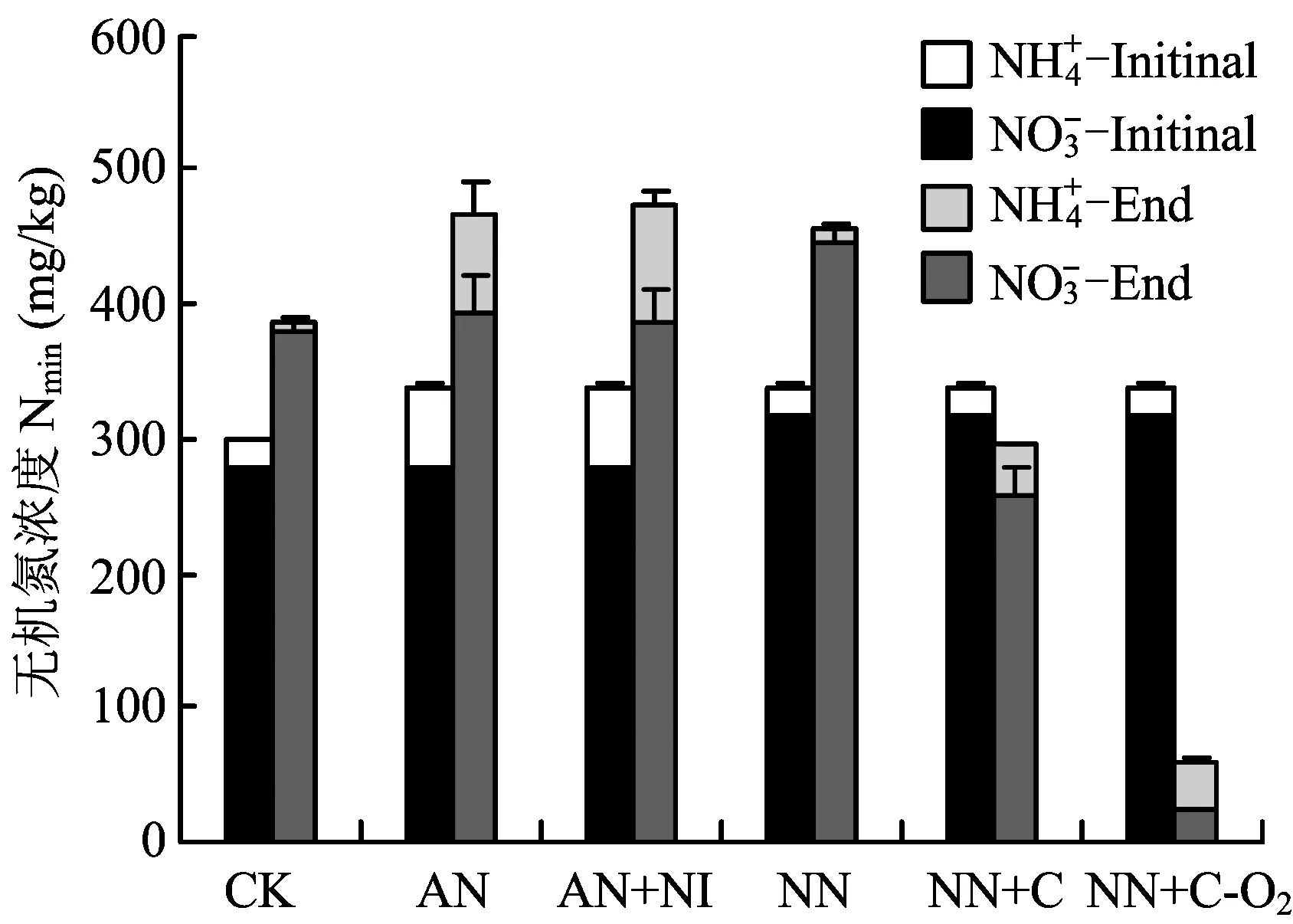
图2 菜地各处理、含量动态变化Fig.different treatments in vegetable soil
稻田好气条件下各处理的无机氮变化如图4所示,CK、AN、AN + NI和NN处理无机氮增加可能是有机氮的矿化引起。NN+C、NN+C-O2处理总无机氮有所降低,对应N2O和NO大量排放,并且其无机氮以铵态氮形式存在,这主要是因为反硝化作用的强烈进行所致。
2.3稻田淹水条件下气态产物动态及N2O产生机制
稻田淹水条件下各碳氮添加处理的气态产物动态和累积排放量如图5和表4所示(试验2)。淹水稻田土壤气体变化与稻田好气条件下有很大差别。稻田淹水条件下铵态氮(AN)、铵态氮+抑制剂(AN+NI)、铵态氮+秸秆(AN+C)以及缺氧时铵态氮+葡萄糖(AN+C-O2)处理与CK相比,均无N2O和NO的累积,此时N2是主要的产物,说明硝化作用很弱,反硝化作用增强。AN+C-O2处理中有大量CH4产生,与其他处理呈显著差异(表4),表明在厌氧条件下提供碳源后,产甲烷菌活性增强。加入硝态氮(NN)后,出现明显的N2O累积,随后N2O含量趋于稳定,伴随N2的产生,该处理N2O和NO排放量较之前处理都有显著差异(表4),说明此时反硝化作用强烈发生。添加硝态氮+碳源(NN+C)后,N2O大量排放和累积,随着O2的消耗,出现厌氧状况,N2O开始发生反硝化作用产生N2,并伴随一定的CH4排放和累积。在缺氧条件下添加硝态氮+葡萄糖(NN+C-O2)处理先出现一个小的NO累积峰,随后出现明显的N2O排放高峰,而后N2O开始减少,对应大量N2累积,并伴随CH4的大量产生,表明此时反硝化作用强烈,而且此时硝态氮含量几乎为零。
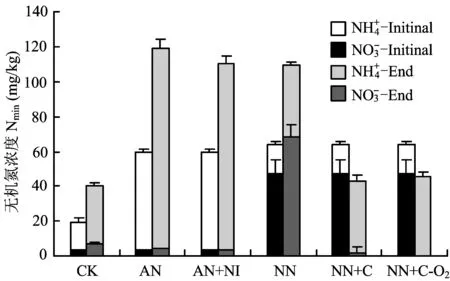
图4 稻田各处理、动态含量变化Fig.different treatments in paddy soil

表3 稻田各处理气体累积排放量及培养前后无机氮变化(mg/kg)
注(Note): 数据为3个重复的平均值±标准误差Data in the table are average of triplicates±standard error; Δ表示在培养阶段末期无机氮浓度与加入碳氮底物后培养初期的浓度之差Δ represents the difference of inorganic nitrogen concentration at the end of the incubation period and its concentration in the initial incubation period with carbon and nitrogen substrates being added; 数据后不同小写字母表示两个处理间差异显著Values followed by different small letters indicate significant difference (P<0.05).
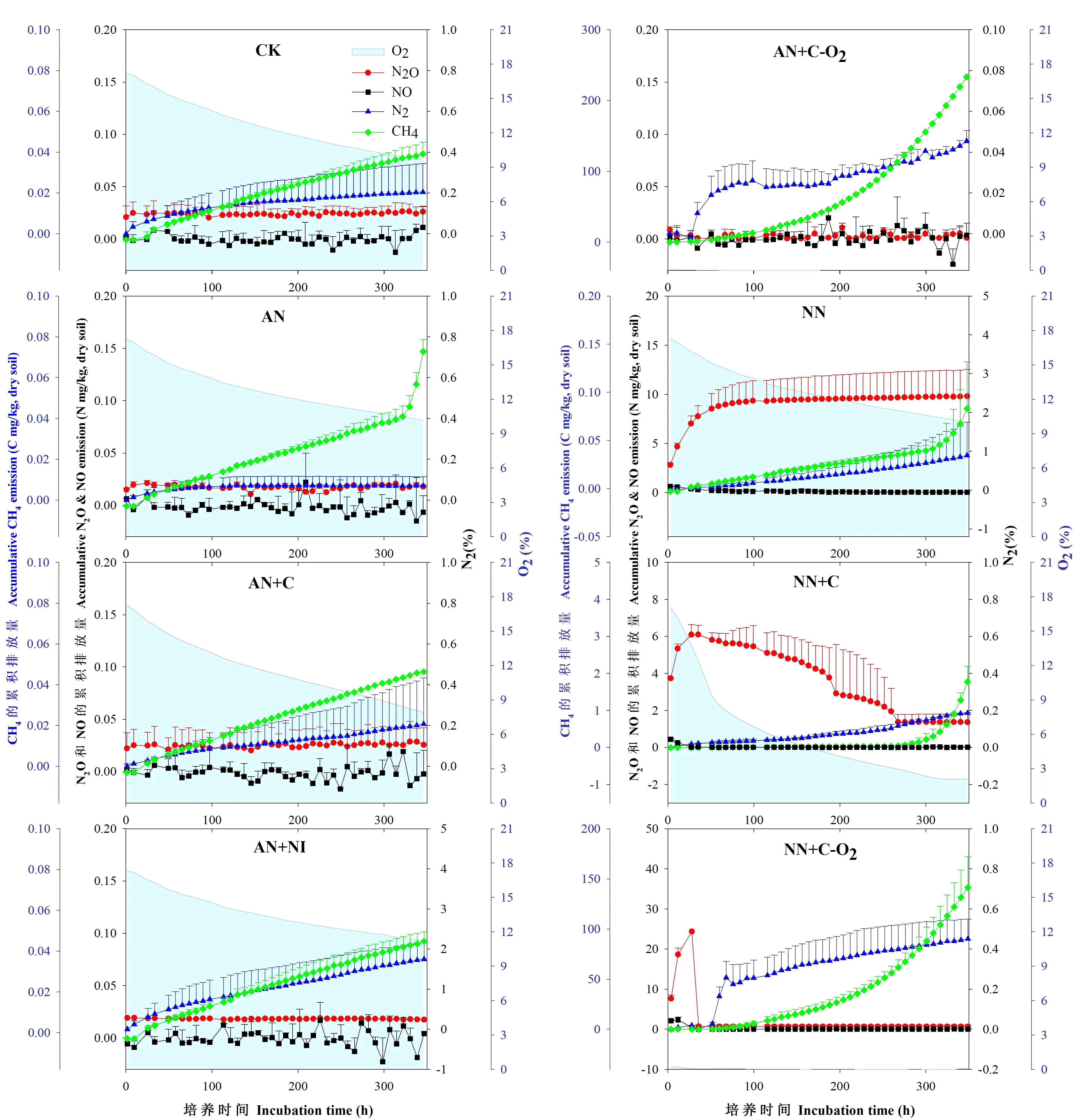
图5 稻田淹水条件下各处理N2O、NO、N2、CO2、CH4累积排放量和O2浓度随时间变化Fig.5 The variation of accumulated N2O, NO, N2, CO2, CH4 emissions and O2concentration in different treatments in the flooded paddy soil
处理TreatmentNON2OCH4N2ΔNH+4ΔNO-3CK 0.01±0.02b0.03±0.005b0.04±0.006c0.21±0.06c7.13±1.96a-1.38±0.36aAN-0.006±0.01b0.02±0.001b0.07±0.006c0.07±0.02c-14.43±7.45bc-1.37±0.24aAN+C-0.002±0.02b0.03±0.01b0.05±0.000c0.21±0.01c-20.89±6.02c-0.84±0.95aAN+NI0.004±0.001b0.18±0.000b0.04±0.003c1.75±0.30a-13.28±3.38bc-1.33±0.28aAN+C-O20.004±0.008b0.001±0.000b233.33±0.58a0.05±0.003c-8.04±4.11b-1.48±0.18aNN 0.04±0.02a9.82±2.74a0.08±0.05c0.89±0.06b11.12±7.16a-24.43±6.17bNN+C 0.02±0.006ab1.36±0.31b1.77±0.30c0.19±0.002c-16.75±3.11bc-40.66±0.75cNN+C-O2 0.04±0.02a0.66±0.29b141.33±21.50b0.49±0.03bc4.16±2.72a-41.49±0.01c
注Note: 数据为3个重复的平均值±标准误差Data in the table are average of triplicates±standard error; Δ表示在培养阶段末期无机氮浓度与加入碳氮底物后培养初期的浓度之差Δ represents the difference of inorganic nitrogen concentration at the end of the incubation period and its concentration in the initial incubation period with carbon and nitrogen substrates being added; 数据后不同小写字母表示两个处理间差异显著Values followed by different small letters indicate significant difference (P<0.05).
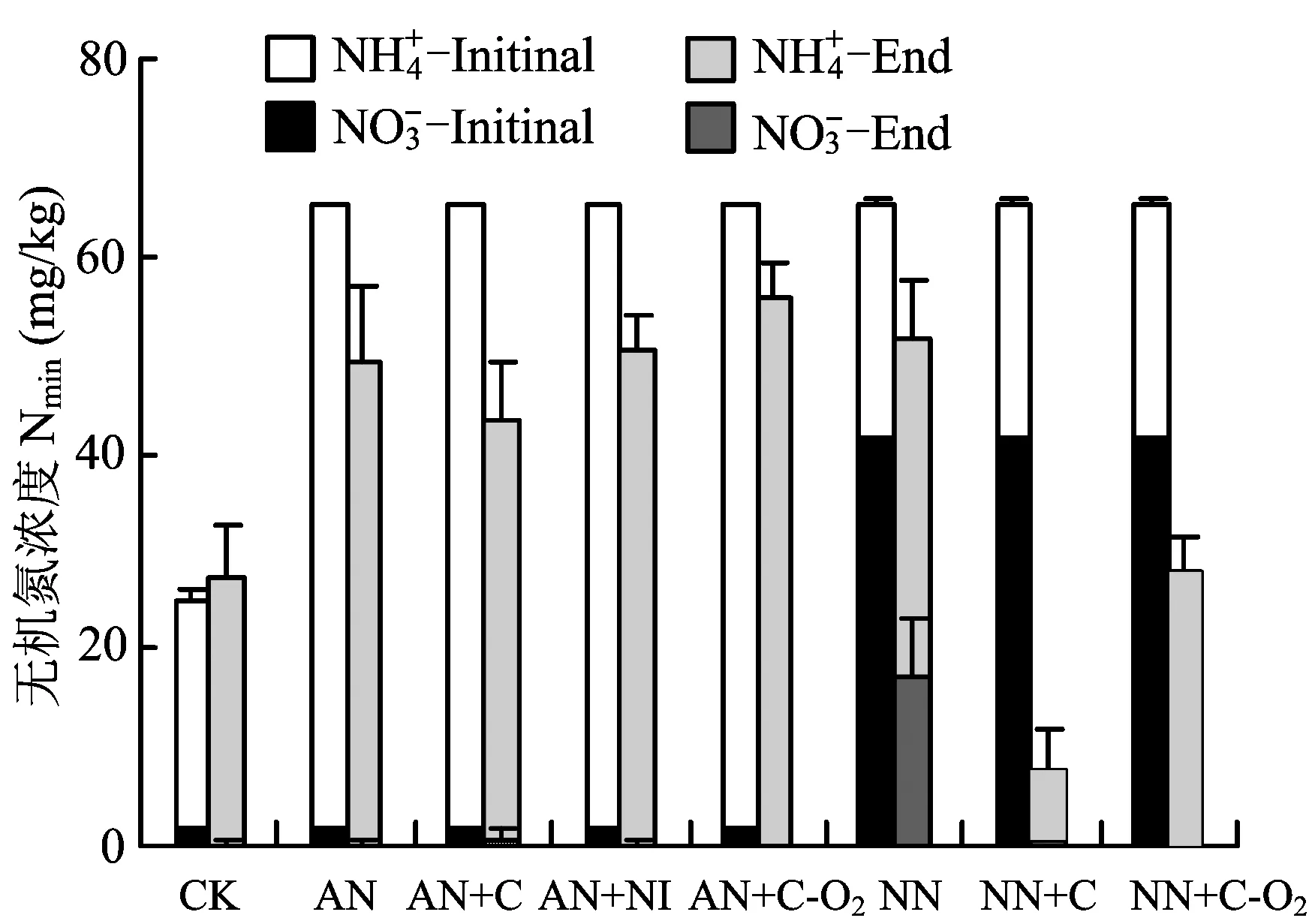
图6 稻田淹水条件下各处理、含量动态变化Fig.different treatments in the flooded paddy soil
3 讨论
3.1菜田土壤硝化-反硝化机制
菜地土壤中,好气培养初期由于加入铵态氮,硝化作用贡献了大量的N2O的排放,添加硝态氮后N2O排放量明显小于铵态氮处理,说明反硝化对其贡献很小,这与阎宏亮等[20]的研究结果类似。Ju等[21]研究了半湿润温带季风气候条件下N2O排放机理,结果表明高累积硝酸盐条件下,硝化过程仍是N2O排放的主要途径,这是因为旱地土壤水分状况和土壤有机碳限制了反硝化作用的进行。本研究菜地酸性红壤受到低碳、较低含水量的影响,反硝化受到了抑制。当提供充足的碳源和厌氧条件,出现N2O和NO的大量排放,说明易氧化态的有机碳能够促进酸性红壤反硝化N2O的产生[22],这与前人的研究结果[21, 23-24]一致。有机碳含量的高低和有效性对反硝化强度至关重要,它既能够为反硝化微生物提供电子供体和能源,又能够被好氧分解,有利于形成土壤厌氧微域,决定土壤反硝化作用的潜力。
3.2稻田土壤的硝化-反硝化机制

4 结论
1)不同土地利用方式土壤N2O产生机制不同,菜地土壤N2O主要来自于硝化作用,好气稻田和淹水稻田N2O主要来源于反硝化作用。
2)由于缺少充足的碳源和厌氧环境,酸性红壤菜地和稻田好气条件下土壤反硝化作用受到限制。当提供充足的碳源和厌氧环境,其反硝化作用强烈发生。
3)反硝化产物组成、产物累积量及出峰顺序与碳源和氧气浓度有关。
4)淹水稻田添加碳源和氮源后,N2为主要产物; 只添加硝态氮,N2O成为主要气态产物。
[1]Robertson G P, Paul E A, Harwood R R. Greenhouse gases in intensive agriculture: contributions of individual gases to the radiative forcing of the atmosphere[J]. Science, 2000, 289(5486): 1922-1925.
[2]Chhabrn A. Carbon and other biogeochemical cyeles[A]. Stocker T F, Qin D, Plattner G K,etal. Climate change 2013[C] UK: Cambodge University Press, 2013. 465-570.
[3]Blackmer A M, Bremner J M. Inhibitory effect of nitrate on reductionof N2O to N2by soil microorganisms[J]. Soil Biology and Biochemistry, 1978, 10(3): 187-191.
[4]Smith K A, Arah J R M. Losses of nitrogen by denitrification and emissions of nitrogen oxides from soils[C].Proceedings of the Fertiliser Society, 1990, 299. 1-34.
[5]Poth M, Focht D D.15N kinetic analysis of N2O production by Nitrosomonas europaea: an examination of nitrifier denitrification[J]. Applied and Environmental Microbiology, 1985, 49(5): 1134-1141.
[6]Wrage N, Van Groenigen J W, Oenema O, Baggs E M. A novel dual-isotope labelling method for distinguishing between soil sources of N2O[J]. Rapid Communications in Mass Spectrometry, 2005, 19(22): 3298-3306.
[7]王朝辉,宗志强,李生秀,陈宝明.蔬菜的硝态氮累积及菜地土壤的硝态氮残留[J].环境科学, 2002, 23(3): 79-83.
Wang Z H, Zong Z Q, Li S X, Chen B M. Nitrate accumulation in vegetables and its residual in vegetable fields[J]. Environmental Science, 2002, 23(3): 79-83.
[8]Lin X G, Yin R, Zhang H Y,etal. Changes of soil microbiologicalproperties caused by land use changing from rice-wheat rotation to vegetable cultivation[J]. Environmental Geochemistry and Health, 2004, 26(2): 119-128.
[9]王朝辉, 宗志强, 李生秀. 菜地和一般农田土壤主要养分累积的差异[J]. 应用生态学报, 2002, 13(9): 1091-1094.
Wang Z H, Zong Z Q, Li S X. Difference of several major nutrients accumulation in vegetable and cereal crop soils[J]. Chinese Journal of Applied Ecology, 2002, 13(9): 1091-1094.
[10]丁洪, 王跃思, 项虹艳, 李卫华. 菜田氮素反硝化损失与N2O排放的定量评价[J]. 园艺学报, 2004, 31(6): 762-766.
Ding H, Wang Y S, Xiang H Y, Li W H.Denitrification loss and N2O emission from nitrogen fertilizer applied to vegetable field[J]. Acta Horticulturae Sinica, 2004, 31(6): 762-766.
[11]Guang X X, Xiao Y Y. Analysis and estimation of N2O emissionsfrom croplands in China and its mitigation options[J]. Rural Eco-Environment, 2000, 16(4): 1-6.
[12]Huang S, Pant H K, Lu J. Effects of water regimes on nitrous oxide emission from soils[J]. Ecological Engineering, 2007, 31(1): 9-15.
[13]Yuan W L, Cao C G, Cheng J P, Xie N N. CH4and N2O emissions and their GWPs assessment in intermittent irrigation rice paddy field[J]. Scientia Agricultura Sinica, 2008, 41(12): 4294-4300.
[14]李香兰, 徐华, 蔡祖聪. 稻田CH4和N2O排放消长关系及其减排措施[J]. 农业环境科学学报, 2008, 27(6): 2123-2130.
Li X L, Xu H, Cai Z C. Trade-off relationship and mitigation options of methane and nitrous oxide emissions from rice paddy field[J]. Journal of Agro-Environment Science, 2008, 27(6): 2123-2130.
[15]Zou J W, Huang Y, Zong L G,etal. Carbon dioxide, methane,and nitrous oxide emissions from a rice-wheat rotation as affected by crop residue incorporation and temperature[J]. Advances in Atmospheric Sciences, 2004, 21(5): 691-698.
[16]Molstad L, Dörsch P, Bakken L R. Robotized incubation system for monitoring gases (O2, NO, N2O, N2) in denitrifying cultures[J]. Journal of Microbiological Methods, 2007, 71(3): 202-211.
[18]王小治, 孙伟, 尹微琴, 封克. pH升高对红壤硝化过程产生N2O的影响[J]. 土壤, 2009, 41(6): 962-967.
Wang X Z, Sun W, Yin W Q, Feng K. Effects of pH on N2O emission from nitrification in acid soil[J]. Soils, 2009, 41(6): 962-967.
[19]邹建文, 黄耀, 宗良纲, 等. 稻田CO2、CH4和N2O排放及其影响因素[J]. 环境科学学报, 2003, 23(6): 758-764.
Zou J W, Huang Y, Zong L G,etal. A field study on CO2, CH4and N2O emissions from rice paddy and impact factors[J]. Acta Scientiae Circumstantiae, 2003, 23(6): 758-764.
[20]阎宏亮, 张璇, 谢立勇, 等. 菜地土壤施用铵态氮肥后N2O排放来源及其动态[J]. 中国农业气象, 2014, 35(2): 141-148.
Yan H L, Zhang X, Xie L Y,etal. Study on the pathway and dynamics of N2O emissions from the vegetable soil fertilized with ammonium nitrogen[J]. Chinese Journal of Agrometeorology, 2014, 35(2): 141-148.
[21]Ju X, Lu X, Gao Z,etal. Processes and factors controlling N2O production in an intensively managed low carbon calcareous soil under sub-humid monsoon conditions[J]. Environmental Pollution, 2011, 159(4): 1007-1016.
[22]贾俊仙, 李忠佩, 车玉萍. 添加葡萄糖对不同肥力红壤性水稻土氮素转化的影响[J]. 中国农业科学, 2010, 43(8): 1617-1624.
Jia J X, Li Z P, Che Y P. Effects of glucose addition on N transformations in paddy soils with a gradient of organic C content in subtropical China[J]. Scientia Agricultura Sinica, 2010, 43(8): 1617-1624.
[23]王海飞, 贾兴永, 高兵, 等. 不同土地利用方式土壤温室气体排放对碳氮添加的响应[J]. 土壤学报, 2013, 50(6): 1172-1182.
Wang H F, Jia X Y, Gao B,etal. Response of greenhouse gas emission to application of carbon and nitrogen in soils different in land use[J]. Acta Pedologica Sinica, 2013, 50(6): 1172-1182.
[24]宋贺, 徐新超, 王敬国, 等. 设施菜田土壤剖面中的反硝化特征[J]. 植物营养与肥料学报, 2012,18(4): 860-867.
Song H, Xu X C, Wang J G,etal. Characteristics of denitrification in different soil layers in a greenhouse vegetable cropping system[J]. Plant Nutrition and Fertilizer Science, 2012, 18(4): 860-867.
[25]Mørkved P T, Dörsch P, Bakken L R. The N2O product ratio of nitrification and its dependence on long-term changes in soil pH[J]. Soil Biology and Biochemistry, 2007, 39(8): 2048-2057.
[26]赵维, 蔡祖聪. 氮肥品种对亚热带土壤N2O排放的影响[J]. 土壤学报, 2009, 46(2): 248-254.
Zhao W, Cai Z C. Effects of fertilizers on N2O emissions from subtropical soils in China[J]. Acta Pedologica Sinica, 2009, 46(2): 248-254.
[27]Zumft W G. Cell biology and molecular basis of denitrification[J]. Microbiology and Molecular Biology Reviews, 1997, 61(4): 533-616.
[28]Schreiber K, Krieger R, Benkert B,etal. The anaerobic regulatorynetwork required forPseudomonasaeruginosanitrate respiration[J]. Journal of Bacteriology, 2007, 189(11): 4310-4314.
[29]Gillam K M, Zebarth B J, Burton D L. Nitrous oxide emissions from denitrification and the partitioning of gaseous losses as affected by nitrate and carbon addition and soil aeration[J]. Canadian Journal of Soil Science, 2008, 88(2): 133-143.
[30]李贵桐, 赵紫娟, 黄元仿, 李保国. 秸秆还田对土壤氮素转化的影响[J]. 植物营养与肥料学报, 2002, 8(2): 162-167.
Li G T, Zhao Z J, Huang Y F, Li B G. Effect of straw returning on soil nitrogen transformation[J]. Plant Nutrition and Fertilizer Science, 2002, 8(2): 162-167.
[31]Philippot L, Andert J, Jones C M,etal. Importance of denitrifierslacking the genes encoding the nitrous oxide reductase for N2O emissions from soil[J]. Global Change Biology, 2011, 17(3): 1497-1504.
[32]陈诺, 廖婷婷, 王睿, 等. 碳底物含量对厌氧条件下水稻土N2、N2O、NO、CO2和CH4排放的影响[J]. 环境科学, 2014, 35(9): 3595-3604.
Chen N, Liao T T, Wang R,etal. Effect of carbon substrate concentration on N2, N2O, NO, CO2and CH4emissions from a paddy soil in anareobic condition[J]. Environment Science, 2014, 35(9): 3595-3604.
[33]Senbayram M, Chen R, Budai A,etal. N2O emission and the N2O/(N2O+N2) product ratio of denitrification as controlled by available carbon substrates and nitrate concentrations[J]. Agriculture, Ecosystems & Environment, 2012, 147: 4-12.
Dynamics of gaseous production after addition of carbon and nitrogen in paddy and vegetable soils
LIU Yan, WANG Hai-fei, ZHU Gao-di, WEI Huan-huan, HE Yan-fang, GAO Bing, SU Fang, JU Xiao-tang*
(CollegeofResourcesandEnvironmentalSciences,ChinaAgriculturalUniversity,Beijing100193,China;AppraisalCenterforEnvironment&Engineering,MinistryofEnvironmentalProtection,Beijing100012,China)
vegetable garden and paddy field; N2O emission; nitrification; denitrification
2014-12-17接受日期: 2015-03-06网络出版日期: 2015-10-16
国家973项目(2012CB417105);国家自然科学基金重点项目(41471190)资助。
刘燕(1991—),女,青海民和人,硕士研究生,主要从事农田土壤N2O产生机制方面的研究。E-mail: liuycau@163.com
Tel: 010-62733459, E-mail: juxt@cau.edu.cn
S143.1; X171
A
1008-505X(2016)02-0326-11
