基于自增强Ru(Ⅱ)复合物构建的新型电致化学发光免疫传感器检测甲胎蛋白
2016-08-19廖妮
廖 妮
(攀枝花学院 生物与化学工程学院,四川 攀枝花 617000)
基于自增强Ru(Ⅱ)复合物构建的新型电致化学发光免疫传感器检测甲胎蛋白
廖妮*
(攀枝花学院生物与化学工程学院,四川攀枝花617000)

自增强;免疫传感器;甲胎蛋白;金纳米笼;空心纳米金
甲胎蛋白(AFP)是存在于正常胎儿血清中的一种胎儿特异性蛋白质,新生儿期迅速减少。1964年,Tatarinow研究发现原发性肝癌患者的血清中存在AFP,之后大量临床研究证实AFP对原发性肝细胞癌有高度的特异性,因此,AFP常作为诊断和检测原发性肝癌的一个特异性临床指标。AFP是一种分子量为6.9万的含糖量3%的糖蛋白,在正常成人血清中的平均含量为3.4 ng/mL,但在某些肿瘤尤其是原发性肝癌患者的血清中AFP含量升高,如果成人血清中的AFP含量高于20 ng/mL,则意味着可能患有肝癌[1-6]。因次,血清中的AFP含量可作为临床诊断某些肿瘤的指标,其研究及检测具有重要意义。


1 实验部分
1.1仪器与试剂
MPI-E型电致化学发光分析系统(西安瑞迈分析仪器有限公司、中科院长春应化所),在检测过程中光电倍增高压为800 V,扫速为100 mV/s;采用三电极体系:修饰的玻碳电极为工作电极,Ag/AgCl电极为参比电极,铂丝电极为对电极。循环伏安测试采用CHI610A型电化学工作站(上海辰华仪器公司),三电极体系:修饰的玻碳电极为工作电极,甘汞电极为参比电极,铂丝电极为对电极。不同纳米复合物的形貌采用S-4800扫描电子显微镜(日本Hitachi Instrument公司)表征,加速电压为20 kV。BRANSONIC 200超声清洗仪(德国Branson Ultraschall公司)。
1.2自增强钌化合物Ru(Ⅱ)@L-Arg的合成
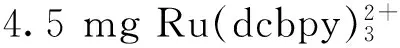

图1 Ru(Ⅱ)@L-Arg化合物的合成示意图Fig.1 A schematic diagram of the procedure used to prepare Ru(Ⅱ)@L-Arg compounds
1.3金纳米笼(AuNCs)的制备
金纳米笼(AuNCs)是以纳米银立方为模板,利用置换反应制得。合成步骤参考文献[32]进行简单的修改。①纳米银立方体(AgNCs)的合成:取30 mL乙二醇(EG)置于三颈烧瓶中,在磁力搅拌下加热至160 ℃,然后加入10 mL含0.2 g聚乙烯吡咯烷酮的乙二醇溶液,随后加入400 μL 3 mmol/L硫化钠的乙二醇溶液。最后将3 mL硝酸银的乙二醇溶液(282 mmol/L)缓慢滴加到上述溶液中,在该过程中保持溶液温度为160 ℃,观察到溶液的颜色由白色变为褐色时,停止加热,室温冷却,用丙酮离心洗涤,将收集的纳米银立方再溶于30 mL水中。②金纳米笼的制备:将制备好的30 mL纳米银立方水溶液加热至沸,保持沸腾10 min,然后缓慢加入100 μL氯金酸(10 mg/mL),并持续沸腾,观察到溶液的颜色从棕色变为粉红色,并保持不变后停止加热,冷却,得到金纳米笼。将得到的胶体金纳米笼离心洗涤,分散在PBS(pH 7.4)缓冲溶液中,备用。
1.4空心纳米金颗粒(HGNPs)的制备
于100 mL水中加入400 μL 0.1 mol/L的柠檬酸钠和400 μL新制备的1.0 mol/L硼氢化钠,室温下通氮气搅拌,然后加入100 μL 0.5 mol/L氯化钴溶液,继续通氮气搅拌,溶液由粉红色变成棕灰色,说明钴离子被还原成钴纳米粒子,然后继续搅拌10 min,使钴离子反应完全。加大氮气通入量,将300 μL 0.1 mol/L的氯金酸溶液缓慢滴加到混合溶液中,滴加完成后停止通氮气,继续室温下搅拌,使钴纳米粒子在空气中再氧化成钴离子,溶液由棕灰色变成蓝紫色,搅拌30 min后,将该溶液离心洗涤,然后分散到1 mL PBS(pH 7.4)缓冲溶液中得到空心纳米金颗粒。
1.5巯基化碳纳米管(SH-CNTs)的制备
CNTs的巯基化是通过化学手段使其表面带巯基,具体制备过程如下:首先,为使CNTs得到更多活化的羧基基团,取2.0 mg CNTs和0.5 mg PTCA溶于5.0 mL水中,在室温条件下搅拌12 h,通过π-π堆积作用使PTCA修饰到CNTs上[33]。向上述溶液中加入2.5 mL EDC和NHS(4∶1)混合溶液搅拌一夜,充分活化CNTs表面的羧基后,加入L-半胱氨酸(L-Cys)持续搅拌8 h,即生成表面带巯基的CNTs(SH-CNTs)。将得到的SH-CNTs离心洗涤,分散在水中,备用。
1.6二抗复合物(Ab2/AuNCs/Ru(Ⅱ)@L-Arg@BSA)的制备
取1 mL自增强Ru(Ⅱ)@L-Arg溶液,向上述溶液中加入2 mL金纳米笼(AuNCs)溶液,然后加入0.2 mL anti-AFP(Ab2),并使其在4 ℃下反应6 h。4 ℃下以10 000 r/min离心30 min除去多余的Ab2,得到产物Ab2/AuNCs/Ru(Ⅱ)@L-Arg。然后将其分散于1 mL PBS(pH 7.4)缓冲溶液中,向其中加入0.5 mL BSA(25 mg/mL)溶液,并于4 ℃下反应4 h以封闭AgNCs表面的非特异性结合位点。最后,通过离心得到产物Ab2/AuNCs/Ru(Ⅱ)@L-Arg@BSA,并分散于1 mL PBS(pH 7.4)中,4 ℃下储存备用。
1.7免疫传感器的制备
电极在修饰之前,先用0.3 μm和0.05 μm的Al2O3粉在抛光布上打磨光滑,然后分别用水和乙醇依次超声清洗,除去表面杂质,最后用水清洗干净,表面光滑的电极在空气中放置,干燥备用。
电致化学发光免疫传感器的示意图如图2所示:取1 mL SH-CNTs加至2 mL 0.5%的Nafion乙醇溶液并超声处理,得到均匀的Nf-SH-CNTs悬浊液。取3 μL Nf-SH-CNTs滴加到预处理过的玻碳电极表面,在室温下空气中干燥,得到一层致密的Nf-SH-CNTs膜。将Nf-SH-CNTs修饰电极浸泡在10 μL空心纳米金颗粒溶液中,在湿润的条件下孵育5 h,通过Au-S键作用将空心纳米金颗粒修饰到电极表面得到HGNPs/Nf-SH-CNTs修饰电极。取15 μL AFP抗体溶液(简称Ab1)在4 ℃下孵育12 h。用水冲去物理吸附的Ab1,然后孵育15 μL 1%牛血清白蛋白(BSA)1 h,用水洗涤后,将得到的免疫传感器储存于4 ℃备用。

图2 电致化学发光免疫传感器组装过程示意图Fig.2 Schematic diagrams of the immunosensor A:the preparation procedure of Ab2/AuNCs/Ru(Ⅱ)@L-Arg(Ab2 bioconjugates)
1.8电极的测试过程
根据双抗夹心模式,在测试之前,将免疫传感器在常温条件下浸于不同浓度的AFP溶液中孵育30 min。将该修饰有目标抗原的传感器与Ab2/AuNCs/Ru(Ⅱ)@L-Arg二抗复合物探针孵育40 min,通过免疫反应结合到电极表面。然后采用MPI-E型电致化学发光分析系统对所修饰电极的电致化学发光行为进行研究,测试底液为3 mL 0.1 mol/L PBS(pH 7.4)缓冲溶液。
2 结果与讨论
2.1不同纳米材料的表征
采用扫描电子显微镜(SEM)对HGNPs和AuNCs两种纳米材料进行表征(图3)。由图可见HGNPs是形状规则的球形(图3A),球形的中间颜色较暗,说明其为空心结构,与文献报道[34]一致。而AuNCs的形貌呈方形结构(图3B),与文献[32,35]所描述的基本相似,说明AuNCs已成功制备。
2.2实验条件的优化及机理探究
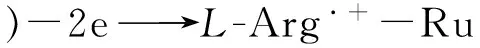
(1)

(2)

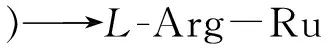
(3)
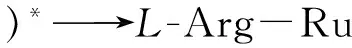
(4)
由于该传感器用于抗原的检测,考虑到蛋白质分子的活性问题,因此选择对Ru(Ⅱ)@L-Arg的ECL发光性能影响较小且接近人体液体环境的pH值,即pH 7.4的PBS缓冲溶液作为检测底液。

图3 HGNPs(A)和AuNCs(B)的扫描电镜表征图Fig.3 SEM images of HGNPs(A) and AuNCs(B)

图4 裸玻碳电极在Ru(Ⅱ)@L-Arg,Ru(Ⅱ),Ru(Ⅱ)+ L-Arg中的ECL响应对比Fig.4 ECL responses of the bare GCE in PBS(pH=7.4)(a), containing Ru(Ⅱ)(b),containing Ru(Ⅱ) and L-Arg(c), containing Ru(Ⅱ)@L-Arg(d)
进一步考察了体系中自增强Ru(Ⅱ)@L-Arg,Ru(Ⅱ)和Ru(Ⅱ)+L-Arg的ECL响应情况(如图4),在扫描电压0.2~1.25 V范围内,分别将裸玻碳电极在Ru(Ⅱ)、Ru(Ⅱ)@L-Arg的PBS缓冲溶液(pH 7.4)中进行扫描,并在Ru(Ⅱ)的PBS缓冲溶液(pH 7.4)中加入L-Arg对裸玻碳电极进行扫描。结果表明,在PBS中加入L-Arg后Ru(Ⅱ)的ECL强度(曲线c)明显高于未加L-Arg(曲线b)时的强度,但低于Ru(Ⅱ)@L-Arg(曲线d)的ECL强度。而裸玻碳电极在PBS(pH 7.4)缓冲溶液底液中进行扫描时无ECL信号(曲线a)。实验结果显示,Ru(Ⅱ)@L-Arg自增强化合物可得到更强的发光强度。这表明分子内ECL反应因缩短了电子传输路径,减少了能量损失,可以得到比分子间ECL反应更强的发光强度。

图5 电极不同修饰阶段的循环伏安图Fig.5 Cyclic voltammograms(CVs) of different modified electrodes a.GCE,b.Nf-SH-CNTs/GCE,c.HGNPs/Nf-SH-CNTs/GCE, d.anti-AFP/HGNPs/Nf-SH-CNTs/GCE,e.BSA/anti-AFP/ HGNPs/Nf-SH-CNTs/GCE,f.AFP/BSA/anti-AFP/HGNPs/ Nf-SH-CNTs/GCE,g.Ab2/AuNCs/Ru(Ⅱ)@L-Arg/AFP/ BSA/anti-AFP/HGNPs/Nf-SH-CNTs/GCE;insert:EIS plots of different modified electrodes;buffer:0.1 mol/L PBS0.1 mol/L KCl
2.3电极修饰过程的循环伏安及电化学交流阻抗性能表征
采用电化学交流阻抗技术(EIS)对电极的每一步修饰进行表征(图5插图)。由裸玻碳电极的阻抗图(曲线a)可以看到本体阻抗较小,说明裸玻碳电极具有很好的导电性能。当巯基化的碳纳米管修饰到玻碳电极上后(曲线b),半圆直径减小,说明电极阻抗值减小,表明巯基化的碳纳米管能促进电子传输。引入HGNPs后,由于HGNPs具有良好的电子传输能力且增大了电极的比表面积,所以半圆直径显著减少,说明电极阻抗值继续降低(曲线c)。Anti-AFP蛋白分子固载到电极表面后,电极阻抗值明显增大(曲线d),这是由于形成了蛋白质分子层,不利于电子的传输。用BSA封闭多余结合位点(曲线e),进一步孵育上抗原(曲线f),然后孵育二抗偶合物(曲线g)。电极阻抗值持续增大,这是由于蛋白质层阻碍了电极表面电子的传输。
2.4免疫传感器的性能
2.4.1免疫传感器对AFP的电致化学发光响应特性在优化条件下,通过夹心免疫反应策略测定了不同标准浓度的AFP抗原对应的ECL响应。结果显示ECL响应信号随抗原浓度的增加而不断增加,在1.0×10-5~1.0×10-3ng/mL范围内,ECL强度(I)与AFP抗原浓度(c,ng/mL)的对数值呈良好的线性关系,线性方程为I=2 252 lgc+11 662,相关系数(r2)为0.993;检出限(S/N=3)为3.3×10-6ng/mL。将该方法与已报道的其他检测AFP的方法进行比较(见表1),结果可见本方法对于AFP的检测具有较好检出限和较宽的检测范围。
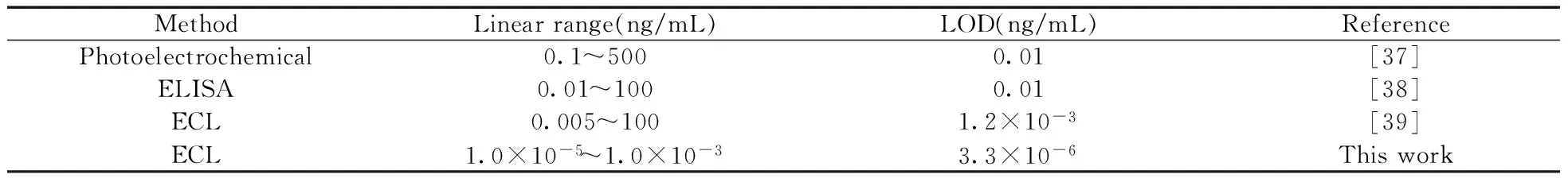
表1 该实验方法与其他检测AFP方法的对比
2.4.2免疫传感器的稳定性、重现性及选择性考察了该ECL免疫传感器的稳定性,将目标传感器在测试底液中连续扫描10圈,其ECL的响应变化很小,说明该传感器的稳定性很好。取10支制备的ECL免疫传感器,分别对1 pg/mL的AFP标准溶液进行检测,测得10支传感器结果的相对标准偏差(RSD)为2.3%,表明该免疫传感器具有良好的精确性和重现性。
选择高浓度的癌胚抗原(CEA)、免疫球蛋白G(IgG)和牛血清白蛋白(BSA)作为干扰物质,考察了该免疫传感器的选择性。结果显示,当无目标抗原时,传感器对3种干扰物混合溶液的ECL响应与空白时的ECL响应无明显差异,说明该传感器的非特异性吸附很小,而将干扰蛋白掺入目标蛋白得到的ECL信号与只有目标抗原时获得的ECL响应信号差异也很小(RSD为2.5%),说明在有其他干扰蛋白存在时制得的免疫传感器对AFP的检测特异选择性也比较理想。
2.4.3免疫传感器的回收率测定为进一步研究该免疫传感器的实际应用价值,配制含不同浓度AFP(0.05,0.10,0.50,1.00 ng/mL)的血清样品,用制备的传感器对其进行检测,结果显示,该免疫传感器的回收率分别为106.0%,98.0%,106.0%,102.0%,可较好地应用于人血清样品中AFP的直接检测。
3 结 论
本文利用共反应试剂和发光体形成一个分子,合成了一种新型的ECL发光体Ru(Ⅱ)复合物。基于该Ru(Ⅱ)的复合物,以金纳米笼作为固载基质构建了一个信号增强型的免疫传感器用于AFP抗原检测,此ECL系统表现出显著增强的电致化学发光效率和稳定性,且无需添加共反应试剂。该ECL免疫传感器为超低浓度蛋白质的检测提供了一种方法参考,并为生物分子检测和生物分析提供了新的可能性。
[1]Ju H X,Yan G F,Chen F,Chen H Y.Electroanalysis,1999,11(2):124-128.
[2]Nomura F,Ohnishi K,Tanabe Y.Cancer,1989,64(8):1700-1707.
[3]Wang H J,Niu H,Cao Y L,Liu H J.Biosens.Bioelectron.,2012,37:6-10.
[4]Niu H,Yuan R,Chai Y Q,Mao L,Yuan Y L,Zhuo Y,Yuan S R,Yang X.Biosens.Bioelectron.,2011,26:3175-3180.
[5]Yang Z J,Fu Z F,Yan F,Liu H,Ju H X.Biosens.Bioelectron.,2008,24(1):35-40.
[6]Zhang Q Y,Wang X,Li Z J,Lin J M.Anal.Chim.Acta,2009,631(2):212-217.
[7]Liew M,Groll M C,Thompson J E,Call S L,Moser J E,Hoopes J D,Voelkerdingl K,Wittwer C.Biotechniques,2007,42:327-333.
[8]Cai Y Y,Li H,Du B,Yang M H,Li Y,Wu D,Zhao Y F,Dai Y X,Wei Q.Biomaterials,2011,32(8):2117-2123.[9]Teramura Y,Iwata H.Anal.Biochem.,2007,365(2):201-207.
[10]Wang G L,Yuan J L,Gong B L,Matsumoto K,Hu Z D.Anal.Chim.Acta,2001,448(1):165-172.
[11]Zhu J,Li J J,Wang A Q,Chen Y,Zhao J W.NanoscaleRes.Lett.,2010,5:1496-1501.
[12]Wang H Y,Sun D Y,Tan Z A,Gong W,Wang L.ColloidsSurf.B,2011,84(2):515-519.
[13]Bertoncello P,Forster R J.Biosens.Bioelectron.,2009,24(11):3191-3200.
[14]Swanick K N,Ladouceur S,Zysman-Colman E,Ding Z F.Chem.Commun.,2012,48:3179-3181.
[15]Chen Z H,Liu Y,Wang Y Z,Zhao X,Li J H.Anal.Chem.,2013,85(9):4431-4438.
[16]Ding C F,Wei S,Liu H T.Chem.-Eur.J.,2012,18:7263-7268.
[17]Deng S Y,Ju H X.Analyst,2013,138:43-61.
[18]Nie G M,Bai Z M,Yu W Y,Chen J.Biomacromolecules,2013,14(3):834-840.
[19]Kim Y,Kim J.Anal.Chem.,2014,86(3):1654-1660.
[20]Kumar S S,Bard A J.Anal.Chem.,2013,85(1):292-298.
[21]Wei H,Liu J F,Zhou L L,Li J,Jiang X,Kang J Z,Yang X R,Dong S J,Wang E K.Chem.Eur.J.,2008,14:3687-3693.
[22]White H S,Bard A J.J.Am.Chem.Soc.,1982,104(25):6891-6895.
[23]Liu X Q,Shi L H,Niu W X,Li H J,Xu G B.Angew.Chem.Int.Ed.,2007,119:425-428.
[24]Liu X Q,Niu W X,Li H J,Han S,Hu L Z,Xu G B.Electrochem.Commun.,2008,10:1250-1253.
[25]Yue X X,Zhu Z Y,Zhang M N,Ye Z Q.Anal.Chem.,2015,87:1839-1845.
[26]Li J G,Yan Q Y,Gao Y L,Ju H X.Anal.Chem.,2006,78:2694-2699.
[27]Lei R,Wang X Y,Zhu S F,Li N.Sens.ActuatorsB,2011,158:124-129.
[28]Sun J,Liang P,Martin M T,Dong L.US,2005,Patent 20050181443.
[29]Sun S G,Yang Y,Liu F Y,Fan J L,Peng X J,Kehr J,Sun L C,Peng X J.DaltonTrans.,2010,39:8626-8630.[30]Zhuo Y,Liao N,Chai Y Q,Gui G F,Zhao M,Han J,Xiang Y,Yuan R.Anal.Chem.,2014,86(2):1053-1060.[31]Au L,Chen Y,Zhou F,Camargo P H,Lim B,Li Z Y N,Ginger D S,Xia Y N.NanoRes.,2008,6(1):441-449.
[32]Skrabalak S E,Chen J,Sun Y G,Lu X M,Au L,Cobley C M,Xia Y N.Acc.Chem.Res.,2008,41(12):1587-1595.
[33]Wu B H,Hu D,Kuang Y J,Yu Y M,Zhang X H,Chen J H.Chem.Commun.,2011,47:5253-5256.
[34]Gui G F,Zhuo Y,Chai Y Q.Biosens.Bioelectron.,2013,47:524-529.
[35]Gui G F,Zhuo Y,Chai Y Q,Yuan R.Anal.Chem.,2014,86(12):5873-5880.
[36]Lin Z Y,Chen J H,Chen G N.Luminescence,2008,23(6):365-369.
[37]Xu R,Jiang Y D,Xia L,Zhang T X,Xu L,Zhang S,Liu D L,Song H W.Biosens.Bioelectron.,2015,74:411-417.[38]Wang Z F,Liu N,Feng F,Ma Z F.Biosens.Bioelectron.,2015,70:98-105.
[39]Zhang L N,Li L,Ma C,Ge S G,Yan M,Bian C R.Sens.ActuatorsB,2015,221:799-806.
Detection of α-Fetoprotein Using a Novel Electrochemiluminescence Immunosensor Based on Self-enhanced Ru(Ⅱ) Complex
LIAO Ni*
(College of Biological and Chemical Engineering,Panzhihua University,Panzhihua617000,China)
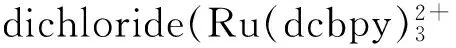
self-enhanced;immunosensor;α-fetoprotein;Au nanocages;hollow gold nanospheres
2015-12-20;
2016-01-22
国家自然科学基金资助项目(21575116)
廖妮,硕士,助教,研究方向:纳米材料与生物传感器,Tel:0812-3370459,E-mail:707584550@qq.com
doi:10.3969/j.issn.1004-4957.2016.07.009
O657.1;O629.7
A
1004-4957(2016)07-0832-07
