Kurthiahuakuii LAM0618T重组酚氧化酶LaclK对乙基紫脱色的研究
2016-08-15阮志勇宋金龙王彦伟何明雄刘小秧胡国全
郭 翔, 阮志勇, 宋金龙, 周 珊, 王彦伟, 何明雄, 刘小秧, 胡国全*
1.农业部沼气科学研究所, 农业部农村可再生能源开发利用重点实验室, 成都 610041;2.中国农业科学院农业资源与农业区划研究所, 农业部农业微生物资源收集与保藏重点实验室, 北京 100081;3.中国水产科学研究院, 北京 100141
KurthiahuakuiiLAM0618T重组酚氧化酶LaclK对乙基紫脱色的研究
郭翔1,2,阮志勇2*,宋金龙3,周珊2,王彦伟1,何明雄1,刘小秧2,胡国全1*
1.农业部沼气科学研究所, 农业部农村可再生能源开发利用重点实验室, 成都 610041;2.中国农业科学院农业资源与农业区划研究所, 农业部农业微生物资源收集与保藏重点实验室, 北京 100081;3.中国水产科学研究院, 北京 100141

乙基紫;LaclK;KurthiahuakuiiLAM0618T;酚氧化酶;脱色
染料广泛应用于纺织染色、纸张、化妆品、食品等行业[1]。在工业上,全世界每年使用的染料和色素有近10 000种,超过7×105t[2]。在染色过程中,有10%~15%的染料随着废水排放。有色工业废水水质成分复杂,毒性大,严重威胁着水生生物和人类的健康[3]。因此废水中染料的去除或降解对生态环境和生物健康具有极其重要的意义。
染料废水处理方法主要分为物理法、化学法和生物法3种。传统的物理法和化学法有很多不足,如高成本、低效率、条件限制、其他废水成分的干扰、形成毒性更大的副产物以及密集的能源需求等[4]。生物法主要是依靠微生物合成的酶,如漆酶、细胞色素P450和木质素降解酶等[5,6]。生物法拥有高效节能、绿色环保、适应面广等优势,已成为处理染料废水的重要方法[7]。
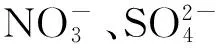
1 材料与方法
1.1材料
E.coliBL21(DE3)/pET28a-laclK原核表达菌株为本实验构建;2,6-二甲氧基苯酚购自Sigma公司;染料乙基紫和其他试剂如甲醇、乙醇、二甲基亚砜、 NaCl、NaF、NaBr、KI、NaNO3、Na2SO4、腐殖酸等均为市售分析纯或色谱纯。
1.2方法
1.2.1重组酶的诱导表达与纯化E.coliBL21(DE3)/pET28a-laclK接种于液体LB培养基(含50 μg/mL卡那霉素),37℃、180 r/min摇床培养到OD600≈ 0.6,加入终浓度为0.2 mmol/L的IPTG和0.2 mmol/L CuSO4·5H2O,16℃、120 r/min摇床继续培养16 h, 诱导LaclK蛋白的表达。
非变性条件下6×His标签重组LaclK蛋白的纯化参考QIAexpress Ni-NTA Fast Start Handbook手册操作。利用Ni-NTA柱亲和纯化蛋白,洗脱液经50 mmol/L Tris-HCl(pH 8.0)缓冲液反复超滤,脱盐和除去咪唑。纯化的蛋白融于50 mmol/L Tris-HCl(pH 8.0),4℃保存备用。SDS-PAGE电泳分析蛋白纯度,Solarbio BCA蛋白浓度测定试剂盒测定蛋白浓度。
1.2.2重组酶活力的测定以2,6-二甲氧基苯酚为底物测定酶活力,测定前3 min在60℃、pH 7.0的反应体系内468 nm处吸光值的线性变化情况[14]。在标准条件(60℃,pH 7.0 )下,1 min内氧化1 μmol 2,6-二甲氧基苯酚所需的酶量定义为1个酶活力单位(U)。
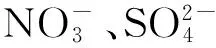
脱色率(%) =[(A0-At)/A0]×100
A0、At分别为对照组和实验组反应t小时后在596 nm处的吸光值。
对照组不添加酶液以等量的缓冲液代替,每组3个重复实验。
1.2.4给酶量对脱色的影响以10 μmol/L乙基紫为底物,测定给酶量25~300 U/L时的脱色率变化。
1.2.5脱色时间对脱色的影响以20 μmol/L乙基紫为底物,给酶量200 U/L,测定不同脱色时间(20~180 min)脱色率的变化。
1.2.6乙基紫浓度对脱色的影响选择不同浓度(10~100 μmol/L)的乙基紫为底物,在给酶量200 U/L的条件下,测定其脱色情况。
1.2.7pH对脱色的影响以20 μmol/L乙基紫为底物,给酶量200 U/L,在不同pH(3.0~10.0)条件下测定脱色率。pH缓冲体系分别为 50 mmol/L柠檬酸-柃檬酸钠缓冲液(pH 3.0~5.0),50 mmol/L 磷酸盐缓冲液 (pH 6.0~7.0),50 mmol/L Tris缓冲液 (pH 8.0~9.0),50 mmol/L甘氨酸-氢氧化钠缓冲液(pH 9.0~10.0)。
1.2.8卤离子对脱色的影响以20 μmol/L乙基紫为底物,给酶量200 U/L,测定不同浓度(10~1 000 mmol/L)的卤离子(F-、Cl-、Br-、I-)对脱色的影响。
1.2.9有机试剂对脱色的影响以20 μmol/L乙基紫为底物,给酶量200 U/L,考察不同浓度(5%~30%,V/V)的有机试剂(甲醇、乙醇和二甲基亚砜)对脱色的影响。
2 结果与分析
2.1纯酶的制备与酶活测定
用SDS-PAGE分析酶的表达和纯化过程,图1第3泳道为经过纯化后的LaclK,表明目的蛋白已获得纯化。以2,6-二甲氧基苯酚为底物,LaclK比酶活为0.43 U/mg。

图1 SDS-PAGE分析纯化的LaclKFig.1 SDS-PAGE analysis of the purified LaclK.M.蛋白Maker;1.菌体裂解上清;2.菌体裂解沉淀;3.纯化的LaclK。
2.2给酶量对乙基紫脱色的影响
在给酶量为100 U/L 的条件下,LaclK对20 μmol/L乙基紫脱色率为68%;当给酶量达到200 U/L,脱色率增至84%;而继续增加给酶量,脱色率不再明显变化(图2)。因此,选择200 U/L为最适给酶量。

图2 给酶量对脱色的影响Fig.2 Effects of LaclK amount on decolorization of ethyl violet.
2.3接种时间对乙基紫脱色的影响
反应20 min,200 U/L LaclK对20 μmol/L乙基紫脱色率为46%;在1 h后脱色率超过了80%;随着时间的延长,脱色率基本保持稳定,为84%(图3)。因此,选择1 h为最适接种时间。

图3 接种时间对脱色的影响Fig.3 Effects of incubation time on decolorization of ethyl violet.
2.4乙基紫浓度对脱色的影响
图4表明,随着乙基紫浓度的增加,脱色率降低。乙基紫浓度低于50 μmol/L时,脱色率高于57%:浓度为10 μmol/L时,脱色率达到91%;浓度为20 μmol/L时,脱色率为84%。当浓度达到100 μmol/L时,脱色率仅为5%。乙基紫与酶分子的空间位组效应会影响酶的反应活性,故乙基紫浓度越高,其脱色率越低[15]。

图4 乙基紫浓度对脱色的影响Fig.4 Effects of ethyl violet concentration on decolorization of ethyl violet.
2.5pH对乙基紫脱色的影响
由图5可知,LaclK脱色乙基紫的最适pH在7.0左右,在pH 5~9内,保持着较高的脱色率,超过了51%,表明LaclK具有广泛的pH作用范围,在中性偏碱条件下也能脱色乙基紫,这是许多真菌漆酶所不具有的[16]。

图5 pH对脱色的影响Fig.5 Effects of pH on decolorization of ethyl violet.
2.6卤离子对乙基紫脱色的影响
纺织工业排放的废水中通常含有大量的卤离子,良好的耐卤特性是酶的工业应用所需要的[17]。卤离子对漆酶的抑制作用表现在Cl-和Br-作为电子供体的竞争性抑制剂,而F-作为非竞争性抑制剂。此外,卤离子还能结合漆酶活性中心的铜离子(type 2和 type 3)发挥抑制作用[18]。可能由于LaclK不存在典型的type 2和type 3铜离子,所以卤离子对其抑制作用不是很明显。如图6所示,NaCl、NaF和NaBr浓度达到1 mol/L时,乙基紫的脱色率还分别达到53.4%、44.3%和58.0% (图6)。KI对乙基紫脱色的抑制作用明显,当体系中存在100 mmol/L KI时,LaclK的脱色能力被完全抑制,这可能与卤离子不同的供体有关;Fang等[14]的研究也发现相同浓度的KCl和NaCl对漆酶活性的影响相差很大。

图6 卤离子对脱色的影响Fig.6 Effects of halide ions on decolorization of ethyl violet.
2.7有机试剂对乙基紫脱色的影响
有机试剂作为良好的溶剂,在有机试剂中的反应可以拓宽酶的应用领域。当脱色体系中存在5%的甲醇、乙醇和二甲基亚砜时,脱色率由83.6%(不加有机试剂)分别变为79.9%、68.9%和73.9%;当甲醇、乙醇和二甲基亚砜浓度增大到20%时,其脱色率分别还有36.1%、10.0%和53.4%(图7)。由于各种原因,如酶构象的改变、底物基态的热力学稳定性、界面失活等,酶在有机溶剂中的活性会有所损失,从而影响其脱色性能[19,20]。无论如何,结果表明LaclK具有一定耐受有机试剂的能力,尤其是对二甲基亚砜的耐受性最好。

图7 有机试剂对脱色的影响Fig.7 Effects of organic solvents on decolorization of ethyl violet.


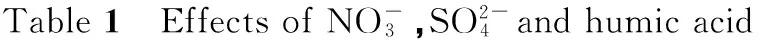
on decolorization of ethyl violet.
3 讨论
有色工业废水常呈中性或碱性,且水质成分复杂,包含各种污染物、有机试剂、硫酸盐、腐殖质以及高浓度的卤离子等[21,22]。以前报道的许多真菌漆酶虽然脱色率高,然而真菌漆酶却存在着很多的局限性,比如大部分的真菌漆酶主要在酸性和中性条件下发挥作用,碱性条件下很容易失活[15];真菌漆酶对卤离子敏感,在浓度达到100 mmol/L时便会失去活性[23]。
本研究中,在pH 7.0,60℃反应1 h,200 U/L的LaclK对10 μmol/L乙基紫脱色率达到91%;当乙基紫浓度达到20 μmol/L时,脱色率仍可维持在80%以上。LaclK展现了在高温、中性条件下,短时间内将染料脱色的性能。此外,LaclK还显示出耐受高浓度卤化物NaCl、NaF和NaBr的特点。LaclK在有机溶剂中的耐受性扩大了酶在苛刻条件下的应用潜力,这一特性使LaclK具有独特的优势,如:消除微生物的传染、增加非极性底物的溶解性、抑制水相反应,并能催化许多在水介质中不稳定的化学反应[24]。
综上所述,LaclK能够在中性偏碱性条件下脱色乙基紫,脱色性能优良,且具有一定的卤化物和有机试剂耐受性,在染料废水的生物修复中具有一定的应用潜力。
[1]Pandey A, Singh P, Iyengar L. Bacterial decolorization and degradation of azo dyes [J]. Int. Biodeterior. Biodegr., 2007, 59: 73-84.
[2]Selvam K, Swaminathan K, Chae K S. Decolourization of azo dyes and a dye industry effluent by a white rot fungusThelephorasp. [J]. Bioresour. Technol., 2003, 88(2): 115-119.
[3]Tunç S, Gürkan T, Duman O. On-line spectrophotometric method for the determination of optimum operation parameters on the decolorization of acid red 66 and direct blue 71 from aqueous solution by fenton process [J]. Chem. Eng. J., 2012, (181-182):431-442.
[4]Shah M P. Microbe-mediated degradation of synthetic dyes in wastewater[A]. In: Singh S N. Microbial Degradation of Synthetic Dyes in Wastewaters [M]. Springer International Publishing Switzerland, 2015, 205-242.
[5]Gao F, Ding H, Shao L,etal.. Molecular characterization of a novel thermal stable reductase capable of decoloration of both azo and triphenylmethane dyes [J]. Appl. Microbiol. Biotechnol., 2015, 99: 255-267.
[6]Jasin ska A, Paraszkiewicz K, Saba M,etal.. Microbial decolorization of triphenylmethane dyes[A]. In: Singh S N. Microbial Degradation of Synthetic Dyes in Wastewaters [M]. Springer International Publishing Switzerland, 2015, 169-186.
[7]Singh L, Singh V P. Textile dyes degradation: a microbial approach for biodegradation of pollutants[A]. In: Singh S N. Microbial Degradation of Synthetic Dyes in Wastewaters [M]. Springer International Publishing Switzerland, 2015, 187-204.
[8]张培培,任随周,许玫英,等.微生物对三苯基甲烷类染料脱色的研究进展[J].微生物学通报,2009, 32(9): 1410-1417.
[9]Jasinska A, Paraszkiewicz K, Sip A,etal.. Malachite green decolorization by the filamentous fungusMyrotheciumroridum-mechanistic study and process optimization [J]. Bioresour. Technol., 2015, 194: 43-48.
[10]Sani R K, Banerjee U C. Decolorization of triphenylmethane dyes and textile and dye-stuff effluent byKurthiasp. [J]. Enzyme Microb. Technol., 1999, 24(7): 433-437.
[11]Ruan Z, Wang Y, Song J,etal..Kurthiahuakuiisp. nov., isolated from biogas slurry, and emended description of the genus Kurthia [J]. Int. J. Syst. Evol. Microbiol., 2014, 64: 518-521.
[12]Cong W, Zhu Z, He H,etal.. A visible dye-based staining method for DNA in polyacrylamide gels by ethyl violet [J]. Anal. Biochem., 2010, 402(1): 99-101.
[13]Velusamy P, Pitchaimuthu S, Rajalakshmi S,etal.. Modification of the photocatalytic activity of TiO2by beta-cyclodextrin in decoloration of ethyl violet dye [J]. J. Adv. Res., 2014, 5(1): 19-25.
[14]Fang Z, Li T, Wang Q,etal.. A bacterial laccase from marine microbial metagenome exhibiting chloride tolerance and dye decolorization ability [J]. Appl. Microbiol. Biotechnol., 2011, 89: 1103-1110.
[15]Saratale R G, Saratale G D, Chang J S,etal.. Bacterial decolorization and degradation of azo dyes: A review [J]. J. Taiwan. Inst. Chem. Eng., 2011, 42(1): 138-157.
[16]Baldrian P. Fungal laccases-occurrence and properties [J]. FEMS. Microbiol. Rev., 2006, 30: 215-242.
[17]Liu H, Cheng Y, Du B,etal.. Overexpression of a novel thermostable and chloride-tolerant laccase fromThermusthermophilusSG0.5JP17-16 inPichiapastorisand its application in synthetic dye decolorization [J]. PLoS ONE, 2015, 10(3): e0119833.
[18]Singh G, Sharma P, Capalash N. Performance of an alkalophilic and halotolerant laccase from γ-proteobacterium JB in the presence of industrial pollutants [J]. J. Gen. Appl. Microbiol., 2009, 55: 283-289.
[19]Khmelnitsky Y L, Rich J O. Biocatalysis in nonaqueous solvents [J]. Curr. Opin. Chem. Biol., 1994, 3: 47-53.
[20]Klibanov A M. Why are enzymesless active in organic solvents than in water? [J]. Trends Biotechnol., 1997, 15: 97-101.
[21]Erdemoglu S, Aksu S K, Sayilkan F,etal.. Photocatalytic degradation of Congo Red by hydrothermally synthesized nanocrystalline TiO2and identification of degradation products by LC-MS [J]. J. Hazard. Mater., 2008, 155(3): 469-476.
[22]Kumar P, Prasad B, Mishra I,etal.. Catalytic thermal treatment of desizing wastewaters [J]. J. Hazard. Mater., 2007, 149: 26-34.
[23]Sinirlioglu Z A, Sinirlioglu D, Akbas F. Preparation and characterization of stable cross-linked enzyme aggregates of novel laccase enzyme fromShewanellaputrefaciensand using malachite green decolorization [J]. Bioresour. Technol., 2013, 146: 807-811.
[24]Rasekh B, Khajeh K, Ranjbar B,etal.. Protein engineering of laccase to enhance its activity and stability in the presence of organic solvents [J]. Engin. Life Sci., 2014, 14(4): 442-448.
Decolorization of Ethyl Violet by Recombinant Phenol Oxidase LaclK fromKurthiahuakuiiLAM0618T
GUO Xiang1,2, RUAN Zhi-yong2*, SONG Jin-long3, ZHOU Shan2, WANG Yan-wei1, HE Ming-xiong1, LIU Xiao-yang2, HU Guo-quan1*
1.KeyLaboratoryofDevelopmentandApplicationofRuralRenewableEnergy,MinistryofAgriculture,BiogasInstituteofMinistryofAgriculture,Chengdu610041,China;2.Key Laboratory of Microbial Resources Collection and Preservation, Ministry of Agriculture, Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3.Chinese Academy of Fishery Sciences, Beijing 100141, China

ethylviolet;LaclK; Kurthia huakuiiLAM0618T;phenoloxidase;decolorization
10.3969/j.issn.2095-2341.2016.04.06
2016-03-19; 接受日期:2016-04-11
中央级公益性科研院所基本科研业务费专项资金(IARRP2014-30);公益性行业(农业)科研专项(201403019)资助。
郭翔,硕士研究生,主要从事环境微生物学研究。E-mail:gx20093879@163.com。*通信作者:胡国全,研究员,主要从事环境微生物学研究。E-mail:huguoquan1@hotmail.com;阮志勇,副研究员,博士,主要从事农业微生物资源发掘与利用研究。E-mail:ruanzhiyong@caas.cn
