基于β-半乳糖苷酶为报告基因的耐辐射异常球菌启动子检测载体构建
2016-08-15周正富
李 杰, 张 陈, 张 维, 周正富
中国农业科学院生物技术研究所, 北京 100081
基于β-半乳糖苷酶为报告基因的耐辐射异常球菌启动子检测载体构建
李杰,张陈,张维,周正富*
中国农业科学院生物技术研究所, 北京 100081
耐辐射异常球菌是一种超强电离辐射抗性的微生物, 其含有大量的胁迫反应相关蛋白及其转录调控因子,在适应环境变化和各种胁迫反应中发挥着重要作用。为深入分析该菌的抗逆基因在不同胁迫下的功能,以β-半乳糖苷酶为报告基因构建了耐辐射异常球菌启动子检测体系。以耐辐射异常球菌基因组为模板扩增groEL、hsp20、relA和relQ启动子片段,将其连接到到大肠杆菌-耐辐射异常球菌穿梭载体pRADZ1上, 构建成具有启动子活性检测功能的重组质粒pRADZ-PgroE、pRADZ-Phsp20、pRADZ-PrelA和pRADZ-PrelQ,并将其转化至耐辐射异常球菌,测定β-半乳糖苷酶酶活。结果显示,这些启动子能在耐辐射异常球菌中启动Lac-Z报告基因的表达,并受到胁迫条件的诱导调控。耐辐射异常球菌启动子活性检测方法构建为该菌株特异性胁迫应答系统的研究提供了重要的实验基础。
β-半乳糖苷酶;启动子活性检测;耐辐射异常球菌;穿梭质粒pRADZ1
耐辐射异常球菌(Deinococcusradiodurans)具有超强的辐射、氧化[1]、高温、干旱等抗性[2],被誉为“世界上最顽强的细菌”,极具研究和应用价值。1999年,美国科学家完成了该菌的全基因组测序工作,并发表于《科学》杂志上。其基因组中共包含 3 187个开放阅读框,其中仅1 493 个基因具有功能预测注释,超过半数的预测开放阅读框编码未知功能的蛋白[3]。这些蛋白可能在耐辐射异常球菌适应环境变化和各种胁迫反应中发挥着重要功能,亟需对这些蛋白的功能及调控网络开展深入的研究。
β-半乳糖苷酶(β-galactosidase),全称为β-D-半乳糖苷半乳糖水解酶, 能水解乳糖为半乳糖和葡萄糖, 也具有转移半乳糖苷的作用,广泛应用于食品加工以及医药、免疫、环境检测等领域[4]。β-半乳糖苷酶基因是动物和微生物基因工程中最常用、最成熟的一种报告基因。报告基因是一种编码可被检测的蛋白或酶的基因,其表型应易于检测且易于与内源性背景蛋白相区别,利用其表达产物来标定目的基因的表达调控。β-半乳糖苷酶基因作为报告基因的应用主要有以下几方面:①用于研究启动子的效能和启动子不同位点突变对表达效能的影响[5];②用于研究表达系统中增强序列等调控序列的功能;③用于衡量载体的表达特征和外源物质对表达调控的影响[6];④以融合基因的形式研究外源基因的表达及其规律[7,8]。
本文选取耐辐射异常球菌中重要抗逆基因groEL、hsp20、relA和relQ的启动子,将其克隆于大肠杆菌-耐辐射异常球菌穿梭载体pRADZ1上,构建大肠杆菌-耐辐射异常球菌双宿主启动子功能检测质粒pRADZ-PgroEL、pRADZ-Phsp20、pRADZ-PrelA和pRADZ-PrelQ,将其转入耐辐射异常球菌中,通过测定β-半乳糖苷酶活性对构建的启动子检测体系进行效能验证,以期获得较为高效的耐辐射异常球菌启动子检测体系。
1 材料与方法
1.1菌株和质粒
本实验所采用的菌株和质粒见表1。
1.2培养基与试剂
1.2.1培养基TGY培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、葡萄糖1 g/L(配置固体培养基,需额外加入琼脂15 g/L)。高温(112℃)高压蒸汽灭菌30 min。
LB培养基:酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 10g/L(配置固体培养基,需额外加入琼脂15 g/L)。高温(121℃)高压蒸汽灭菌20 min。
1.2.2试剂碳酸钠终止液(1 mol/L):称取106 g的碳酸钠,溶解于1 L的蒸馏水中,调整pH至7.5,室温保存。
邻硝基苯-β-D-半乳吡喃糖苷(ONPG):将ONPG固体溶于0.1 mol/L pH 7.5的磷酸钠缓冲液中,终浓度为4 mg/mL,4℃保存。
Z Buffer:分别称取16.1 g Na2HPO4·7H2O固体、4.78 g NaH2PO4固体、0.75 g KCl固体和0.246 g MgSO4·7H2O固体,加蒸馏水溶解,定容至1 L,调整pH至7.0,使用前加β-巯基乙醇。
1.3实验方法
1.3.1DNA 的提取及操作质粒快速提取、检测以及DNA 的酶切、连接、大肠杆菌感受态的制备及转化按《分子克隆》[9]所述方法进行,耐辐射异常球菌的转化参照Spizizen[10]提供的方法进行。
1.3.2载体构建根据耐辐射异常球菌基因组序列,设计引物(表2)。以D.radioruans的基因组为模板,分别扩增groEL、hsp20、relA和relQ基因的启动子片段。扩增体系(20.0 μL):10×PCR缓冲液2 μL,dNTPs混合溶液2 μL,10 μmol/L引物0.5 μL,Taq酶0.2 μL,25 mg/L DNA模板2.0 μL。PCR获得了耐辐射异常球菌分子伴侣蛋白基因groEL、热激蛋白基因hsp20、严紧反应关键酶基因relA和relQ基因的启动子片段,片段大小分别为463 bp、248 bp、313 bp和282 bp。连接克隆载体pJET1.2/blunt vector,转化到E.coliJM109感受态中,涂布于含有 50 μg/mL Amp的LB固体培养基筛选阳性克隆。利用BglⅡ和SpeⅠ酶切载体pRADZ1和重组子pJET-PgroEL、pJET-Phsp20、pJET-PrelA、pJET-PrelQ,切胶回收酶切产物,连接得到载体pRADZ-PgroEL、pRADZ-Phsp20、pRADZ-PrelA和pRADZ-PrelQ(图1,彩图见图版一)。筛选合适的重组子,酶切及测序验证。

表2 引物列表
注:划线部分为酶切位点。
1.3.3线性转化活化甘油管里的D.radioruans菌株并转接于新鲜TGY液体培养基。培养至OD600=0.6时,收集菌体。菌体中加入180 μL TGY液体培养基、20 μL 70%的甘油、20 μL 0.3 mol/L CaCl2,剧烈震荡重悬菌体,30℃温水浴孵育80 min。取出50 μL菌液于新管中,加入要转化的重组质粒10 μL,充分震荡混匀,30℃温水浴孵育90 min。加入新鲜TGY培养基,30℃摇床培养12 h。菌液涂布于含有3 μg/mL氯霉素的TGY固体培养基上,30℃培养箱培养2 d,筛选重组子。
1.3.4β-半乳糖苷酶测定方法接种重组菌株到含有3 μg/mL氯霉素的TGY液体培养基中,培养种子液。按初始OD600=0.1转接至50 mL培养基中,30℃培养至OD600=0.6。取出菌液1 mL,离心收集菌体,重悬于500 μL Z buffer中,加入50 mmol/L β-巯基乙醇、50 μg/mL溶菌酶、10 μg/mL DNase1,震荡混匀,37℃孵育1 h,加20 μL甲苯。37℃孵育120 min,加入150 μL邻硝基苯-β-D-半乳吡喃糖苷(ONPG),混匀后30℃孵育直至出现黄色,记录反应开始时间。待样品出现黄色,再加入500 μL 1 mol/L的Na2CO3终止反应,记录反应终止时间,样品放冰上待测。将样品在4℃,12 000 g离心10 min,用紫外分光光度计测定上清OD550和 OD420值,作为对照。
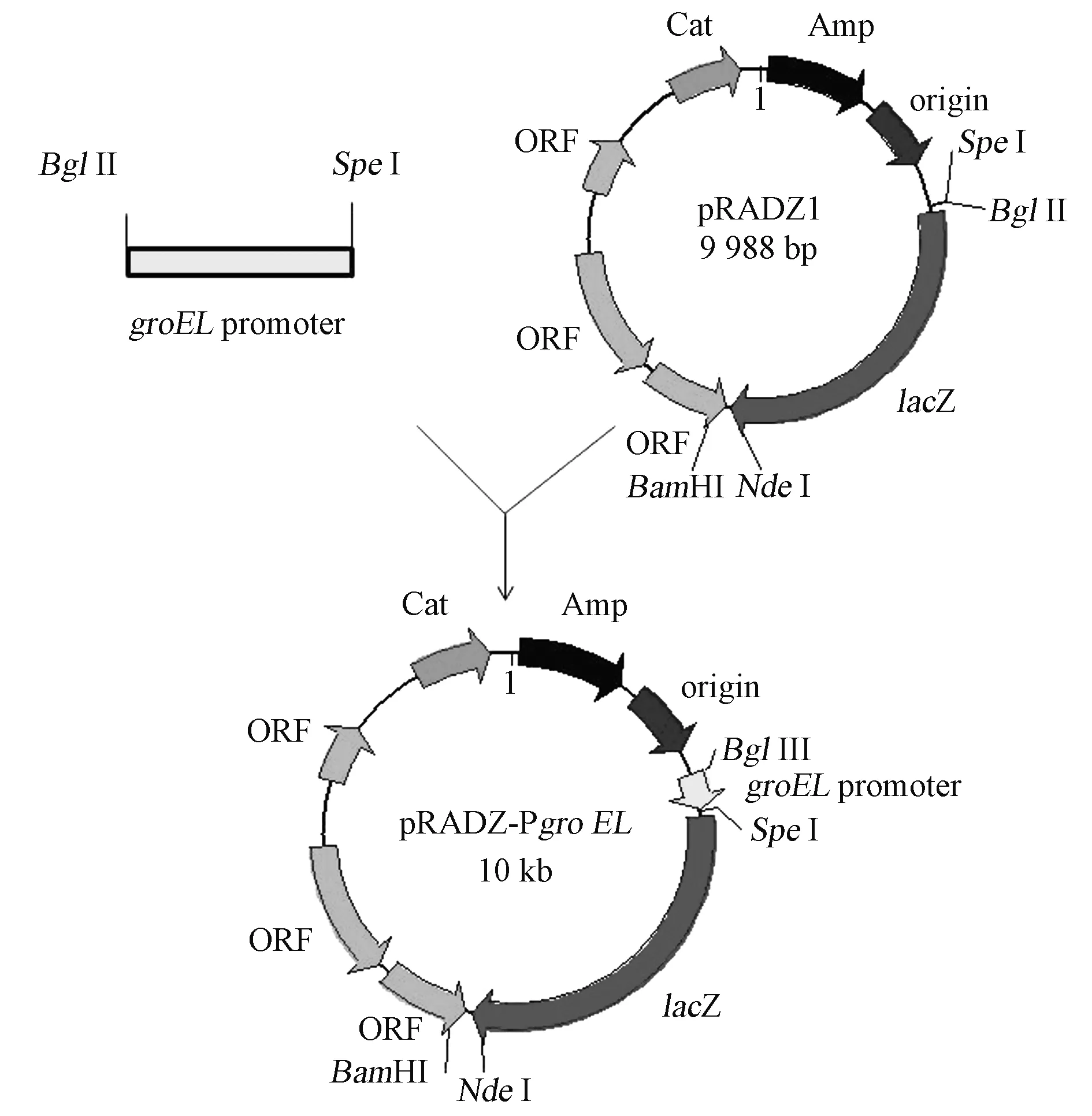
图1 重组载体pRADZ-PgroEL构建示意图Fig.1 The construction of vector pRADZ-PgroEL.(彩图见图版一)
热激胁迫样品处理条件:菌株培养至OD600=0.6时,转移到42℃摇床热激处理2 h,收集菌体测定酶活,处理过程与对照组相同。
按以下公式计算β-半乳糖苷酶的活性:
U=1 000×(OD420-1.75×OD550)/(t×0.1×OD600)
其中t为反应时间(min)。
1.3.5荧光实时定量PCR本研究使用SYBR©Premix ExTaqTM试剂盒配置实时定量q-PCR反应体系,用 7500型实时定量仪进行荧光实时定量PCR实验,每个样品平行3次。 使用相对定量方法,以野生型菌株D.radiodurans的16S rDNA作为内部参比基因,利用ΔΔCT法进行数据统计分析。
2 结果与分析
2.1耐辐射异常球菌启动子检测载体的构建与转化
利用本实验室保存的含有β-半乳糖苷酶报告基因的大肠杆菌-耐辐射异常球菌穿梭载体pRADZ1作为基础载体,并对其改造。将获得的启动子片段插入到载体β-半乳糖苷酶报告基因上游,完成耐辐射异常球菌启动子检测载体的构建,并通过双酶切以及测序验证阳性转化子(图2)。将筛选正确的重组质粒pRADZ-PgroEL、pRADZ-Phsp20、 pRADZ-PrelA和pRADZ-PrelQ转入耐辐射异常球菌野生型菌株中,利用抗性筛选获得正确重组菌株。

图2 重组质粒BglⅡ/SpeⅠ酶切电泳Fig.2 Digestion results of recombinant plasmid by BglⅡ/SpeⅠ.M:Trans2K Plus Ⅱ DNA maker; 1.pRADZ-PrelA; 2:pRADZ-PrelQ; 3:pRADZ-Phsp20; 4:pRADZ-PgroEL
2.2启动子检测载体β-半乳糖苷酶活性测定
重组菌株β-半乳糖苷酶活性测定结果(图3)显示,正常条件下,relA的酶活是64.41,而42℃热激2 h后,酶活为139.36,上调了2.12倍。relQ在正常条件下酶活为65.83,热激后酶活为132.01,上调了2倍。hsp20在正常条件下酶活为11 049.75,而热激后,酶活为45 131.00,上调了4.08倍。与正常条件下相比,热激后groEL酶活从2 316.81提高为5 432.80,上调了2.34倍。

图3 耐辐射异常球菌启动子β-半乳糖苷酶活性测定Fig.3 Promoter activities in D. radiodurans using lacZ reporter gene.A:正常条件和42℃热激处理下relA、relQ启动子β-半乳糖苷酶测定;B:正常条件和42℃热激处理下hsp20启动子β-半乳糖苷酶测定;C:正常条件和42℃热激处理下groEL启动子β-半乳糖苷酶测定
2.3启动子检测体系的实时定量q-PCR验证
利用实时定量q-PCR对耐辐射异常球菌的分子伴侣蛋白GroEL、热激蛋白Hsp20、严紧反应关键酶RelA和RelQ在正常生长与42℃热激条件下的表达量进行分析,对构建启动子检测体系的结果进行验证。研究结果显示(图4),热激条件下groEL与hsp20表达发生显著变化,分别上调了3.97倍和6.95倍;relA与relQ的表达也同样提高,分别提高了1.91倍和2.12倍。实时定量q-PCR验证结果与β-半乳糖苷酶活性检测结果基本一致。

图4 热激胁迫下抗逆相关基因groEL、hsp20、relA和relQ的相对表达量Fig.4 The expression of groEL, hsp20, relA and relQ of D. radiodurans under different conditions.
3 讨论
耐辐射异常球菌中,groEL基因编码分子伴侣蛋白,在某一蛋白质不能自发折叠的情况下,GroEL与辅分子伴侣GroES能促进蛋白质的折叠, GroEL具有ATP水解酶的活性部位,可结合并水解ATP,同时自身构象发生改变[11]。groEL启动子在42℃热激2 h后β-半乳糖苷酶酶活显著提高,为正常条件下的2.34倍。RelA是核糖体结合蛋白,可催化ATP 的焦磷酸根基团转移到GTP或GDP核糖的3′羟基合成pppGpp或ppGpp[12]。在革兰氏阴性菌中,RelA仅具有(p)ppGpp合成酶活性,而在阳性菌中RelA具有(p)ppGpp合成酶和水解酶活性。RelQ首先发现于变形链球菌中,是一种短的(p)ppGpp合成酶,且仅具有(p)ppGpp合成酶活性[13]。42℃热激2 h后,relA和relQ的β-半乳糖苷酶酶活约为正常条件下的2倍。Hsp20是小的热休克蛋白,它能提高菌对过氧化氢的耐受性,激活氧化还原状态的蛋白,从而保持氧化还原平衡[14]。热激后hsp20的β-半乳糖苷酶酶活约为正常条件下的4倍,与Singh等[13]的结果一致。
β-半乳糖苷酶为报告基因的启动子检测结果与实时定量q-PCR检测结果都能够有效的表明不同条件下基因的表达变化。相比之下,实时定量q-PCR仅能反应基因在不同样本间的相对变化关系,但β-半乳糖苷酶启动子检测结果不仅能够反应这种变化趋势,还能够很好地展现基因在整个细胞代谢中的相对表达量。本研究中,分子伴侣蛋白基因groEL、热激蛋白基因hsp20在热激条件下的表达量都发生上调。实时定量q-PCR检测结果显示这2个基因都发生了显著的变化,但2个基因之间是无法比较的。β-半乳糖苷酶启动子检测结果显示groEL基因的表达量在2 316.81~5 432.80单位范围变化,而hsp20从11 049.75提高到45 131.00个单位。这样的结果表明,hsp20在细胞应对热激胁迫条件中变化更为剧烈,可能发挥更加重要的生理功能。β-半乳糖苷酶具有蛋白折叠简单、定量检测方便和检测灵敏度高等优点,有利于基因启动子及调控序列的研究。本文在大肠杆菌-耐辐射异常球菌穿梭载体pRADZ1基础上构建了以β-半乳糖苷酶为报告基因的耐辐射异常球菌启动子检测体系。通过测定β-半乳糖苷酶活性,对该菌重要抗逆基因groEL、hsp20、relA和relQ的启动子功能展开分析,并利用实时定量q-PCR对构建的启动子检测体系进行效能验证,获得了较为高效的耐辐射异常球菌启动子检测方法。
[1]王金辉, 周正富, 张 维, 等. 超强辐射抗性微生物: 耐辐射异常球菌[J]. 生物技术进展, 2013, 3(2): 90-95.
[2]Slade D, Radman M. Oxidative stress resistance inDeinococcusradiodurans[J]. Microbiol. Mol. Biol. Rev., 2011, 75(1): 133-191.
[3]White O, Eisen J A, Heidelberg J F,etal.. Genome sequence of the radioresistant bacteriumDeinococcusradioduransR1 [J]. Science,1999, 286: 1571-1577.
[4]张 莉, 李庆章, 田 雷. β-半乳糖苷酶研究进展[J]. 东北农业大学学报, 2009, 40(7): 128-131.
[5]陈晓月,金宁一,皱 伟,等. β-半乳糖苷酶在枯草芽孢杆菌中的分泌表达[J]. 中国生物工程杂志, 2008,(5): 111-115.
[6]杨 民, 党耕町, 马庆军. 携带半乳糖苷酶报告基因重组腺相关病毒体内转染骨组织的实验观察[J]. 中国组织工程研究与临床康复, 2007, 11(19): 3677-3680.
[7]汪 川, 张朝武. β-半乳糖苷酶基因及其在基因学中的应用[J]. 预防医学情报杂志, 2002, 18(3): 213-215.
[8]于西佼, 李 纾. 报告基因及其在生物膜研究中的应用[J]. 国际口腔医学杂志, 2006, 33(1): 15-17.
[9]Green M R, Sambrook J. Molecular Cloning: A Laboratory Manual[M]. New York: Cold Spring Harbor Laboratory Press, 2012.
[10]Spizizen J. Transformation of biochemically deficient strains ofBacillussubtilisby deoxyribonucleate[J]. Proc. Natl. Acad. Sci. USA, 1958, 44(10): 1072.
[11]姚 玲, 蔺 宗, 傅正伟. GroEL 的耗能分子伴侣机制[J]. 生物化学与生物物理进展, 2015, 42(2): 154-160.
[12]刘 彪, 宁德刚. 细菌应激反应中 (p) ppGpp 代谢的调控[J]. 微生物学通报, 2011, 38(9): 1425-1429.
[13]Kim J N, Ahn S J, Seaton K,etal.. Transcriptional organization and physiological contributions of therelQoperon ofStreptococcusmutans[J]. J. Bacteriol., 2012, 194(8): 1968-1978.
[14]Singh H, Appukuttan D, Lim S. Hsp20, a small heat shock protein ofDeinococcusradiodurans, confers tolerance to hydrogen peroxide inEscherichiacoli[J]. J. Microbiol. Biotechnol., 2014, 24(8): 1118-1122.
Construction of Promoter Function Analysis Vector Using β-galactosidase Report System inDeinococcusradiodurans
LI Jie, ZHANG Chen, ZHANG Wei, ZHOU Zheng-fu*
BiotechnologyResearchInstitute,ChineseAcademyofAgriculturalSciences,Beijing100081,China
Deinococcusradioduransis a robust bacterium which shows extreme ionizing-radiation tolerance. Abundant proteins and transcriptional factors are important for the various stress response inD.radiodurans. In order to construct the promoter function analysis system that use β-galactosidase gene as report gene inD.radiodurans, we used the genome ofD.radioduransas template to amplificate the promoters ofgroEL,hsp20,relAandrelQby PCR, then connected them toE.coli-D.radioduransshuttle vector pRADZ1, obtained the recombinant plasmids pRADZ-PgroEL, pRADZ-Phsp20, pRADZ-PrelAand pRADZ-PrelQ, which could analyze the activity of promoter. Then we transformed those recombinant plasmids intoD.radiodurans, and measured the activity of β-galactosidase, the result showed that these promoters can start expression ofLac-Z, and could be regulated under stress. This study provided theoretical basis for the further work of stress response mechanism inDeinococcusradiodurans.
β-galactosidase; promoter function analysis;Deinococousradiodurans; shuttle vector
10.3969/j.issn.2095-2341.2016.04.08
2016-03-03; 接受日期:2016-04-08
国家973计划项目(2015CB755700);国家转基因新品种培育重大专项(2014ZX0800301B);国家自然科学基金项目(31370126)资助。
李杰,本科生,研究方向抗逆微生物分子生物学。*通信作者:周正富,助理研究员,博士,主要从事极端环境微生物分子生物学研究。E-mail:zhouzhengfu@caas.cn
