旋覆花内酯通过抑制炎症反应对缺血脑组织发挥保护作用
2016-08-15董立鹏赵景茹祝春华
温 雅,董立鹏,赵景茹,祝春华
(河北医科大学第二医院神经内科,河北 石家庄 050000)
·论著·
旋覆花内酯通过抑制炎症反应对缺血脑组织发挥保护作用
温雅,董立鹏,赵景茹,祝春华
(河北医科大学第二医院神经内科,河北 石家庄 050000)
[摘要]目的探讨旋覆花内酯(Acetylbritannilactone,ABL)通过抑制炎症反应对小鼠缺血性脑组织发挥保护作用及其机制。方法线栓法建立CD1小鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。实验分为假手术组、MCAO组、ABL小剂量组(10 mg/kg)和ABL大剂量组(30 mg/kg)。ABL于术前30 min腹腔注射,术后24 h后处死小鼠。各组取材前进行神经功能评分,分别用Western blotting和RT-PCR的方法检测缺血脑组织中肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、Toll样受体4(Toll-like receptors 4,TLR4)、肿瘤坏死因子受体相关因子6(tumor necrosis receptor associated factor 6,TRAF6)和核因子κB(nuclear factor-kappaB,NF-κB)蛋白和基因水平的变化,并观察神经功能、脑水肿程度和脑梗死体积。结果与假手术组比较,MCAO组TNF-α、IL-1β、TLR4、TRAF6和NF-κB蛋白和基因表达水平明显升高(P<0.05);ABL能够显著下调炎症因子TNF-α、IL-1β的表达,降低TLR4、TRAF6和NF-κB的水平(P<0.05),明显改善神经功能、减轻脑水肿、减小梗死体积(P<0.05)。结论ABL通过抑制脑缺血引发的TLR4/TRAF6/NF-κB级联途径减少TNF-α、IL-1β的表达,发挥对缺血脑组织的抗炎作用,同时改善了脑缺血后小鼠神经功能缺损,减轻脑水肿,减小梗死体积,起到神经保护作用。
[关键词]脑缺血;炎症;旋履花内酯;小鼠
doi:10.3969/j.issn.1007-3205.2016.05.001
缺血性脑卒中是最常见的脑卒中类型,在世界范围内,是成人的第3大死亡原因,致残的首位原因。缺血后的继发性脑损伤是患者病情加重和影响预后的重要原因,导致继发性脑损伤的病理机制主要包括炎症反应、氧化应激、兴奋性氨基酸毒性、自由基形成等。这几种因素之间相互作用,构成复杂的调控网络,导致一系列病理级联反应,其中炎症反应是继发性脑损伤的最重要原因之一[1-2]。在缺血性脑损伤中,从受损的脑组织、血管和坏死细胞中释放细胞因子,激活Toll样受体(Toll-like receptors,TLRs),诱导炎性细胞因子,如白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的合成与释放[3-4]。这些细胞因子引起脑缺血后的炎症反应,进一步加重原发性脑损伤。TLRs/核因子κB(nuclear factor-kappaB,NF-κB)信号通路在促进炎症反应中发挥重要作用,激活TLRs能够诱导下游转录因子NF-κB的激活,并诱导炎症相关分子和细胞因子的基因转录[5-6]。旋覆花内酯(Acetylbritannilactone,ABL)是经二氧化碳超临界萃取、系统分离得到的具有抗炎活性的单体化合物,已经证实其在巨噬细胞和血管平滑肌细胞中表现出强有力的抗炎和抗增殖作用[7-8]。而ABL在脑缺血中的的作用及机制有待明确。本研究通过建立小鼠永久性大脑中动脉闭塞(middle cerebral artery occlusion,MCAO,MCAO)模型,观察ABL对脑缺血后炎症因子表达的影响,探讨其对缺血性脑组织的保护作用及机制。
1 材料与方法
1.1动物和试剂
1.1.1实验动物成年雄性健康清洁级CD1小鼠136只,体质量25~30 g,购自北京维通利华实验动物技术有限公司。所有动物实验均参照中华人民共和国科学技术部颁布的《实验动物管理条例》执行,并通过伦理委员会批准。
1.1.2试剂和仪器兔抗TNF-α多克隆抗体(美国Abcam公司);兔抗IL-1β多克隆抗体(美国Abcam公司);兔抗核因子κB(nuclear factor-kappaB,NF-κB)多克隆抗体(美国Cell signaling公司);兔抗TLR4多克隆抗体(美国CABGENT公司);兔抗肿瘤坏死因子受体相关因子6(tumor necrosis receptor associated factor 6,TRAF6)多克隆抗体(美国Bioworld公司);DYY-12型电泳仪(北京 六一仪器厂);Synergy-HT多功能酶标仪(美国Bio-Tek);PCR扩增仪(德国Eppendorf公司);7500型荧光定量PCR仪(美国ABI公司);光学显微镜(日本OLYMPUS)。
1.1.3引物设计与合成上海生物工程公司合成,引物序列如下。TNF-α:上游5′-CACCACCATCA-AGGACTCAA-3′,下游5′-AGGCAACCTGACCA-CTCTCC-3′;IL-1β:上游5′-GCAACTGTTCCTG-AACTCAACT-3′,下游5′-ATCTTTTGGGGTCC-GTCAACT-3′;NF-κB:上游5′-ACAGACCCAGG-AGTGTTCACAGA-3′,下游5′-CATGGACACAC-CCTGGTTCAG-3′;TLR-4:上游5′-CTCACAG-ATAGCCTGGCCAATC-3′,下游5′-CCATCTCA-CAAGGCATGTCCAG-3′;TRAF6:上游 5′-TGG-ATTCTACACAGGCAGACC-3′,下游 5′-TCA-AAGCGGGTAGAGACTTCA-3′;GAPDH:上游5′-CGTGTTCCTACCCCCAATGT-3′,下游5′-TG-TCATCATACTTGGCAGGTTTCT-3′。
1.2方法
1.2.1分组和模型线栓法建立永久性小鼠右侧MCAO模型[9]。随机将136只CD1小鼠分为假手术组、MCAO组、ABL小剂量(ABL-L)组、ABL大剂量(ABL-H)组。假手术组血管分离后不插线栓。ABL干预组分别以10 mg/kg和30 mg/kg,于MCAO术前30 min腹腔注射。
1.2.2神经功能缺失评分MCAO术后24 h,采用改良的Longa分级法进行行为学评分:0分,无神经功能损伤症状;1分,提尾时不能完全伸展对侧前肢;2分,对侧前肢屈曲;3分,行走时向瘫痪侧转圈;4分,行走时向瘫痪侧跌倒;5分,不能自发行走,意识丧失。
1.2.3脑组织含水量测定小鼠在手术后24 h断头,迅速取脑。冠状切开去除额极,双侧取约2 mm厚的脑组织,采用干湿法测定脑含水量:(脑组织湿质重-脑组织干质量)/湿质重×100%。
1.2.4脑梗死体积测定各组小鼠在相应时间断头取脑,均匀切成5片冠状切片,浸入2% TTC溶液,37 ℃孵育15 min,染上颜色后取出置于4 %多聚甲醛中固定24 h。梗死体积百分比={[总梗死体积-(梗死同侧半球总体积-梗死对侧半球总体积)]/梗死对侧半球体积} ×100%。
1.2.5脑缺血后炎症因子的表达及TLR4/TRAF6/NF-κB级联途径中相关因子的检测采用Western blotting和RT-PCR检测脑组织中炎症细胞因子TNF-α、IL-1β,以及NF-κB、TLR-4和TRAF6的表达。
1.3统计学方法应用SPSS 13.0统计软件处理数据。计量资料比较分别采用单因素方差分析和q检验。神经功能评分比较采用秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠脑缺血后的神经功能缺损比较与假手术组相比,其他3组神经功能评分均显著升高(P<0.05),即有明显的神经功能障碍。ABL-H组神经功能评分得到明显改善(P<0.05),但ABL-L组与MCAO组比较差异无统计学意义(P>0.05)。见表1。
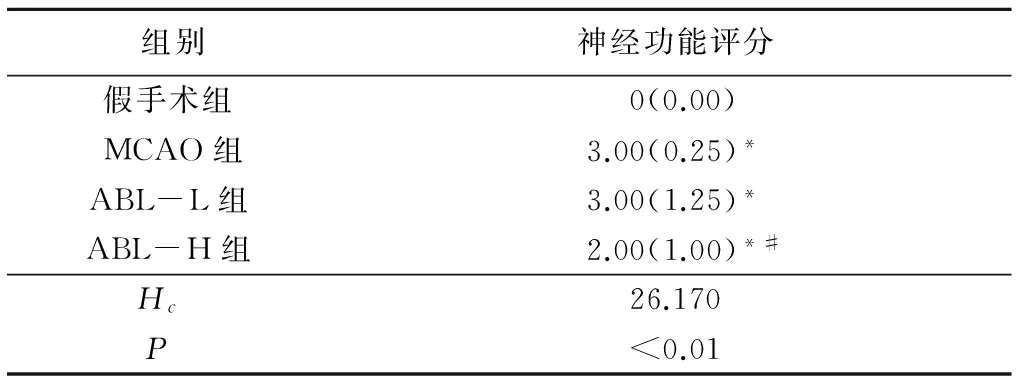
表1 4组神经功能评分比较
*P<0.05与假手术组比较#P<0.05与MCAO组比较(秩和检验)
2.2各组局灶性脑缺血损伤后的脑水肿比较术后24 h,与假手术组相比,其他3组小鼠病变侧脑组织含水量明显升高(P<0.05)。ABL处理后,与MCAO组相比,ABL-H组在24 h观察发现病变侧脑组织含水量明显降低,差异有统计学意义(P<0.05);而ABL-L组脑组织含水量与MCAO组比较差异无统计学意义(P>0.05)。见表2。
表24组术后24 h脑组织含水量比较
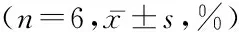

组别脑组织含水量假手术组 77.87±0.98MCAO组85.08±1.13*ABL-L组84.75±1.09*ABL-H组82.41±1.15*#F 55.875P <0.01
*P<0.05与假手术组比较#P<0.05 与MCAO组比较(q检验)
2.3各组局灶性脑缺血损伤后的梗死体积比较通过TTC染色法测定脑梗死体积。假手术组小鼠脑组织表现为均匀一致的红色,而MCAO组则出现大范围苍白色梗死区域。ABL处理后,大、小2个剂量组苍白色梗死区域体积均显著缩小(P<0.05),提示ABL能够减轻局灶性脑缺血后的梗死体积,从而发挥脑保护作用。见表3。
表34组术后24 h脑梗死体积比较
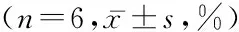

组别梗死体积百分比假手术组 0.00±0.00MCAO组55.21±2.14ABL-L组41.50±1.48*ABL-H组26.60±1.77*F 3949.932P <0.05
*P<0.05与MCAO组比较(q检验)
2.4ABL下调炎症细胞因子的表达Western blotting和RT-PCR结果显示,与假手术组比较,MCAO组TNF-α和IL-1β蛋白和基因均表达明显升高(P<0.05),而不同剂量ABL组均能降低TNF-α和IL-1β蛋白和基因的表达(P<0.05),其中ABL-H组更为明显。见表4,5。
表4ABL降低TNF-α、IL-1β的蛋白表达
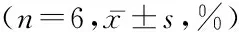
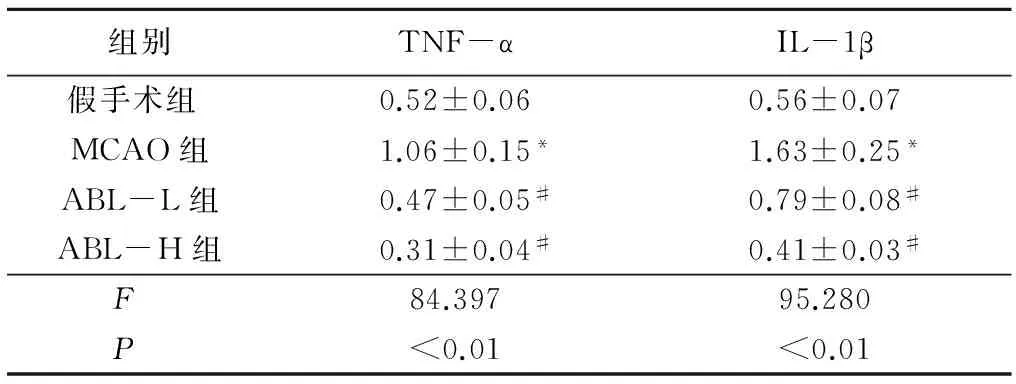
组别TNF-αIL-1β假手术组 0.52±0.060.56±0.07MCAO组1.06±0.15*1.63±0.25*ABL-L组0.47±0.05#0.79±0.08#ABL-H组0.31±0.04#0.41±0.03#F 84.39795.280P <0.01<0.01
*P<0.05与假手术组比较#P<0.05与MCAO组比较(q检验)
表5ABL降低TNF-α、IL-1β的基因表达
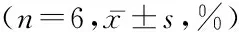

组别TNF-αIL-1β假手术组 1.12±0.121.06±0.09MCAO组1.58±0.21*1.87±0.28*ABL-L组0.79±0.09#1.35±0.11#ABL-H组0.45±0.06#0.72±0.07#F 79.37354.987P <0.01<0.01
*P<0.05与假手术组比较#P<0.05与MCAO 组比较(q检验)
2.5ABL降低TLR4、TRAF6及核NF-κB的表达通过Western blotting和RT-PCR检测缺血脑组织TLR4、TRAF6及核NF-κB蛋白和mRNA表达水平,评价ABL对TLR4/TRAF6/NF-κB炎性信号通路的影响。脑缺血24h后,MCAO组TLR-4、TRAF6及NF-κB水平明显升高(P<0.05),而ABL处理后,TLR-4、TRAF6及NF-κB的表达水平显著下降(P<0.05)。见表6,7。
表6ABL降低TLR-4、TRAF6及NF-κB的蛋白表达

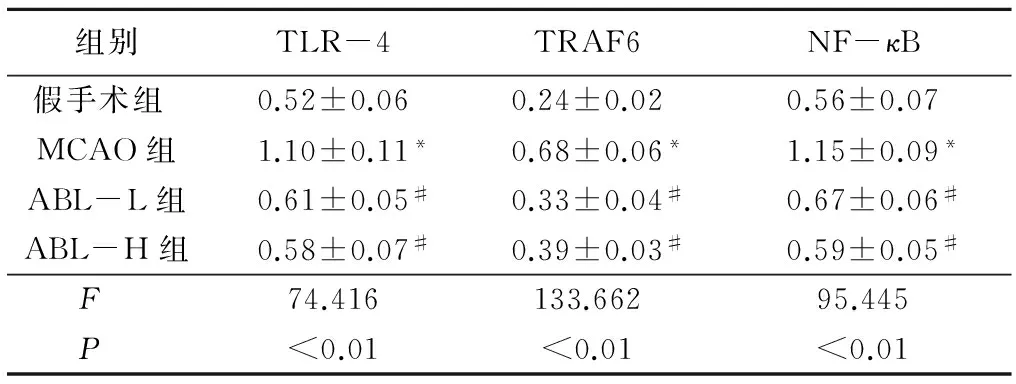
组别TLR-4TRAF6NF-κB假手术组 0.52±0.060.24±0.020.56±0.07MCAO组1.10±0.11*0.68±0.06*1.15±0.09*ABL-L组0.61±0.05#0.33±0.04#0.67±0.06#ABL-H组0.58±0.07#0.39±0.03#0.59±0.05#F 74.416133.66295.445P <0.01<0.01<0.01
*P<0.05与假手术组比较#P<0.05与MCAO组比较(q检验)
表7ABL降低TLR-4、TRAF6及NF-κB的基因表达

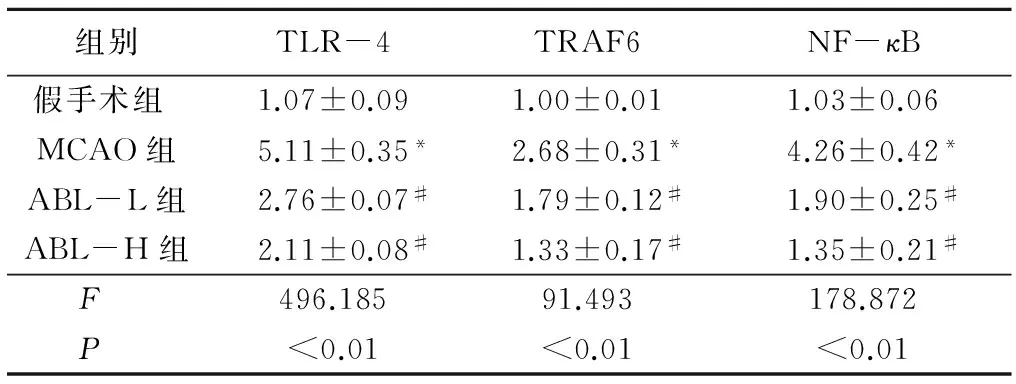
组别TLR-4TRAF6NF-κB假手术组 1.07±0.091.00±0.011.03±0.06MCAO组5.11±0.35*2.68±0.31*4.26±0.42*ABL-L组2.76±0.07#1.79±0.12#1.90±0.25#ABL-H组2.11±0.08#1.33±0.17#1.35±0.21#F 496.18591.493178.872P <0.01<0.01<0.01
*P<0.05与假手术组比较#P<0.05与MCAO组比较(q检验)
3 讨 论
脑梗死后缺血损伤的病理生理学机制非常复杂,主要涉及炎症、氧化应激、自由基损伤、钙超载和神经元凋亡等多个环节,各个环节相互作用,相互影响,构成复杂的级联损伤。其中过度的炎症反应存在于脑梗死后组织坏死及缺血区域,导致炎性损伤已成共识,本实验室的前期研究亦证实了这一点[10-11]。炎症反应的发生由促炎因子的活化引发,如TNF-α、IL-1β和白细胞介素6,改变血流量,增加血管通透性,从而引起继发性缺血,加重脑损伤[12]。TNF-α作为一个重要的促炎细胞因子,无论是在永久性还是在缺血-再灌注大脑中动脉闭塞模型中都是显著升高的[13]。IL-1β是白细胞介素家族重要促炎细胞因子,与卒中密切相关。在MCAO模型中,增加TNF-α和IL-1β表达则会导致脑梗死体积扩大及神经元死亡[14]。
TLRs是IL-1受体超家族高度保守成员之一,有证据表明,TLRs被脑组织损伤释放的内源性损伤相关分子模式激活,在介导脑缺血后继发性损伤中发挥重要作用[15]。TLR4被激活后,招募下一个信号蛋白IL-1受体相关激酶,导致其自身磷酸化[16],磷酸化的IRAKs脱落下来并与TRAF6结合形成复合物,并使TAB1、TAB2磷酸化。TRAF6自身泛素化,通过NF-κB诱导激酶活化作用,并形成活化的IκB激酶复合体,最终IκB泛素化降解,NF-κB由与IκB结合所处的静息态转变为激活状态,游离的NF-κB转移到胞核[17]。
ABL是经二氧化碳超临界萃取、系统分离得到的具有抗炎活性的单体化合物,化学结构属于苯并呋喃酮衍生物,是一种极具开发前景的抗炎新药。目前在血管内皮细胞及血管平滑肌细胞中有较为深入的研究,证实ABL对促炎基因[包括环氧合酶(cyclooxygenase,COX-2)、iNOS]和细胞黏附分子基因(包括VCAM-1、ICAM-1、MMP-9和黏蛋白C)表达均具有显著抑制作用,从而明显减轻炎症介质的合成、释放及血管炎性反应[7-8]。此外,ABL能够抑制血小板源性生长因子(platelet derived growth factor,PDGF)诱导的DNA合成和细胞增殖,导致增殖血管平滑肌细胞的凋亡[18]。近来,在神经系统变性疾病如阿尔茨海默病中研究发现,ABL能明显抑制NF-κB的表达,从而抑制COX-2表达,抑制炎症反应,改善痴呆大鼠的学习记忆障碍[19]。而ABL在脑缺血中的作用目前研究较少。
本研究结果显示,ABL可改善局灶性脑缺血损伤后小鼠神经功能缺损,减轻脑水肿,减小梗死体积,起到神经保护作用。其机制可能是通过抑制脑缺血引发的TLR4/TRAF6/NF-κB信号级联减少TNF-α、IL-1β的表达,发挥对脑缺血损伤的抗炎作用。但ABL通过何种因子或途径影响上述通路,以
及是否还通过其他作用机制起到抗炎作用,仍需进一步深入研究。
[参考文献]
[1]Kim JY,Kawabori M,Yenari MA. Innate inflammatory responses in stroke:mechanisms and potential therapeutic targets[J]. Curr Med Chem,2014,21(18):2076-2097.
[2]Jiang T,Gao L,Guo J,et al. Suppressing inflammation by inhibiting the NF-kappaB pathway contributes to the neuroprotective effect of angiotensin-(1-7) in rats with permanent cerebral ischaemia[J]. Br J Pharmacol,2012,167(7):1520-1532.
[3]Lambertsen KL,Biber K,Finsen B. Inflammatory cytokines in experimental and human stroke[J]. J Cereb Blood Flow Metab,2012,32(9):1677-1698.
[4]Tu XK,Yang WZ,Chen JP,et al. Curcumin inhibits TLR2/4-NF-Κb signaling pathway and attenuates brain damage in permanent focal cerebral ischemia in rats[J]. Inflammation,2014,37(5):1544-1551.
[5]Gesuete R,Kohama SG,Stenzel-Poore MP. Toll-like receptors and ischemic brain injury[J]. J Neuropathol Exp Neurol,2014,73(5):378-386.
[6]Ma Y,He M,Qiang L. Exercise therapy downregulates the overexpression of TLR4,TLR2,MyD88 and NF-κB after cerebral ischemia in rats[J]. Int J Mol Sci,2013,14(2):3718-3733.
[7]Han M,Wen JK,Zheng B,et al. Acetylbritannilatone suppresses NO and PGE2 synthesis in RAW 264.7 macrophages through the inhibition of iNOS and COX-2 gene expression[J]. Life Sci,2004,75(6):675-684.
[8]Liu YP,Wen JK,Zheng B,et al. Acetylbritannilactone suppresses lipopolysaccharide-induced vascular smooth muscle cell inflammatory response[J]. Eur J Pharmacol,2007,577(1/3):28-34.
[9]Dong L,Qiao H,Zhang X,et al. Parthenolide is neuroprotective in rat experimental stroke model:downregulating NF-κB,phospho-p38MAPK,and caspase-1 and ameliorating BBB permeability[J]. Mediators Inflamm,2013,2013:370804.
[10]祝春华,温雅,王力娜,等.过氧化物酶体增殖物激活受体γ在保护大鼠脑缺血中的作用[J].河北医科大学学报,2014,35(9):993-996.
[11]祝春华,温雅,王力娜,等.替米沙坦对大鼠缺血后核因子κB表达的影响[J].河北医科大学学报,2013,34(5):497-500.
[12]Feng Q,Wang YL,Yang Y. Neuroprotective effect of interleukin-6 in a rat model of cerebral ischemia[J]. Exp Ther Med,2015,9(5):1695-1701.
[13]Xin Q,Cheng B,Pan Y,et al. Neuroprotective effects of apelin-13 on experimental ischemic stroke through suppression of inflammation[J]. Peptides,2015,63:55-62.
[14]Sun J,Zhu Y,Zhang L,et al. Effects of xuelian injection on cerebral TNF-α,IL-1β and MMP-9 in rats experienced focal cerebralischemia/reperfusion[J]. Int J Clin Exp Med,2014,15(9):2632-2638.
[15]Wang PF,Xiong XY,Chen J,et al. Function and mechanism of toll-like receptors in cerebral ischemic tolerance:from preconditioning to treatment[J]. J Neuroinflammation,2015,12:80.
[16]Lin SC,Lo YC,Wu H. Helical assembly in the MyD88-IRAK4-IRAK2 complex in TLR/IL-1R signaling[J]. Nature,2010,465(7300):885-890.
[17]Zhao J,Zhang X,Dong L,et al. Cinnamaldehyde inhibits inflammation and brain damage in a mouse model of permanent cerebral ischemia[J]. Br J Pharmacol,2015,172(20):5009-5023.
[18]Liu B,Han M,Sun RH,et al. Acetylbritannilactone induces G1arrest and apoptosis in vascular smooth muscle cells[J]. Int J Cardiol,2011,149(1):30-38.
[19]王英杰,柴锡庆,韩梅,等.旋覆花内酯抑制AD模型大鼠海马环加氧酶2和核转录因子κB的表达[J].中国药理学通报,2008,24(4):437-440.
(本文编辑:刘斯静)
[收稿日期]2015-12-28;[修回日期]2016-01-08
[作者简介]温雅(1981-),女,河北石家庄人,河北医科大学第
[中图分类号]R743.31
[文献标志码]A
[文章编号]1007-3205(2016)05-0497-05
Acetylbritannilactone exerts the neuroprotective effect on ischemic cerebral tissues by inhibiting the inflammatory responses
WEN Ya, DONG Li-peng, ZHAO Jing-ru, ZHU Chun-hua
(Department of Neurology, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China)
【Abstract】ObjectiveThis study is to explore the protective role and mechanism of Acetylbritannilactone(ABL) on inflammatory responses induced by focal cerebral ischemia in mice. MethodsMale CD1 mice were subjected to permanent middle cerebral artery occlusion(MCAO). The mice were randomly divided into sham-operated group, MCAO group, ABL-L group(10 mg/kg) and ABL-H group(30 mg/kg). ABL was injected intraperitoneally 30 minutes prior to MCAO operation. Mice were anesthetized and sacrificed at 24 h after stroke. Western blotting and RT-PCR were used to examine the expression of tumor necrosis factor-α(TNF-α), interleukin-1β(IL-1β), Toll-like receptor 4(TLR4), tumor necrosis receptor associated factor 6(TRAF6) and nuclear factor-kappa B(NF-κB). And the neurological deficit scores, brain water content and infarct volume were explored. ResultsCompared to sham group, the expressions of TNF-α, IL-1β, TLR-4, TRAF6 and NF-κB were significantly increased in MCAO group(P<0.05). ABL treatment markedly down-regulated expressions of TNF-α, IL-1β, TLR4, TRAF6, and NF-κB(P<0.05). The neurological deficit scores, infarct volume and brain water content were alleviated compared to MCAO group(P<0.05). ConclusionABL treatment effectively ameliorates neurological defect, brain edema and brain infarct volume. ABL decreases inflammatory responses by suppressing the expression of the proinflammatory signaling molecules TLR4, TRAF6 and NF-κB, inhibiting TNF-α and IL-1β expression in ischemic cerebral tissue of MCAO mice.
[Key words]brain ischemia; inflammation; Acetylbritannilactone; mice
二医院主治医师,医学博士,从事脑血管疾病诊治研究。
