盐类水解在近两年高考中的应用
2016-08-15邹虎林甘肃平凉机电工程学校
邹虎林(甘肃平凉机电工程学校)
盐类水解在近两年高考中的应用
邹虎林
(甘肃平凉机电工程学校)
《考试大纲》要求学生了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。无论是强酸弱碱盐还是强碱弱酸盐都能发生水解,弱酸的阴离子和弱碱的阳离子发生水解后对溶液中离子浓度的大小会有很大的影响,近几年高考对盐类水解这一问题考查较多。
一、水解原理
1.强碱弱酸盐
此类盐中的弱酸的阴离子能与水电离出的H+结合成弱电解质,从而使原来水的电离平衡被打破,使溶液中c(OH-)>c(H+),溶液显碱性。
2.强酸弱碱盐
此类盐中的弱碱的阳离子能与水电离出的OH-结合成弱电解质,从而使原来水的电离平衡被打破,使得溶液中c(H+)>c(OH-),溶液显酸性。
二、考查角度
1.对溶液中离子浓度大小比较的考查。
2.对溶液中各种离子之间的电荷守恒的考查。
3.对溶液中质子守恒的考查。
3.对溶液中物料守恒的考查。
三、试题剖析
例1.(2014年安徽)室温下,下列溶液中离子浓度关系正确的是 ( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
解析:根据电荷守恒可知HS-+H2O⇌OH-+HS-,HS-+H2O⇌H2S+OH-,所以c(OH-)>c(HS-),A错;依据电荷守恒可知c(Na+)+c (H+)=c(OH-)+2c(C2O)+c(HC2O),根据物料守恒可得c(Na+)=c (HC2O)+c(C2O)+(H2C2O4),结合电荷守恒及物料守恒可得c(OH-)=c(H+)+(HC2O)+2(H2C2O4),B正确;Na2CO3溶液中的电荷守恒是c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO),C错。根据电荷守恒及物料守恒可得c(Na+)+2c(Ca2+)=c(CH3COO-)-+c(CH3COOH) +c(Cl-),D错。答案为B
例2.(2015年海南)0.1mol下列气体分别与1L 0.l mol·L-1的NaOH溶液反应,形成的溶液pH最小的是 ( )
A.NO2B.SO2C.SO3D.CO2
解析:NO2和NaOH恰好反应完全得到NaNO3和NaNO2的混合溶液,该溶液中含有强碱弱酸盐,水溶液显碱性,A错;SO2与NaOH恰好完全反应生成NaHSO3,该物质是强碱弱酸盐,由于HSO3-电离大于水解作用,所以溶液显酸性,B错;SO3与NaOH恰好完全反应生成NaHSO4,该盐是强酸强碱的酸式盐,电离是溶液显酸性,C正确;CO2与NaOH恰好完全反应生成NaHCO3,该物质是强碱弱酸盐,由于HCO电离小于水解作用,所以溶液显碱性,D错。答案:C
例3.(2015年天津)室温下,将0.05molNa2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是( )
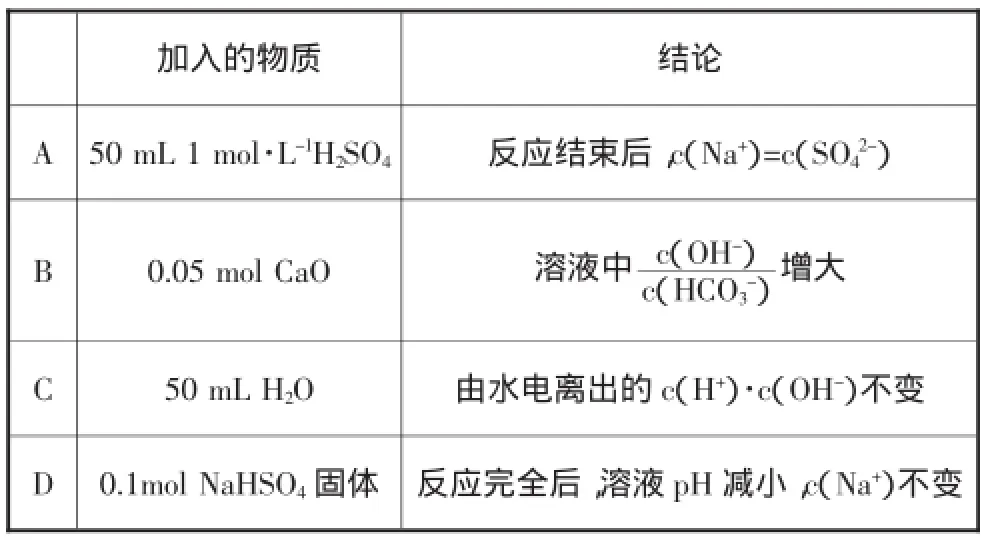
加入的物质 结论A 50 mL 1 mol·L-1H2SO4反应结束后,c(Na+)=c(SO42-)B 0.05 mol CaO 溶液中c(OH-)c(HCO3-C 50 mL H2O 由水电离出的c(H+)·c(OH-)不变D 0.1mol NaHSO4固体 反应完全后,溶液pH减小,c(Na+)不变)增大
解析:室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,溶液呈碱性。加入50mL 1 mol·L-1H2SO4,H2SO4与Na2CO3恰好反应,则反应后的溶液溶质为Na2SO4,根据电荷守恒得c(Na+)=2c(SO),A错;向溶液中加入0.05molCaO,则c(OH-)增大,且Ca2++CO=CaCO3↓,使CO+H2O⇌HCO+OH-平衡左移,c(HCO)减小,故增大,B正确;加入50mL H2O,CO水解产生的c(OH-)减小,水电离出的c(H+)·c(OH-)减小,C错;加入0.1molNaHSO4固体,NaHSO4为强酸酸式盐电离出H+与CO反应,则反应后溶液为Na2SO4溶液,溶液呈中性,故溶液pH减小,引入了Na+,故c(Na+)增大,D错。答案:B
·编辑 李建军
