基于丝素蛋白的新型骨科内固定材料的制备与表征
2016-08-15蒲小兵史成龙冯星龙尹庆水
蒲小兵,郑 冠,史成龙,冯星龙,张 涛,夏 虹,尹庆水,张 余
实验研究
基于丝素蛋白的新型骨科内固定材料的制备与表征
蒲小兵,郑 冠,史成龙,冯星龙,张 涛,夏 虹,尹庆水,张 余
目的探讨基于可降解丝素蛋白的新型骨科内固定材料的制备方法及其表征。方法采用三元溶液对脱胶后的天然蚕茧进行溶解,经过透析、冻干、再溶解等处理,得到具有良好力学性能的材料。扫描电镜观察材料表面及横断面的微观结构,能谱分析仪检测材料表面的主要成分及元素组成,傅里叶变换红外光谱仪分析特征谱带;同时检测材料的热学性质、接触角、生物力学性能、吸水膨胀率和降解特性等。结果材料结构致密,主要成分是C、N、O,在1 622.44 cm-1和1 513.98 cm-1处有明显吸收峰。热重分析和差示扫描量热仪试验证实材料具有明显的热耐受性;表面接触角为(106.8±0.9)°,呈明显疏水性;生物力学实验表明材料所能承受的平均最大载荷为(437±52)N,能够满足临床骨科内固定材料的要求。经过改性的材料仍有一定的吸水性及可降解性:浸泡2 h吸水速度开始增快,48 h后基本达到饱和,最大吸水率为(30.7±0.3)%;随着浸泡时间延长,材料直径不断增加,48 h时直径增大率达(17.9±1.5)%;材料的降解曲线拟合符合二阶函数规律。结论制备出的基于丝素蛋白的新型骨科内固定材料具有结构致密、热耐受性良好、力学性能稳定及可降解等优点。
丝素蛋白;骨折固定术,内;生物相容性材料;蛋白质结构,二级;生物力学;温度;物理学;溶解度;生物降解,环境
Preparation and characterization of novel silk protein-based material for orthopaedic internal fixation
PU Xiaobing,ZHENG Guan,SHI Chenglong,FENG Xinglong,ZHANG Tao,XIA Hong,YIN Qingshui,ZHANG Yu.Hospital of Orthopaedics,Guangzhou General Hospital of Guangzhou Military Command,Institute of Traumatic Orthopaedics of PLA,Key Laboratory of Trauma&Tissue Repair of Tropical Area of PLA,Guangzhou,Guangdong 510010,China
丝素蛋白是一种天然的蛋白材料,在骨组织工程中有广泛的应用前景,目前已有文献报道其作为骨科可吸收内固定材料在骨缺损修复中应用的可能性[1-2],但未有研究对该材料进行系统的材料学表征检测。本实验采用改良的丝素蛋白提取方法,利用三元溶液溶解体系及六氟异丙醇等溶剂对脱胶后蚕茧进行溶解,再用甲醇溶液处理,制备出具有良好力学特性的丝素蛋白骨科可吸收内固定材料;并利用一系列材料学方法对材料形貌、结构及功能进行系列化表征研究,为骨科可吸收内固定材料的选择提供依据。
1 材料与方法
1.1主要材料、试剂与仪器
1.1.1主要材料和试剂 PBS溶液、蛋白酶ⅩⅣ、无水碳酸钠、无水氯化钙、无水乙醇、六氟异丙醇、甲醇;实验用水均为去离子水;家蚕蚕茧购自广西百色。
1.1.2主要仪器 LC-210.2型电子天平、电磁炉、DHG-9246A型电热恒温鼓风干燥箱、DF-101S型集热式恒温加热磁力搅拌器、透析袋、高温炉、低温冰箱、真空干燥机、称重天平、PHS-2C数字式酸度计;酶标仪(Thermo公司,美国)、离心机(Thermo公司,美国)、OCA15接触角测量系统(Dataphysics公司,德国)、S-3700 N扫描电镜(Hitachi公司,日本)、INCA Energy 300能谱分析仪(Oxford公司,英国)、VERTEX70傅里叶变换红外光谱仪(Bruker公司,德国)、STA449F3热重分析与差示扫描量热仪(NETZSCH公司,德国)。
1.2基于丝素蛋白骨科内固定材料的制备
1.2.1脱胶 量取5 000 mL去离子水,煮沸后加入0.06%的Na2CO33 g搅拌均匀,按浴比1∶50(w∶v)加入适量削口蚕茧煮沸脱胶3次,30 min/次,去离子水清洗干净,烘箱内烘干后溶解于摩尔比为1∶2∶8的三元溶液(CaCl2·CH3CH2OH·H2O)中2 h。1.2.2透析 将丝素溶液装入透析袋,置于去离子水中4℃透析3 d,即得到丝素蛋白溶液。离心2次,20 min/次,18 000 rpm,—20℃冷冻3 d。
1.2.3再溶解 将冰块状丝素蛋白溶液冻干5~7 d,然后将得到的再生丝素蛋白剪碎后与六氟异丙醇溶液按1∶4比例再溶解,获得再生丝素蛋白溶液。
1.2.4成形 将再生丝素蛋白溶液放入事先准备好的模具中,置于甲醇中3 d,从纯甲醇、六氟异丙醇到纯水进行梯度反应,即分4次加水,每次间隔1 h,即得到棒状材料,根据需要切成圆片状。
1.2.5干燥 通风橱中干燥至少1周,60℃烤箱干燥5 d,得到基于丝素蛋白的骨科可吸收内固定材料。
1.3电镜观察和能谱分析
取直径3 mm、厚度1 mm的薄片样品,清洗干燥后,在扫描电镜下观察材料表面及横断面的微观结构,用能谱分析仪检测材料表面的主要成分及元素组成。
1.4红外光谱分析
采用傅里叶变换红外光谱仪测试样品的特征谱带,扫描分辨率2 cm-1,扫描范围4 000 cm-1~5 000 cm-1。
1.5热学性质测试
采用热重分析与差示扫描量热仪对样品进行测试,扫描范围50℃~600℃,升温速率10℃/min,氮气流量120 mL/min。
1.6接触角测量
将微量注射器固定于载物台上方,调整摄像头焦距以及摄像头至载物台的距离,加入样品。调节采样旋钮以抽取1μL液体,缓慢升高载物台,触碰悬挂在进样器下端的液滴后下降,使液滴留在固体平面上。冻结图像后测量材料表面多处接触角,取平均值。作为判别润湿情况的依据,通常把接触角θ=90°作为润湿与否的界限;θ>90°为不润湿;θ<90°为润湿,角度越小,润湿性能越好;当θ为0°时,液体在固体表面上铺展,固体被完全润湿。一般来说,材料与水的接触角越大,其表面的疏水性越强。
1.7力学性能检测
选取5件直径4 mm、长度12 mm的棒状样品进行三点弯实验:安装夹具,试样安装在夹具力值传感器一端,力传感器回零,然后夹持试样另一端,按一定预紧力紧固样品;选择电压控制模式简单拉试样,粗略了解试样最大载荷等物理特性;设定极限,选择控制方式,设定实验参数,系统自动调校;获取设定数据后运行试验,结束实验后保存实验数据。
1.8吸水膨胀率检测
称取样品干重(Wd),量取直径(Dd)。将6件样品于37℃在PBS溶液中浸泡0、10、20、30 min,1、2、6、12、24、48、72、96、120 h。于相应时相点取出材料,滤纸清除表面水分,称取样品湿重(Ws),量取直径(Ds)。根据以下公式进行计算:吸水膨胀率(%)=(Ws-Wd)/Ws×100%,直径增加比率(%)=(Ds-Dd)/Ds×100%。
1.9降解性能检测
取3件直径0.5 cm、厚度0.1 cm的样品,称取初始重量(m0)后置入含1 mg/mL蛋白酶ⅩⅣ的PBS溶液中,37℃孵育,设置不含蛋白酶的PBS溶液作为对照组。每48 h更换1次溶液,1、2、4、8、12周后取出样品,PBS溶液彻底洗净、干燥、称重(m1),并进行扫描电镜观察。重量损失(%)=(m0-m1)/m0×100%。
2 结果
2.1大体结构与微观形貌
大体结构上,基于丝素蛋白的骨科内固定材料表面较光滑,可制成棒状、板状、螺钉等不同形态,具有良好的可加工性(图1)。
在扫描电镜100倍放大倍率下,可见材料表面均匀粗糙,这种粗糙表面既可增强其与骨界面的把持力,又有利于螺钉的固定;在5 000倍放大倍率下,材料仍未见明显孔径(图2)。能谱分析结果显示,材料的主要成分是C、N、O(图3),均为氨基酸结构的主要成分。

图1 材料制备形状 可制成棒状、板状及螺钉形状,具有良好的加工性能

图2 材料扫描电镜图片(材料结构致密,均无明显孔径)2A×100 2B×500 2C×1 000 2D×5 000

图3 材料能谱分析仪检测结果 主要成分是C、N、O及少量Ca离子
2.2红外光谱分析结果
傅里叶红外光谱仪扫描结果显示,材料主要为β-折叠构像(图4)。β-折叠成分越多,提示材料越稳定,机械强度越好。材料伸缩振动峰在1 622.44 cm-1处(相当于β折叠结构的吸收峰),1 513.98 cm-1处为无规卷曲结构特征峰(图4)。
2.3热学性能
100℃时材料重量丢失极小,155℃时丢失1.54%,252℃时丢失8.21%,完全能够耐受人体温度(图5)。
2.4接触角
材料在未改性前亲水,经过六氟异丙醇、甲醇处理后,材料表面接触角为(106.8±0.9)°,呈明显的疏水性(图6)。
2.5生物力学性能
5件材料样本能承受的最大载荷分别为384.99、257.73、485.02、507.90、548.87 N,平均最大载荷为(437±52)N,能够满足临床骨科内固定材料的要求(图7)。
2.6吸水膨胀率
如图8所示,浸泡10 min时材料重量开始增加,2 h开始吸水速度增快,48 h后基本达到饱和,最大吸水率为(30.7±0.3)%。材料的直径增长速度在浸泡2 h后开始增加,并随着浸泡时间的延长而不断加快,浸泡48 h时直径增大率达(17.9± 1.5)%。
2.7可降解性能
如图9所示,材料的降解曲线拟合符合二阶函数规律,y=0.00087x2+0.2003x— 0.495,R2= 0.98。根据公式推导,材料在体外环境酶作用下降解3个月,重量减少百分比为24.57%,体外完全降解需要8个月。
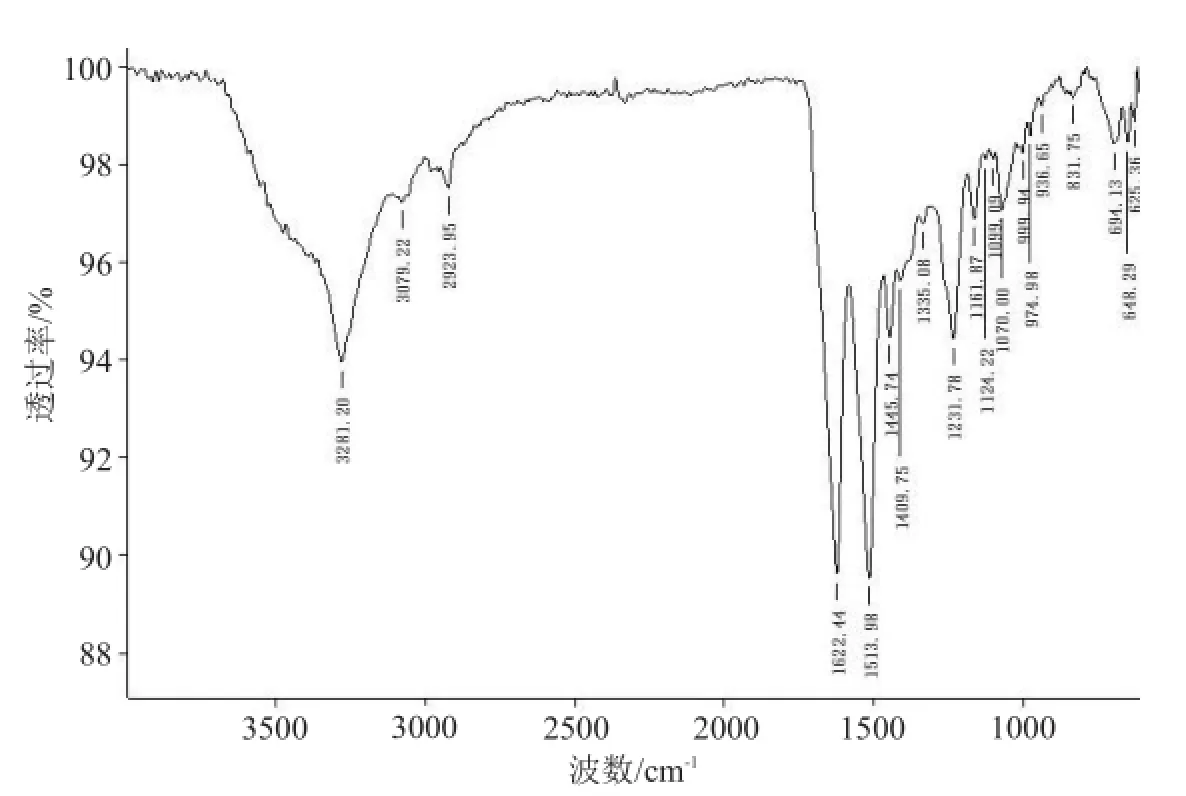
图4 材料的红外光谱分析测试曲线 主要为β-折叠成分和无规卷曲结构

图5 材料热学性能分析结果 TG:热重分析;DSC:差示扫描量热仪

图6 材料接触角测试结果

图7 材料生物力学测试结果

图8 各时相点材料的体外吸水膨胀率 8A不同时相点PBS中样品吸水率 8B不同时相点PBS中样品直径增大率

图9 材料置于含1 mg/mL蛋白酶ⅩⅣPBS溶液中的重量减少拟合曲线
3 讨论
目前在骨科领域,以钛金属为主要材料的内固定系统应用最为广泛,但存在以下缺点:刚度强,易造成骨折部位的局部应力遮挡,导致骨再造不全或局部创面延迟愈合;材料的温度和接触敏感性也会增强患者的不适感觉;大部分患者需施行内固定取出术,增加了手术风险和医疗成本;金属离子的降解易引发炎性反应而导致内固定失败等[3-5]。
骨科可吸收材料是一个新的研究方向,目前主要是聚乳酸等复合材料,能够提高创伤后骨的再愈合能力[6-8],但聚乳酸在降解过程中会产生一种酸性物质,可导致局部炎性反应,产生无菌性窦道,进而引起骨折不愈合、固定松动、创面难愈合等问题[9-10]。有鉴于此,人们目前致力于寻找一种可同时满足刚度、强度、韧性、抗腐蚀性、生物相容性等要求的可吸收骨科内固定材料。
作为一种天然的蛋白材料,丝素蛋白应用历史悠久。它主要包括18种氨基酸,由2条链紧紧缠绕,形成致密的蛋白空间构象,即SilkⅠ和SilkⅡ结构[11]。其中SilkⅠ结构呈曲柄形,包括无规卷曲和α螺旋;SilkⅡ结构为反平行β折叠,这种结构更加稳定,是丝素蛋白的基础构象。考虑到其外侧包绕的丝胶蛋白是引起机体免疫反应的主要原因[12],故人们在提取丝素蛋白时需要进行脱胶处理,通常采用碱水反复煮沸洗净来实现脱胶。在对脱胶蚕丝进行三元溶液溶解时我们发现,85℃时蚕丝溶解速度最快;而所获得的丝素蛋白经冻干、六氟异丙醇再溶解后置于甲醇溶液中,其含无规卷曲及α螺旋结构的SilkⅠ结构将转变为稳定的SilkⅡ结构,进而得到力学强度良好、结构致密的丝素棒或丝素板。
目前,丝素蛋白主要以膜、丝线、支架材料的形式应用于医学领域[13-14]。有学者将丝素蛋白水溶液与丝素蛋白六氟异丙醇溶液分别制成支架材料,复合牙髓干细胞后植入裸鼠体内,25周后2种植入材料均无明显免疫反应,前者完全降解,后者有部分剩余[15];Wang等[16]分别将盐沥取法和六氟异丙醇处理制得的丝素蛋白多孔材料植入大鼠皮下,结果表明,材料在体内均可降解,降解行为是可预测的,而其所引起的免疫反应均较轻微;Meinel等[1]报道了骨髓间充质干细胞(Bone marrow derived mesenchymal stem cells,BMSCs)植入丝素蛋白支架在生物反应器中治疗骨缺损的研究结果,发现丝素蛋白有明显的成骨及促进骨生长的作用,从而进一步拓宽了丝素蛋白支架材料的应用范围。Park等[17]则指出,其所制备的静电纺丝的丝素蛋白三维多孔支架可明显促进MC3T3-E1成骨细胞碱性磷酸酶的活性和成骨分化能力;而在小鼠颅骨缺损修复实验中,丝素蛋白支架组的新骨形成能力优于聚乳酸支架组。另外多个研究结果亦证实,基于丝素蛋白的三维多孔支架材料在促进成骨的同时,还具有良好的力学性能和生物相容性[18-20]。
基于丝素蛋白的复合材料研究也受到学者们的关注。Li等[21]尝试以丝素蛋白纳米纤维、骨形成蛋白-2和纳米羟基磷灰石构建复合丝素蛋白纳米纤维,将人BMSCs接种于该纤维上,结果显示该纤维能明显上调人BMSCs成骨分化的相关蛋白表达,促进Ca2+沉积。
目前,基于丝素蛋白的骨科内固定材料研究甚少,仅见Perrone等[2]将丝素蛋白材料用于大鼠骨折内固定的实验研究,其结果证实,丝素蛋白骨内固定材料力学性能和生物降解性能良好,且不会引起炎症反应。但该研究未对其材料进行系统的表征研究,且生产周期较长。我们改进了传统的再生丝素蛋白提取方法,即改变了脱胶蚕丝溶解时的温度,加快了再生丝素的提取时间;同时改变了再生丝素与六氟异丙醇的比例,使其溶解得更加充分,制作出的材料具有更好的力学强度。我们对改良工艺制备出的材料进行了完整的表征分析,结果显示,该材料无明显孔隙,材料表面利于增强其与骨之间的摩擦力,增强内固定效果;材料的亲水能力下降,可能在客观上降低了细胞在材料上的可黏附性;生物力学强度方面亦能满足临床内固定的需求。
但是,该材料的制备目前还存在一些不足:材料制备过程中,特别是制备较大形状材料时易产生空泡,需要进一步改善制备工艺;同时易出现形变,造成材料不必要的浪费;材料的应用价值还需进一步的生物学实验和临床试验研究来证实。
[1]Meinel L,Fajardo R,Hofmann S,et al.Silk implants for the healing of critical size bone defects[J].Bone,2005,37(5): 688-698.
[2]Perrone GS,Leisk GG,Lo TJ,et al.The use of silk-based devices for fracture fixation[J].Nat Commun,2014,5:3385.
[3]Nagels J,Stokdijk M,Rozing PM.Stress shielding and bone resorption in shoulder arthroplasty[J].J Shoulder Elbow Surg,2003,12(1):35-39.
[4] JacobsJJ,GilbertJL,UrbanRM.Corrosionofmetal orthopaedic implants[J].J Bone Joint Surg Am,1998,80(2): 268-282.
[5]Jacobs JJ,Hallab NJ,Skipor AK,et al.Metal degradation products:a cause for concern in metal-metal bearings?[J]. Clin Orthop Relat Res,2003(417):139-147.
[6]Zhang J,Ebraheim N,Lausé GE,et al.A comparison of absorbable screws and metallic plates in treating calcaneal fractures:a prospective randomized trial[J].J Trauma Acute Care Surg,2012,72(2):E106-E110.
[7] Böstman OM,Laitinen OM,Tynninen O,et al.Tissue restoration after resorption of polyglycolide and poly-laevolactic acid screws[J].J Bone Joint Surg Br,2005,87(11): 1575-1580.
[8]Varghai D,Chim H,Gosain AK.Mechanical analysis of resorbable plates for long-term soft-tissue molding[J].J Craniofac Surg,2011,22(2):543-545.
[9] BöstmanOM.Absorbableimplantsforthefixationof fractures[J].J Bone Joint Surg Am,1991,73(1):148-153.
[10]Bozic KJ,Perez LE,Wilson DR,et al.Mechanical testing of bioresorbable implants for use in metacarpal fracture fixation [J].J Hand Surg Am,2001,26(4):755-761.
[11]Altman GH,Diaz F,Jakuba C,et al.Silk-based biomaterials [J].Biomaterials,2003,24(3):401-416.
[12]Omenetto FG,Kaplan DL.New opportunities for an ancient material[J].Science,2010,329(5991):528-531.
[13]Wang Y,Kim HJ,Vunjak-Novakovic G,et al.Stem cellbased tissue engineering with silk biomaterials [J]. Biomaterials,2006,27(36):6064-6082.
[14]Kundu B,Rajkhowa R,Kundu SC,et al.Silk fibroin biomaterials for tissue regenerations[J].Adv Drug Deliv Rev,2013,65(4):457-470.
[15]Zhang W,Ahluwalia IP,Literman R,et al.Human dental pulp progenitor cell behavior on aqueous and hexafluoroisopropanol based silk scaffolds[J].J Biomed Mater Res A,2011,97(4):414-422.
[16]Wang Y,Rudym DD,Walsh A,et al.In vivo degradation of three-dimensionalsilk fibroin scaffolds[J].Biomaterials,2008,29(24-25):3415-3428.
[17]Park SY,Ki CS,Park YH,et al.Electrospun silk fibroin scaffolds with macropores for bone regeneration:an in vitro and in vivo study[J].Tissue Eng Part A,2010,16(4): 1271-1279.
[18]Ju HW,Sheikh FA,Moon BM,et al.Fabrication of poly (lactic-co-glycolic acid)scaffolds containing silk fibroin scaffolds for tissue engineering applications[J].J Biomed Mater Res A,2014,102(8):2713-2724.
[19]Zhao J,Zhang Z,Wang S,et al.Apatite-coated silk fibroin scaffolds to healing mandibular border defects in canines[J]. Bone,2009,45(3):517-527.
[20]Riccio M,Maraldi T,Pisciotta A,et al.Fibroin scaffold repairs critical-size bone defects in vivo supported by human amniotic fluid and dental pulp stem cells[J].Tissue Eng Part A,2012,18(9-10):1006-1013.
[21]Li C,Vepari C,Jin HJ,et al.Electrospun silk-BMP-2 scaffolds for bone tissue engineering[J].Biomaterials,2006,27(16):3115-3124.
(本文编辑:张辉)
XIA Hong,E-mail:gzxiahong2@126.com
Objective To explore the preparation method and characterization of a new silk protein-based material used for orthopaedic internal fixation.Methods Unglued natural cocoon was dissolved by ternarysolution,and then the material with good mechanical properties was obtained after the treatment of dialysis,freeze-drying and redissolution.Microstructures of the surface and cross section of the material were observed by scanning electron microscopy(SEM),main components and elements on the surface of the material were measured by energy disperse spectrometer,and the characteristic spectral lines were analyzed using Fourier transform infrared(FTIR)spectrometer;Thermal properties,contact angles,biomechanical properties,water absorption and degradation characteristics were examined simultaneously.Results Dense structure of the material was observed by SEM,carbon,nitrogen and oxygen were the major elements in the surface of the material,and the absorption peaks showed obvious distribution at 1622.44 cm-1and 1513.98 cm-1when using FTIR spectrometer. Thermogravimetric analyzer and differential scanning calorimeter tests proved that the material had the property of good thermal tolerance;Contact angle was(106.8±0.9)°,displaying significantly hydrophobic feature;Biomechanical test showed the average maximum load was(437±52)N,which was enough to meet the current mechanical need for orthopaedic fixation.Modified material was still absorbent and biodegradable:speed of water absorption began increasing 2 h after being soaked,and it reached saturation after 48 hours'soaking,with the maximum of the rate of water uptake was(30.7±0.3)%;Diameter of the material increased with the soaking time,and the increasing rate of diameter reached(17.9±1.5)%at 48 h after soaking;The degradation curve of the material conformation was in accordance with the rules of second-order function.Conclusion New developed silk protein-based material for orthopaedic internal fixation has the advantages of dense structure,good thermal tolerance,high mechanical stability and biodegradability.
Silk;Fracture fixation,internal;Biocompatible materials;Protein structure,secondary;Biomechanics;Temperature;Physics;Solubility;Biodegradation,environmental
R687.3;R61
A
1674-666X(2016)03-158-08
10.3969/j.issn.1674-666X.2016.03.005
中国博士后科学基金面上项目(2014M562668)
510010广州军区广州总医院骨科医院全军创伤骨科研究所全军热区创伤救治与组织修复重点实验室前两位作者对本文有同等贡献,均为
夏虹,E-mail:gzxiahong2@126.com
