电针小海与下巨虚穴对DU模型大鼠ChAT及α7 nAchR的影响
2016-08-13邓石峰许明倪伟张雨辰杨璐佳张泓湖南中医药大学长沙40007湖南中医药大学第二附属医院长沙4008
邓石峰,许明,倪伟,张雨辰,杨璐佳,张泓(.湖南中医药大学,长沙 40007;.湖南中医药大学第二附属医院,长沙 4008)
·动物实验·
电针小海与下巨虚穴对DU模型大鼠ChAT及α7 nAchR的影响
邓石峰1,许明1,倪伟1,张雨辰2,杨璐佳1,张泓1
(1.湖南中医药大学,长沙 410007;2.湖南中医药大学第二附属医院,长沙 410208)
目的 观察电针十二指肠溃疡(duodenal ulcer, DU)模型大鼠小海、下巨虚对大鼠血清肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、血清乙酰胆碱转移酶(choline acetyltransferase, ChAT)及十二指肠组织烟碱型乙酰胆碱受体α7(neuronal acetylcholine receptorsα7, α7 nAchR)等表达的影响,朱步探讨“合治内府”中“合”穴的相对特异性。方法 将40只健康SD大鼠随机分为空白组(A组)、模型组(B组)、小海组(C组)和下巨虚组(D组),每组10只。于大鼠右臀部皮下部注射10%盐酸半胱胺建立大鼠DU模型,造模成功后,C组电针小海穴,D组电针下巨虚穴。肉眼观察各组大鼠十二指肠组织溃疡并评分,采用双抗体夹心酶联免疫吸附测定(ELISA)法检测大鼠血清中 TNF-α表达,用可见紫外分光光度计进行比色,测量大鼠血清中ChAT的表达,蛋白质印迹法(western blot)检测大鼠十二指肠组织中α7 nAchR的表达。结果 造模后,B组、C组和D组大鼠十二指肠溃疡评分较A组显著增高(均P<0.01),C组、D组评分显著低于B组(均P<0.01),且D组显著低于C组(P<0.01)。B组TNF-α表达较A组显著增高(P<0.01),C组、D组TNF-α显著低于B组(均P<0.01),且D组显著低于C组(P<0.01)。C组ChAT表达较B组有升高趋势但无统计学意义(P>0.05),D组ChAT表达明显高于B组(P<0.01),且高于C组(P<0.05)。与B组相比,C组和D组α7 nAchR表达显著增高(均P<0.01)。各组ChAT与α7 nAchR表达呈显著的正相关(r=0.444,P=0.007)。结论 电针小海、下巨虚均能降低DU大鼠血清中十二指肠溃疡评分及TNF-α的表达,升高血清中ChAT与十二指肠组织中α7 nAchR的表达,说明电针对十二指肠溃疡产生治疗作用有可能是通过调节TNF-α等来实现的,其机制有可能是通过激活胆碱能抗炎通路产生抗炎作用来完成的。D组效果优于C组,提示下巨虚存在相对特异性。
电针;胆碱能抗炎通路;穴,小海;穴,下巨虚;十二指肠溃疡;血清肿瘤坏死因子-α;血清乙酰胆碱转移酶;十二指肠组织烟碱型乙酰胆碱受体α7;大鼠
目前,研究腧穴临床作用的相对特异性是针灸学领域的热点之一。在特定穴中,手足六阳经除了五输穴中各有 1个合穴(通常称之为经合穴)外,其所属的六腑各自还有 1个下合穴(通常称之为腑合穴或六腑下合穴)。对于合穴的临床应用,后世多遵循《灵枢·邪气脏腑病形》提出的“荥输治外经,合治内府”“治内府奈何?取之于合”等应用原则,即认为合穴的临床意义主要在于治疗相应的内腑病变[1-2]。那么“合治内府”之合究竟是指经合穴还是六腑下合穴亦或包含了上述两类合穴?现今为止,无论文献研究还是实验研究均没有明确的结论,也给临床应用带来了一定的困惑。
笔者选取较为经典的小肠腑病——十二指肠溃疡(duodenal ulcer, DU)模型大鼠为研究对象,以手太阳小肠经经合穴小海、下合穴下巨虚为刺激点,观察电针与小肠相关的两个“合穴”后,DU大鼠十二指肠溃疡评分以及TNF-α、ChAT和α7 nAchR的表达,分析并比较电针小海、下巨虚是否能对十二指肠溃疡炎症反应产生治疗效应以及胆碱能抗炎通路(cholinergic anti-inflammatory pathway, CAP)是否在其中发挥作用等,以期朱步探讨其对十二指肠溃疡可能的治疗机制以及“合治内府”的部分内涵,同时也为特定穴临床应用的相对特异性研究进行一些有益的尝试。
1 材料和方法
1.1 动物分组及处理
健康Sprague-Dawley大鼠40只,SPF级,雌雄各半,体重为205~235 g,饲养温度为20℃~25℃,湿度为 50%~70%,动物及饲料由湖南中医药大学动物实验中心提供(湖南省动物质量合格证编号4304701041)。大鼠适应性饲养 1星期,给与充分的标准饲料和饮用水,光照充分。于实验前24 h禁食不禁水,随机分为空白组(A组)、模型组(B组)、小海组(C组)和下巨虚组(D组),每组10只(每组雌雄各半)。A组以生理盐水替代盐酸半胱胺(Sigma公司)溶液造模,之后不做其他处理;B组造模成功后固定于鼠板上30 min;C组固定后取双侧小海进行治疗;D组取双侧下巨虚进行电针治疗。观察各组大鼠的精神活动、禁食饮水等情况。实验过程中对动物的处置符合 2009年《Ethical issues in animal experimentation》[3]相关动物伦理学标准的条例。
1.2 主要材料、试剂与仪器
1.2.1 材料和试剂
盐酸半胱胺(美国sigma公司进口)、毫针(0.30 mm ×25 mm,苏州医疗用品厂有限公司)、水合氯醛(天津市科密欧化学试剂有限公司)、多聚甲醛(天津市科密欧化学试剂有限公司)、75%乙醇(北海国发海洋生物股份有限公司)、TNF-α酶联免疫分析试剂盒(上海国药生物)、乙酰胆碱转移酶测试盒(南京建成生物工程研究所)、兔抗大鼠α7 nAchR抗体(长沙维尔生物科技有限公司)。
1.2.2 仪器
SDZ-V型电子针疗仪(苏州医疗用品厂有限公司)、全套动物手术器械、CBV-1500A型无菌工作台(上海杨仰净化装备有限公司)、TGL16M台式高速冷冻离心机(长沙科威实业有限公司)、DYCZ-40A转膜仪(北京六一仪器厂)。
1.3 造模方法
采用Szabo[4]法制造DU大鼠。在大鼠禁食不禁水24 h后,皮下注射10%盐酸半胱胺(300 mg/kg),自由饮食。造模24 h后,为了保吴溃疡的慢性过程,分别给造模大鼠饮用1%的半胱胺水。
1.4 电针方法
1.4.1 穴位定取
根据林文注主编《实验针灸学》[5]及华兴邦制定的《实验动物图谱》提供的方法,并参照人体腧穴骨度分寸法量取。①小海位于大鼠前肘突与肱骨髁之间的凹陷中,直刺5 mm;②下巨虚位于大鼠膝关节后外侧胫骨外上髁下约15 mm处,直刺5 mm。
1.4.2 电针操作方法
造模成功后第1天起,C组与D组大鼠捆绑后分别针刺双侧小海、下巨虚穴。使用SDZ-V型华佗牌电针治疗仪,参数为疏密波(10/50 Hz),左侧接正极,右侧接负极,以肢体出现震颤为度,留针30 min。每日1次,治疗10 d。
1.5 样本的采集与处理
治疗结束后将各组大鼠麻醉,立即开腹,EP管行腹主动脉采血,4℃,4000转/min,15 min后取上清液于-70℃低温冰箱保存;采血后迅速分离十二指肠,将十二指肠沿十二指肠系膜纵轴方向剪开并用冰生理盐水冲洗干净,先行肉眼溃疡评分,取出1块约150 mg的肠组织,采用 10%福尔马林溶液固定,石蜡包埋;另取部分十二指肠组织(约 5 mm×8 mm)迅速置于-70℃低温冰箱保存。
1.6 观察指标
1.6.1 肉眼下观察病损组织黏膜溃疡指数并评分
按照Moraes等[6]的方法,并加以改良,评价十二指肠黏膜损伤程度。0分为黏膜正常;1分为黏膜充血、水肿;2分为黏膜糜烂、出血;3分为浅溃疡;4分为深溃疡;5分为溃疡穿孔。
1.6.2 血清中TNF-α的检测
采用双抗体夹心酶联免疫吸附测定(ELISA)法,严格按照试剂盒所述步骤操作。①建立标准曲线后加样,每孔中加入血清100 μL,封板置37℃恒温箱中120 min;②5次洗板后在每孔加入第一抗体工作液50 μL,旋涡振荡器上混匀后封板置37℃恒温,60 min;③洗板5次后每孔加入酶标抗体工作液 100 μL,混匀后封板置37℃恒温箱,60 min;④洗板 5次每孔加入底物液100 μL,混匀后封板 37℃置恒温箱反应 10 min;⑤每孔加入终止液50 μL,混匀,立即在450 nm波长下测定吸光度值,通过标准曲线计算样品中TNF-α的含量。
1.6.3 血清中的ChAT的检测
采用可见紫外分光光度计进行比色测量,严格按照试剂盒所述步骤操作。①按说明准备好试剂、标准品及样品;②分别在对应的测定管和空白管试剂中加入样品和标准品,混匀,于37℃水浴预温5 min后水浴20 min,100℃沸水水浴 2 min终止反应;③混匀后,4000 r/min×10 min后取上清液进行显色方应;④混匀,静置15 min后,在324 nm处,用1 cm光径、2 mm内径的石英比色皿,蒸馏水调零,测定各管的吸光度值(OD值);⑤在pH值为7.2的条件下,37℃时每1 mL血清样本每分钟转移 1 μmol乙酰基给胆碱的能力定义为1个酶活力单位(U/mL),根据公式ChAT活力(U/mL)=(测定管OD值—测定空白管OD值)×反应总体积÷(反应时间×1.98×10-5×比色光径×取样量)×1000 =128.78×(测定管 OD值—测定空白管 OD值)计算ChAT的含量。
1.6.4 十二指肠肠组织中的α7 nAchR受体的检测
采用蛋白质印迹法检测十二指肠组织中的α7 nAchR蛋白表达。①洗涤组织并加入裂解液,匀浆并离心,沉淀分离后得到膜蛋白并冻存;②BCA蛋白定量试剂盒(Wellbio)测定蛋白浓度,样品加入等体积 2× SDS加样缓冲液,煮沸5 min,经电卢后转膜,封闭液封闭 1 h;③加一抗 rabbit α7 AChR(封闭液稀释),4℃孵育过夜,TBST洗15 min×3次;④TBST洗涕15 min ×3次;⑤加入二抗(封闭液稀释),室温孵育1 h,TBST 洗15 min×3次;⑥用ECL发光法检测蛋白表达状况;⑦显影冲洗。每张膜上做一种目的蛋白和相应内参蛋白B,并用Image J分析软件将图片上每个特异条带灰度值数字化。AChR α7蛋白值为目的蛋白的灰度值除以内参β-actin的灰度值,将其上带和下带比值(相对灰度值)的平均值作为结果。
1.7 统计学方法
所有数据以均数±标准差表示,均进行正态性检验。符合正态分布者,多组计量资料采用单因素方差分析(One-way ANOVA),方差齐者用LSD法和SNK法,方差不齐者用Dunnett’s T2或Dunnett’s T3法;ChAT 与α7 nAchR相关性采用直线相关分析。所有数据采用SPSS 16.0软件进行统计处理。以P<0.05表示差异具有统计学意义。
2 结果
B组大鼠造模后死亡1只(死于十二指肠穿孔),C组和D组在治疗过程中分别死亡2只和1只(死于十二指肠穿孔及急性感染),故最终纳入统计共36只。
2.1 各组大鼠十二指肠溃疡肉眼评分比较
由表1可见,B组、C组和D组十二指肠溃疡评分与A组比较,差异均具有统计学意义(P< 0.01)。C组和D组治疗后十二指肠溃疡评分与B组比较,差异均具有统计学意义(P<0.01)。D组治疗后十二指肠溃疡评分与C组比较,差异具有统计学意义(P<0.01)。
表1 各组大鼠十二指肠溃疡肉眼评分比较 (±s,分)

表1 各组大鼠十二指肠溃疡肉眼评分比较 (±s,分)
注:与A组比较1)P<0.01;与B组比较2)P<0.01;与C组比较3)P<0.01
组别 n 十二指肠溃疡肉眼评分A组 10 0.20±0.42 B组 9 4.00±0.501)C组 8 3.13±0.641)2)D组 9 1.89±0.601)2)3)
2.2 各组大鼠血清中TNF-α表达结果比较
由表2可见,B组、C组和D组TNF-α表达均升高,与A组比较,差异均有统计学意义(P< 0.01)。C组和D组治疗后TNF-α表达较B组均显著降低(P<0.01)。D组治疗后TNF-α表达与C组比较,差异具有统计学意义(P<0.01)。
表2 各组大鼠血清中TNF-α表达结果比较 (±s,ng/L)

表2 各组大鼠血清中TNF-α表达结果比较 (±s,ng/L)
注:与A组比较1)P<0.01;与B组比较2)P<0.01;与C组比较3)P<0.01
组别 n TNF-α表达A组 10 110.76±13.92 B组 9 361.06±9.451)C组 8 317.87±19.691)2)D组 9 275.36±14.971)2)3)
2.3 各组大鼠血清ChAT表达比较
表3 各组大鼠血清ChAT表达比较 (±s,U/mL)
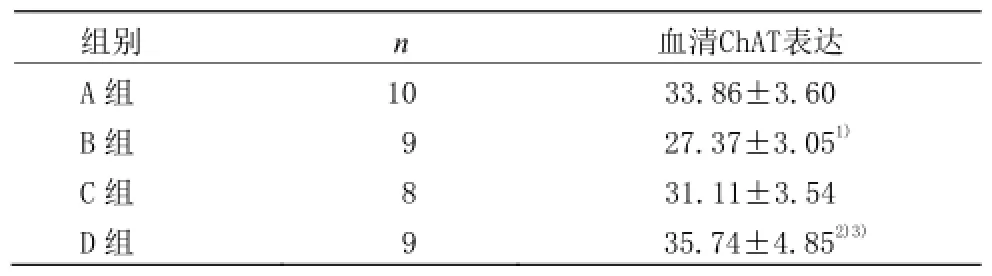
表3 各组大鼠血清ChAT表达比较 (±s,U/mL)
注:与A组比较1)P<0.01;与B组比较2)P<0.01;与C组比较3)P<0.05
组别 n 血清ChAT表达A组 10 33.86±3.60 B组 9 27.37±3.051)C组 8 31.11±3.54 D组 9 35.74±4.852)3)
由表3可见,B组大鼠血清ChAT表达与A组比较,差异具有统计学意义(P< 0.01)。C组治疗后血清ChAT表达较 B组有增高趋势,但两组比较差异无统计学意义(P>0.05)。D组治疗后血清ChAT表达较B组显著增高(P< 0.01),且与 C组比较,差异具有统计学意义(P<0.05)。
2.4 各组大鼠十二指肠组织α7 nAchR含量比较
由图1及表4可见,B组、C组和D组十二指肠溃疡组织中α7 nAchR含量与A组比较,差异均具有统计学意义(P< 0.01)。C组和D组治疗后十二指肠溃疡组织中α7 nAchR含量较B组均显著增高(P<0.01)。而D组治疗后十二指肠溃疡组织中α7 nAchR含量较C组有增高趋势,但差异无统计学意义(P>0.05)。
表4 各组大鼠十二指肠组织α7 nAchR含量比较 (±s)

表4 各组大鼠十二指肠组织α7 nAchR含量比较 (±s)
注:与A组比较1)P<0.01;与B组比较2)P<0.01
组别 n α7 nAchR含量A组 10 0.88±0.11 B组 9 0.51±0.031)C组 8 0.62±0.051)2)D组 9 0.70±0.091)2)
2.5 ChAT与α7 nAchR相关性分析
直线相关分析结果表明,各组大鼠血清中ChAT表达与十二指肠组织中α7 nAchR表达呈显著的正相关(r= 0.444,P=0.007)。
3 讨论
消化性溃疡(peptic ulcer, PU)是最常见的消化系疾病之一,在人群中发病率较高,平均每 10人中就有1人患过PU[7],而DU又是PU的主要病种。炎症反应为DU的基本病理变化之一,与DU的病理过程密切相关。TNF-α是诸多炎症因子中重要的一种,在机体受到有害刺激后起关键的使动作用。郑海涵等[8]研究发现,TNF-α作为细胞增殖和凋亡的主要促炎因子,在炎症性肠病的发病机制中起到重要的调节作用。姚莉亚等[9]研究表明,TNF-α的测定可作为判断 PU病变程度及疗效的参考指标。
本实验中,B组大鼠十二指肠溃疡肉眼评分及TNF-α的表达显著高于A组(均P< 0.01),证实了促炎因子大量表达,表明炎症反应在DU病理过程中的重要作用;C组溃疡评分及 TNF-α表达显著低于 B组(均P<0.01),表明电针小海穴能够降低DU大鼠十二指肠溃疡评分及TNF-α的表达,从而对DU大鼠起到一定的治疗作用;D组溃疡评分及TNF-α的表达显著低于B组和C组(均P< 0.01),提示电针下巨虚穴可有效降低DU大鼠肠溃疡评分及 TNF-α的表达,其疗效优于电针小海穴。
在近年来发现的神经抗炎通路——胆碱能抗炎通路中,下丘脑能够接受炎症刺激的信号,并通过兴奋迷走神经释放乙酰胆碱(acetylcholine, Ach)调控下游的炎症因子,从而达到抗炎的作用[10]。ChAT合成Ach,其在血清中含量的变化能够一定程度地反映出Ach含量的变化。进一步的研究证实,α7 nAchR是胆碱能通路中Ach与下游炎症细胞结合发挥抗炎作用的特异性的受体,广泛分布于巨噬细胞、单核细胞等免疫细胞表面[11],其中,TNF-α是最早发现能够被胆碱能通路调控的下游因子之一[12-13]。针灸对炎症有较好的治疗调节作用,近年来研究证明,其治疗机理与胆碱能通路的调整关系密切[14-17]。
薛平等[18]研究表明,重症胰腺炎大鼠血清中碱酯酶(true choline esterase, TChE)较假手术组显著升高(P< 0.01),乙酰胆 ChAT表达较假手术组显著降低(P<0.01),提示胆碱能抗炎通路在正常情况下可能呈激活状态,释放较多的Ach以维吴正常的生理活动。本研究中有类似的发现,A组ChAT和α7 nAchR表达较高,造模后ChAT和α7 nAchR表达显著降低(P<0.01),表明 DU炎症发生时,胆碱能抗炎通路受到抑制;电针治疗后,C组ChAT表达较B组呈增高趋势(P>0.05),α7 nAchR表达较B组显著增高(P<0.01);D组ChAT和α7 nAchR表达较B组显著增高(P<0.01),直线相关分析结果表明,各组大鼠血清中ChAT表达与十二指肠组织中α7 nAchR表达呈显著的正相关(r=0.444,P=0.007),提示电针治疗后,胆碱能通路中 Ach释放增多并与相应受体结合发挥效应,产生抗炎作用。与 C组比较,D 组ChAT表达增高(P<0.05),α7 nAchR表达有增高趋势(P>0.05),提示下巨虚能更有效地激活胆碱能通路,其对通路的影响要优于小海穴。
本实验中,B组、C组和D组的ChAT、α7 nAchR表达依次升高,且溃疡评分及 TNF-α的表达依次降低,提示DU发病时,胆碱能抗炎通路受到抑制,电针小海、下巨虚可通过缓解胆碱能抗炎通路受到的抑制作用,减轻炎症反应,从而达到抗炎作用。同时比较而言,下D组效果优于C组,说明下巨虚穴存在相对特异性,由此观之,“合治内府”之“合”主要应指下合穴。
综上所述,①电针小海、下巨虚均能降低DU大鼠血清中十二指肠溃疡评分及 TNF-α的表达,升高血清中ChAT与十二指肠组织中α7 nAchR的表达,说明电针对DU产生治疗作用有可能是通过调节TNF-α等来实现的,其机制有可能是通过激活胆碱能抗炎通路产生抗炎作用来完成的。②比较而言D组效果优于C组,说明下巨虚穴存在相对特异性。③本研究结果部分证实“合治内府”之“合”主要应指下合穴,其具体内涵仍需进一步研究。
[1] 赵京生,史欣德.下合穴概念术语研究[J].中国针灸,2010,30 (12):1035-1037.
[2] 赵京生,史欣德.下合穴理论的研究[J].中国针灸,2011,31(7): 646-652.
[3] Adolphe M, Parodi AL.Ethical issues in animal experimentation[J].Bull Acad Natl Med, 2009,193(8):1803-1804.
[4] Szabo S.Duodenal ulcer disease.Animal model: cysteamine-induced acute and chronic duodenal ulcer in the rat[J].Am J Pathol, 1978,93 (1):273-276.
[5] 林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1999: 287-290.
[6] Moraes MF, Nyhus LM, Kalahanis NG, et al.Role of the sympathetic nervous system in peptic ulcer production in rats[J].Surgery, 1978,83(2):194-199.
[7] 中华消化杂志编委会.消化性溃疡病诊断与治疗规范建议(2008,黄山)[J].中华消化杂志,2008,28(7):447-450.
[8] 郑海涵,吴正祥.TNF-α在 IBD发病机制中的调节[J].胃肠病学和肝病学杂志,2011,20(2):191-193.
[9] 姚莉亚,徐立.消化性溃疡患者血清 c反应蛋白和肿瘤坏死因子α水平测定的临床意义[J].现代消化及介入诊疗,2008,13(3):214-216.
[10] Tracey KJ.The inflammatory reflex[J].Nature, 2002,420(6917):853-859.
[11] Tracey KJ.Physiology and immunology of the cholinergic antiinflammatory pathway[J].J Clin Invest, 2007,117(2):289-296.
[12] Borovikova LV, Ivanova S, Zhang M, et al.Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin[J].Nature,2000,405(6785):458-462.
[13] Abraham E, Matthay MA, Dinarello CA, et al.Consensus conference definitions for sepsis, septic shock, acute lung injury, and acute respiratory distress syndrome: time for a reevaluation[J].Crit Care Med, 2000,28(1):232-235.
[14] 胡森,宋琪,王磊,等.电针兴奋胆碱能抗炎通路对内毒素引起的细胞因子释放和脏器功能损害作用研究[J].中国中西医结合急救杂志,2008,15(4):205-208.
[15] 李建国,彭周全,杜朝晖,等.电针足三里激活胆碱能抗炎通路抗大鼠失血性休克的研究[J].中国中西医结合急救杂志,2006,12(1): 27-31.
[16] 李叶晟,徐峰,李洪梅,等.电针刺激大鼠足三里穴对肝缺血再灌注损伤的保护作用[J].第二军医大学学报,2011,32(2):191-194.
[17] 胥阳,宋学敏,李建国,等.电针足三里对严重烫伤大鼠凝血功能和血浆促炎性细胞因子的影响[J].武汉大学学报(医学版),2012,33 (4):453-461.
[18] 薛平,黄宗文,张鸿彦,等.柴芩承气汤对重症急性胰腺炎大鼠胆碱能抗炎通路的影响[J].四川大学学报,2006,37(1):66-68.
Effect of Electroacupuncture at Points Xiaohai and Xiajuxu on ChAT and α 7 nAchR in a Rat Model of DU
DENG Shi-feng1,XU Ming1, NI Wei1, ZHANG Yu-chen2, YANG L u-jia1, ZHANG Hong1. 1.Hunan University o f Traditional C hinese Med icine,Changsha 410007,China; 2.Hunan University of Traditional Chinese Medicine Second Hospital,Changsha 410208,China
Objective To investigate the effect of electroacupuncture at points Xiaohai and Xiajuxu on the expressions of tumour necrosis factor-α (TNF-α) and choline acetyltransferase (ChAT) in serum and nicotinic acetylcholine receptor α 7 (α 7 nAchR) in duodenal tissues in a rat model of duodenal ulcer (DU) and preliminarily explore the relative specificity of He-Sea point in “treating visceral diseases with He-Sea point”.Methods Forty healthy SD rats were randomized into blank (A), model (B), Xiaohai (C) and Xiajuxu (D) groups, 10 rats each.A rat model of DU was made by subcutaneous injection of 10% cysteamine hydrochloride at the right buttock.After successful model making, group C was given electroacupuncture at point Xiaohai and group D, at point Xiajuxu.Duodenal tissue ulcer was macroscopically observed and scored in every group of rats.Rat serum expression of TNF-α was determined by double antibody sandwich enzyme-linked immunosorbent assay (ELISA); rat serum expression of ChAT, by ultraviolet spectrophotometry & colorimetry; rat duodenal expression of α7 nAchR, by Western blot.Results After model making,the duodenal ulcer score was significantly higher in groups B, C and D than in group A (all P<0.01) and significantly lower in groups C and D than in group B (both P<0.01) and in group D than in group C (P<0.01).TNF-α expression was significantly higher in group B than in group A (P<0.01) and significantly lower in groups C and D than in group B (both P<0.01)and in group D than in group C (P<0.01).ChAT expression tended to increase in group C compared with group B but there was no statistically significant difference (P>0.05) and was significantly higher in group D than in group B (P<0.01) or C (P<0.05).α7 nAchR expression was significantly higher in groups C and D than in group B (both P<0.01).There was a positive correlation between ChAT and α7 nAchR expressions in every group (r=0.444, P=0.007).Conclusions Electroacupuncture at both points Xiaohai and Xiajuxu can reduce the duodenal ulcer score and serum TNF-α expression and increase serum ChAT and duodenal α7 nAchR expressions in DU rats.The results show that the therapeutic effect of electroacupuncture on duodenal ulcer may be produced by regulating TNF-α.Its mechanism may be activating cholinergic anti-inflammatory pathway to produce an anti-inflammatory effect.The effect being better in group D than in group C suggests that Xiajuxu has the relative specificity.
Electroacupuncture; Cholinergic anti-inflammatory pathway; Point, Xiaohai; Point, Xiajuxu; Duodenal ulcer; Serum tumour necrosis factor-α; Serum choline acetyltransferase; Duodenal nicotinic acetylcholine receptor α 7; Rats
2016-01-18
R2-03
A
10.13460/j.issn.1005-0957.2016.07.0876
1005-0957(2016)07-0876-05
国家自然科学基金项目(81173327/H2718)
邓石峰(1987- ),男,2011级硕士生
张泓(1963- ),男,教授,博士生导师,Email:zh5381271@sina.com
