Smad4在结肠癌组织中的表达及其临床意义
2016-08-12刘岩青盛吉章赵磊杨猛杨文华戴殿禄
刘岩青,盛吉章,赵磊,杨猛,杨文华 ,戴殿禄
(沧州市中心医院,a肿瘤外二科,b心内科,河北 沧州 061000)
Smad4在结肠癌组织中的表达及其临床意义
刘岩青a,盛吉章b,赵磊b,杨猛a,杨文华a,戴殿禄a
(沧州市中心医院,a肿瘤外二科,b心内科,河北 沧州061000)
摘要:目的探讨Smad4 mRNA的表达在结肠癌组织与癌旁正常组织之间的表达差异,及与结肠癌临床病理参数与预后的关系。 方法选择78例结肠癌手术切除的标本,选取结肠癌组织和相应的癌旁正常组织;采用荧光定量逆转录聚合酶链反应(RT-PCR)检测两组Smad4 mRNA表达水平,Kaplan-Meier法和Cox比例回归模型分析Smad4 mRNA表达与结肠癌临床病理参数与预后之间的关系。结果结肠癌组织中Smad4 mRNA表达水平显著低于癌旁组织(P<0.05)。淋巴结转移、血管淋巴管浸润、肿瘤TNM分期与Smad4-mRNA负相关(P<0.05)。Kaplan-meier生存分析显示Smad4高表达的结肠癌患者有更长的生存期。多因素分析结果显示Smad4 mRNA表达水平是影响结肠癌预后的独立影响因子。结论Smad4表达在结肠癌的发生、发展发挥着抑制因子的作用,是影响结肠癌预后的独立影响因子。
关键词:结肠肿瘤;Smad4蛋白质;聚合酶链反应
结肠癌在全球范围内是发病率居第三位,病死率居第二位的恶性肿瘤[1-2],在我国也有逐年增长的趋势。结肠癌的发生及其发展是一个需要经过多步骤、多阶段的复杂过程[3]。Smad4基因位于人染色体18q21,是首先在胰腺癌中发现的新型抑癌基因,其所编码的Smad4蛋白是转化生长因子-β (TGF-β) 信号通路和骨转化蛋白(BMP)通路的重要级联分子,在信号转导、调节靶基因的转录过程中发挥着重要的作用[5]。在多种肿瘤中均发现Smad4表达缺失,其中大约30%~40%的结肠癌患者中存在Smad4基因的表达缺失或失活,研究表明Smad4在肿瘤演进的多种病理过程发挥着重要的作用。本研究采用荧光定量逆转录聚合酶链反应检测结肠癌组织及相应的癌旁正常组织中Smad4 mRNA的表达情况,并探讨其在结肠癌发生、发展过程中的作用。
1 资料与方法
1.1病例收集及随访选取在沧州市中心医院2007年1月至2008年12月就诊的结肠癌患者经手术切除并病理诊断的人新鲜结肠癌组织及相应的癌旁组织78例为研究对象,每例标本检测的淋巴结数量均大于12枚,保存于-80℃冰箱中。其中男41例,女37例,男女比例1.10∶1,年龄35~78岁,中位年龄(58.3±7.8)岁。按NCCN结肠癌临床实践指南TNM标准进行分期:Ⅰ期26例,Ⅱ期31例, Ⅲ 期13例,Ⅳ8例。同时收集患者的临床资料还包括:肿瘤的大小、分化程度、浸润程度、淋巴结转移、淋巴管血管浸润。所有患者术前均未接受化疗或放疗。
患者的生存状况通过电话随访、门诊及住院复查的方式,随访截止至2015年3月20日。中位随访时间55月,随访期间58例患者无复发转移,13例出现复发转移,17例患者死亡,8例患者失访。
1.2主要试剂Trizol购于Invitrogen公司,RNA纯化试剂盒、2×SYBR Green Mix、MuLV逆转录酶、RNase、dNTP、TaqDNA聚合酶等均购于美国Applied Biosystems 公司。
1.3Real-time PCR按 EZ Spin Column RNA Purification Kit 说明提取结肠癌组织及癌旁组织总RNA。核酸蛋白分析仪鉴定RNA样品的浓度和纯度,正常RNA的吸光度A260nm/A280nm值均在1.8~2.0。以提取的RNA为模板逆转录合成cDNA。反应结束后取出cDNA按1∶1稀释,4℃保存。RT-PCR的引物序列由上海生物工程技术服务公司合成(表1)。采用SYBR Green 染色法检测基因mRNA水平的表达。以β-actin为内参,以2-△△Ct法计算Ct值。摸索适当的反应条件,得到引物的最佳退火温度58℃,每个反应设3个复管,反应结束后,荧光定量PCR仪自动分析各管的循环阈值(threshold cycle,Ct)。不同组别中各目的基因相对表达量用2-△Ct法进行计算,采用2-△△Ct法计算实验组标本中目的基因表达相对于对照组表达的倍数。标本△Ct值=标本Ct值-标本内参Ct值,△△Ct值=目的标本△Ct值-对照标本△Ct值[6]。
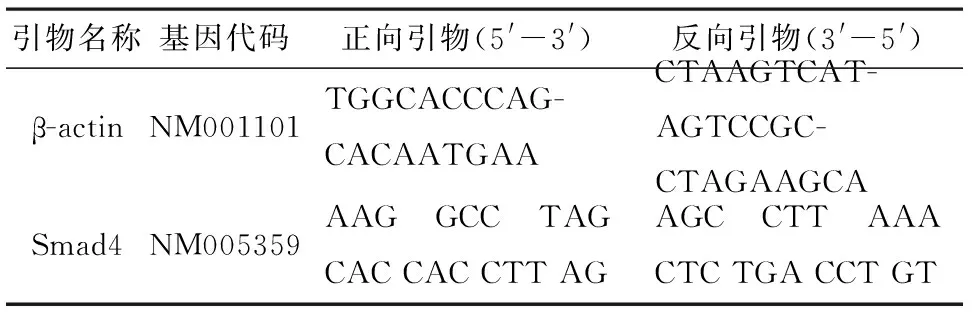
表1 PCR引物列表

2 结果
2.1Smad4 mRNA在结肠癌组织中的表达显著低于癌旁正常组织经RT-PCR检测,Smad4 mRNA在癌组织中的相对表达量为0.723(25%~75% range:0.589~0.804),癌旁组织中的相对表达量为2.176(25%~75% range:1.765~2.734),结果证实两组间Smad4 mRNA的表达水平相比,差异有统计学意义(P<0.05),Smad4 mRNA在结肠癌组织中的表达水平明显低于其相应的癌旁正常组织中的表达水平(图1)。
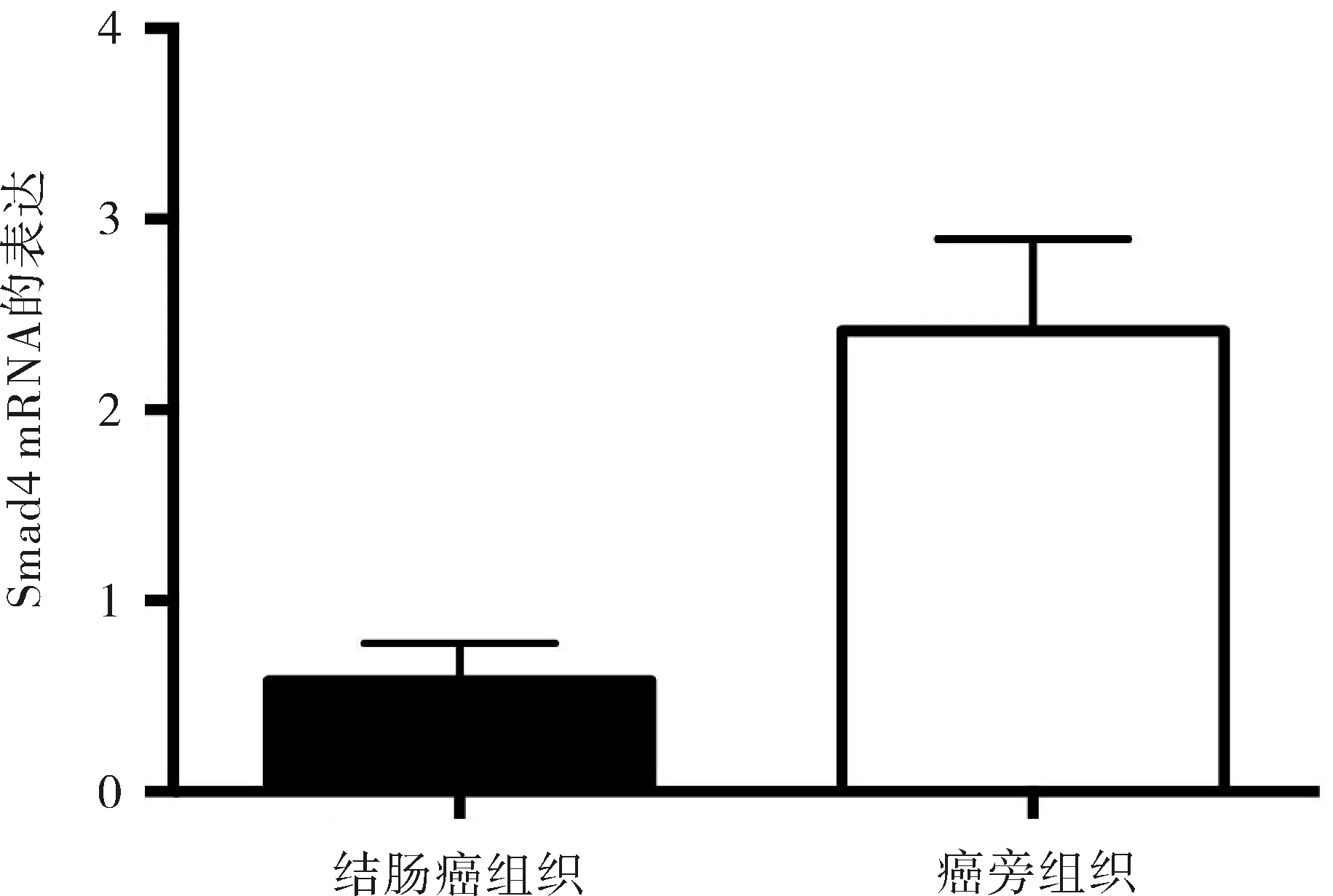
图1 结肠癌组织与相应的癌旁组织中 Smad4 mRNA的表达水平对比表2 Smad4在结肠癌中的表达与临床病理特征的关系

临床病理指标例数Smad4mRNA的表达/例(%)高表达低表达P值性别男4120(48.8)21(51.2)0.821女3719(51.4)18(48.6)年龄<60岁3316(48.5)17(51.5)0.819≥60岁4523(51.1)22(48.9)肿瘤大小<5cm3219(59.4)13(40.6)0.167≥5cm4620(43.5)26(56.5)TNM分期Ⅰ2620(76.9)6(23.1)0.011Ⅱ3116(51.6)15(48.4)Ⅲ132(15.4)11(84.6)Ⅳ81(12.5)7(87.5)肿瘤分化程度低分化1810(55.6)8(44.4)0.905中分化3819(50)19(50)高分化2210(45.5)12(54.5)肿瘤位置左半结肠2712(44.4)15(55.6)0.922横结肠111(64.7)6(35.3)7右半结肠3416(47.1)18(52.9)浸润深度未侵透浆膜层4122(53.7)19(46.3)0.496侵透浆膜层3717(45.9)20(54.1)淋巴结转移阴性6237(59.7)25(40.3)0.001阳性162(12.5)14(87.5)血管淋巴管浸润阴性7039(55.7)31(44.3)0.003阳性80(0)8(100)
2.2Smad4 mRNA 在结肠癌组织中的表达与临床病理参数的关系78例结肠癌患者根据Smad4 mRNA表达水平的中位值将其分为高表达组与低表达组。结果证实高表达的Smad4 mRNA表达水平与淋巴结转移、TNM分期、淋巴管血管浸润呈明显的负相关(均P<0.05)。Smad4 mRNA表达水平与年龄、性别、肿瘤分化程度、肿瘤大小、浸润深度、肿瘤位置无相关性(均P>0.05)。见表2。
2.3Smad4 mRNA在结肠癌组织中的表达与结肠癌患者预后的关Kaplan-Meier生存分析结果显示,Smad4 mRNA高表达组5年生存率为82.1%,而Smad4 mRNA低表达组5年生存率仅为37.2%。Smad4 mRNA低表达组的5年生存率明显的差于Smad4 mRNA高表达组,两者之间差异有统计学意义(P<0.05),我们进一步将结肠癌患者分为早期组(Ⅰ、Ⅱ期)和进展期组(Ⅲ、Ⅳ期),分别进行了生存分析,结果显示,早期和进展期结肠癌患者中Smad4 mRNA低表达组的5年生存率均明显的差于Smad4 mRNA高表达组,差异有统计学意义(均P<0.05)(图2)。

注:(A)早期结肠癌患者生存曲线图。(B)进展期结肠癌患者生存曲线图。
图2Smad4低表达组与高表达组结肠癌患者生存曲线图
Cox回归模型分析结果显示Smad4 mRNA表达水平为影响结肠癌患者预后的独立影响因子(P<0.05)。单因素分析结果表明,TNM分期、淋巴结转移、血管淋巴管浸润及Smad4 mRNA表达水平均与结肠癌患者的预后有明显相关(P<0.05)。进一步多因素分析结果显示TNM分期、淋巴结转移、血管淋巴管浸润及Smad4 mRNA表达水平是影响结肠癌患者预后的独立的影响因子(P<0.05)(表3)。

表3 单因素和多因素分析影响结肠癌预后的因素
3 讨论
结肠癌是消化系统最常见的恶性肿瘤之一,严重威胁着人类的健康和生命。目前虽然有治疗手段多样,包括手术治疗、化疗、靶向治疗及生物免疫治疗等,使早期结肠癌的治愈率明显提高,但复发转移性的结肠癌的治疗效果仍然不是很理想[7-8]。因此,寻找可以对结肠癌进行早期诊断及预测其复发转移、评价预后和疗效的分子标记物十分重要。
Smad蛋白是TGF-β家族的下游信号蛋白,在信号转导、调节靶基因的转录过程中发挥着重要的作用。Smad蛋白根据功能不同分为受体激活性Smads、共同介导性Smads及抑制性Smads三类[9]。Smad2与Smad3均属共同介导性Smad蛋白,其被磷酸化后与Smad4形成异源性多聚体,然后转入核内与DNA结合,从而发挥激活DNA转录,调节靶蛋白的表达的作用[10]。Smad4基因位于人染色体18q21[11],其所编码的Smad4蛋白是转化生长因子-β(TGF-β)信号通路和骨转化蛋白(BMP)通路的重要级联分子,在信号转导、调节靶基因的转录过程中发挥着重要的作用[5,12-13]。
有研究报道,Smad4在多种肿瘤中发挥着抑制肿瘤发生发展及侵袭与转移的能力,包括胰腺癌、乳腺癌、结肠癌及食管癌[5,14-16]。Li等[17]报道Smad4低表达与结肠癌的淋巴管生成及淋巴结转移情况关系密切。Papageorgis等[5]经体外实验和动物实验证实Smad4基因失活与结肠癌的肿瘤血管生成和化疗耐药有密切关系,但有关Smad4 mRNA水平与结肠癌临床病理参数之间的关系尚无明确定论。因此,我们采用荧光定量逆转录聚合酶链反应检测结肠癌组织及相应的癌旁正常组织中Smad4 mRNA的表达情况,研究证实,结肠癌组织中Smad4 mRNA的表达与相应的癌旁正常组织中Smad4 mRNA水平的表达相比有明显的降低。我们进一步研究了Smad4 mRNA的表达与结肠癌临床病理参数之间的关系。低表达Smad4 mRNA与结肠癌TNM分期、淋巴结转移、血管淋巴管浸润明显相关。但是,Smad4 mRNA的异常表达与年龄、性别、发病部位及肿瘤大小、肿瘤分化程度、肿瘤浸润深度等无明显相关。Fukuchi等亦报道Smad4的表达与食管鳞癌的肿瘤分期、浸润深度等有明显的负相关,因此推测Smad4的低表达可能是结肠癌患者进展期中的晚期现象,在结肠癌的发生、发展中发挥重要的作用。虽然Smad4在结肠癌发生发展中的机制研究尚不充分,但本研究揭示了Smad4 mRNA的表达与结肠癌临床病理参数之间的关系,从临床病例特征分析,Smad4在结肠癌的发生、发展发挥着重要的作用,与国外研究Smad4蛋白表达与结肠癌的临床病理参数间的关系的研究结果基本一致[18-20]。
Smad4在肿瘤预后中的作用结论不一。本研究通过对结肠癌病例的随访发现,Smad4 mRNA高表达组5年生存率为82.1%,而Smad4 mRNA低表达组5年生存率仅为37.2%,两者相比有明显的差异。这与Mesker等[18]报道的Smad4在早期结肠癌患者预后中的作用的研究结果是一致的。Hiwatashi报道,Smad4高表达的肝细胞癌患者有更差的预后[21]。但还有研究显示,在食管鳞状细胞癌患者中,Smad4mRNA高表达的患者有更好的预后,与本研究结果相似[22]。本研究结果显示,Smad4 mRNA低表达组的5年生存率明显的差于Smad4 mRNA高表达组,两者之间相比差异有统计学意义(P<0.05),考虑到本研究中约2/3的患者为早期结肠癌患者,我们进一步将结肠癌患者分为早期组(Ⅰ、Ⅱ期)和进展期组(Ⅲ、Ⅳ期),分别进行了生存分析,结果显示,早期和进展期结肠癌患者中Smad4 mRNA低表达组的5年生存率均明显的差于Smad4 mRNA高表达组,差异有统计学意义(均P<0.05),进一步排除了结肠癌分期对生存分析的干扰。何新阳等[23]报道,结肠癌的预后与淋巴结转移等因素相关,因此我们首先单因素分析Smad4 mRNA表达、TNM分期、淋巴结转移、血管淋巴管浸润与结肠癌患者的总生存期相关,进一步多因素分析结果显示Smad4 mRNA低表达是结肠癌患者预后不良的独立危险因素之一。本研究首次揭示了Smad4 mRNA低表达提示了结肠癌患者较差的总生存率,Smad4 mRNA有可能成为影响结肠癌患者预后的独立影响因子。然而调控Smad4 mRNA表达的分子机制并不清楚,还有待进一步的研究。
总之,本研究证实Smad4 mRNA在结肠癌组织的表达下调。Smad4 mRNA 表达与结肠癌TNM分期、淋巴结转移及血管淋巴管浸润明显相关。所有结果显示Smad4的低表达与结肠癌的侵袭性相关,在结肠癌的发生、发展中发挥重要的作用,Smad4是影响结肠癌患者预后的独立的影响因子,为结肠癌的治疗及预后提供了新的靶点。
参考文献
[1]Siegel R,DeSantis C,Virgo K,et al.Cancer treatment and survivorship statistics[J].CA Cancer J Clin,2012,62(4):220-241.
[2]Saika K,Sobue T.Cancer statistics in the world[J].Gan To Kagaku Ryoho,2013,40(13):2475-2480.
[3]Haggar FA,Boushey RP.Colorectal cancer epidemiology:incidence,mortality,survival,and risk factors[J].Clin Colon Rectal Surg,2009,22(4):191-197.
[4]Mlecnik B,Tosolini M,Charoentong P,et al.Biomolecular network reconstruction identifies T-cell homing factors associated with survival in colorectal cancer[J].Gastroenterology,2010,138(4):1429-1440.
[5]Papageorgis P,Cheng K,Ozturk S,et al.Smad4 inactivation promotes malignancy and drug resistance of colon cancer[J].Cancer Res,2011,71(3):998-1008.
[6]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-Delta Delta C(T) Method.[J].Methods,2001,25(4):402-408.
[7]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[8]江陈,常家聪.大肠癌的治疗方法研究进展[J].安徽医药,2012,16(2):247-249.
[9]Maduzia LL,Padgett RW.Drosophila MAD,member of the Smad family,translocates to the nucleus upon stimulation of the dpp pathway[J].Biochem Biophys Res Commun,1997,238(2):595-598.
[10] Vrljicak P,Myburgh D,Ryan AK,et al.Smad expression during kidney development[J].Am J Physiol Renal Physiol,2004,286(4):625-633.
[11] Yanagisawa J,Yanagi Y,Masuhiro Y,et al.Convergence of transforming growth factor-beta and vitamin D signaling pathways on SMAD transcriptional coactivators[J].Science,1999,283(5406):1317-1321.
[12] Lagna G,Hata A,Hemmati-Brivanlou A,et,al.Partnership between DPC4 and SMAD proteins in TGF-beta signalling pathways[J].Nature,1996,383(6603):832-836.
[13] Wakefield LM,Roberts AB.TGF-beta signaling:positive and negative effects on tumorigenesis[J].Curr Opin Genet Dev,2002,12(1):22-29.
[14] Hahn SA,Bartsch D,Schroers A,et al.Mutations of the DPC4/Smad4 gene in biliary tract carcinoma[J].Cancer Res,1998,58(6):1124-1126.
[15] Miyaki M,Iijima T,Konishi M,et al.Higher frequency of Smad4 gene mutation in human colorectal cancer with distant metastasis[J].Oncogene,1999,18(20):3098-3103.
[16] Natsugoe S,Xiangming C,Matsumoto M,et al.Smad4 and transforming growth factor beta1 expression in patients with squamous cell carcinoma of the esophagus[J].Clin Cancer Res,2002,8(6):1838-1842.
[17] Li X,Liu B,Xiao J,et al.Roles of VEGF-C and Smad4 in the lymphangiogenesis,lymphatic metastasis,and prognosis in colon cancer[J].J Gastrointest Surg,2011,15(11):2001-2010.
[18] Mesker WE,Liefers GJ,Junggeburt JM,et al.Presence of a high amount of stroma and downregulation of SMAD4 predict for worse survival for stage I-II colon cancer patients[J].Cell Oncol,2009,31(3):169-178.
[19] Isaksson-Mettavainio M,Palmqvist R,Dahlin AM,et al.High SMAD4 levels appear in microsatellite instability and hypermethylated colon cancers,and indicate a better prognosis[J].Int J Cancer,2012,131(4):779-788.
[20] Voorneveld PW,Jacobs RJ,De Miranda NF,et al.Evaluation of the prognostic value of pSMAD immunohistochemistry in colorectal cancer[J].Eur J Cancer Prev,2013,22(5):420.
[21] Hiwatashi K,Ueno S,Sakoda M,et al.Strong Smad4 expression correlates with poor prognosis after surgery in patients with hepatocellular carcinoma[J].Ann Surg Oncol,2009,16(11):3176-3182.
[22] Lv J,Cao XF,Ji L,et al.Association of beta-catenin,Wnt1,Smad4,Hoxa9,and Bmi-1 with the prognosis of esophageal squamous cell carcinoma[J].Med Oncol,2012,29(1):151-160.
[23] 何新阳,梁伟,姚寒辉.结肠癌术后预后分析[J].安徽医药,2012,16(10):1468-1469.
通信作者:戴殿禄,男,主任医师,研究方向:消化系统肿瘤的临床与基础研究,E-mail:daidianlu111@163.com
doi:10.3969/j.issn.1009-6469.2016.07.030
(收稿日期:2016-02-20,修回日期:2016-05-15)
Correlation of Smad4 expression with clinical characteristics and its relevance to prognosis in colorectal carcinoma
Liu Yanqinga,Sheng Jizhangb,Zhao Leib,et al
(a.DepartmentofOncology;b.DepartmentofCardiology,CangzhouCentralHospital,Cangzhou,Hebei061001,China)
Abstract:ObjectiveTo investigate the Smad4 mRNA expression in colon cancer tissues and adjacent non-cancerous tissues and its potential relevance to clinicopathological variables and prognosis.Methods78 cases of colorectal cancer samples including colon cancer tissues,paracancerous normal tissues were selected.Smad4 mRNA expression of the 2 groups were detected by real-time fluorescence quantitative (RT-PCR).Kaplan-Meier analysis and Cox proportional hazards regression models were used to investigate the correlation between Smad4 expression and prognosis of colon cancer patients.ResultsThe expression level of Smad4 mRNA in colon cancer tissues was significantly lower than that of the paracancerous tissues and normal tissues (P<0.05).Our results indicated that lymph node metastasis,angiolymphatic invasion,and TNM staging were negatively correlation with Smad4 mRNA expression (P<0.05).Kaplan-Meier survival analysis showed that patients with high Smad4 expression have longer overall survival.Multivariate analysis revealed that Smad4 expression was an independent predictor of overall survival.ConclusionSmad4 might play a negative role in colon cancer development and could serve as an independent predictor of prognosis.
Key words:Colonic Neoplasms;Smad4 Protein;Polymerase Chain Reaction
