漆黄素逆转慢性应激鼠认知损害突触可塑性研究
2016-08-12杨仙萍涂传龙庄聪文石晓磊翁向群
杨仙萍,涂传龙,庄聪文,石晓磊,翁向群
(南京军区福州总医院侨宾科,福建 福州 350025)
漆黄素逆转慢性应激鼠认知损害突触可塑性研究
杨仙萍,涂传龙,庄聪文,石晓磊,翁向群
(南京军区福州总医院侨宾科,福建 福州350025)
摘要:目的探讨漆黄素逆转慢性束缚应激小鼠认知损害的突触可塑性研究。方法用CD1小鼠建立慢性束缚应激模型,漆黄素(25 mg·kg-1·d-1)灌胃给药,漆黄素给药前30 min双侧背侧海马微量注射U0126(0.5 μg/侧)。场电生理研究海马CA1区长时程增强(LTP)的变化,高尔基染色观察树突棘数量改变,Western blot检测突触膜蛋白表达。结果漆黄素逆转慢性应激鼠海马CA1区LTP损害,提高海马树突棘数量,ERK特异性阻断剂U0126阻断其效应。结论漆黄素逆转慢性应激鼠海马突触可塑性损害,可能与ERK通路有关。
关键词:漆黄素;CA1区,海马;认知障碍;神经元可塑性;小鼠,近交ICR
应激激活下丘脑-垂体-肾上腺轴和提高应激激素糖皮质激素循环浓度[1]。急性应激可提高身体和精神反应,但长期应激反应会导致一系列负面效应,包括损害海马依赖的认知功能[2]。与学习记忆密切相关海马组织分布高密度糖皮质激素受体,因此特别容易受高糖皮质激素的损伤。长期慢性应激损害海马组织,包括神经化学、兴奋性和神经形态,甚至导致神经细胞死亡,继而损害海马依赖的相关学习记忆功能[3-4]。
突触可塑性是指突触传递效率在某些因素的作用下可出现不同程度的持续性上调或下调,包括突触传递可塑性、突触发育可塑性和突触形态的可塑性[5]。长时程增强(Long-term potentiation,LTP)是突触传递可塑性重要一种。大量实验证实海马突触可塑性与学习记忆密切相关,是学习与记忆功能的细胞分子机制[5]。
我们既往已证实富含于草莓等水果、蔬菜中的黄酮类化合物漆黄素改善慢性束缚应激导致的海马相关学习记忆损害[6-7],且海马组织突触可塑性是学习记忆的细胞分子机制,因此,我们将进一步研究漆黄素逆转慢性束缚应激导致的认知损害的突触可塑性研究。
1 材料与方法
1.1动物雄性CD1(ICR)小鼠8~10周龄,CD1小鼠购买于北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2002-0003。动物饲养于环境温度24~27 °C,自由获得食物和水,光照周期12 h。动物适应1周后才开始实验处理。
1.2药品及试剂漆黄素粉末购买于美国Sigma公司,纯度≥98%,漆黄素溶解于5%羧甲基纤维素钠溶液,连续漆黄素灌胃(25 mg·kg-1) 14 d,对照组给予等体积5%羧甲基纤维素钠溶液。U0126,ERK特异性阻断剂,溶于50%二甲亚砜(dimethyl sulfoxide,DMSO),最终浓度为1 g·L-1,漆黄素给药前30min双侧背侧海马微量注射U0126,每侧注射量为0.5 μL,每天注射1次,连续给药14 d[8]。Synapsin I抗体(Abcam)、PSD95抗体(Abcam)。
1.3慢性束缚应激CD1鼠塞于50 mL通风离心管,保持小鼠仅能呼吸运动,每天3 h,连续21 d,束缚应激结束后放回饲养笼。束缚应激期间对照鼠禁饮禁食3 h。
1.4海马场电位记录记录配制人工脑脊液(artificial cerebrospinal fluid,ACSF)(1 000 mL):KCl 3.6 mmol·L-1,NaCl 119 mmol·L-1,MgSO4.7H2O 1.3 mmol·L-1,NaH2PO4.2H2O 1.0 mmol·L-1,CaCl22.5 mmol·L-1,NaHCO326 mmol·L-1,葡萄糖 10 mmol·L-1。振动切片机切取厚度为400 μm的冠状脑片,切好的脑片转移至孵育槽孵育1.5 h后开始场电位记录。记录Schaffer侧支( CA1区锥体细胞的场兴奋性突触后电位(field excitatory postsynaptic potential,fEPSP),输出单刺激,每30秒刺激一次标本,记录基础fEPSP曲线,基础fEPSP记录稳定后给予高频刺激,后继续用单刺激方式刺激记录fEPSP。LTP幅度的计算方法:高频刺激后45~60 min的fEPSP幅度叠加平均值与高频刺激前fEPSP幅度均值的比值计为LTP的幅度。
1.5高尔基染色10%水合氯醛腹腔注射麻醉小鼠,后将其固定在手术台上手术,将灌流针插入小鼠心间并将针管连接到用0.5%亚硝酸钠溶液滴注,剪破右心耳放血,至从右心耳流出的液体无血色,遂将灌注液换成10%甲醛生理盐水溶液继续灌注进行固定。固定液灌注充分后用媒染液灌注,至流出液显浓厚桔红色。开颅取出脑组织,仍用媒染液浸泡,置暗处避光,室温3 d。换瓶用1%硝酸银水溶液浸泡镀银,置暗处3 d。每日换新银液一次,并及时摇动瓶,使镀银充分。后用震荡切片机切为厚度为50 μm的切片。切片再浸于2%重铬酸钾水溶液漂洗10 min。流水漂洗后贴片于预先涂有1%明胶并烘干的载玻片上。经酒精梯度脱水:70%-80%-90%-95%-95%-100%-100%,每次5 min。经二甲苯漂洗10 min,树胶封片,然后用盖玻片覆盖组织。
1.6突触小体的准备与Western blot适量海马组织加入匀浆液(0.32 mol·L-1蔗糖,4 mmol·L-1HEPES(pH7.4),1X蛋白酶抑制剂混合物)中匀浆,匀浆液1 000×g、4℃离心10 min,上层液12 000×g、4°C离心15 min,细胞碎片重新加入匀浆液(0.32 mol·L-1蔗糖,4 mmol·L-1HEPES(pH7.4),1×蛋白酶抑制剂混合物)中匀浆,匀浆液12 000×g、4°C离心15 min,突触小体碎片加入溶液(50 mmol·L-1HEPES(pH7.4),2 mmol·L-1EDTA,1×蛋白酶抑制剂混合物),即为突触小体蛋白提取物,检测突触膜蛋白表达变化。BCA法制作标准曲线,测定样品总蛋白浓度。SDS-PAGE胶单孔上样量20 μg总蛋白,恒压(80~120 V)电泳,恒流250 mA电转膜后封闭PVDF膜1 h,一抗4°C冰箱摇床孵育过夜,二抗室温摇床孵育1 h,TBST洗脱3次后化学发光成像系统发光。
1.7脑立体定位及双侧套管安置取实验用小鼠,称重,用2%戊巴比妥钠麻醉,剂量为40 mg·kg-1。待小鼠完全麻醉后,将其固定在立体定位仪上,使其头部固定并尽量保持水平。将针管对准前囟,以前囟为基点,按照需要定位的脑区坐标,在颅骨表面找到相应位置,做上记号。用钻头在记号处钻孔,将针管按照定位坐标的深度插入到需要的脑区。用牙托粉固定套管。双侧背侧海马具体坐标如下:(前囟为基点)前囟向后1.8 mm,中线旁开1.4 mm,向下2.2 mm。套管安放好之后,小鼠需休息1周再展后续的实验。
2 结果
2.1漆黄素逆转慢性应激鼠海马LTP损害海马CA1区突触LTP研究见图1。与对照组相比,应激组海马长时程增强(Long-term potentiation,LTP)受损(P<0.05),慢性漆黄素处理逆转其损害(P<0.05)。考虑到LTP的增强或逆转效果可能与漆黄素引起的基础突触传递改变有关,因此我们观察反映基础突触传递功能的指标:输入-输出曲线(input-output curve,I/O曲线)。漆黄素不影响小鼠海马区I/O曲线,组间差异无统计学意义(P>0.05)。这些结果表明,漆黄素对慢性应激鼠海马LTP的逆转作用并不是通过改变海马基础突触传递功能起作用的,而可能是通过作用于突触后的某些信号分子实现的。
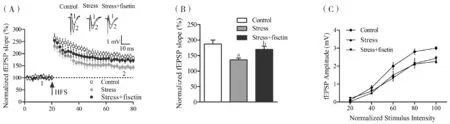
注:(A)海马CA1区高频刺激诱发的LTP;(B)各组HFS-LTP比较的条形图,与对照组对比,aP<0.05;与应激组相比,bP<0.05;(C)各组输入-输出曲线。
图1漆黄素逆转慢性应激鼠海马LTP损害
2.2漆黄素提高慢性应激鼠海马树突棘密度既往研究发现慢性漆黄素处理逆转慢性应激鼠海马突触前蛋白Synapsin I和突触后蛋白PSD95的减少(P<0.05)。而突触膜蛋白的表达增加,常提示突触形态和数量增多,常由树突棘密度增加间接提示[9]。本研究发现与对照组相比,慢性应激鼠海马CA1区树突棘密度明显减低(P<0.01),漆黄素处理可逆转其改变(P<0.05)。
2.3抑制海马ERK活性阻断漆黄素逆转神经可塑性损害既往研究发现漆黄素可激活神经细胞内的ERK通路,且通过激活ERK发挥神经保护、认知增强效应[6,10]。漆黄素灌注口服前0.5 h海马局部脑区微量注射ERK阻断剂U0126,观察其阻断效应。与应激组相比,漆黄素处理提高应激鼠海马突触前蛋白和突触后蛋白表达(P<0.05),漆黄素灌注口服前半小时海马微量注射U0126完全逆转其效应(P<0.05)。同样地,海马微量注射U0126也逆转漆黄素提高海马LTP和树突棘密度(P<0.05),即U0126阻断漆黄素逆转慢性应激鼠突触可塑性损害的效应。
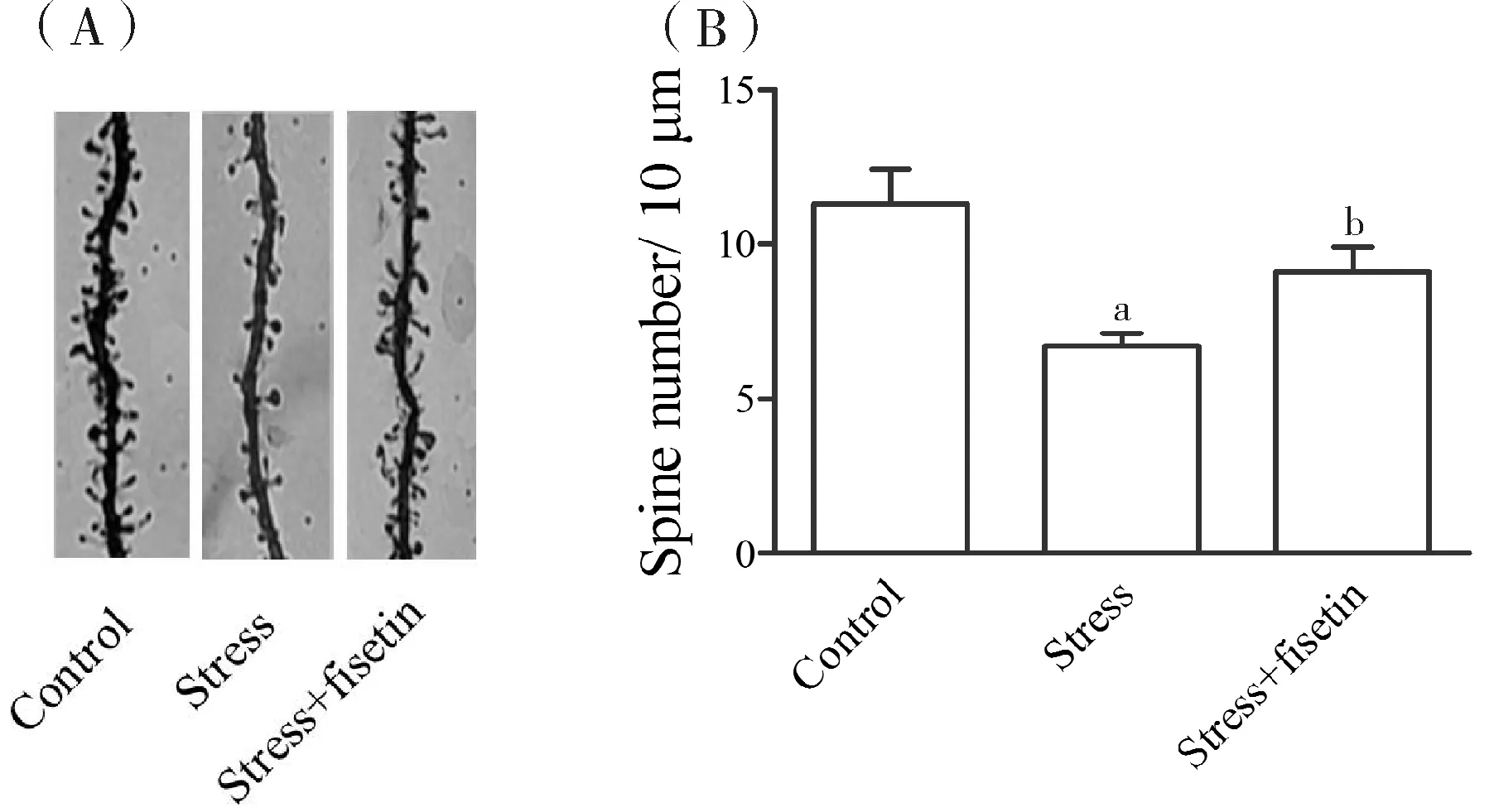
注:(A)代表性海马CA1区锥体神经元树突棘Golgi-cox染色图像(5 μm);(B)海马CA1区锥体神经元树突棘密度统计图,与对照组对比,aP<0.01;与应激组相比,bP<0.05。
图2漆黄素提高慢性应激鼠海马树突棘密度
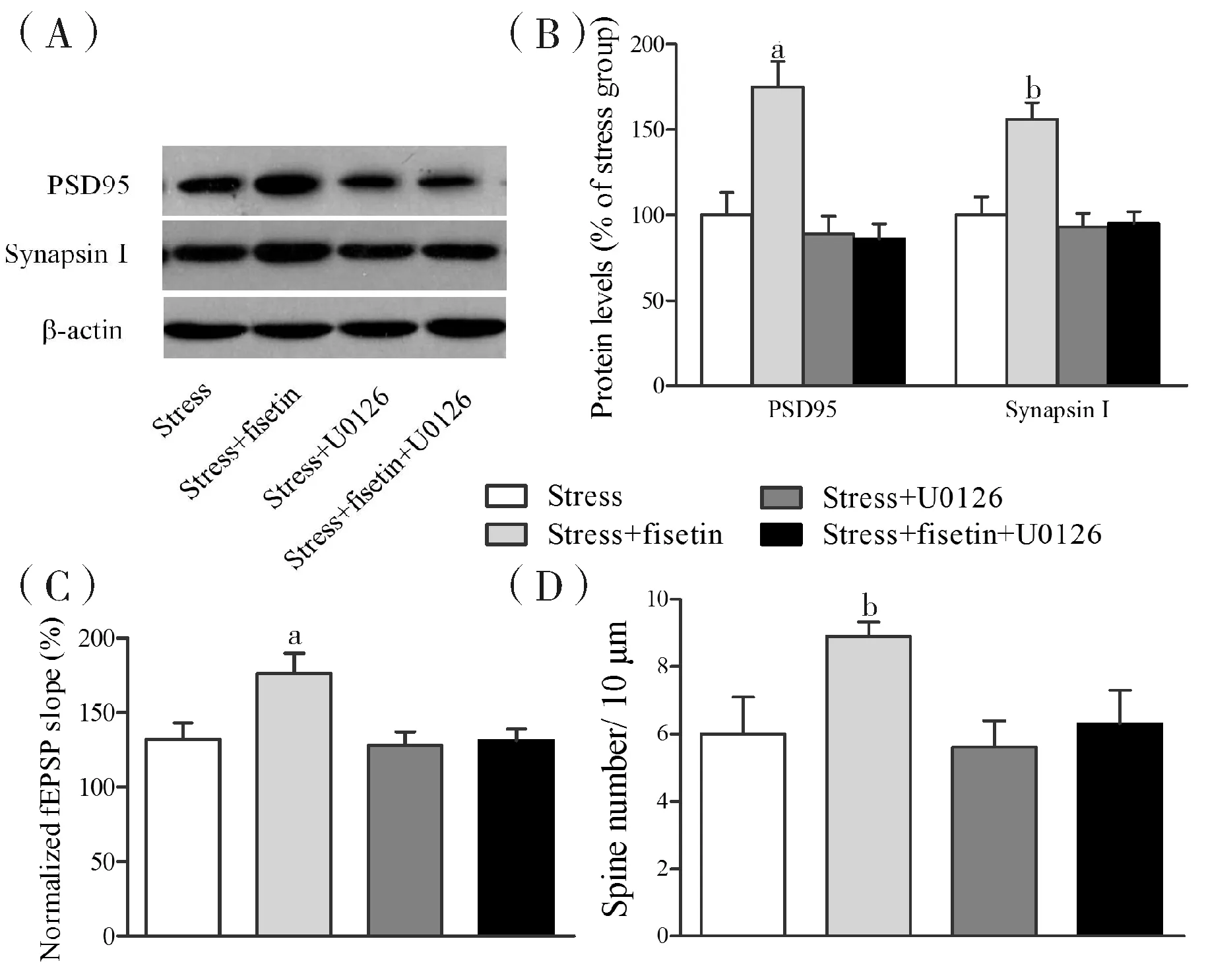
注:(A)代表性突触膜蛋白免疫条带;(B)相对蛋白条带强度;(C)各组HFS-LTP比较的条形图;(D)各组树突棘密度统计图;与stress组对比,aP<0.05;与stress+fisetin组相比,bP<0.05。
图3抑制ERK活性阻断漆黄素逆转神经可塑性损害
3 讨论
短时温和应激提高实验动物学习和记忆功能,长期强烈应激损害海马依赖的记忆功能,而且,长时间或高剂量糖皮质激素给药获得同样的效应[11]。人类受到长期应激后也导致海马依赖的外显记忆损害。海马LTP是海岸依赖的学习记忆功能的分子机制,既往研究也证实慢性应激同时也损害海马LTP[11],本实验发现慢性束缚应激损害小鼠海马LTP,慢性漆黄素给药逆转其损害,说明漆黄素逆转慢性束缚应激导致的认知损害[6],也逆转海马LTP损害。长期应激或高浓度糖皮质激素损伤海马突触树突棘形态,即导致海马锥体神经元顶端树突棘萎缩和退化[12]。高剂量糖皮质激素甚至可导致海马锥体神经元死亡。本实验发现漆黄素逆转慢性束缚应激鼠海马锥体神经元树突棘密度,也表明漆黄素逆转其神经纤维网稀疏。既往实验证实海马微注射ERK抑制剂U0126完全阻断漆黄素改善认知功能[6],本实验也发现U0126完全阻断漆黄素逆转慢性应激鼠海马突触蛋白的表达、海马LTP和树突棘的变化。总之,漆黄素逆转慢性束缚应激导致的学习记忆功能,也逆转其突触可塑性变化,且漆黄素可能通过ERK通路调节神经可塑性发挥改善认知功能。
参考文献
[1]Sharvit A,Segal M,Kehat O,et al.Differential modulation of synaptic plasticity and local circuit activity in the dentate gyrus and CA1 regions of the rat hippocampus by corticosterone[J].Stress,2015,18(3):319-327.
[2]Kolber BJ,Wieczorek L,Muglia LJ.Hypothalamic-pituitary-adrenal axis dysregulation and behavioral analysis of mouse mutants with altered glucocorticoid or mineralocorticoid receptor function[J].Stress,2008,11(5):321-338.
[3]Conrad CD.A critical review of chronic stress effects on spatial learning and memory[J].Prog Neuropsychopharmacol Biol Psychiatry,2010,34(5):742-755.
[4]Kim EJ,Pellman B,Kim JJ.Stress effects on the hippocampus:a critical review[J].Learn Mem,2015,22(9):411-416.
[5]Citri A,Malenka RC.Synaptic plasticity:multiple forms,functions,and mechanisms[J].Neuropsychopharmacology,2008,33(1):18-41.
[6]涂传龙,庄聪文,石晓磊,等.漆黄素逆转慢性应激鼠认知损害及其机制[J].安徽医药,2016,20(1):13-16.
[7]Maher P.How fisetin reduces the impact of age and disease on CNS function[J].Front Biosci(Schol Ed),2015,7:58-82.
[8]Orr PT,Rubin AJ,Fan L,et al.The progesterone-induced enhancement of object recognition memory consolidation involves activation of the extracellular signal-regulated kinase(ERK) and mammalian target of rapamycin(mTOR) pathways in the dorsal hippocampus[J].Horm Behav,2012,61(4):487-495.
[9]Li N,Lee B,Liu RJ,et al.mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists[J].Science,2010,329(5994):959-964.
[10] Currais A,Prior M,Dargusch R,et al.Modulation of p25 and inflammatory pathways by fisetin maintains cognitive function in Alzheimer's disease transgenic mice[J].Aging Cell,2014,13(2):379-390.
[11] Pittenger C,Duman RS.Stress,depression,and neuroplasticity:a convergence of mechanisms[J].Neuropsychopharmacology,2008,33(1):88-109.
[12] Xu C,Ma XM,Chen HB,et al.Orbitofrontal cortex 5-HT2A receptor mediates chronic stress-induced depressive-like behaviors and alterations of spine density and Kalirin7[J].Neuropharmacology,2016,S0028-3908(16)30055-30057.
基金项目:福建省自然科学基金资助项目(2009J01188)
通信作者:翁向群,女,副主任医师,研究方向:老年病,E-mail:xqwengzj@163.com
doi:10.3969/j.issn.1009-6469.2016.07.008
(收稿日期:2016-03-12,修回日期:2016-05-20)
Synaptic plasticity following fisetin’s reversion of cognitive impairment provoked by chronic stress in mice
YANG Xianping,TU Chuanlong,ZHUANG Congwen,et al
(FuzhouGeneralHospitalofNanjingMilitaryCommand,Fuzhou,Fujian350025,China)
Abstract:ObjectiveTo investigate synaptic plasticity following the prevention of cognitive deficits by fisetin treatment provoked by chronic stress in mice.MethodsMice were subjected to chronic restraint stress for 21 days.Stressed mice received repeated gavage of 25 mg·kg-1fisetin once daily for 14 consecutive days.Mice were injected with U0126(0.5 μg/side) 30 min before fisetin treatment.Effects of fisetin on long-term potentiation (LTP) in mouse hippocampal slices were investigated by electrophysiological methods.The expressive levels of proteins in the hippocampus of mice were analyzed by Western blot.The spine density in mice was investigated by Golgi staining.ResultsFisetin reversed hippocampal LTP in stressed mice,increased the density of dendritic spines.However,pretreatment with U0126,a specific ERK inhibitor,blocked the restoration of synaptic plasticity by fisetin in stressed mice.ConclusionsChronic oral administration of fisetin restores synaptic plasticity in stressed mice,which may be related to ERK signaling pathway involved in the hippocampus.
Key words:Fisetin;CA1 Region,hippocampal;Cognition disorders;Neuronal plasticity;Mice,inbred ICR
