免疫磁纳米粒子对肠炎沙门氏菌的富集分离
2016-08-10胡雨欣湖南农业大学食品科技学院食品科学与生物技术湖南省重点实验室湖南长沙410128
胡雨欣,郑 舒,何 早,罗 芳,刘 霞*(湖南农业大学食品科技学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
免疫磁纳米粒子对肠炎沙门氏菌的富集分离
胡雨欣,郑 舒,何 早,罗 芳,刘 霞*
(湖南农业大学食品科技学院,食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
摘 要:采用化学共沉淀法制备了羧基化磁纳米粒子,分别对磁纳米粒子-沙门氏菌多克隆抗体复合物(免疫磁纳米粒子)的偶合条件和免疫磁纳米粒子富集分离肠炎沙门氏菌的条件进行了优化,为肠炎沙门氏菌的富集分离和检测提供一种更为快捷、高效的方法。结果表明,当51.7 μg/mL羧基化磁纳米粒子与碳二亚胺/N-羟基丁二酰亚胺(0.4 mol/L/0.1 mol/L)、1.0 mg/mL的多克隆抗体的体积比为1∶2∶2时,37 ℃水浴加热40 min,两者的偶合效果最佳。应用上述优化条件制备的免疫磁纳米粒子吸附104CFU/mL肠炎沙门氏菌,当两者的体积比为4∶5,孵育时间为40 min时,免疫磁纳米粒子对肠炎沙门氏菌的吸附效率可达到94.36%。
关键词:免疫磁纳米粒子;肠炎沙门氏菌;富集分离
引文格式:
胡雨欣, 郑舒, 何早, 等.免疫磁纳米粒子对肠炎沙门氏菌的富集分离[J].食品科学, 2016, 37(13): 162-167.
HU Yuxin, ZHENG Shu, HE Zao, et al.Enrichment and isolation of Salmonella enteritidis by immune magnetic nanoparticles[J].Food Science, 2016, 37(13): 162-167.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613029. http://www.spkx.net.cn
沙门氏菌是引起食物感染和食物中毒的最重要食源性致病菌之一,禽蛋和肉类食品是其主要的传播媒介[1-2]。人食入过量活菌会产生腹泻、呕吐、发热等症状,严重者会出现败血症、脱水、酸中毒、无尿、心力衰竭等[3],急救不及时将会危及生命。在世界各地的食物中毒中,沙门氏菌引起的中毒病例占首位或第二位[4],因而受到了人们强烈的关注,如何有效地解决沙门氏菌在食品中的污染是食品安全监测工作中的重点之一。
现有分析检测方法通常都需要复杂的增菌过程[5-8],而对目标菌进行预增菌或高效分离富集是其实现快速检测的重要前提。因此,选择合适的富集分离方法,使目标菌从复杂的食品基质中分离出来,同时清除食品基质中的干扰物质,对实现目标菌灵敏且特异的检测至关重要[9]。
近年来,基于磁性纳米材料的免疫磁分离法(immunemagnetic separation,IMS)已经广泛地应用于食源性致病菌的分离[10-14]。经过生物学修饰和功能化的磁性纳米材料,可特异性地识别食源性致病菌,再利用外加磁场分离菌体,即可实现食品中少量致病菌的特异性的快速富集分离[15-19]。本研究采用化学共沉淀法,制备了表面羧基修饰的功能化磁纳米粒子(magnetic nanoparticles,MNPs),利用MNPs表面的羧基,通过氨基偶联的方法将沙门氏菌多克隆抗体(anti-Salmonella polyclonal antibody,PAb)结合在MNPs的表面,制备出对肠炎沙门氏菌具有特异性吸附的免疫MNPs。利用该免疫MNPs对肠炎沙门氏菌(Salmonella enteritidis)进行富集分离,获得吸附性能最佳的免疫MNPs的制备条件和吸附条件。
1 材料与方法
1.1 菌种与试剂
肠炎沙门氏菌多克隆抗体(anti-Salmonella polyclonal antibody,PAb,ab35156) 美国Abcam公司;肠炎沙门氏菌(CICC21482) 湖南省食品药品检验研究院。
富里酸、FeCl3·6H2O、FeSO4·7H2O、无水乙醇、氯化钠、磷酸氢二钠、磷酸二氢钠、牛血清白蛋白(bovine serum albumin,BSA) 国药集团化学试剂有限公司;乙醇胺(ethanolamine hydrochloride,EA)、碳二亚胺(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide,EDC)、N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS) 美国Sigma-Aldrich公司;磷酸盐缓冲溶液(phosphate-buffered saline,PBS)(1 L PBS包含3.223 g磷酸二氢钠、0.45 g磷酸氢二钠和8 g氯化钠,0.1 mol/L氢氧化钠,pH 7.4),营养肉汤培养基、营养琼脂培养基、SS琼脂培养基 广东环凯生物科技有限公司。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本岛津公司;VORTEX-2旋涡振荡仪 美国Scientific Industries公司;KQ-100超声波清洗仪 昆山市超声仪器有限公司;SPX-250BS-Ⅱ恒温箱 上海新苗医疗器械制造有限公司。
1.3 方法
1.3.1 羧基化MNPs的制备
参考Zhou Chunjiao等[20]的方法,采用化学共沉淀法一步生成表面羧基化的MNPs。250 mL三口瓶中加入120 mL超纯水,通入氮气除尽氧气后;升温至80 ℃,再加入0.4 g富里酸;当溶液沸腾后立即加入20 mL含有2 mmol/L FeCl3·6H2O、1 mmol/L FeSO4·7H2O的混合溶液和5 mL 6.25 mol/L NaOH,回流100 min。待溶液冷却至室温后,经磁性分离,多次纯水与无水乙醇洗涤至中性,配成一定浓度溶液后,4 ℃保存备用。
1.3.2 免疫MNPs制备条件的优化
利用MNPs表面的羧基,经氨基偶联方法将PAb偶合在其表面,制备出对肠炎沙门杀菌具有特异性吸附的免疫MNPs。取PBS缓冲液稀释的MNPs溶液(51.7 μg/mL)40 μL,利用新配制的EDC/NHS(0.4 mol/L/0.1 mol/L)40 μL混合溶液活化其表面的羧基后,加入40 μL一定浓度的抗体稀释液,漩涡振荡3 min,冰浴超声5 min后,加入0.1 mol/L 40 μL EA漩涡振荡5 min进行封闭,然后静置30 min,经外加磁场分离未结合的PAb,并用PBS反复洗涤3 遍,重悬至初体积。
1.3.2.1 PAb与羧基化MNPs偶合浓度的参考量的确定
以BSA为标准蛋白,配制一系列已知质量浓度的BSA标准溶液。使用紫外分光光度计在波长278 nm处测定其吸光度,并绘制相应的标准曲线,通过拟合线性关系获得线性方程。然后取未知质量浓度的BSA 2 mL,测定其在278 nm波长处的吸光度值(A1);通过1.3.2节的方法与51.7 μg/mL羧基化MNPs结合后,经外加磁场富集羧基化MNPs结合与BSA的偶合物,小心吸取上清液,测定其在278 nm波长处的吸光度值(A2)。通过测定BSA在被结合前后278 nm波长处的吸光度值,由线性方程计算出与该浓度的羧基化MNPs结合的BSA浓度,并以此作为肠炎沙门氏菌多克隆抗体与该浓度MNPs偶合的参考使用量[21]。
1.3.2.2 EDC/NHS添加量的确定
取30 μL 51.7 μg/mL的MNPs至1.5 mL离心管中;分别加入30、40、50、60 μL EDC/NHS(0.4 mol/L/0.1 mol/L),漩涡振荡3 min,冰浴超声5 min;加入60 μL 1 mg/mL BSA,漩涡振荡3 min,冰浴超声5 min;加入0.1 mol/L EA,漩涡振荡5 min,PBS缓冲液定容至2 mL。静置30 min后用紫外-可见分光光度计扫描紫外全波段光谱,根据258 nm波长处的吸光度,确定EDC/NHS的最佳添加比例。
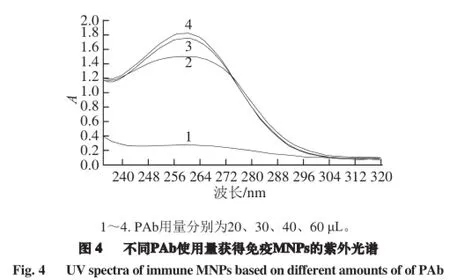
1.3.2.3 PAb用量的确定
取20 μL 51.7 μg/mL的MNPs至1.5 mL离心管中;加入40 μL EDC/NHS(0.4 mol/L/0.1 mol/L),漩涡振荡3 min,冰浴超声5 min;分别加入加20、30、40、60 μL 1.0 mg/mL PAb,冰浴超声1 min;PBS缓冲液定容至2 mL。静置于37 ℃水浴中反应一定时间后,用紫外-可见分光光度计扫描紫外全波段光谱,根据258 nm波长处的吸光度,确定PAb与羧基化MNPs的最佳体积比。
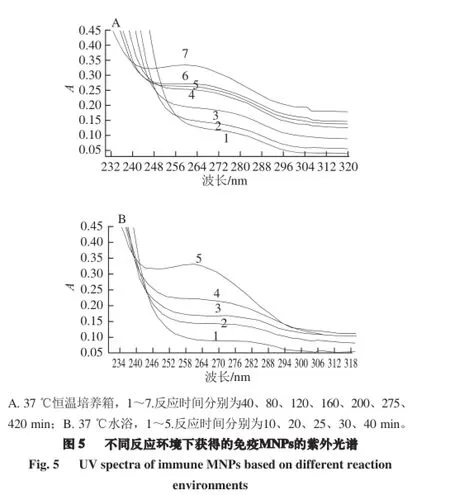
1.3.2.4 反应环境的影响
取20 μL 51.7 μg/mL的MNPs至1.5 mL离心管中;加入40 μL EDC/NHS(0.4 mol/L/0.1 mol/L),漩涡振荡3 min,冰浴超声5 min;加20 μL 0.5 mg/mL PAb,冰浴超声1 min;PBS溶液定容至2 mL。分别静置于37 ℃水浴和恒温培养箱中反应一定时间后,用紫外-可见分光光度计扫描紫外全波段光谱,确定最适合的反应环境。
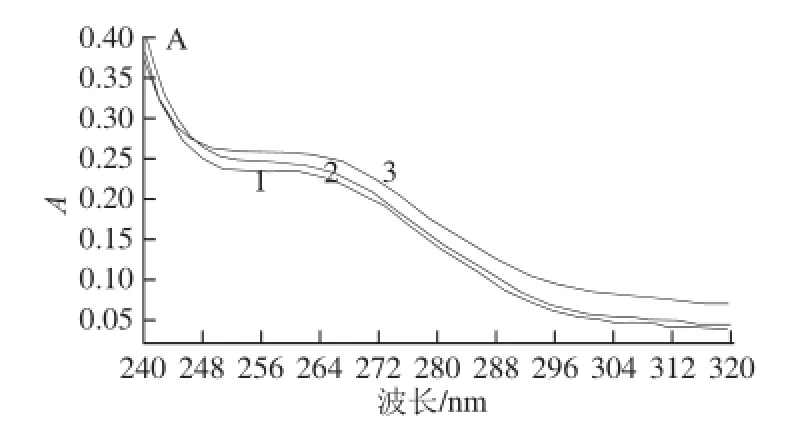
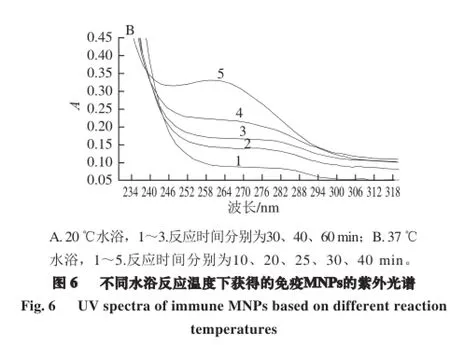
1.3.2.5 反应温度的影响
取20 μL 51.7 μg/mL的MNPs至1.5 mL离心管中;加入40 μL EDC/NHS(0.4 mol/L/0.1 mol/L),漩涡振荡3 min,冰浴超声5 min;加20 μL 0.5 mg/mL PAb,冰浴超声1 min;PBS溶液定容至2 mL。分别静置于37 ℃和20 ℃水浴中反应一定时间后,用紫外-可见分光光度计扫描紫外全波段光谱,确定最适合的反应温度。
1.3.2.6 免疫MNPs 4 ℃保存效果
将51.7 μg/mL羧基化MNPs与1.0 mg/mL PAb偶合好之后放置于4 ℃冰箱保存,每天使用紫外-可见分光光度计测定其在波长258 nm处的吸光度值变化,以考察免疫MNPs在4 ℃条件下的保存效果。
1.3.3 免疫MNPs高效富集肠炎沙门氏菌
1.3.3.1 肠炎沙门氏菌的活化
接种冻藏的肠炎沙门氏菌菌株至50 mL营养肉汤培养基中,37 ℃活化过夜。取活化好的菌液5 mL至灭菌离心管中,5 000 r/min离心5 min后小心去掉上清液,沉淀用PBS重悬至初体积,备用。
1.3.3.2 免疫MNPs用量对吸附效率的影响
无菌操作下,调节肠炎沙门氏菌菌液浓度为104CFU/mL。分别取上述制备的免疫MNPs 20、40、60、80、100 μL至1.5 mL离心管中,每管各加入100 μL菌液,37 ℃水浴中孵育40 min,磁性分离,取上清液100 μL于SS平板涂布计数,每个梯度平行3 次。再将平板置于(36±1) ℃培养18~24 h,根据菌落计数计算吸附效率,同时做空白对照。考察所制备的免疫MNPs对该沙门氏菌吸附效率的影响。
1.3.3.3 反应时间对吸附效率的影响
无菌条件下,取100 μL 104CFU/mL沙门氏菌稀释液于1.5 mL灭菌离心管中,加入80 μL上述制备的免疫MNPs,37 ℃分别孵育10、20、30、40、50、60 min,磁性分离,取上清液100 μL于SS平板涂布计数,每个梯度平行3 次。再将平板置于(36±1) ℃培养18~24 h,根据菌落计数计算吸附效率,同时做空白对照。考察反应时间对吸附效率的影响。
1.3.3.4 免疫MNPs富集沙门氏菌的吸附效率计算
将免疫MNPs富集分离肠炎沙门氏菌过后的上清液采取合适的稀释度,取100 μL于SS平板涂布。再将平板置于(36±1) ℃培养18~24 h,根据菌落计数计算其吸附效率[22]。
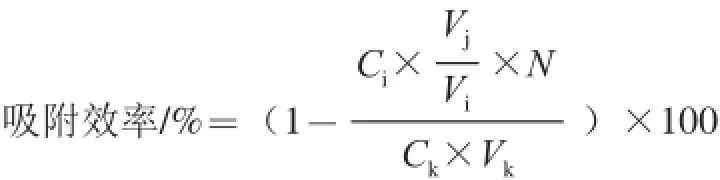
式中:Ci为平板计数菌落数/(CFU/mL);Ck为加入菌悬液浓度/(CFU/mL);Vi为涂布取样体积/mL;Vj为菌悬液及MNPs加入总体积/mL;Vk为菌悬液加入体积/mL;N为稀释倍数。
2 结果与分析
2.1 羧基化MNPs生物功能化的紫外表征
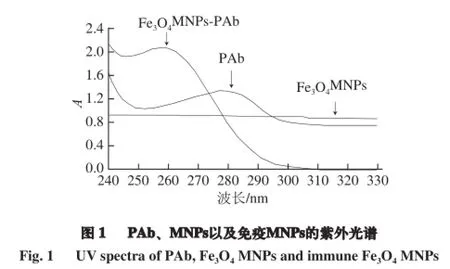
紫外光谱可用来表征抗体是否与MNPs相结合。图1显示了PAb、MNPs以及免疫MNPs的紫外光谱,发现278 nm处的吸收峰为PAb的紫外特征吸收峰;MNPs (Fe3O4MNPs)无显著的紫外特征吸收峰;258 nm处的吸收峰为免疫MNPs的紫外特征吸收峰。免疫MNPs的紫外特征吸收峰值出现蓝移,可能与MNPs粒子的光吸收与散射以及与半导体材料本身具有的间接带隙(indrect band gap)的特性有关[23-24]。
2.2 PAb在羧基化MNPs表面最佳偶合浓度参考量的确定
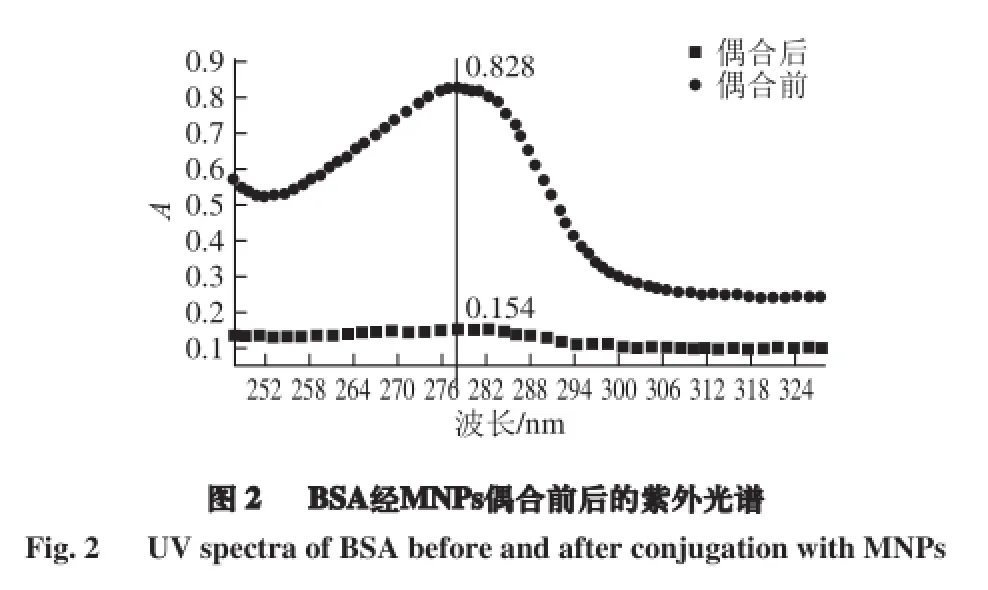
为节约实验成本,本实验采用BSA作为模拟蛋白,获得PAb在羧基化MNPs表面最佳偶合浓度的参考量。BSA在278 nm波长处的标准曲线方程为Y=0.707 86X-0.013 1(R2=0.999 3)。图2为根据1.3.2.1节进行操作,获得的BSA与MNPs偶合前后的紫外光谱图。通过图2可知,BSA经MNPs偶合前后,在278 nm处的吸光度值分别为0.828及0.154,可得与羧基化MNPs (51.7 μg/mL)偶合的BSA的吸光度值为ΔY=0.674,将该值带入BSA的线性方程,可算得X≈0.971 mg/mL,即与51.7 μg/mL羧基化MNPs偶合的BSA的质量浓度为0.971 mg/mL,以此作为PAb与MNPs偶合的参考使用量。
2.3 EDC/NHS添加量的确定
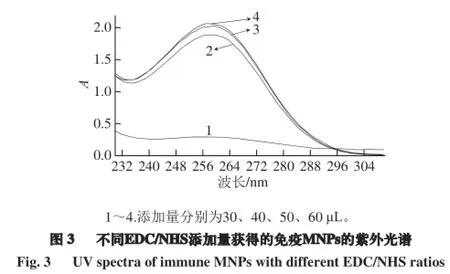
由图3可知,当30 μL 51.7 μg/mL的MNPs溶液中加入EDC/NHS(0.4 mol/L/0.1 mol/L)混合液活化其表面的羧基时,当添加量由30 μL增加至60 μL时,复合物的吸光度在不断增加,说明MNPs表面的羧基活化程度随着EDC/NHS(0.4 mol/L/0.1 mol/L)混合液的增加而不断增加。MNPs表面的羧基被活化的程度越大,与一定体积的PAb结合的就越多。因此,当51.7 μg/mL MNPs生物功能化时,选择EDC/NHS(0.4 mol/L/0.1 mol/L)与MNPs两者的体积比为2∶1,以活化其表面的羧基。
2.4 PAb用量的确定
根据1.3.2.3节,获得了不同体积比的PAb(1.0 mg/mL)与MNPs(51.7 μg/mL)结合的紫外光谱(图3)。如图4所示,当PAb使用量为MNPs(20 μL)的3 倍时,免疫MNPs的吸光度值最大,说明偶合的效果最好;但是与2 倍使用量下的吸光度值差别并不明显。这说明PAb用量在MNPs的2 倍以上时,MNPs的表面基本已被BSA覆盖;考虑到抗体较为昂贵,故选择PAb(1.0 mg/mL)与MNPs(51.7 μg/mL)两者的体积比为2∶1进行后续实验。
2.5 反应环境对免疫磁纳米粒子形成的影响
根据1.3.2.4节,将51.7 μg/mL MNPs与1.0 mg/mL PAb按照最佳使用量,分别在37 ℃水浴和恒温培养箱中进行偶合,每隔一定的时间进行紫外表征。在反应过程中,PAb的特征峰不断蓝移,当二者偶合达稳定状态时,其特征峰蓝移至258 nm处。如图5所示,当MNPs与PAb在恒温箱中反应时,420 min才偶合完全,而二者在水浴中反应,40 min即可完成偶合,时间缩短了10 倍。其原因可能是水浴加热相比恒温箱提供的空气加热,可以平稳地加热,对溶液的加热具有接触包裹性比较好的特点。因此,MNPs与PAb的偶合选择在水浴中进行。
2.6 反应温度对免疫磁纳米粒子形成的影响
根据1.3.2.5节方法,将51.7 μg/mL MNPs与1.0 mg/mL PAb按照最佳使用量,分别在37 ℃和20 ℃水浴中进行偶合,每隔一定的时间进行紫外表征。如图6所示,在37 ℃水浴条件下,MNPs与PAb 40 min即可完成偶合,形成免疫MNPs,而在20 ℃水浴下偶合完成则需要60 min;且免疫MNPs在37 ℃条件下能达到比在20 ℃条件下更高的吸光度值。这说明在37℃水浴加热条件下比在20 ℃时,两者偶合的效率更高。其原因是PAb在37℃条件下具有更好的生物活性,能与羧基化的MNPs结合得更快、更好,故MNPs与PAb的偶合的最佳反应温度为37 ℃。
2.7 免疫磁纳米粒子4 ℃保存效果
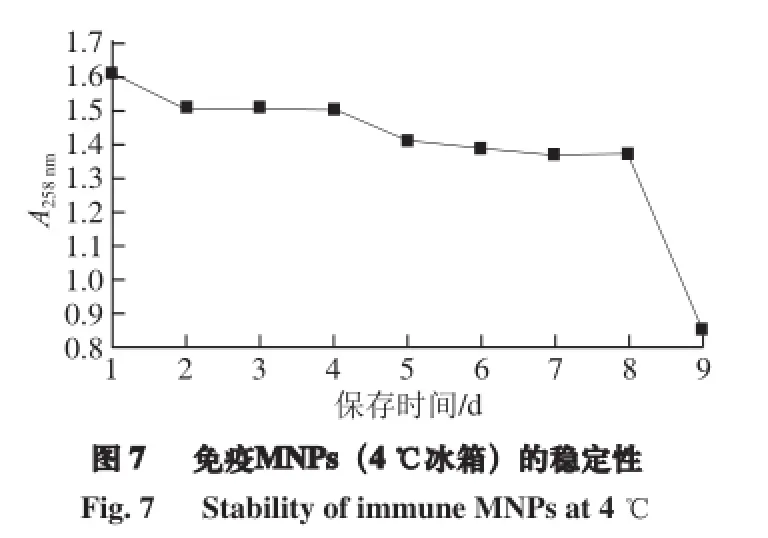
将最佳偶合条件下获得的免疫MNPs放置于4 ℃冰箱保存,每天使用紫外-可见分光光度计测定其258 nm处的吸光度值变化,以观察其在4 ℃条件下的保存效果。如图7所示,免疫MNPs在前8 d的吸光度值下降幅度较小,而在第9天出现了非常明显的下降,说明该免疫MNPs在4 ℃冰箱中至少可保存一周。导致其保存效果降低的原因,可能是保存温度、物理状态、保存液的成分和抗体的光敏感性引起的PAb生物活性的降低,从而导致免疫MNPs的偶合度下降[25]。
2.8 免疫MNPs用量对吸附效率的影响
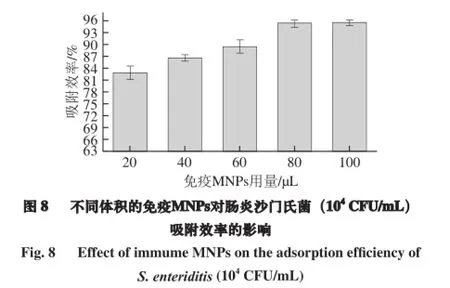
按照1.3.3.2节方法,记录24 h之后上层清液的细菌生长状态后,计算出吸附效率如图8所示,5 个添加量的免疫MNPs对沙门氏菌的平行3 次吸附效率平均值分别为82.81%、86.56%、89.50%、95.32%、95.56%,随着免疫MNPs使用量的增加使其对细菌的吸附能力增强。当免疫MNPs的使用量达到80 μL时,吸附效率达到95.32%,而100 μL的免疫MNPs的吸附效率仅比80 μL时增加0.24%,吸附效果未并达到显著增加。考虑经济效益最优原则,选择80 μL免疫MNPs吸附100 μL沙门氏菌菌液(104CFU/mL)。通过类比可得,当最优条件下制备的的免疫MNPs与104CFU/mL沙门氏菌菌液的体积比为4∶5时其吸附效率可达到95.32%。
2.9 反应时间对吸附效率的影响
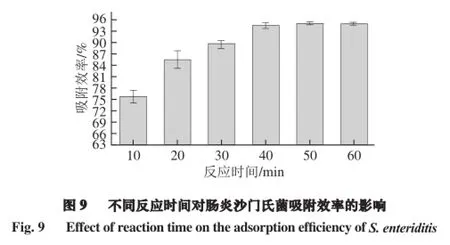
如图9所示,6 个不同反应时间的平行3 次吸附效率平均值分别为75.70%、85.58%、89.56%、94.36%、94.84%、94.84%,随着免疫MNPs与沙门氏菌结合时间的增加,吸附效率不断增加,当免疫MNPs吸附沙门氏菌反应时间为40、50、60 min时,其吸附效率的平均值变化并不明显,说明反应时间达50 min时,该反应体系能够吸附最多数量的目标菌,吸附效率达到最大值94.84%,时间过短免疫MNPs与沙门氏菌结合不充分。而当反应时间40 min时,吸附效率已经达到94.36%,考虑到时间过长细菌有可能死亡或脱离免疫MNPs,故选择40 min作为免疫MNPs吸附沙门氏菌的最佳时间。
3 结 论
免疫MNPs以其能快速、高效富集分离沙门氏菌的能力,具有巨大的实际应用价值。本实验采用化学共沉淀法制备了羧基化MNPs,通过对羧基化MNPs与PAb偶合及免疫MNPs高效富集分离肠炎沙门氏菌的条件进行优化,进一步对免疫MNPs富集分离沙门氏菌的最佳效率进行研究。结果发现,在偶合羧基化MNPs与PAb的过程中,当加热环境为37 ℃水浴加热、羧基化MNPs (51.7 μg/mL)与EDC/NHS(0.4 mol/L/0.1 mol/L)、PAb(1.0 mg/mL)的体积比为1∶2∶2时具有最佳偶合效率。再者,在免疫MNPs富集分离肠炎沙门氏菌(104CFU/mL)的研究中发现,当肠炎沙门氏菌稀释液浓度为104CFU/mL、两者的体积比为4∶5,孵育40 min时具有最大吸附效率,为94.36%。经上述条件优化后,大大提升了免疫MNPs富集分离沙门氏菌的能力,使其更加高效、便捷。
参考文献:
[1] GAST R K, GUARD-PETTER J, HOLT P S.Characteristics of Salmonella enteritidis contamination in eggs after oral, aerosol, and intravenous inoculation of laying hens[J].Avian Diseases, 2002, 46(3): 629-635.DOI:10.1637/0005-2086(2002)046[0629:COSECI]2.0.CO;2.
[2] HERRERA P, AYDIN M, PARK S H, et al.Utility of egg yolk antibodies for detection and control of foodborne Salmonella[J].Agriculture, Food and Analytical Bacteriology, 2013, 3: 195-217.
[3] MORENO SWITT A I, SOYER Y, WARNICK L D, et al.Emergence,distribution, and molecular and phenotypic characteristics of Salmonella enterica Serotype 4, 5, 12: i:-[J].Foodborne Pathogens and Disease, 2009, 6(4): 407-415.DOI:10.1089/fpd.2008.0213.
[4] 黄文宇, 柳陈坚.食源性沙门氏菌检测方法的研究进展[J].生物技术, 2009, 19(3): 95-97.
[5] LEE K M, RUNYON M, HERRMAN T J, et al.Review of Salmonella detection and identification methods: aspects of rapid emergency response and food safety[J].Food Control, 2015, 47: 264-276.DOI:10.1016/j.foodcont.2014.07.011.
[6] JAIN S, CHATTOPADHYAY S, JACKERAY R, et al.Highly sensitive detection of Salmonella typhi using surface aminated polycarbonate membrane enhanced-ELISA[J].Biosensors and Bioelectronics, 2012, 31(1): 37-43.DOI:10.1016/j.bios.2011.09.031.
[7] MALORNY B, BUNGE C, HELMUTH R.A real-time PCR for the detection of Salmonella enteritidis in poultry meat and consumption eggs[J].Journal of Microbiological Methods, 2007, 70(2): 245-251.DOI:10.1016/j.mimet.2007.04.013.
[8] 王卓, 郭皓, 张元玲, 等.达州市 2007-2010 年沙门菌监测结果分析[J].国外医学(医学地理分册), 2011, 32(4): 251-253.DOI:10.3969/ j.issn.1001-8883.2011.04.008.
[9] 黄小林, 许恒毅, 熊勇华, 等.磁性纳米材料在食源性致病菌分离中应用的研究进展[J].食品科学, 2014, 35(11): 280-285.DOI:10.7506/ spkx1002-6630-201411056.
[10] WANG Y L, RAVINDRANATH S, IRUDAYARAJ J.Separation and detection of multiple pathogens in a food matrix by mgnetic SERS nanoprobes[J].Analytical and Bioanalytical Chemistry, 2011, 399(3): 1271-1278.DOI:10.1007/S00216-010-4453-6.
[11] CHEN L Y, ZHANG J.Bioconjugated magnetic nanoparticles for rapid capture of Gram-positive bacteria[J].Biosensors and Bioelectronics, 2012,1(Suppl 11): 55.DOI:10.4172/2155-6210.S11-005.
[12] SUNG Y J, SUK H J, SUNG H Y, et al.Novel antibody/ gold nanoparticle/magnetic nanoparticle nanocomposites for immunomagnetic separation and rapid colorimetric detection of Staphylococcus aureus in milk[J].Biosensors and Bioelectronics,2013, 43: 432-439.DOI:10.1016/j.bios.2012.12.052.
[13] CHUNGLOK W, WURAGIL D K, OAEW S, et al.Immunoassay based on carbon nanotubes-enhanced ELISA for Salmonella enterica serovar Typhimurium[J].Biosensors and Bioelectronics, 2011, 26(8): 3584-3589.DOI:10.1016/j.bios.2011.02.005.
[14] JOO J, YIM C, KWON D, et al.A facile and sensitive detection of pathogenic bacteria using magnetic nanoparticles and optical nanocrystal probes[J].Analyst, 2012, 137(16): 3609-3612.DOI:10.1039/c2an35369e.
[15] ZHANG L, XU J, MI L, et al.Multifunctional magnetic-plasmonic nanoparticles for fast concentration and sensitive detection of bacteria using SERS[J].Biosensors and Bioelectronics, 2012, 31(1): 130-136.DOI:10.1016/j.bios.2011.10.006.
[16] ZHAN S, YANG Y, SHEN Z, et al.Efficient removal of pathogenic bacteria and viruses by multifunctional amine-modified magnetic nanoparticles[J].Journal of Hazardous Materials, 2014, 274: 115-123.DOI:10.1016/j.jhazmat.2014.03.067.
[17] BHAISARE M L, ABDELHAMID H N, WU B S, et al.Rapid and direct MALDI-MS identification of pathogenic bacteria from blood using ionic liquid-modified magnetic nanoparticles (Fe3O4@ SiO2)[J].Journal of Materials Chemistry B, 2014, 2(29): 4671-4683.DOI:10.1039/c4tb00528g.
[18] WANG J, ALI Z, WANG N, et al.Simultaneous extraction of DNA and RNA from Escherichia coli BL 21 based on silica-coated magnetic nanoparticles[J].Science China Chemistry, 2015, 58(11): 1774-1778.DOI:10.1007/s11426-015-5483-x.
[19] LIU R, GE Y, HOLDEN P A, et al.Analysis of soil bacteria susceptibility to manufactured nanoparticles via data visualization[J].Beilstein Journal of Nanotechnology, 2015, 6(1): 1635-1651.DOI:10.3762/bjnano.6.166.
[20] ZHOU C J, RONG P F, ZHANG W J, et al.Fulvic acid coated iron oxide nanoparticles for magnetic resonance imaging contrast agent[J].Functional Materials Letters, 2010, 3(3): 197-200.DOI:10.1142/ S179360471000124X.
[21] HAO Y, YE M Q, CHAO Q G, et al.Simultaneous detection of multifood-borne pathogenic bacteria based on functionalized quantum dots coupled with immunomagnetic separation in food samples[J].Journal of Agricultural and Food Chemistry, 2009, 57: 517-524.DOI:10.1021/jf802817y.
[22] 章建辉.免疫磁珠快速检测金黄色葡萄球菌方法的研究[D].长沙:湖南师范大学, 2013.
[23] KAUSHIK A, KHAN R, SOLANKI P R, et al.Iron oxide nanoparticles: chitosan composite based glucose biosensor[J].Journal of Biosensors and Bioelectronics, 2008, 24(4): 676-683.DOI:10.1016/ j.bios.2008.06.032.
[24] ZHAO G, XU J J, CHEN H Y.Fabrication, Characterization of Fe3O4multilayer film and its application in promoting direct electron transfer of hemoglobin[J].Electrochemistry Communication, 2006, 8(1): 148-154.DOI:10.1016/j.elecom.2005.11.001.
[25] 张静, 张政朴, 贺秉坤.染料壳聚糖微球的制备及其对人血清蛋白吸附性能研究[J].高分子学报, 2006(4): 640-644.
DOI:10.7506/spkx1002-6630-201613029 10.7506/spkx1002-6630-201613029. http://www.spkx.net.cn
中图分类号:R155.5
文献标志码:A
文章编号:1002-6630(2016)13-0162-06
收稿日期:2015-09-17
基金项目:公益性行业(农业)科研专项(201303084)
作者简介:胡雨欣(1990—),女,硕士,研究方向为食品安全与控制。E-mail:627649521@qq.com
*通信作者:刘霞(1976—),女,副教授,博士,研究方向为食品分析,食品营养与安全。E-mail:liuxiaspr@aliyun.com
Enrichment and Isolation of Salmonella enteritidis by Immune Magnetic Nanoparticles
HU Yuxin, ZHENG Shu, HE Zao, LUO Fang, LIU Xia*
(Hunan Province Key Laboratory of Food Science and Biotechnology, College of Food Science and Technology,Hunan Agricultural University, Changsha 410128, China)
Abstract:In this study, carboxyl-coated magnetic namoparticles (MNPs) were prepared using a chemical coprecipitation method.The coupling conditions for conjugates (immune MNPs) of MNPs and anti-Salmonella polyclonal antibody (PAb)were optimized, and then the application of immune MNPs in the enrichment and isolation of Salmonella enteritidis was evaluated, which will provide a more fast and effective way for the detection of Salmonella.The results showed that the optimal coupling of MNPs and PAb was achieved when the volume ratio of 51.7 μg/mL MNPs to 0.4 mol/L EDC-0.1 mol/L NHS to 1.0 mg/mL PAb was 1:2:2 in a water bath at 37 ℃ for 40 min.The adsorption efficiency attained 94.36% when the volume ratio between 51.7 μg/mL immune MNPs and 104CFU/mL S.enteritidis was 4:5, and the incubation time was 40 min.
Key words:immune magnetic namoparticles; Salmonella enteritidis; enrichment and separation
