葡萄糖氧化酶脂质体的制备与表征
2016-08-10关桦楠韩博林瑙阿敏徐丽萍哈尔滨商业大学食品工程学院黑龙江哈尔滨50076东北林业大学盐碱地生物资源环境研究中心黑龙江哈尔滨50040
关桦楠,韩博林,瑙阿敏,王 鑫,徐丽萍,孙 璐(.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 50076;.东北林业大学盐碱地生物资源环境研究中心,黑龙江 哈尔滨 50040)
葡萄糖氧化酶脂质体的制备与表征
关桦楠1,2,韩博林1,瑙阿敏1,王 鑫1,徐丽萍1,孙 璐2
(1.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076;2.东北林业大学盐碱地生物资源环境研究中心,黑龙江 哈尔滨 150040)
摘 要:以大豆卵磷脂和胆固醇作为壁材,采用薄膜蒸发-冻融法制备葡萄糖氧化酶脂质体。以包封率作为指标,通过单因素和正交试验设计优化确定最佳制备工艺,并考察脂质体的形貌、粒径分布和稳定性指标。结果表明:最佳工艺参数为:大豆卵磷脂与胆固醇质量比4∶1、芯材质量5 mg(500 U)、水化时间15 min、冻融循环10 次,此条件下包封率可达到(87.7±2.1)%;粒径分布均匀,分散性较好,平均粒径为(164.75±2.55) μm;4 ℃和室温(23.0±0.5)℃贮存条件下脂质体包封率无变化,酶活性稳定。
关键词:葡萄糖氧化酶;脂质体;稳定性;薄膜蒸发-冻融法;表征
引文格式:
关桦楠, 韩博林, 瑙阿敏, 等.葡萄糖氧化酶脂质体的制备与表征[J].食品科学, 2016, 37(13): 120-124.DOI:10.7506/ spkx1002-6630-201613021. http://www.spkx.net.cn
GUAN Huanan, HAN Bolin, NAO Amin, et al.Preparation and characterization of glucose oxidase liposomes[J].Food Science,2016, 37(13): 120-124.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613021. http://www.spkx.net.cn
葡萄糖氧化酶(glucose oxidase,GOD)是一种常见的需氧脱氢酶,在分子氧的存在下,利用氧为电子受体,特异性的催化氧化β-D-葡萄糖生成D-葡萄糖酸内酯,同时消耗氧生成过氧化氢[1]。GOD多分布在植物、动物和微生物中,具有专一性强、高效和生物相容性良好的特点[2]。目前,它被广泛地应用于食品脱氧、除菌、面粉改良和防止褐变等诸多领域,是最为重要的食品工业用酶之一[3-7]。然而,游离的GOD在使用中易失活和贮存稳定性差的缺点严重的制约了其在食品工业中的深层次应用[8]。为了解决这一问题,GOD固定化技术的探索与改良成为目前研究的热点。脂质体是由磷脂类双分子层所构成的一种单室或多室囊泡结构,其结构类似生物膜,又称人工生物膜[9-11]。研究表明,脂质体可作为生物活性酶载体,通过囊化作用延长生物酶的寿命,有效地保持其活性[12]。常见的制备方法有薄膜法、冻融法、注入法、超声波法和表面活性剂法等[13-17]。其中,薄膜蒸发法是将磷脂与胆固醇和药物共溶于氯仿(或其他有机溶剂)中,通过减压蒸发在容器内壁形成均匀薄膜[13,18]。这种方法制备的脂质体包裹容积较大,对脂溶性或水溶性药物均可获得较高的包封率,操作简单[19]。如干扰素[20]、紫杉醇[21]、红景天苷[22]等均用此法制得脂质体。冻融法是指快速冷冻过程中,由于冰晶的形成,使形成的脂质体膜破裂,形成冰晶的片层与破碎的膜同时存在,在缓慢融化过程中,暴露出的脂膜互相融合重新形成脂质体,采用此法制备的脂质体具有均一的粒径分布,且膜壁机械强度较高[23-25]。本实验结合两种方法的优势,采用薄膜蒸发-冻融联用法制备大粒径GOD脂质体。通过对包封率的考察,确定脂质体的最佳制备工艺,并对其进行表征,评估脂质体中GOD的稳定性。
1 材料与方法
1.1 试剂与仪器
葡萄糖氧化酶(100 U/mg)、鱼精蛋白、大豆卵磷脂、胆固醇 美国Sigma-Aldrich公司;吐温-20、靛蓝胭脂红(批号:20110607) 天津市科密欧化学试剂有限公司。
R-201旋转蒸发仪 上海申顺生物科技有限公司;TU-1900双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;BT-9300H激光粒度分布仪 美国惠普公司;JDG-0.2冻干机 兰州科近真空冻干技术有限公司。
1.2 方法
1.2.1 GOD脂质体制备工艺的单因素试验
按照不同质量比例(1∶1、2∶1、3∶1、4∶1、5∶1)分别称取大豆卵磷脂和胆固醇(作为壁材),吸取一定质量的葡萄糖氧化酶粉末(0.05、1、3、5、10 mg)及吐温-20共溶于10 mL的二氯甲烷中。30 ℃恒温水浴,调节旋转蒸发仪的转速为100 r/min,待茄形瓶内有机溶剂除净且内壁出现均匀的蜂窝状透明薄膜后,加入5 mL pH 7.4的磷酸盐缓冲液,继续水化一定时间(5、10、15、20、25 min),使薄膜溶胀水和完全,得到悬浮液后取出。微孔滤膜过滤去杂质,将滤液置于液氮中1 min,待冷冻完全后迅速放入37 ℃的水浴锅中,完全融化后再次放入液氮中冷冻,如此反复,经过一定的循环次数(5、10、15、20、25 次),至样品完全融化后,于室温放置10 min,反复离心清洗3 次获得GOD脂质体,4 ℃密封保存,以包封率为指标,选择壁材质量比(大豆卵磷脂与胆固醇的质量比)、芯材质量(GOD的质量)、冻融次数和水化时间作为考察因素,优化GOD脂质体的制备工艺。
1.2.2 GOD脂质体制备工艺的正交试验优化设计
通过上述单因素优化试验结果,分别获得4 个因素中最适的3 个水平,采用L9(34)正交试验表,优化制备工艺,以脂质体包封率作为衡量指标,并利用DPS 7.05软件对正交结果进行分析,最终确定GOD脂质体的最佳制备工艺条件(n=5)。
1.2.3 GOD活力的测定
参照周建芹等[1]方法,采用靛蓝胭脂红褪色分光光度法绘制标准曲线,测定GOD活性。酶活力单位定义为:37 ℃条件下,1 min内催化葡萄糖氧化反应产生1 μg过氧化氢所需的酶量为1 U。
1.2.4 GOD脂质体包封率的测定
采用鱼精蛋白沉淀法去除体系中游离的GOD[19]。准确称取1 mg的GOD脂质体冻干粉末和1 mL的鱼精蛋白液(10 mg/mL),漩涡振荡混合均匀,静置5 min,加去离子水1 mL混匀,1 000 r/min离心5 min,去上清液,除去游离的酶,再加入适量甲醇,漩涡振荡器混匀,溶胀后检测酶活力,此即为脂质体内酶活力。按下式计算GOD脂质体包封率[24]。

1.2.5 GOD脂质体的表征
按最佳工艺制备GOD脂质体,采用透射电子显微镜观察脂质体冻干样品的整体表观形貌,利用激光散射粒度仪测定GOD脂质体的粒径大小及分布范围。
为了评估GOD脂质体所包埋酶的稳定性,根据活性包封率计算结果,选取相同含量和活性的游离酶液为参照样品。将5 mg GOD脂质体粉末悬浮于1 mL去离子水中并与相同含量活性的游离酶一起放置于4 ℃和室温(23.0±0.5) ℃避光环境中,于不同的时间(0、5、10、15、20、25、30、35、40、45、50、55、60 d)测定脂质体中GOD和游离GOD的相对酶活力(即实际酶活力与初始酶活力的比值)[8]。
2 结果与分析
2.1 壁材质量比对GOD脂质体包封率的影响
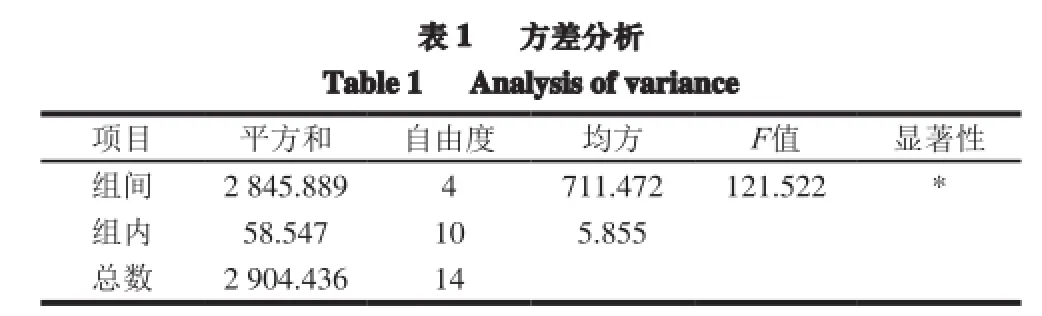
传统的脂质体制备方法获得的脂质体存在包封率低、稳定性差的特点,因此本实验选择改良后的薄膜蒸发法-冻融联用法来制备GOD脂质体,采用鱼精蛋白沉淀法去除游离的GOD,以检测不到游离酶活性为标准,评估GOD脂质体的包封率,并以此为指标进行单因素优化试验。首先,筛选设计不同壁材质量比(m(大豆卵磷脂)∶m(胆固醇)分别为1∶1、2∶1、3∶1、4∶1和5∶1,其中胆固醇为0.01 g)参与优化试验。由图1可知,当壁材质量比为3∶1、4∶1和5∶1时,包封率较大,其中当壁材质量比为4∶1时,包封率达到最大值81.46%。方差分析结果(表1)表明,壁材质量比对脂质体的包封率具有显著影响。部分研究结果证实,胆固醇是一种两性化合物,可以插入脂质双层膜间,亲水性基团趋向水相表面,脂肪链平行排列在脂质双层膜中心的烷基链;但是,当胆固醇含量大于某一范围时,它可以降低药物分子在双层膜间的分配,从而引起包封率的下降,这与本试验的结果基本相似[10]。综上所述,选择壁材质量比为3∶1、4∶1和5∶1这3 个水平参与正交设计试验。
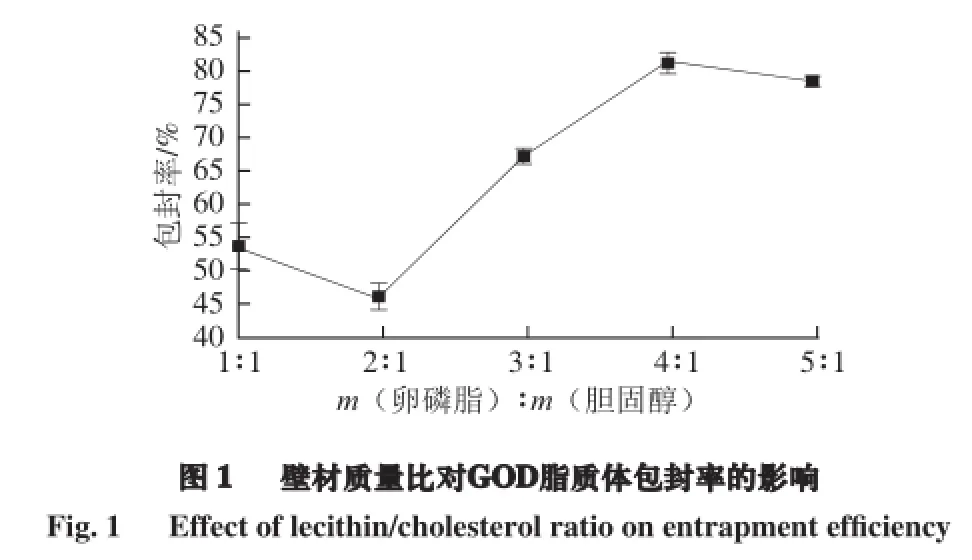
注:*.差异显著(P<0.05)。下同。
2.2 芯材质量对GOD脂质体包封率的影响
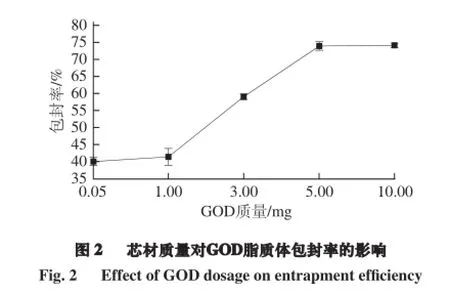
脂质体既可以包埋水溶性的芯材,也可以包埋脂溶性的芯材,但多项研究结果表明,水溶性芯材的包埋效果明显不如脂溶性芯材[25-27]。本实验的芯材为溶于水相的葡萄糖氧化酶,因此选择芯材质量作为优化因素。分别选择0.05、1、3、5、10 mg的葡萄糖氧化酶进行实验。结果如图2所示,当芯材(GOD)质量增加,包封率逐渐提高,当GOD质量达到5 mg时,包封率数值基本稳定,约为74.0%。原因是当GOD质量超过5 mg时,超出了脂质膜的饱和限度,造成了脂质体的溶胀,进而影响了包封率。方差分析(表2)表明,芯材质量对脂质体的包封率具有显著性影响。因此选择芯材质量3(约300 U)、5(约500 U)、10 mg(约1 000 U)3 个水平参与正交试验设计。

表 2 方差分析Table 2 Analysis of variance项目 平方和 自由度 均方 F值 显著性组间 3 318.291 4 829.573 267.547 *组内 31.007 10 3.101总数 3 349.297 14
2.3 水化时间对GOD脂质体包封率的影响
在脂质体的制备过程中,水化的作用是极为重要的,本实验中磷脂与胆固醇在形成薄膜后加入水化液,才可以使贴在内壁的磷脂层有序的卷曲脱离形成脂质体[26]。由图3可知,水化时间越长包封率越大,且该因素具有一定的显著性影响(表3),但是相关研究中提到[10,27],水化时间过长容易造成壁材和芯材的氧化,综合考虑,选择15、20、25 min作为最适的3 个水平。


表 3 方差分析Table 3 Analysisof variance项目 离差平方和 自由度 均方 F值 显著性组间 808.231 4 202.058 125.866 *组内 16.053 10 1.605总数 824.284 14
2.4 冻融次数对GOD脂质体包封率的影响
在循环冻融的过程中,较适宜的冻融次数,可以使脂质体粒径趋于均匀化,使包封率及稳定性有所改良[11]。由表4可知,冻融次数对脂质体的包封率具有显著性影响。由图4可知,随着冻融次数的增加,脂质体的包封率有所提高,达到最大值64.80%;而达到最大包埋程度后,随着次数的增加,包封率有下降的趋势。其原因可能是过多的冻融次数会造成脂质体在冷冻形成冰晶的过程中,部分脂质体发生分子间的碰撞,导致部分脂质体球发生破裂;再有可能发生在重新缓慢融化的脂质体,膜间相互融合的过程中,使得脂质体的尺寸变大,包埋的GOD酶量虽然变多,但是脂质体生物外膜会相对变薄,导致脂质体更容易破裂,使得包封率降低[13]。综合考虑,选择冻融循环10、15、20 次作为3 个最适水平。
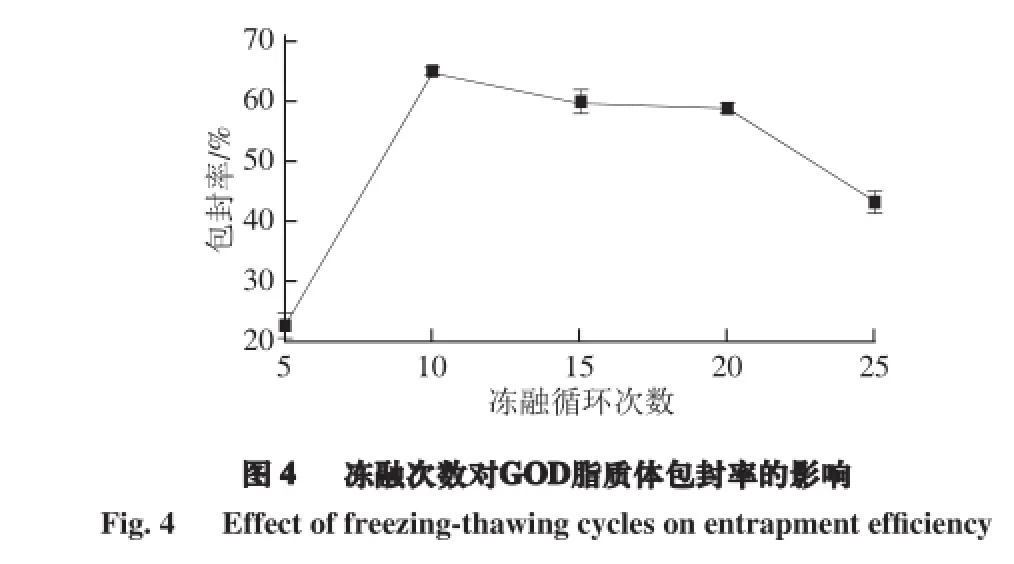

表4 方差分析Table 4 Analysis of variance项目 平方和 自由度 均方 F值 显著性组间 3 551.429 4 887.857 224.774 *组内 39.500 10 3.950总数 3 590.929 14
2.5 GOD脂质体制备工艺的正交试验优化
根据单因素试验结果,以包封率作为考察指标,设定壁材质量比(A)、芯材质量(B)、冻融次数(C)和水化时间(D)四因素三水平进行正交试验,利用正交表L9(34)进行设计优化分析,选择包封率最高的配方作为制备脂质体的最佳工艺。

表 5 正交试验设计方案及结果Table 5 Orthogonal array designL9(34)withexperimentalresults试验号 A壁材质量比 B芯材质量/mg C冻融次数 D水化时间/min 包封率% 1 1(3∶1) 1(3) 1(10) 1(15) 63.4 2 1 2(5) 2(15) 2(20) 60.8 3 1 3(10) 3(20) 3(25) 62.8 4 2(4∶1) 1 2 3 72.4 5 2 2 3 1 79.4 6 2 3 1 2 78.6 7 3(5∶1) 1 3 2 56.8 8 3 2 1 3 81.4 9 3 3 2 1 86.3 K1187.0 192.6 223.4 229.1 K2234.4 221.6 219.5 196.2 K3224.5 227.7 199.0 216.6 k162.333 64.200 74.467 76.367 k276.800 73.867 73.167 65.400 k374.833 75.900 66.333 72.200极差R 14.467 11.700 8.134 10.967因素主次 A>B>D>C最优组合 A2B3C1D1
由表5可知,4 个因素影响包封率的次序分别为:A>B>D>C,即壁材质量比>芯材质量>水化时间>冻融次数。利用正交设计优化获得的最佳制备处方工艺优化为:A2B3C1D1,即大豆卵磷脂与胆固醇质量比4∶1、葡萄糖氧化酶质量10 mg、冻融次数10 次、水化时间15 min。根据最佳制备工艺条件再进行酶脂质体的制备,并重复5 次,测定最佳工艺下的平均包封率为(87.7±2.1)%,相对标准偏差为1.24%。与此前的方法相比,采用此法所制备的脂质体较大程度提高了包封率[15-17,23]。即1 mg的冻干葡萄糖氧化酶脂质体中平均包埋0.326 mg的葡萄糖氧化酶。
2.6 GOD脂质体的表征
利用优化后的工艺体系制备GOD脂质体,平均包封率为(87.7±2.1)%,采用光学显微镜和激光粒度分布仪对GOD脂质体粉末的表观形貌和粒径分布进行表征。由图5A可知,GOD脂质体的基本呈现规则的圆球形,没有明显的聚集现象,且表面没有缺陷。由图5B可知,GOD脂质体的粒径分布较为均匀,主要集中(约50%的脂质体微粒)在100~250 μm的范围内,有效平均粒径约为(164.75±2.55) μm,多分散系数(polydispersity,PDI)为0.258,数值较小,分散性较好,体系较为均匀。

脂质体作为新型药物载体,具有类似于生物膜的磷脂双分子层,可将脂溶性或水溶性药物包覆于脂膜内部,隔绝外界不良环境对药物的影响,进而提高所包覆药物的稳定性。本实验中,考察脂质体内GOD与游离的GOD在相同时间间隔内的酶活性变化,可以有效评估脂质体中GOD的稳定性。由图6可知,在4 ℃和室温避光贮藏条件下,脂质体中的GOD与游离GOD的相对酶活力都随时间的延长而下降。由图6A可知,在相同的时间间隔内脂质体中的GOD相对酶活力比游离的GOD的高。相对酶活力的检测初始值皆为96%,游离的GOD相对酶活力呈下降的趋势,说明酶活性开始逐渐丧失,到达35 d时相对酶活力基本达到平衡,维持在30%。脂质体中GOD在60 d的间隔时间内依然维持较高的相对酶活力,达到了93%。由图6B可知,在室温条件下,游离的GOD在贮存40 d后,相对酶活力就已下降至25%;与此同时,脂质体中的GOD相对酶活力仍然维持在83%。结果表明,GOD脂质体分别在4 ℃和室温条件下贮存60 d和40 d后,包封率基本不变,说明脂质体没有破裂溶出。所包覆的GOD在脂膜的保护下,能够有效隔绝外界环境对酶活性的影响,进而提高了酶的贮存稳定性。

3 结 论
目前,葡萄糖氧化酶被广泛应用食品工业中,但是其提纯过程繁琐,加工成本偏高,且游离态的GOD稳定性差,因此探索适合的固定化技术对葡萄糖氧化酶的应用具有重要意义。本实验采用薄膜蒸发-冻融联用法成功制备出了GOD脂质体,并考察了脂质体的理化性质和稳定性。结果表明,GOD脂质体的最佳制备工艺为壁材质量比4∶1、芯材质量5 mg(500 U)、水化时间15 min、冻融循环10 次。利用此工艺所制备的脂质体的平均包封率可达到(87.7±2.1)%;在不同温度条件下,脂质体中的GOD的酶活力稳定性得到提高。
参考文献:
[1] 周建芹, 陈韶华, 王剑文.定向固定化葡萄糖氧化酶及其酶学性质的研究[J].食品科学, 2009, 30(1): 186-189.
[2] 刘超, 袁建国, 王元秀, 等.葡萄糖氧化酶的研究进展[J].食品与药品, 2010, 12(7): 285-289.
[3] GULDEN Y, SEZGINTURK M K.A new methodology for the determination of enzyme activity based on carbon nanotubes and glucose oxidase[J].Journal of Pharmaceutical and Biomedical Analysis, 2015, 115(10): 254-259.DOI:10.1016/j.jpba.2015.07.037.
[4] PALOD P A, SINGH V.Improvement in glucose biosensing response of electrochemically grown polypyrrole nanotubes by incorporating crosslinked glucose oxidase[J].Materials Science and Engineering: C,2015, 55: 420-430.DOI:10.1016/j.msec.2015.05.038.
[5] 李艳, 李静.葡萄糖氧化酶及其应用[J].食品工程, 2006, 9(3): 9-11.
[6] SUSANTO H, SAMSUDIN A M, ROKHATI N, et al.Immobilization of glucose oxidase on chitosan-based porous composite membranes and their potential use in biosensors[J].Enzyme and Microbial Technology, 2013, 52(6/7): 386-392.DOI:10.1016/ j.enzmictec.2013.02.005.
[7] 钱军民, 李旭祥.纤维素固定化葡萄糖氧化酶的研究[J].西安交通大学学报, 2001, 35(4): 416-420.
[8] ZHU Yanan, JIANG Yanjun, GAO Jing, et al.Immobilization of glucose oxidase in liposome-templated biomimetic silica particles[J].Chinese Journal of Catalysis, 2013, 34(1): 741-750.DOI:10.1016/ S1872-2067(11)60159-6.
[9] 熊伟, 李雄辉, 胡居吾, 等.薄膜-超声法制备二氢杨梅素脂质体的工艺研究[J].食品工业科技, 2012, 33(5): 254-257.DOI:10.13386/ j.issn1002-0306.2012.05.026.
[10] MAKOTO Y, NORRIYUKI T, MIKU Y.Catalase-conjugated liposomes encapsulating glucose oxidase for controlled oxidation of glucose with decomposition of hydrogen peroxide produced[J].Colloids and Surfaces B: Biointerfaces, 2010, 79(2): 403-408.DOI:10.1016/j.colsurfb.2010.05.006.
[11] 马宁, 濮少杰, 李峰, 等.茶多酚脂质体的制备[J].食品科学, 2012,33(20): 16-20.
[12] 徐云龙, 徐盛, 杨欣欣.溶菌酶脂质体的制备工艺[J].华东理工大学学报(自然科学版), 2006, 32(8): 939-942.DOI:10.14135/ j.cnki.1006-3080.2006.08.010.
[13] 宋佳佳, 刘宁.薄膜蒸发-冷冻干燥法制备乳糖酶脂质体[J].食品工业, 2011(9): 29-32.
[14] 王健, 李明轩.冷冻干燥对提高脂质体稳定性的研究概况[J].中国医药工业杂志, 2005, 36(9): 576-580.
[15] 吴亚妮, 徐云龙, 孙文晓.木瓜蛋白酶纳米脂质体的制备及其粒度控制[J].上海交通大学学报(农业科学版), 2007, 25(2): 1052-1091.
[16] 任文霞, 李建科.茶多酚脂质体的制备[J].食品工业科技, 2008,29(11): 186-189.DOI:10.13386/j.issn1002-0306.2008.11003.
[17] 胥传来, 乐国伟, 吴振国.维生素C新剂型脂质体制备办法比较[J].中国饲料, 2002(10): 26-28.DOI:10.3969/ j.issn.1004-3314.2002.10.013.
[18] 熊伟, 李雄辉, 胡居吾, 等.薄膜-超声法制备二氢杨梅素脂质体的工艺研究[J].食品工业科技, 2012, 33(5): 254-257.DOI:10.13386/ j.issn1002-0306.2012.05.026.
[19] 孙维彤, 黄桂华, 叶杰胜, 等.鱼精蛋白凝聚法测定脂质体和纳米脂质体包封率[J].中国药学杂志, 2006, 41(22): 1717-1721.
[20] 曾德贵, 曾洪辉.干扰素脂质体的制备与质量控制[J].制剂技术,2010, 19(19): 37-38.
[21] 张一鸣, 刘靖新, 周颖琳, 等.固相萃取-高效液相色谱法测定紫杉醇脂质体的包封率[J].分析科学学报, 2014, 30(5): 705-708.DOI:10.13526/j.issn.1006-6144.2014.05.021.
[22] 王妍, 张水华, 李云富, 等.膜材性质及制备方法调控下的脂质体负载干扰素的研究[J].食品科学, 2008, 29(2): 59-63.
[23] 张奇, 邓英杰.冻融法制备5-氟尿嘧啶脂质体及其稳定性考察[J].沈阳药科大学学报, 2000, 17(2): 87-89.DOI:10.14066/j.cnki.cn21-1349/r.2000.02.003.
[24] 李红茹, 李淑芬.脂质体中药物包封率的测定方法[J].药物分析杂志, 2007, 27(11): 1844-1848.DOI:10.16155/j.0254-1793.2007.11.046.
[25] 叶兆伟, 承伟.脂质体包封率测定方法及影响因素[J].中国生物制品学杂志, 2007, 20(10): 789-792.DOI:10.3969/ j.issn.1004-5503.2007.10.022.
[26] 郑会娟, 刘成梅, 刘伟, 等.中链脂肪酸脂质体的制备及其性质测定[J].食品科学, 2010, 31(22): 170-175.
[27] YANG Shuibing, LIU Chengmei, LIU Wei, et al.Preparation and characterization of nanoliposomes entrapping medium-chain fatty acids and vitamin C by lyophilization[J].International Journal of Molecular Sciences, 2013, 14(10): 19763-19773.DOI:10.3390/ ijms141019763.
DOI:10.7506/spkx1002-6630-201613021
中图分类号:Q84
文献标志码:A
文章编号:1002-6630(2016)13-0120-05
收稿日期:2015-09-15
基金项目:国家自然科学基金青年科学基金项目(31201376);中国博士后科学基金资助项目(2014T70304;2013M531009);黑龙江省博士后基金资助项目(LBH-Z13002);黑龙江省科学基金项目(C2016034)
作者简介:关桦楠(1983—),男,副教授,博士,研究方向为食品质量与安全。E-mail:guanhuanan3@163.com
Preparation and Characterization of Glucose Oxidase Liposomes
GUAN Huanan1,2, HAN Bolin1, NAO Amin1, WANG Xin1, XU Liping1, SUN Lu2
(1.College of Food Engineering, Harbin University of Commerce, Harbin 150076, China;2.Alkali Soil Natural Environmental Science Center, Northeast Forestry University, Harbin 150040, China)
Abstract:Egg phosphatidylcholine and cholesterol were used as coating materials to prepare glucose oxidase (GOD)liposomes by a thin film evaporation-freezing thawing method.Single factor experiments and orthogonal array design methods were used to optimize the preparation conditions based on encapsulation efficiency.The shape, stability and particle size distribution of liposome-encapsulated glucose oxidase were systematically investigated.The optimal process parameters were obtained as follows: mass ratio between egg phosphatidylcholine and cholesterol of 4:1, 5 mg (500 U) of GOD, hydration time of 15 min, and 10 freezing-thawing cycles.The encapsulation efficiency of GOD liposomes was up to (87.7 ± 2.1)%, with an average diameter of approximately (164.75 ± 2.55) μm under the optimized conditions.The encapsulation efficiency did not significant change at 4 ℃ and room temperature (23.0 ± 0.5) ℃, and the activity of GOD remained stable.
Key words:glucose oxidase; liposome; stability; film evaporation-freezing thawing method; characterization
