卡托普利干预自发性高血压大鼠血清代谢组学研究
2016-08-10杨雯晴蒋海强李运伦臧沿平褚岩珺
杨雯晴,蒋海强,李运伦,臧沿平,褚岩珺
(山东中医药大学 1.第一临床医学院,2.实验中心,山东 济南 250355;3. 山东中医药大学附属医院高血压国家中药临床研究基地,山东 济南 250011)
卡托普利干预自发性高血压大鼠血清代谢组学研究
杨雯晴1,蒋海强2,李运伦3,臧沿平1,褚岩珺1
(山东中医药大学 1.第一临床医学院,2.实验中心,山东 济南250355;3. 山东中医药大学附属医院高血压国家中药临床研究基地,山东 济南250011)
目的通过代谢组学方法研究卡托普利干预自发性高血压大鼠血清内源性代谢物的变化,进一步探索卡托普利的作用机制。方法采用快速高分离液相-四级杆飞行时间串联质谱联用技术采集大鼠血清内源性代谢物信息,经偏最小二乘法判别分析,识别显著差异的变量,鉴定潜在生物标志物。结果正常组、模型组、卡托普利组的血清内源性代谢物、代谢模式发生了明显变化。经数据库查询共确定了4个生物标记物及其代谢途径,与血管内皮功能密切相关。结论代谢组学从机体整体代谢角度揭示了卡托普利保护血管内皮功能的可能作用机制,在阐释药物复杂的作用机制方面显示出了独特的潜力。
卡托普利;代谢组学;血管内皮功能;自发性高血压大鼠;快速高分离液相-四级杆飞行时间串联质谱联用技术;生物标志物
卡托普利(captopril)是临床常用的血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors,ACEI),对高血压患者具有良好的靶器官保护和心血管终点事件预防作用[1]。在近几年的临床研究中发现[2],卡托普利可以减轻患者血流动力或代谢异常,延缓左室肥厚,以及改善血管内皮功能,但其具体的作用途径目前尚需要进一步探索。
代谢组学是继基因组学、转录组学、蛋白组学后系统生物学的一个重要分支,应用分离和检测技术获取能够表征代谢物的小分子集合[3],以研究关于生物体被扰动后其内源性代谢产物种类、数量及变化规律[4]。近年来,它在疾病标志物的发现、疾病诊断、药物药效和毒性评价等方面得到广泛研究和应用。生物体在疾病状态下代谢网络发生缺陷,药物干预使缺陷部分正常化,利用代谢组学方法可以从微观角度检测生理、病理、药物干预前后内源性代谢产物的变化特征,从小分子水平阐释药物作用靶点及作用机制。本实验借助快速高分离液相-四级杆飞行时间串联质谱联用(rapid resolution liquid chromatography/quadrupole-time of flight tandem mass spectrometry, RRLC-Q-TOF-MS)作为研究手段,分析卡托普利干预自发性高血压大鼠(SHR)前后血清内源性代谢产物的变化特征,以进一步探索卡托普利的作用机制。
1 材料
1.1动物8周龄♂ SHR(SPF级)12只,购自北京维通利华实验动物技术有限公司,合格证书:SCXK(京)2006-0009。8周龄♂ Wistar大鼠(SPF级)6只,购自山东中医药大学实验动物中心,合格证书:SCXK(鲁)20051015。
1.2实验药物卡托普利片(广州白云山制药厂产品,批号H44021739)粉碎、研细,加入生理盐水适量制成浓度2.08 g·L-1的混悬液,置4℃冰箱保存备用。
1.3仪器和软件ALC-NIBP型清醒大鼠血压心率测定仪(上海奥尔科特生物科技有限公司);ALC-HTP动物恒温系统(上海奥尔科特生物科技有限公司);ALC-NIBP无创血压测量分析系统(上海奥尔科特生物科技有限公司);快速高分离液相-四级杆飞行时间串联质谱联用仪(Agilent 6520 RRLC-Q-TOF,Agilent Cor.美国),色谱柱为Zorbax SB-C18(2.1 mm×150 mm,3.5 μm), Masshunter工作站、Agilent Quanlitative Analysis质谱分析软件和Mass Profiler Professional数据处理软件(Agilent Cor.美国);SIMCA-P(version 11.5,Umetrics AB,Umea,Sweden)。乙腈、甲醇(色谱纯,Merck公司);甲酸(色谱纯,美国Tedia公司);水(Milli-Q超纯水)。其他试剂均为分析纯。
2 实验方法
2.1动物分组及给药方法8周龄♂ SHR12只,随机分成模型组与卡托普利组,每组6只,并设Wistar大鼠6只作为正常组。卡托普利组给予卡托普利25 mg·kg-1,模型组和正常组给予等量的生理盐水。每天1次,持续用药28 d,每周测定动物体重调整给药剂量。
2.2血压检定分别于给药后第1周末、第2周末、第3周末、第4周末,采用无创性尾动脉脉搏间接测压法测量各组大鼠清醒状态下尾动脉收缩压,连续测量3次,取平均值作为应测血压值。
2.3样品采集与制备末次用药24 h后,麻醉大鼠,下腔静脉取血,2 500 r·min-1离心15 min,取上清液,得血清,存于-80℃冰箱。用时室温解冻,精密移取血清500 μL,加入1 000 μL甲醇,涡旋2 min,冰箱4℃冷藏4 h,置离心机13 000 r·min-1离心15 min,倾出上清液,微孔滤膜滤过后置于液相进样瓶中,-20℃下保存,4℃进样。
2.4分析条件色谱条件:柱温25℃,流速0.3 mL·min-1,进样量为10 μL。流动相为0.1%甲酸-水(A)-乙腈(B),梯度洗脱(V/V),0~20 min,5%~80% B;20~30 min,80%~90% B;30~40 min,90%~95% B。质谱条件:采用标准电喷雾离子源(ESI),正离子模式,检测参数设置为毛细管电压4 kV,雾化气压为35 psi,干燥气流速9 mL·min-1,干燥气温度350℃,碎片电压175 V,参比离子质荷比(m/z)121.050873和922.009798,质量数扫描范围m/z 100~1 000。
2.5数据处理运用Agilent Quanlitative Analysis软件查找未知化合物,归类,给出化合物的“Feature 分子特征”。运用MPP进行保留时间校准、峰对齐、基线校准、数据的归一化和对数转换。初始过滤器可以通过丰度、保留时间范围或质量范围进行滤噪,根据80%规则,进一步去除在某一组中出现频率(非零值)低于80%的化合物。通过MPP的统计分析功能,对于3组数据选用ANOVA分析,并采用Turkey post hoc检验进行多重比较(P<0.05)。P值<0.05的差异变量,再通过趋势分析-倍数变化过滤器,把模型组设为对照条件,即正常组与模型组或卡托普利组与模型组对比,保留能有一组满足倍数变化(FC=2)的变量。将经过MPP处理找到的变量,导入SIMCA-P,进行有监督的偏最小二乘法-判别分析(partial least-square discriminant analysis,PLS-DA),选择变量投影重要性(variable importance for the projection,VIP)>1的变量为潜在生物标志物[5]。根据化合物的精确分子量查询METLIN(http://www.metlin.scipps.edu)、HMDB(http://www.hmdb.ca)、KEGG(http://www.kegg.com)3个在线数据库,参照有关文献,分析化合物质谱,鉴定化合物结构,并进一步发现代谢物相关代谢通路。
3 结果
3.1各组大鼠收缩变化给药前,模型组大鼠血压明显高于正常组(P<0.05),与卡托普利组差异无统计学意义(P>0.05)。给予卡托普利1周后与给药前相比即出现血压的下降(P<0.05),随着干预时间的延长,降压效果逐渐增强,较模型组差异具有统计学意义(P<0.05)。而整个实验过程中,正常组与模型组大鼠血压水平稳定,与干预前无明显波动(P>0.05)。结果见Tab 1。
3.2血清样品的LC-MS分析应用LC-MS进行分离检测,使用正离子模式,测定大鼠血清中的小分子代谢产物。Fig 1为正离子模式下典型的血清总离子流图,可以发现正常组、模型组与卡托普利组存在一定的差别。
3.3偏最小二乘法判别分析(PLS-DA)采用有监督的多维统计分析方法对3组样本之间的差异进行分析。由Fig 2可知,模型组在空间上与正常组无交叉和重叠,区分良好,提示正常大鼠与SHR代谢模式存在明显差异;卡托普利组在空间上与模型组相互分离,提示经卡托普利干预后SHR血清代谢模式发生改变。所建模型变量的拟合能力指数(R2Y)为 0.899,模型的预测指数Q2为0.632,提示模型的拟合能力和预测能力良好。
3.4生物标记物的鉴定及相应代谢途径分析根据多元统计中变量的载荷大小是代谢组学中寻找生物标记物的常用方法。在PLS-DA模型中,VIP值越大对分组的贡献也越大,选择VIP>1,且具有统计学意义的变量作为潜在生物标志物的鉴别依据[5],如Fig 3。再结合质谱同位素匹配结果和代谢物数据库检索,对潜在的生物标志物进行鉴定,结果如表2所示。为进一步比较卡托普利对筛选出的潜在靶标代谢物的干预作用,比较了这4个代谢物的峰强度,见Fig 4所示。通过对大鼠血清样品进行分析,发现与正常组相比,模型组大鼠血清中鞘氨醇以及溶血磷脂酰胆碱的含量升高,同时油酸酰胺的含量下降,其代谢紊乱主要与鞘脂类代谢、脂肪酸代谢以及甘油磷脂代谢相关。经卡托普利干预后不同程度地纠正了代谢的异常,说明卡托普利对SHR有调节作用。
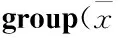
Tab 1 Change of systolic blood pressure in each ±s,mmHg)
*P<0.05vsmodel group;#P<0.05vsprevious administration; 1 mmHg=0.133 kPa
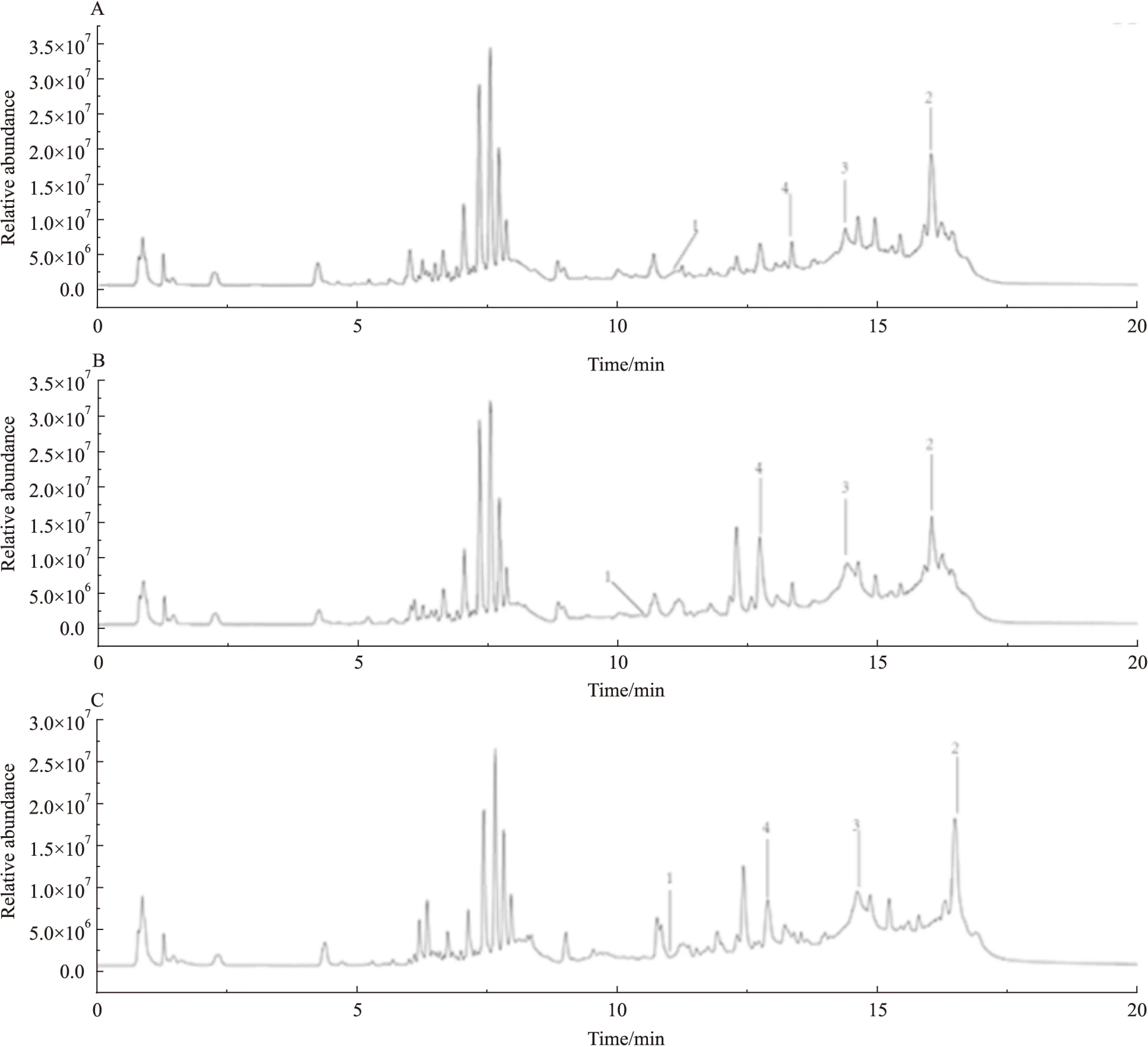
Fig 1 Representative total ion current chromatograms of rat serum
A:Normal group;B:Model group;C:Captopril group(1. Sphinganine,2. Oleamide,3. LysoPC(18 ∶0),4.LysoPC(16 ∶0))
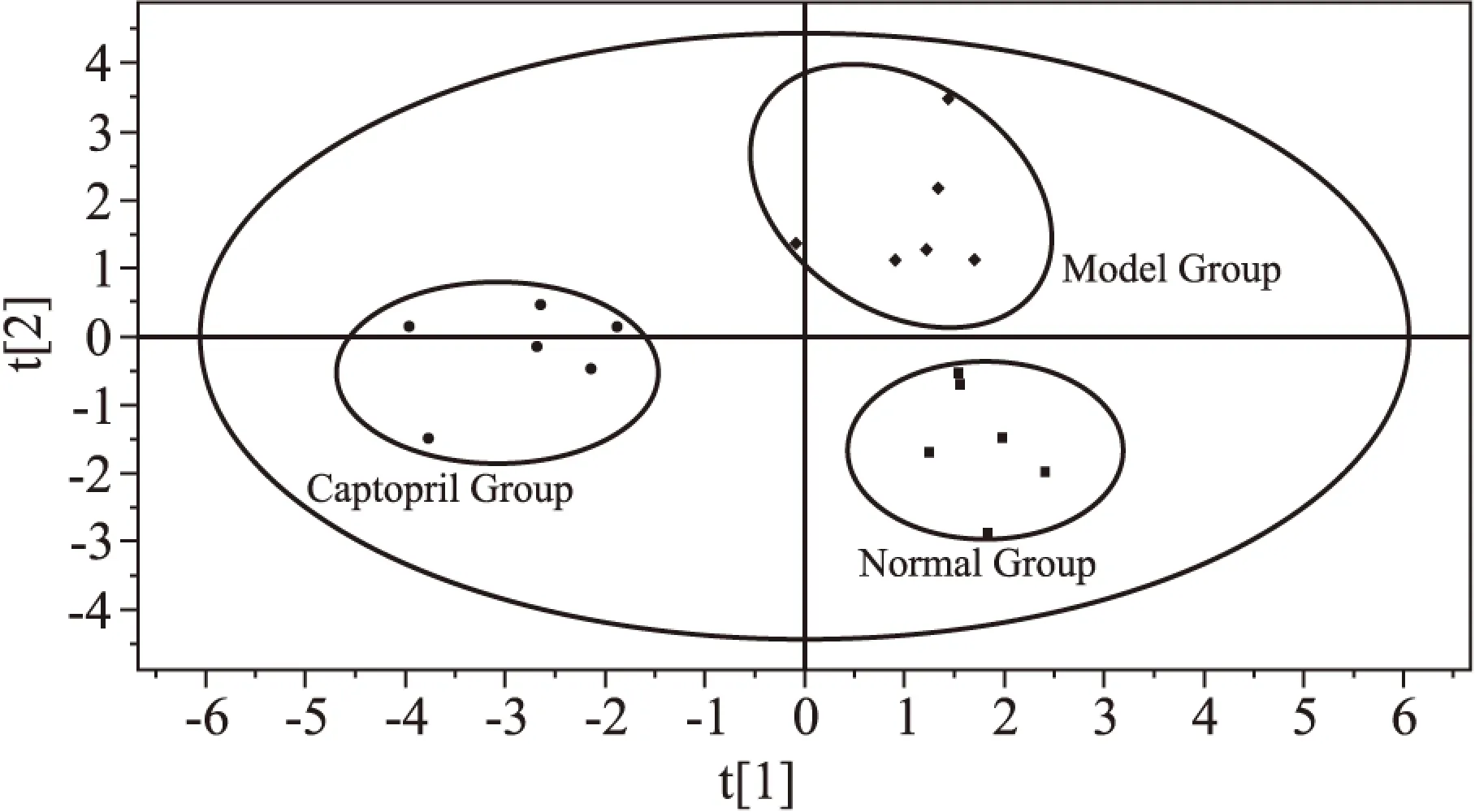
Fig 2 Score scattering plots of PLS-DA of metabonome of rat serum in three groups
4 讨论
血管内皮细胞是血管内平衡的主要调节器,参与血管张力和结构调整。在高血压病理状态下,体内血管紧张素Ⅱ(AngⅡ)的浓度升高,激活AT1受体,使细胞内钙离子浓度增加;或激活细胞膜表面的NADH/NADPH氧化酶,引起氧化应激反应[6],均可导致血管内皮细胞的受损。因此,保护血管内皮功能是抗高血压的一个重要目标。卡托普利作为第1个投入临床使用的ACEI类药物,不仅可以有效控制血压,同时对大动脉乙酰胆碱依赖性舒张功能有一定的修复作用[7],可以改善血管内皮功能,其机制与抑制血管紧张素转换酶(angiotensin converting enzyme, ACE),减少AngⅡ的生成有关[8]。

Tab 2 Potential biomarkers in rat serum and metabolic pathway
atrends of model group compared with normal group and Captopril group of metabolites (↑): up-regulated, (↓): down-regulated

Fig 3 VIP score chart of PLS-DA
本课题组在卡托普利有效降低SHR收缩压的基础上,借助代谢组学的技术手段,对卡托普利干预后SHR 产生的内源性应答改变进行了分析,发现鞘氨醇、溶血磷脂酰胆碱、油酸酰胺在表达上存在差异,进一步研究发现其对血管内皮功能有着重要作用。
鞘氨醇(sphingosine,Sp)是鞘磷脂的主要代谢物之一。细胞内鞘脂代谢平衡是细胞稳态的重要方面,在细胞增殖、分化和凋亡的调节中发挥重要作用。目前研究证明,Sp是细胞增殖的负调控因子,能够抑制细胞生长、促进细胞凋亡[9]。Sp诱导细胞凋亡涉及多种信号传导途径,丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)通路是其中之一,有研究表明,Sp诱导细胞的凋亡依赖于p38MAPK的活化[10]。高血压状态下,AngⅡ作用于AT1R后,可激活磷脂酶C(PLC),催化4,5-二磷酸磷脂酰肌醇生成三磷酸肌醇(IP3)和二酰基甘油(DAG)。IP3促进细胞内释放Ca2+,致使细胞内钙升高,DAG激活磷酸激酶C(PKC),进而活化MAPKs路径,引起一系列细胞增殖分裂效应[11]。本实验中,经卡托普利干预后,大鼠血清中Sp的含量降低,说明卡托普利通过抑制ACE,减少AngII的生产,进而影响了MAPKs路径的活化,部分地抑制了Sp诱导的凋亡。
油酸酰胺(oleamide),又称顺-9,10-十八碳烯酞胺(cis-9,10-octadecenoamide),最初从被剥夺睡眠的猫的脑脊液中分离鉴定,是近几年发现的内源性睡眠诱导物质,具有多种药理学作用。有学者发现,油酸酰胺可以抑制由低钾诱发的细胞凋亡,其作用机制与抑制蛋白酶caspase-3有关[12]。目前研究已证明[13],大麻素样作用的油酸酰胺对SHR主动脉具有舒张作用,与其能增强SHR感觉神经的活性有关。多种证据表明水解油酸酰胺和花生四烯酸(arachidonic acid,AA)的酶同为脂肪酸酰胺水解酶(FAAH),两者相互竞争性地抑制对方的水解[14]。在高血压病理状态下,AngⅡ激动AT1R后经Gq通路的作用,卵磷脂裂解产生AA。本实验结果显示,卡托普利组大鼠血清中油酸酰胺的含量较模型组增多,这可能与卡托普利干预后,AngII生成受到抑制,导致Gq通路激活受到影响,AA生成减少有关。但由于油酸酰胺生理作用的分子机制大部分还不清楚,其舒张血管的机制仍需要深入研究。
Ang Ⅱ通过激活AT1R活化NADPH氧化酶,产生氧化应激反应,并诱导活性氧(ROS)的产生[15],而ROS在氧化修饰低密度脂蛋白(LDL)生成溶血磷脂酰胆碱(lysophosphatidylcholine, LPC)中具有重要作用[16-17]。LPC是氧化型低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)的主要活性成分,具有细胞毒性,使内皮细胞变性、坏死、脱落,其含量高的时候会发生溶血反应,破坏纤溶和凝血系统的平衡[18]。LPC能激活PKC,通过Ca2+依赖或Ca2+非依赖途径,导致血管平滑肌收缩,并抑制NO的释放,导致内皮依赖性收缩,影响其依赖性舒张[19]。付云峰等[20]发现卡托普利对LPC所引起的血管内皮依赖性舒张反应的损害有明显的保护作用,并推断其可能与卡托普利能够减少NO的灭活,以及降低内源性一氧化氮合酶(NOS)抑制剂的蓄积,增加内皮细胞NO的合成有关。本实验中模型组大鼠血清LPC含量升高,经卡托普利干预后明显下调,提示卡托普利在一定程度上参与了LPC的调节。但卡托普利是通过抑制AngⅡ的生成后,调控NADPH氧化酶的活化,减少ROS的产生,进而使LPC生成减少,还是直接抑制了LPC的生成,其中间的具体作用环节还需要进一步的实验进行证明。
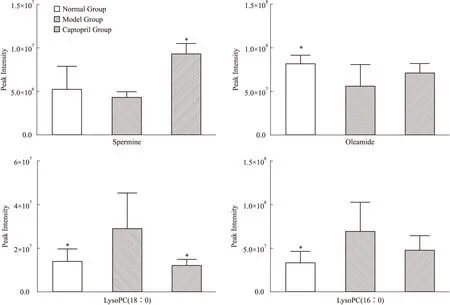
Fig 4 Comparison of different potential biomarkers in rat serum of normal group, model group and Captopril group after intervention
综上所述,本课题组从代谢的角度,从小分子水平阐释了卡托普利干预SHR后,通过抑制AngⅡ的生成,使AT1R激活减少,进而调节鞘氨醇、溶血卵磷脂、油酸酰胺等代谢产物的表达,达到保护血管内皮功能的目的。从整体改变与微观转化的角度,为探索卡托普利保护血管内皮功能的作用机制提供了新的靶点和思路。本课题组将进一步通过实验验证鉴定潜在生物标志物,以明确卡托普利保护血管内皮功能的信号传导机制。
[1]Danchin N, Cucherat M, Thuillez C,et al. Angiotensin-converting enzyme inhibitors in patients with coronary artery disease and absence of heart failure or left ventricular systolic dysfunction:an overview of long-term randomized controlled trials[J].ArchInternMed,2006,166(7): 787-96.
[2]Simko F, Pechanova O, Krajcirovicova K,et al. Effects of captopril, spironolactone, and simvastatin on the cardiovascular system of non-diseased Wistar rats[J].IntJCardiol, 2015, 190:128-30.
[3]Kouskoumvekaki I, Panagiotou G. Navigating the human metabolome for biomarker identification and design of pharmaceutical molecules[J].JBiomedBiotechnol, 2011,ppi:525497.
[4]贾伟,蒋健,刘平,等.代谢组学在中医药复杂理论体系研究中的应用[J].中国中医药杂志,2006,31(8):621-4.
[4]Jia W, Jiang J, Liu P, et al. Application of metabonomics in conplicated theory system research of traditional Chinese medicine[J].ChinaJChinMatMed,2006,31(8):621-4.
[5]Chong I G,Jun C H. Performance of some variable selection methods when multicollinearity is present[J].ChemometrIntellLabSystems, 2005,78(S1-2):103-12.
[6]Pueyo M E,Gonzalez W, Nicoletti A,et al. Angiotensin Ⅱ stimulates endothelial vascular cell adhesion molecule-1 via nuclear factor-kappa B activation induced by intracellular oxidative stress[J].ArteriosclerThrombVascBiol, 2000, 20(3): 645-51.
[7]王现珍,蒋嘉烨,陆家凤,等. SHR高血压进程中不同类型血管内皮功能损伤及药物修复研究[J].中国药理学通报,2010,26(2):163-8.
[7]Wang S Z, Jiang J H, Lu J F, et al. Study in the damage of endothelial function and administration recovery among different arteries during the developing progress of SHR[J].ChinPharmacolBull, 2010,26(2):163-8.
[8]刘和亮,赵金垣.血管紧张素转换酶抑制剂对化学性急性呼吸窘迫综和征治疗作用的实验研究[J].中华预防医学杂志,2002,36(2):93-6.
[8]Liu H L, Zhao J H. An experiment study of therapeutic effect of ACEI on chemical induce ARDS in rats[J].ChinJPrevMed,2002,36(2):93-6.
[9]Cuvillier O. Sphingosine in apoptosis signaling[J].BiochimBiophysActa, 2002, 1585(2-3):153-62.
[10]Frasch S C,Nick J A,Fadok V A,et al. p38 mitogen-activated protein kinase-dependent and-independent intracellular signal transduction pathways leading to apoptosis in human neutrophils[J].JBiolChem, 1998, 273(14): 8389-97.
[11]Peng S, Qi Y, Christensen N,et al. Capture ElISA and in vitro cell binding assay for the detection of antibodies to human papillomavirus type 6b virus-like particles in patients with anogenital warts[J].Pathology,1999,31(4): 418-22.
[12]杨静玉,吴春福,阿部和穗,松林则夫. 油酸酰胺对低钾诱导的培养大鼠小脑颗粒细胞凋亡的抑制作用[J].中国药理学会通讯,2000,17(2):33.
[12]Yang J Y, Wu C F, A B H S, Song L Z F. Inhibition effect of oleamide against apoptosis induced by low potassium in cultured rat cerebellar granule neurous[J].ChinPharmacolSocietyNewsletter, 2000,17(2):33.
[13]Hopps J J, Dunn W R, Randall M D. Enhanced vasorelaxant effects of the endocannabinoid-like mediator, oleamide, in hypertension[J].EurJPharmacol,2012,684(1-3):102-7.
[14]Mechoulam R, Fride E, Hanus L, et al. Anandamide may mediate sleep induction[J].Nature, 1997, 389(6646): 25-6.
[15]Abel Martin Garrido, Kathy K.Griendling. NADPH oxidases and angiotensin Ⅱ receptor signaling[J].MolCellEndocrinol, 2009, 302(2): 148-58.
[16]Wierzbicki A S,Chowienczyk P J, Cockcroft J R,et al. Cardiovascular risk factors and endothelial dysfunction[J].ClinSci, 2004,107(6): 609-15.
[17]戴文卓,石静萍,林兴建. 厄贝沙坦对溶血磷脂酰胆碱所致人静脉内皮细胞损害的影响[J]. 中国卒中杂志, 2008, 3(10): 721-5.
[17]Dai W Z, Shi J P, Lin X J. The study of protection of irb on human umbilical vein endothelial cells impaired by lysophosphatidylcholine[J].ChinJStroke,2008,3(10): 721-5.
[18]宋丹军,潘家琪,李鹏旭,等.溶血磷脂酰胆碱在肝脏疾病中的研究进展[J]. 中国药理学通报,2014,30(12):1642-6.
[18]Song D J,Pan J Q,Li P X,et al.Research progress of lysophosphatidylcholines for liver diseases[J].ChinPharmacolBull,2014,30(12):1642-6.
[19]Ota Y, Kugiyama K, Sugiyama S, et al. Complexes of apoA-1 with phosphatidycholine suppress dysregulation of arterial tone by oxidized LDL[J].AmJPhysiol, 1997,273(3): 1215-22.
[20]付云峰,熊燕,邓华菲,付四海. 卡托普利抗同型半胱氨酸和溶血性磷脂酰胆碱损伤大血管内皮功能[J]. 中国药理学与毒理学杂志, 2003, 17(3): 179-83.
[20]Fu Y F, Xiong Y, Deng H F, Fu S H. Protection of captopril against homocysteine and lysophosphatidylcholine induced endothelium damage in isolated rat aorta[J].ChinJPharmacolToxicol, 2003, 17(3):179-83.
Intervention effect of Captopril on serum of spontaneous hypertension rats based on metabonomic research
YANG Wen-qing1, JIANG Hai-qiang2, LI Yun-lun3, ZANG Yan-ping1,CHU Yan-jun1
(1.TheFirstClinicalCollege,2.ExperimentalCenter,ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China;3.TraditionalChineseMedicineClinicalResearchBaseforHypertensionofAffiliatedHospitalofShandongUniversityof
TraditionalChineseMedicine,Jinan250011,China)
AimsTo analyze the intervention effect of Captopril on serum endogenous metabolites alternations in spontaneous hypertension rats(SHR) and to investigate possible therapeutic mechanism.MethodsThe rapid resolution liquid chromatography/quadrupole-time of flight tandem mass spectrometry(RRLC-Q-TOF-MS) and technology coupled with partial least squares discriminant analysis(PLS-DA) processed by SIMCA-P software were used to distinguish significantly different variables and identify potential biomarkers.ResultsCompared to the normal group, metabolic profiling changed significantly in model group and Captoril group. Totally 4 metabolins and their metabolic pathways were detected, which were closely related to the endothelial function.ConclusionMetabolomics reveals possible therapeutic mechanism of Captopril for protecting endothelial function from overall metabolism of the body. It also shows unique potential in terms of interpretation of the complex mechanisms of drugs.
captopril; metabonomics; endothelial function; spontaneous hypertension rats; RRLC-Q-TOF-MS; biomarkers
2016-02-18,
2016-04-04
中国博士后科学基金特别资助项目(No 2015T80741);国家自然科学基金资助项目(No 81473653)
杨雯晴(1987-),女,博士生,研究方向:中医药治疗高血压,E-mail:winnie0416q@163.com;蒋海强(1982-),男,博士,硕士生导师,通讯作者,E-mail:jhq12723@163.com;李运伦(1969-), 男,博士,教授,博士生导师,研究方向:中医药治疗高血压,通讯作者,E-mail:li.yunlun@163.com
10.3969/j.issn.1001-1978.2016.07.022
A
1001-1978(2016)07-0998-06
R-332;R322.12;R349.1;R544.1;R972.4
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.044.html