水飞蓟素对人骨肉瘤Saos-2细胞的抑制作用及相关机制
2016-08-10邬亚华王子瑶殷嫦嫦
严 晨,邬亚华,王子瑶,殷嫦嫦,殷 明
(南昌大学1.第二附属医院、2.研究生院医学部,江西 南昌 330006;3.九江学院,江西 九江 332000)
水飞蓟素对人骨肉瘤Saos-2细胞的抑制作用及相关机制
严晨1,2,邬亚华3,王子瑶1,2,殷嫦嫦3,殷明1
(南昌大学1.第二附属医院、2.研究生院医学部,江西 南昌330006;3.九江学院,江西 九江332000)
目的研究水飞蓟素对人骨肉瘤Saos-2细胞增殖、凋亡的影响,并探讨其可能的作用机制。方法设置对照组及不同浓度水飞蓟素组,作用人骨肉瘤Saos-2细胞。倒置相差显微镜观察细胞形态变化;CCK-8法测定细胞增殖;流式细胞仪检测细胞凋亡;Western blot检测ERK1/2、p-ERK1/2及cleaved caspase-3蛋白表达。结果水飞蓟素抑制Saos-2细胞增殖,呈时间及浓度依赖性;水飞蓟素诱导Saos-2细胞凋亡,呈浓度依赖性;水飞蓟素降低Saos-2细胞p-ERK1/2蛋白表达,增加Saos-2细胞cleaved caspase-3蛋白表达,呈浓度依赖性,而ERK1/2蛋白表达无明显变化。结论水飞蓟素能够抑制人骨肉瘤Saos-2细胞增殖及诱导其凋亡,其作用机制可能与抑制ERK信号通路及上调caspase-3蛋白表达有关。
水飞蓟素;骨肉瘤;增殖;凋亡;机制;ERK信号通路;caspase-3
骨肉瘤(osteosarcoma,OS)是最常见的原发性恶性骨肿瘤,多发于儿童及青少年[1]。目前,OS的主要治疗策略为手术切除联合化疗。近年来统计,无转移OS患者的总生存率能达到70%,而出现肺转移或骨转移,生存率只有25%~50%[2],且大剂量使用化疗药物产生严重的毒副作用及耐药的频繁发生,使得OS患者的生存率并没有得到明显提高,因此,OS的治疗需进一步探讨。研究发现,一些中药也具有抑制肿瘤细胞的作用,且毒副作用小,可作为传统化疗药物的辅助用药或联合使用,以增加化疗药物的敏感性或减少其用量,以更好的抗OS治疗。
水飞蓟素(silymarin,SM)是从植物水飞蓟中提取的一种活性成分,为多酚类黄酮,具有抗炎、抗氧化、抗纤维化、肝细胞再生等作用,临床已运用其治疗肝脏疾病[3]。近年来研究发现,SM对乳腺癌、皮肤癌、前列腺癌、宫颈癌、结肠直肠癌、卵巢癌、肝癌、膀胱癌、肺癌具有抑制作用[4-6],但对OS的作用尚不清楚。本实验研究SM对OS的作用,并进一步探讨其可能的作用机制。
1 材料
1.1细胞系人骨肉瘤Saos-2细胞为本实验室库存。
1.2主要药品与试剂水飞蓟素(山东西亚生化科技有限公司,批号1035907);DMSO(Solarbio公司,美国,批号02A033);胰酶(Solarbio公司,美国,批号20150806);α-MEM(Hyclone公司,美国,批号NAP1372);胎牛血清(Hyclone公司,美国,批号:NYM1035);CCK-8细胞增殖检测试剂盒(上海经科化学科技有限公司,批号:JK-021);Annexin V-FITC /PI凋亡检测试剂盒(北京庄盟国际生物基因科技有限公司,批号:150509J);总蛋白提取试剂盒(北京普利莱基因技术有限公司,批号:P1250);兔抗人ERK1/2单克隆抗体(Cell Signaling公司,美国,批号:14);p-ERK1/2单克隆抗体(Cell Signaling公司,美国,批号:15);兔抗人GAPDH(Proteintech公司,美国,批号:10494-1-AP);cleaved caspase-3多克隆抗体(Proteintech公司,美国,批号:9677-1-AP);辣根过氧化物酶标记的羊抗兔二抗(北京康为世纪生物科技有限公司,批号:1215E)。
2 方法
2.1细胞培养人骨肉瘤Saos-2细胞从液氮中复苏后,用10%胎牛血清的α-MEM培养基,置于37℃ 5% CO2的培养箱中培养,每3 d换液1次,待细胞汇合80%~90%后,按1 ∶3传代、培养或进行相关实验。
2.2倒置相差显微镜观察细胞形态变化取对数生长期Saos-2细胞,按每孔5×104接种于24孔板中,常规培养24 h后,按照实验分组更换含不同药物浓度的培养基,实验分6组:0 μmol·L-1(对照组)、40、80、120、160、200 μmol·L-1,作用48 h后,倒置相差显微镜观察细胞形态,并拍照。
2.3CCK-8法测定细胞增殖取对数生长期Saos-2细胞,按每孔5×103接种于96孔板中,常规培养24 h后,按照实验分组更换含不同药物浓度的培养基,实验分组同2.2,各药物浓度组均设3个复孔和1个空白孔,分别作用24、48、72 h后,每孔加入10 μL CCK-8试剂,37℃培养箱中孵育2 h,酶标仪(波长450 nm)测定各孔吸光度OD(A)值。各组吸光度OD=A细胞-A空白,细胞增殖抑制率(inhibition rate, IR):IR/%=(1-OD实验/OD对照)×100%。
2.4流式细胞仪检测细胞凋亡取对数生长期Saos-2细胞,按每孔5×105接种于6孔板中,常规培养24 h后,按照实验分组更换含不同药物浓度的培养基,实验分组同2.2,作用48 h后,消化收集细胞,用PBS重新悬浮细胞,并计数,各组取2×105细胞悬浮液,1 500 r·min-1,5 min离心后弃上清,加入500 μL 1×Binding Buffer轻轻重悬细胞,重悬后,先加入5 μL Annexin V-FITC,再加入10 μL PI,轻轻混匀,在室温下,避光反应10 min,行流式细胞仪检测,计算凋亡率。
2.5Western blot检测细胞内ERK1/2、p-ERK1/2及cleaved caspase-3蛋白表达取对数生长期Saos-2细胞,按每孔5×105接种于6孔板中,常规培养24 h后,按照实验分组更换含不同药物浓度的培养基,实验分4组:对照组(0 μmol·L-1)、低浓度组(40 μmol·L-1)、中浓度组(120 μmol·L-1)、高浓度组(200 μmol·L-1),作用48 h后,常规消化收集各组细胞,按总蛋白抽提试剂盒操作说明提取各组细胞总蛋白,行聚丙烯酰胺(SDS-PAGE)凝胶电泳,转膜,5% BSA封闭,孵育一抗GAPDH(1 ∶4 000)、ERK1/2(1 ∶1 000)、p-ERK1/2(1 ∶2 000)、cleaved caspase-3(1 ∶1 000),4℃过夜,1×TBTS洗膜3次,孵育二抗(1 ∶6 000),1×TBTS 洗膜3次,暗室胶片曝光,条带用Image J软件进行灰度分析。

3 结果
3.1细胞形态学观察显微镜下观察显示:对照组细胞生长良好,呈梭形或不规则形,胞质透亮,胞膜光整;处理组部分细胞体积缩小、变圆,细胞内颗粒增多,胞膜边缘毛糙,折光度增强,呈细胞凋亡样形态学改变;处理组细胞数量减少,细胞间隙增宽,可见少许细胞脱壁、漂浮,随着浓度的增大,处理组上述形态学改变越明显(Fig 1 )。
A: Control group(0 μmol·L-1); B:40 μmol·L-1;C:80 μmol·L-1; D:120 μmol·L-1; E:160 μmol·L-1; F:200 μmol·L-1

Fig 2 Apoptosis rate of Saos-2 cells treated with silymarin
*P<0.05vscontrol
3.2水飞蓟素对骨肉瘤Saos-2细胞增殖的影响CCK-8结果显示:处理组均抑制骨肉瘤Saos-2细胞增殖,药物浓度越大,作用时间越长,增殖抑制越明显,与对照组相比差异有显著性(P<0.05),见Tab 1。
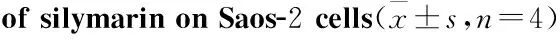
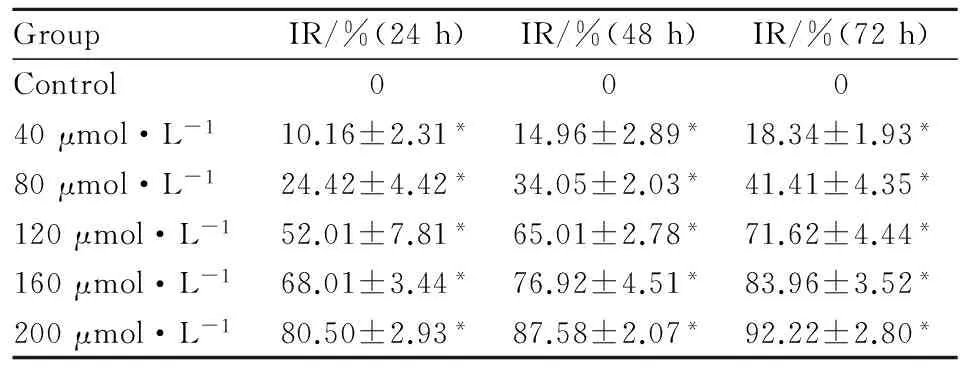
GroupIR/%(24h)IR/%(48h)IR/%(72h)Control00040μmol·L-110.16±2.31*14.96±2.89*18.34±1.93*80μmol·L-124.42±4.42*34.05±2.03*41.41±4.35*120μmol·L-152.01±7.81*65.01±2.78*71.62±4.44*160μmol·L-168.01±3.44*76.92±4.51*83.96±3.52*200μmol·L-180.50±2.93*87.58±2.07*92.22±2.80*
*P<0.05vscontrol
3.3水飞蓟素对骨肉瘤Saos-2细胞凋亡的影响流式细胞仪检测结果显示:水飞蓟素诱导细胞凋亡,各组细胞凋亡率分别为(2.08±0.12)%、(8.15±0.37)%、(15.37±1.06)%、(32.68±2.02)%、(48.34±1.59)%、(67.58±2.43)%,处理组浓度越高,凋亡率越大,与对照组比差异有显著性(P<0.05),见Fig 2。
3.4水飞蓟素对骨肉瘤Saos-2细胞ERK1/2、p-ERK1/2及cleaved caspase-3蛋白表达的影响Western blot结果显示:水飞蓟素降低Saos-2细胞内p-ERK1/2蛋白表达,增加cleaved caspase-3蛋白表达,与对照组相比差异有显著性(P<0.05),而ERK1/2蛋白表达无明显变化(Fig 3)。
4 讨论
研究证实[7-10],水飞蓟素具有预防癌症发生及抗肿瘤作用,毒副作用小,还能增加多柔比星、顺铂和卡铂的敏感性。本研究CCK-8及流式检测结果显示,水飞蓟素能够抑制Saos-2细胞增殖并诱导其凋亡,并呈浓度依赖性。
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是一类丝氨酸/酪氨酸蛋白激酶,广泛存在于哺乳动物细胞内,MAPKs信号通路为细胞内重要信号转导通路,参与调控细胞的存活、生长、增殖、分化及凋亡等多项生理过程[11]。非磷酸化的MAPKs为静息状态,而磷酸化的MAPKs为激活状态,当MAPKs信号通路受到上游激酶作用下,发生磷酸化后而被激活,进一步激活下游转录因子,启动相关基因及蛋白表达,发挥生物学效应。研究发现,多种恶性肿瘤中MAPKs信号通路过表达或过激活,如:肝癌、肾癌、胰腺癌、食管癌[12-16]。MAPKs主要包括3个亚家族:ERK(extracellular signal-regulated kinase)家族、JNK(C-JUN-N terminal kinase)家族、p38家族,其中ERK与细胞的生长、增殖密切相关。有研究报道,水飞蓟素可通过MAPKs信号转导通路促进肺腺癌A549细胞凋亡,其中ERK1/2磷酸化明显受到抑制[17]。徐良志等[18]研究发现,大黄素通过抑制ERK信号通路,抑制骨肉瘤细胞增殖,导致细胞凋亡。caspase家族是一组半胱氨酸蛋白酶,在介导细胞凋亡过程中起到重要的作用。细胞凋亡途径有多种,但绝大多数途径末端都是通过caspase的级联激活,最终激活caspase-3,形成具有活性的cleaved caspase-3片段,进一步产生一系列级联反应,导致细胞凋亡[19]。施剑明等[20]研究发现,槲皮素、顺铂能增加骨肉瘤MG-63细胞cleaved caspase-3蛋白表达,抑制细胞增殖及促进其凋亡。本研究中,水飞蓟素作用骨肉瘤Saos-2细胞48h后,p-ERK1/2蛋白表达降低,cleaved caspase-3蛋白表达增加,呈浓度依赖性,而ERK1/2蛋白表达无明显变化,表明水飞蓟素能够抑制ERK磷酸化,阻滞ERK信号传导通路,同时上调caspase-3蛋白表达。
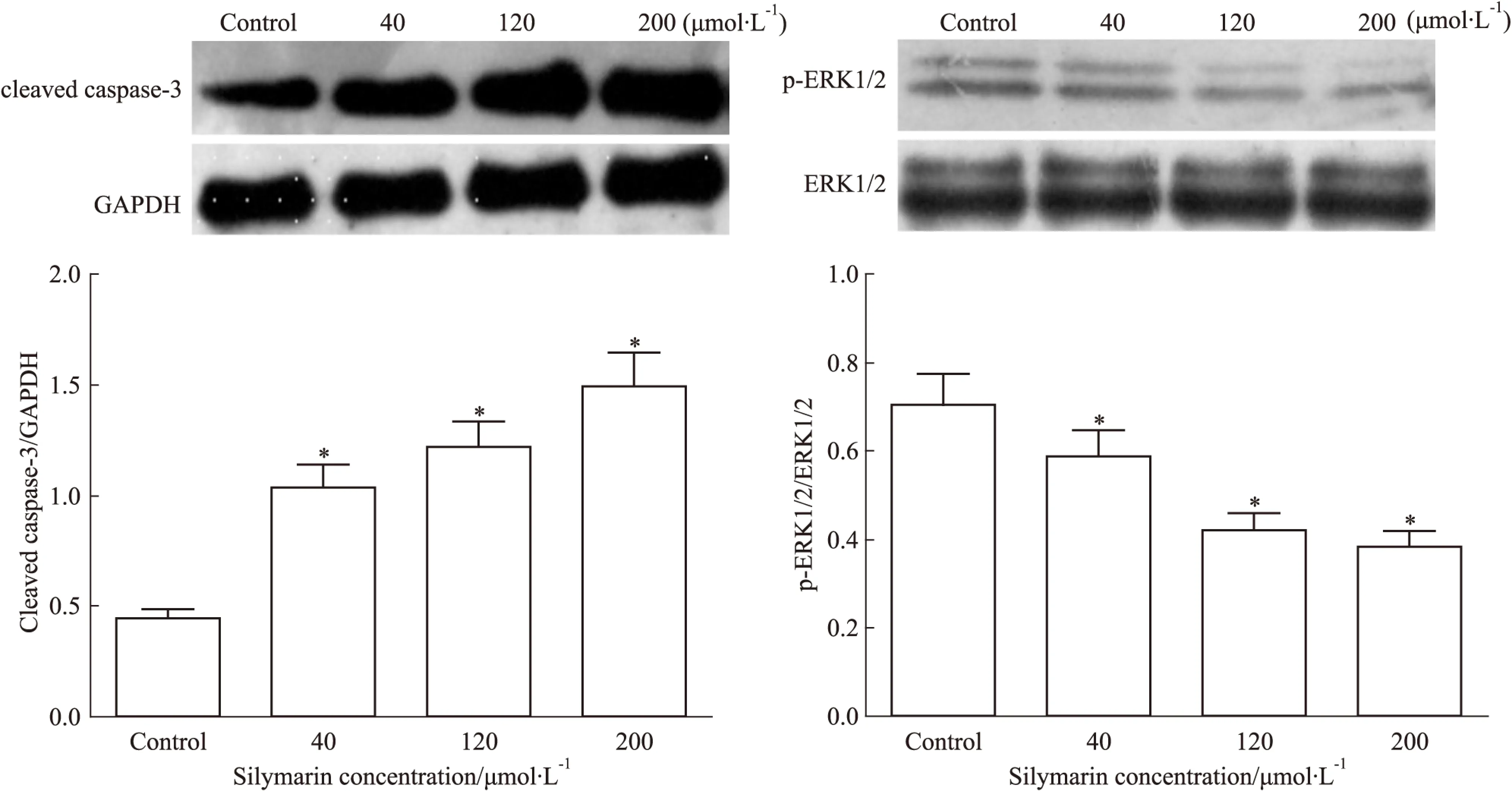
Fig 3 Cleaved caspase-3,ERK1/2,p-ERK1/2 protein expression of Saos-2 cells treated with silymarin for 48h detected by Western ±s,n=4)
综上所述,水飞蓟素能够抑制Saos-2细胞增殖及诱导其凋亡,可能与抑制ERK信号通路及上调caspase-3蛋白表达有关。本研究为水飞蓟素抗骨肉瘤及其作用靶点提供一定的实验参考。
(致谢:本实验在九江学院医学转化实验室完成,感谢实验室全体成员对本实验的支持与帮助!)
[1]Miwa S, Sugimoto N, Yamamoto N, et al. Caffeine induces apoptosis of osteosarcoma cells by inhibiting AKT/mTOR/S6K, NF-κB and MAPK pathways[J].AnticancerRes, 2012, 32(9): 3643-9.
[2]Liu Y, He J, Chen X, et al. The proapoptotic effect of formononetin in human osteosarcoma cells: involvemt of inactivation of ERK and Akt pathways[J].CellPhysiolBiochem, 2014, 34(3):637-45.
[3]Saller R, Meier R, Brignoli R. The use of silymarin in the treatment of liver diseases[J].Drugs,2001,61(14)2035-63.
[4]Agarwal R, Agarwal C, Ichikawa H, et al. Anticancer potential of silymarin: from bench to bed side[J].AnticancerRes, 2006, 26(6B): 4457-98.
[5]Singh R P, Agarwal R. Prostate cancer chemoprevention by silibinin: bench to bedside[J].MolCarcinog, 2006, 45(6): 436-42.
[6]Singh R P, Agarwal R. A cancer chemopreventive agent silibinin, targets mitogenic and survival signaling in prostate cancer[J].MutatRes, 2004, 555(1-2): 21-32.
[7]Saxena A, Saxena A K, Singh J, et al. Natural antioxidants synergistically enhance the anticancer potential of AP9-cd, a novel lignan composition from Cedrus deodara in human leukemia HL-60 cells[J].ChemBiolInteract, 2010, 188(3): 580-90.
[8]Deep G, Gangar S C, Oberlies N H, et al. Isosilybin A induces apoptosis in human prostate cancer cells via tageting Akt, NF-κB, and androgen receptor signaling[J].MolCarcinog, 2010, 49(10): 902-12.
[9]Kaur M, Velmurugan B, Tyagi A, et al. Silibinin suppresses growth of human colorectal carcinoma SW480 in culture and xenograft through down-regulation of beta-catenin-dependent signaling[J].Neoplasia,2010,12(5): 415-24.
[10]Cheung C W, Gibbons N, Johnson D W, Nicol D L. Silibinin-a promising new treatment for cancer[J].AnticancerAgentsMedChem, 2010, 10(3): 186-95.
[11]钟良瑞, 魏克民. 三叶青黄酮对肺癌A549 细胞生长抑制与MAPKs 通路关系的研究[J]. 中国药理学通报, 2014, 30(1): 101-4.
[11]Zhong L R,Wei K M. Radix tetrastigma hemsleyani flavone suppresses human lung carcinomaA549 cell by regulating MAPKs pathway[J].ChinPharmacolBull, 2014, 30(1): 101-4.
[12]Young A, Lyons J. Ras signaling and therapies[J].AdvCancerRes, 2009, 102: 1-17.
[13]Wang C, Maass T, Krupp M, et al. A systems biology perspective on cholangiocellular carcinoma development: focus on MAPK-signaling and the extracellular environment[J].JHepatol, 2009, 50(6): 1122-31.
[14]Ding Y, Boguslawski E A, Berghuis B D, et al. Mitogen-activated protein kinase kinase signaling promotes growth and vascularization of fibrosarcoma[J].MolCancerTher, 2008, 7(3): 648-58.
[15]Peng C L, Guo W, Ji T, et al. Sorafenib induces growth inhibition and apoptosis in human synovial sarcoma cells via inhibiting the RAF/MEK/ERK signaling pathway[J].CancerBiolTher, 2009, 8(18): 1729-36.
[16]Keswani R N, Chumsangsri A, Mustafi R, et al. Sorafenib inhibits MAPK-mediated proliferation in a Barrett′s esophageal adenocarcinoma cell line[J].DisEsophagus, 2008,21(6): 514-21.
[17]李文海,梁军,王春梅,等. 水飞蓟素可通过MAPK信号转导通路促进肺腺癌A549细胞凋亡[J]. 第四军医大学学报, 2008, 29(5): 461-4.
[17]Li W H, Liang J, Wang C M, et al. Apoptosis of lung adenocarcinama cell line A549 promoted by silymarin through MAPK signal transduction pathway[J].JFourthMilMedUniv, 2008, 29(5): 461-4.
[18]徐良志, 陈昆仑. 大黄素对骨肉瘤细胞增殖的抑制及相关机制[J].山东大学医学版, 2014, 52(6):37-40.
[18]Xu L Z, Chen K L. Inhibitory effect and its mechanism of emodin on the proliferation of human osteosarcoma cellline[J].JShanDongUniv(HeaSci),2014,52(6):37-40.
[19]刘金娟, 杨成流, 陈永强, 等. 鱼腥草地下茎提取物诱导胃癌细胞SGC-7901凋亡机制的研究[J]. 中国药理学通报, 2014, 30(2): 257-61.
[19]Liu J J, Yang C L, Chen Y Q, et al. Mechanism of SGC-7901 apoptosis induced by Houttuynia cordata thunb subterraneous stem extraction[J].ChinPharmacolBull, 2014, 30(2): 257-61.
[20]施剑明, 殷嫦嫦, 孙维君, 等. 槲皮素联合顺铂对人骨肉瘤MG63细胞增殖及凋亡的影响[J]. 中国药理学通报, 2014, 30(10): 1361-6.
[20]Shi J M, Yin C C, Sun W J, et al. Effect of quercetin combined with cisplatin on proliferation and opoptosis of human osteosarcoma cell MG63[J].ChinPharmacolBull, 2014, 30(10): 1361-6.
Inhibitory effect of silymarin on human osteosarcoma Saos-2 cells and its mechanism
YAN Chen1,2, WU Ya-hua3, WANG Zi-yao1,2, YIN Chang-chang3, YIN Min1
(1.TheSecondAffiliatedHospitaltoNanchangUniversity,2.MedicalGraduateSchoolofNanchangUniversity,Nanchang330006,China;3.JiujiangCollege,JiujiangJiangxi332000,China)
AimTo study the effect of silymarin on proliferation and apoptosis of human osteosarcoma saos-2 cells and to explore its possible mechanisms.MethodsControl group and different concentration groups of silymarin were set, and Saos-2 cells were treated with silymarin. Celluar morphologic changes were observed by inverted phase contrast microscope. Proliferation of cells was tested CCK-8 assay. Apoptosis rate of cells was analyzed by flow cytometry. ERK1/2、p-ERK1/2 and cleaved caspase-3 protein expression were measured by Western blot.ResultsSilymarin inhibited the proliferation of Saos-2 cells in a time-dependent and concentration-dependent manner. Silymarin induced the apoptosis of Saos-2 cells in a concentration-dependent manner. Silymarin decreased p-ERK1/2 protein expression and increased cleaved caspase-3 protein expression in a concentration-dependent manner, while ERK1/2 protein expression had no obvious change.ConculsionsSilymarin can inhibit the proliferation of human osteosarcoma saos-2 cells and induce apoptosis of them, and the mechanism may be related to inhibition of ERK signaling pathway and upregulated caspase-3 protein expression.
silymarin; osteosarcoma; proliferation; apoptosis; mechanism; ERK signaling pathway; caspase-3
2016-02-21,
2016-04-14
国家自然科学基金资助项目(No 81160226)
严晨(1986-),男,硕士生,研究方向:中药抗骨肿瘤,E-mail:yanchen8623@163.com;殷明(1958-),男,教授,主任医师,博士生导师,研究方向:脊柱与肿瘤,通讯作者,E-mail: yinming0791@aliyun.com
10.3969/j.issn.1001-1978.2016.07.016
A
1001-1978(2016)07-0966-05
R284.1;R329.24;R329.25;R738.302.2
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.032.html