脑CYP2E1参与脂多糖诱导的神经元损伤
2016-08-10那淑芳杨哲琼
那淑芳,姚 慧,李 杰,杨哲琼,乐 江
(武汉大学基础医学院药理学系,湖北 武汉 430071)
脑CYP2E1参与脂多糖诱导的神经元损伤
那淑芳,姚慧,李杰,杨哲琼,乐江
(武汉大学基础医学院药理学系,湖北 武汉430071)
目的研究脂多糖(LPS)所致炎症与脑细胞色素P450 2E1和CYP2E1之间的相互影响。方法采用具有胆碱能神经元特征的IMR-32人神经母细胞瘤细胞系,分别给予低剂量(0.1 mg·L-1)和高剂量(1.0 mg·L-1)LPS处理24 h,检测LDH和SOD活性。在LPS处理前45 min,分别加入p38抑制剂SB203580和ERK抑制剂U0126处理IMR-32细胞,观察MAPK信号系统对神经元CYP2E1表达的影响。采用具有多巴胺能神经元特征的SH-SY5Y人神经母细胞瘤细胞系建立高表达CYP2E1细胞系,并与正常SH-SY5Y细胞同时给予低剂量(0.1 mg·L-1)和高剂量(1.0 mg·L-1)LPS处理24 h后检测LDH和SOD活性。结果与对照组相比,高剂量LPS处理IMR-32细胞,SOD的活力下降15.0%(P<0.01),LDH上升1.38倍(P<0.01),CYP2E1 mRNA升高1.25倍(P<0.01),蛋白水平升高1.19倍(P<0.05)。p38和ERK抑制剂可拮抗高剂量LPS对CYP2E1的诱导作用。低剂量LPS处理CYP2E1高表达SH-SY5Y细胞,LDH的升高幅度较非高表达的对照组上升了1.28倍(P<0.01),SOD活力下降幅度增加了3.53倍(P<0.01);高剂量LPS使得CYP2E1高表达SH-SY5Y细胞LDH的升高幅度较非高表达的对照组上升了1.54倍(P<0.01),SOD活力下降幅度增加了2.17倍(P<0.01)。结论LPS可上调神经元所表达的CYP2E1水平,其调控作用可能与ERK和p38信号传导通路相关。高表达CYP2E1加剧LPS对神经元的损伤,提示CYP2E1参与了炎症所致神经细胞损伤的病理过程。
脂多糖;炎症;神经元;ERK信号传导通路;p38信号传导通路
随着人口老年化,神经退行性疾病已成为危害人类健康的重要疾病。研究提示,帕金森病、阿尔茨海默病、多发性硬化、肌萎缩侧索硬化症等神经退行性疾病的病理生理学改变与持续的炎症反应过程密切相关[1-3],然而其病理机制尚需深入研究。
细胞色素P450(cytochrome P450,CYP)超家族酶系参与内源性物质(如脂肪酸、维生素、胆酸)和外源性物质(如药物、毒物、前致癌物)的代谢失活及活化。CYP超家族酶系虽主要表达在肝脏,但也表达于肝外器官,如脑。在CYP亚型中,CYP2E1蛋白空间结构具有可变性,故易出现底物与酶解偶联而产生活性自由基[4]。2012年,德国学者对帕金森病患者大脑皮层和壳核的14495个基因的CpG岛的甲基化水平进行分析,发现仅CYP2E1基因甲基化水平明显下降,mRNA水平明显升高[5]。
脂多糖(LPS)为革兰阴性细菌外壁层中一种特有的化学成分[6],能够刺激体内多种细胞合成和释放众多内源性生物活性因子,导致炎症反应发生[7]。文献报道,LPS腹腔注射、颅内注射均可用于建立动物神经炎症模型。IMR-32细胞为具有胆碱能神经元特征的人神经母细胞瘤细胞系; SH-SY5Y细胞为具有多巴胺能神经元特征的人神经母细胞瘤细胞系。文献报道,脑CYP2E1在IMR-32细胞和SH-SY5Y细胞中均具有表达。本文拟利用上述人神经母细胞瘤细胞系,观察脑CYP2E1在LPS所致神经元损伤中的作用。
1 材料与方法
1.1细胞培养和试剂IMR-32和SH-SY5Y人神经母细胞瘤细胞,置于恒温37℃,含5% CO2的培养箱中进行培养。培养基分别为含10%胎牛血清(Gibco公司)及1%青霉素-链霉素双抗生素(碧云天生物技术研究所)的MEM培养基或DMEM培养基(杭州吉诺生物医药技术有限公司)。含EDTA胰蛋白酶用于细胞消化、传代(杭州吉诺生物医药技术有限公司)。考马斯亮兰试剂盒、总超氧化物歧化酶(T-SOD)测试盒、乳酸脱氢酶(LDH)测定试剂盒,购于南京生物建成生物工程研究所。LPS(来源于大肠杆菌055:B5)、DMSO、SB203580、U0126,购于Sigma公司;所用兔抗大鼠多克隆CYP2E1抗体,购自Millipore公司。辣根过氧化物酶(HRP)标记的羊抗兔IgG单克隆抗体购自碧云天生物技术研究所。
1.2细胞分组及处理选取生长良好细胞制成细胞悬液,接种于6孔和24孔细胞培养板。待细胞贴壁后,换液,分别给予低剂量(0.1 mg·L-1)LPS、高剂量(1.0 mg·L-1)LPS或等体积PBS溶液,孵育24 h。抑制性实验中,细胞给予ERK抑制剂U0126(10 μmol·L-1)或p38抑制剂SB203580(20 μmol·L-1),45 min后分别加入低或高剂量LPS,共孵育24 h。
1.3构建高表达CYP2E1的SH-SY5Y人神经母瘤细胞系构建pcDNA3.1-CYP2E1重组质粒,利用LipofectamineTM3000转染试剂,将人CYP2E1 cDNA表达质粒转入SH-SY5Y细胞中。转染48 h后,胰蛋白酶消化细胞,接种至培养皿,用含10%胎牛血清和100 mg·L-1G418的DMEM培养基继续培养[8]。两周后,将孤立克隆转移到6孔板中,继续传代培养。通过RT-PCR和Western blot鉴定每个克隆CYP2E1表达,以获得稳定表达CYP2E1的细胞系。
1.4乳酸脱氢酶(LDH)和超氧化物歧化酶(SOD)活性测定将IMR-32细胞、高表达CYP2E1的SH-SY5Y细胞制成细胞悬液分别接种24孔板,培养24 h待贴壁。细胞给予低浓度(0.1 mg·L-1)、高浓度LPS(1.0 mg·L-1)或等体积PBS溶液处理,每组8孔,继续培养24 h。收集培养基上清液,按试剂盒说明书检测培养基中LDH水平,可见光分光光度计测定440 nm处吸光度[9]。
按SOD检测试剂盒说明书检测培养基中SOD水平。黄嘌呤及黄嘌呤氧化酶系产生超氧阴离子,氧化羟胺生成亚硝酸铵盐,在显色剂作用下呈紫红色,利用可见光分光光度计550 nm处测定吸光度。
1.5Real-time RT-PCRTRIzol(Incitrogen公司)提取IMR-32细胞总RNA,使用Revert Aid First Strand cDNA synthesis试剂盒将总RNA逆转录为cDNA。设计人CYP2E1引物序列:5′-CCGCTTCCCATCATCGGGAAC,3′-GCGCTTCCTTCACCGCCTTGT。RPLP0作为内参,引物序列为:5′-GGCGACCTGGAAGTCCAACT,3′-CCATCAGCACCACAGCCTTC[10]。退火温度为60℃,循环数为30。1.6Western blot收集细胞,PBS洗涤细胞,加入RIPA裂解液,冰上裂解30 min。使用考马斯亮蓝法测定蛋白浓度,并将各组样品稀释至相同蛋白浓度。取30 μg总蛋白,加入上样缓冲液等体积混合,置于100℃沸水中变性处理5 min。样品经SDS-PAGE凝胶电泳,电泳结束后转印至PVDF膜上。用5% PBST配制的脱脂奶粉,在37℃封闭2 h,加入兔抗大鼠多克隆CYP2E1抗体(1 ∶1 500)孵育2 h。PBST洗涤3次,每次10 min。加入辣根过氧化物酶(HRP)标记的羊抗兔IgG单克隆抗体(1 ∶7 000),37℃孵育1 h。PBST洗涤3次,每次10 min。采用辣根过氧化物酶-ECL化学发光显影,曝光胶片。扫描胶片,用灰度分析软件Alpha EaseFC分析目的条带。
2 结果
2.1LPS引发IMR-32神经细胞出现损伤与对照组相比,低剂量(0.1 mg·L-1)、高剂量(1.0 mg·L-1)LPS可使得IMR-32神经细胞LDH分别升高1.18倍(P<0.05)和1.38倍(P<0.01)。然而,与对照组相比,高剂量LPS致SOD的活力下降15.0%(P<0.01),但低剂量LPS对SOD的活力无明显影响(Fig 1)。
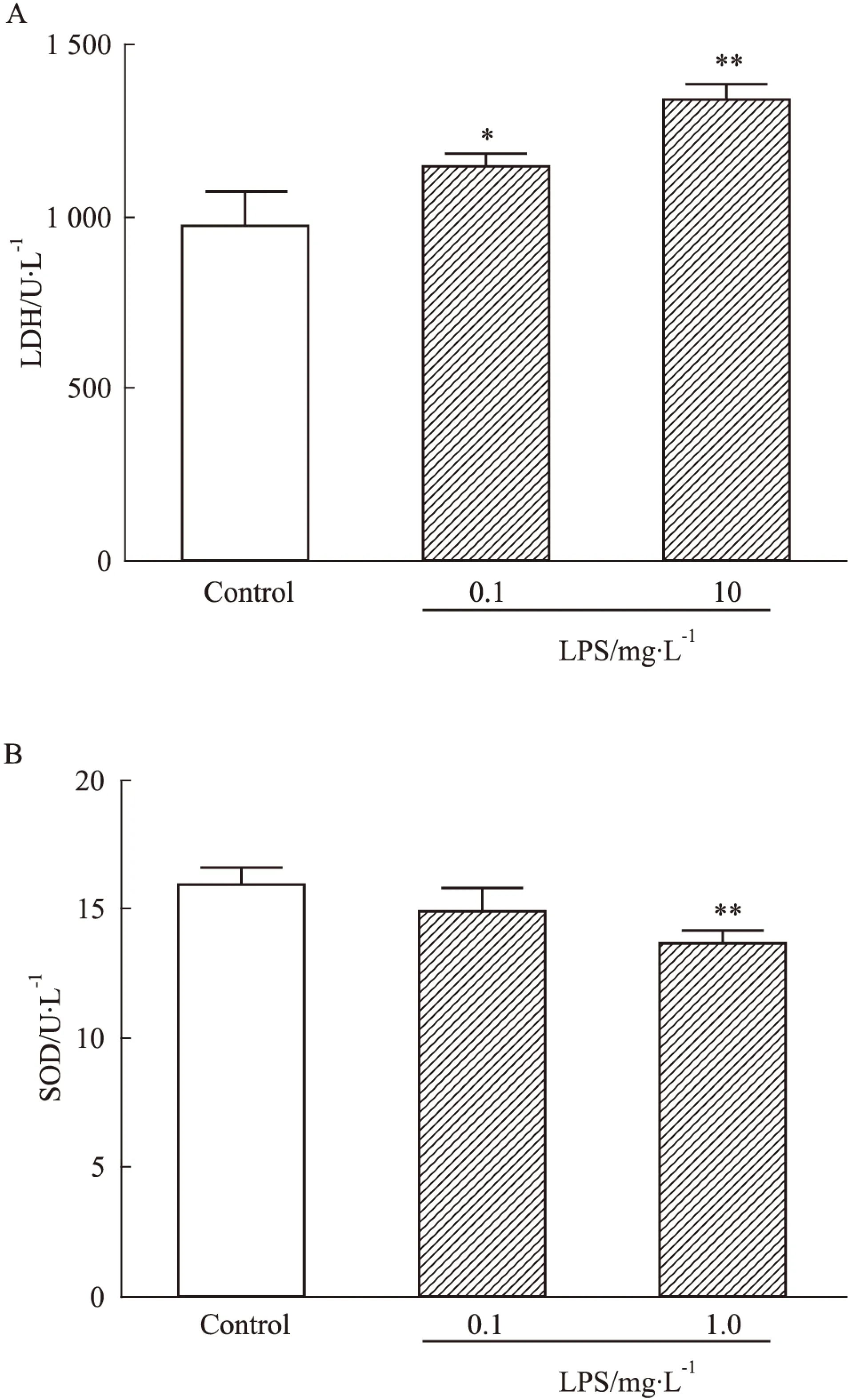
Fig 1 Effect of LPS treatment on levels of LDH(A) and SOD(B) in IMR-32 neuroblastoma cells
*P<0.05,**P<0.01vscontrol
2.2LPS对IMR-32神经细胞CYP2E1 表达水平的影响与正常对照组相比,低剂量(0.1 mg·L-1)LPS对IMR-32细胞CYP2E1 mRNA水平、蛋白表达水平无明显影响。高剂量(1.0 mg·L-1)LPS可明显诱导IMR-32细胞CYP2E1 mRNA水平,其mRNA水平较对照组升高1.25倍(P<0.01)(Fig 2A)。Western blot实验结果表明,高剂量LPS处理组细胞CYP2E1蛋白水平较对照组升高1.19倍(P<0.05)(Fig 2B)。
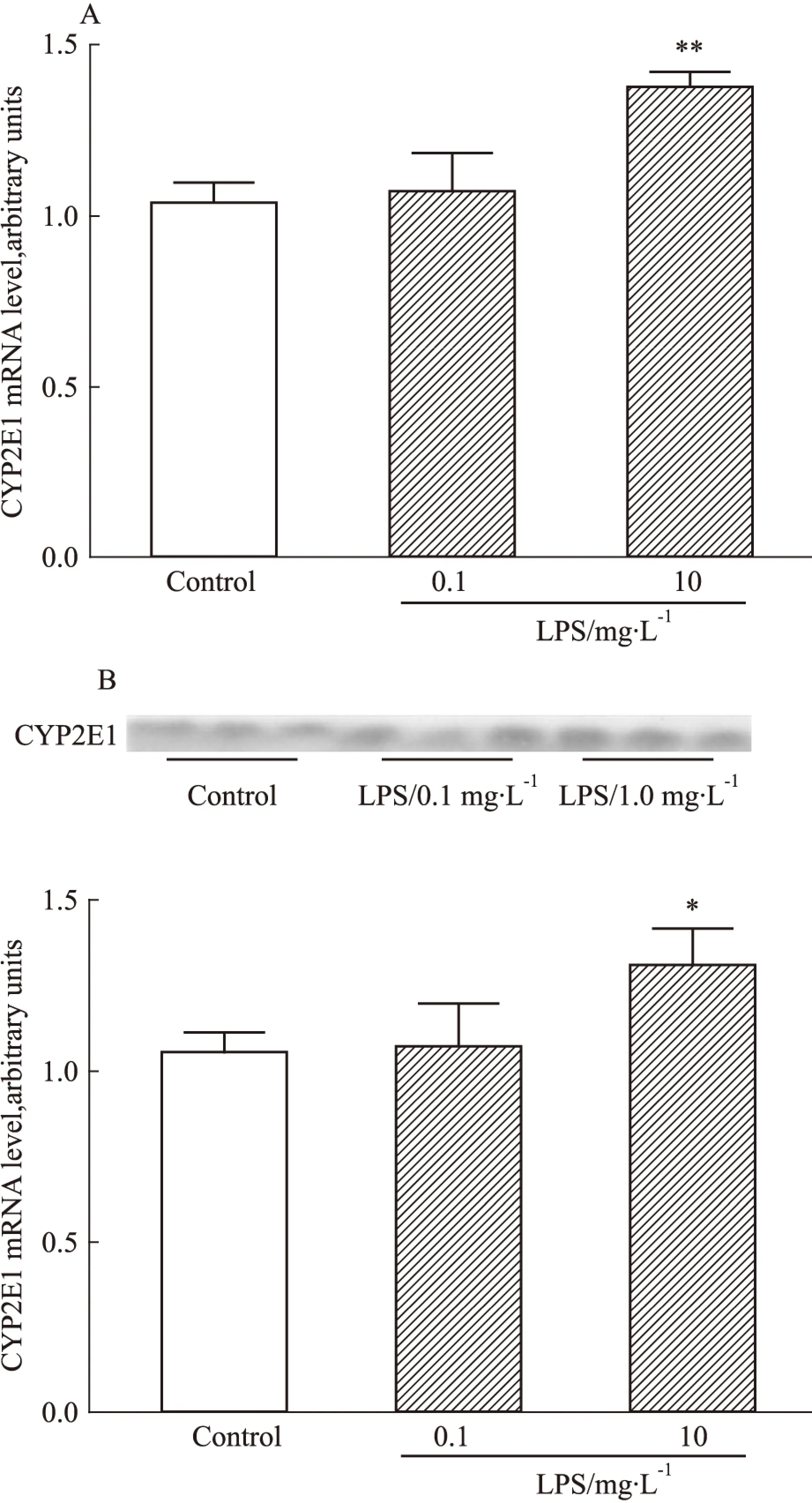
Fig 2 Alteration of CYP2E1 mRNA and protein in IMR-32 neuroblastoma cells after LPS treatment
A: Effect of LPS on the levels of CYP2E1 mRNA in IMR-32 neuroblastoma cell. B: Effect of LPS on the levels of CYP2E1 protein in IMR-32 neuroblastoma cell. Representative Western blot of CYP2E1 protein is shown above, and the protein relative density is shown as the histogram.*P<0.05,**P<0.01vscontrol.
2.3ERK和p38抑制剂可拮抗LPS对CYP2E1 mRNA的诱导作用ERK抑制剂U0126(10 μmol·L-1)和p38抑制剂SB203580(20 μmol·L-1)单独处理IMR-32细胞,未见CYP2E1mRNA水平出现变化(Fig 3A)。IMR-32细胞分别给予不同抑制剂45 min后,加入1.0 mg·L-1LPS共孵育,U0126和SB203580使得细胞CYP2E1 mRNA水平分别下降20.6%(P<0.01)和24.2%(P<0.01)(Fig 3B)。结果提示,LPS可能通过激活ERK和p38通路诱导CYP2E1表达。

Fig 3 Effects of ERK and p38 inhibitors on LPS-induced CYP2E1 mRNA levels in IMR-32 neuroblastoma cells
A: The levels of CYP2E1 mRNA had no obvious change after the treatment of SB203580 and U0126. B: The up-regulation of CYP2E1 by LPS could be attenuated by SB203580 and U0126 pretreatment.**P<0.01vscontrol;△△P<0.01vsLPS
2.4SH-SY5Y神经细胞高表达CYP2E1加剧LPS所致细胞损伤Real-time PCR和Western blotting证实,高表达CYP2E1的SH-SY5Y细胞系构建成功(Fig 4A,B)。与正常对照组相比,低剂量(0.1 mg·L-1)LPS处理SH-SY5Y细胞,LDH水平升高1.55倍(P<0.01),SOD活力下降8.3%;而高表达CYP2E1的SH-SY5Y细胞,LDH水平升高1.98倍(P<0.01),SOD活力下降29.3%(P<0.01)。与此同时,与正常对照组相比,高剂量(1.0 mg·L-1)LPS使得LDH水平升高2.17倍(P<0.01),SOD活力下降20.4%(P<0.01);而高表达CYP2E1的SH-SY5Y细胞,LDH水平升高3.34倍(P<0.01),SOD活力下降44.2%(P<0.01)。研究结果提示,高表达CYP2E1可加剧LPS所致神经细胞损伤。
3 讨论
实验结果表明,LPS可在转录水平上调神经元CYP2E1表达,其诱导机制可能与激活MAPK信号通路有关,而高表达CYP2E1可加重LPS所致神经元损伤。目前,由炎症介导的CYP2E1的变化在肝内的调控机制已较为明确,但是对中枢内CYP2E1的变化情况研究较少。在大鼠肝癌细胞Fao细胞系的体外实验中,证实炎症因子通过多重机制下调CYP2E1基因的表达[11]。炎症因子刺激人肝脏原代培养细胞后也发现,CYP2E1 mRNA水平下降。以往研究提示,炎症因子可能调控HNF-1α和其他转录因子作用于CYP2E1的5′-端上游调控区域,或影响CYP2E1 mRNA的稳定性而下调其表达。有报道[12],卡介苗制备的免疫性肝炎模型中,因NF-κB信号转导通路活化而抑制CYP2E1的下调。
本文数据表明,炎症对脑CYP2E1表达调控机制不同于肝脏。不同剂量(0.1 mg·L-1和1.0 mg·L-1)LPS处理IMR-32细胞,可导致细胞出现损伤,且诱导CYP2E1 mRNA和蛋白水平表达。分裂原激活的蛋白激酶(MAPKs)是丝氨酸/苏氨酸蛋白激酶家族,包括细胞外信号调节激酶(ERK)、c-Jun Np-末端蛋白激酶(JNK)和p38 MAPK等[13]。MAPK信号通路参与细胞增殖、存活和凋亡。本研究表明,ERK和p38抑制剂均可不同程度拮抗LPS对CYP2E1的诱导效应。结果提示,LPS可能通过激活ERK和p38信号传导通路,继而影响下游转录因子,上调神经元CYP2E1表达水平。文献报道[14],MAPK信号通路参与了乙醇对神经胶质细胞CYP2E1的表达调控。
低剂量(0.1 mg·L-1)LPS处理SH-SY5Y细胞,高表达CYP2E1后LDH的升高幅度上升了1.28倍(P<0.01),SOD活力下降幅度增加了3.53倍(P<0.01);高剂量(1.0 mg·L-1)LPS处理细胞,高表达CYP2E1后LDH的升高幅度上升了1.54倍(P<0.01),SOD活力下降幅度增加了2.17倍(P<0.01)。实验数据表明,CYP2E1表达量增加可加剧神经细胞的损伤。CYP2E1具有较高的NADPH氧化活性,代谢过程中会产生活性氧,如羟自由基(·OH)、超氧阴离子(O2-)和过氧化氢(H2O2)等,使得活性氧ROS产生增多。当活性氧含量超过机体清除能力时,则发生氧化损伤,破坏膜结构的完整性,改变膜结合酶,膜通透性增加,流动性改变,损伤线粒体,破坏DNA修饰,使细胞内环境紊乱,能量衰竭,膜功能丧失[5]。在腹腔注射神经毒素1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)制备的帕金森病动物模型中,CYP2E1基因敲除小鼠所出现的多巴胺能神经元损伤程度明显弱于对照组[15]。脑CYP2E1可能是神经炎症引发神经细胞损伤的重要中央环节。脑CYP2E1在与炎症相关的神经退行性疾病病理生理过程中的作用仍需进一步研究。
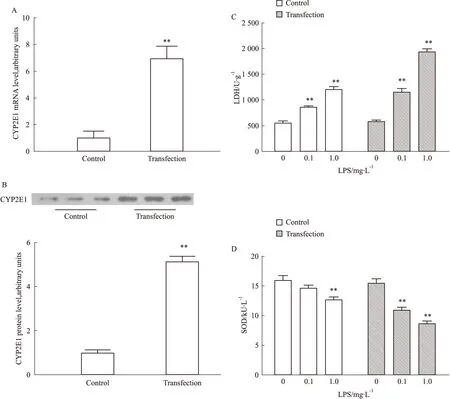
Fig 4 Effect of LPS treatment on levels of LDH and SOD in SH-SY5Y neuroblastoma cells overexpressing CYP2E1
A: Transfection increased CYP2E1 mRNA levels in SH-SY5Y cells. B: Transfection increased CYP2E1 protein levels in SH-SY5Y cells. Representative Western blot of CYP2E1 protein is shown above, and the protein relative density is shown as the histogram. C: The levels of LDH were aggrandized in SH-SY5Y cells overexpressing CYP2E1 after LPS treatment. D: The SOD activity in SH-SY5Y cells overexpressing CYP2E1 were reduced in LPS treatment.**P<0.01vscontrol.
(致谢:本研究在武汉大学基础医学院药理系完成,得到国家自然基金项目资助,在此表示感谢!)
[1]Deleidi M, Isacson O. Viral and inflammatory triggers of neurodegenerative diseases[J].SciTranslMed, 2012, 4(121): 121ps3.
[2]Phani S, Loike J D, Przedborski S. Neurodegeneration and inflammation in Parkinson′s disease[J].ParkinsonismRelatDisord, 2012, 18 Suppl 1: S207-09.
[3]Glass C K, Saijo K, Winner B, et al. Mechanisms underlying inflammation in neurodegeneration[J].Cell, 2010, 140(6): 918-34.
[4]刘晨晖,乐江. 细胞色素P450 CYP2E1酶构型特征及其表达调控机制的研究进展[J]. 中国药理学与毒理学杂志,2010,24(02): 155-60.
[4]Liu C H, Yue J. Progress of research on characteristics of cytochrome P-450 CYP2E1 in protein structure and regulation mechanisms[J].ChinJPharmacolToxicol,2010,24(02):155-60.
[5]Kaut O, Schmitt I, Wullner U. Genome-scale methylation analysis of Parkinson′s disease patients′ brains reveals DNA hypomethylation and increased mRNA expression of cytochrome P450 2E1[J].Neurogenetics,2012,13(1): 87-91.
[6]Wang G, Namura S. Effects of chronic systemic treatment with peroxisome proliferator-activated receptor alpha activators on neuroinflammation induced by intracerebral injection of lipopolysaccharide in adult mice[J].NeurosciRes, 2011, 70(2): 230-37.
[7]张雪梅,熊焕章. LPS诱导的炎症反应信号传导通路研究进展[J]. 中国兽医杂志, 2010, 46(7):45-7.
[7]Zhang X M, Xiong H Z. Research progress in LPS induced inflammatory response of signaling transduction pathway[J].ChinJVeterMed,2010,46(7): 45-7.
[8]Leon-Buitimea A, Rodriguez-Fragoso L, Lauer F T,et al. Ethanol-induced oxidative stress is associated with EGF receptor phosphorylation in MCF-10A cells overexpressing CYP2E1[J].ToxicolLett, 2012, 209(2): 161-5.
[9]Zhong Y, Dong G, Luo H, et al. Induction of brain CYP2E1 by chronic ethanol treatment and related oxidative stress in hippocampus, cerebellum, and brainstem[J].Toxicology,2012,302(2-3): 275-84.
[10]Barzon L, Masi G, Pacenti M, et al. Expression of aromatase and estrogen receptors in human adrenocortical tumors[J].VirchowsArch,2008,452(2):181-91.
[11]Hakkola J, Hu Y, Ingelman-Sundberg M. Mechanisms of down-regulation of CYP2E1 expression by inflammatory cytokines in rat hepatoma cells[J].JPharmacolExpTher, 2003, 304(3): 1048-54.
[12]贾金雪, 秦金东, 李学峰, 等.钝化NF-κB的活化对免疫性肝损伤大鼠CYP2E1的影响[J].中国药理学通报,2015,31(8):1076-80.
[12]Jia J X, Qing J D, Li X F, et al. Effect of blunting NF kappa B activation on CYP2E1 in immunological liver injury rats[J].ChinPharmacolBull, 2015, 29(8):1076-80.
[13]Davis R J. The mitogen-activated protein kinase signal transduction pathway[J].JBiolChem,1993,268(20): 14553-56.
[14]Jin M, Ande A, Kumar A, Kumar S. Regulation of cytochrome P450 2e1 expression by ethanol: role of oxidative stress-mediated pkc/jnk/sp1 pathway[J].CellDeathDis, 2013, 4(3): e554.
[15]Viaggi C, Vaglini F, Pardini C, et al. MPTP-induced model of Parkinson′s disease in cytochrome P450 2E1 knockout mice[J].Neuropharmacology,2009,56(8): 1075-81.
Involvement of brain CYP2E1 in damage to neuronal cells induced by lipopolysaccharide
NA Shu-fang, YAO Hui, LI Jie, YANG Zhe-qiong, YUE Jiang
(DeptofPharmacology,BasicMedicalSchool,WuhanUniversity,Wuhan430071,China)
AimTo investigate the interactions between the neuroinflammation caused by lipopolysaccharide(LPS) and brain CYP2E1.MethodsThe human cholinergic neuroblastoma cell line IMR-32 was treated with LPS(0.1 mg·L-1, 1.0 mg·L-1), and the LDH and SOD activities were determined after 24 h incubation. In order to determine the roles of MAPK signaling pathway in the regulation of CYP2E1 by LPS, the IMR-32 cells were treated with p38 pathway inhibitor SB203580 or ERK pathway inhibitor U0126 for 45 min before the incubation with LPS. The human dopaminergic neuroblastoma cell line SH-SY5Y with CYP2E1 over-expression was established. The LDH and SOD activities were determined in SH-SY5Y cells over-expressed CYP2E1 and control cells treated with LPS(0.1 mg·L-1, 1.0 mg·L-1) for 24 h.ResultsThe levels of LDH in IMR-32 cells treated with high-dose LPS were increased by 1.38-fold(P<0.01) compared with the control group, and the levels of SOD reduced by 15.0%(P<0.01).Compared with the control, CYP2E1 mRNA and protein levels in IMR-32 cells treated with high-dose LPS were increased by 1.25-fold(P<0.01) and 1.19-fold(P<0.05). The up-regulation of CYP2E1 by LPS could be attenuated by SB203580 and U0126 pretreatment. Compared with the control cells, the CYP2E1 over-expression increased LDH levels by 1.28-fold(P<0.01) and decreased SOD levels by 3.53-fold(P<0.01) after the low-dose of LPS treatment. The CYP2E1 over-expression increased LDH levels by 1.54-fold(P<0.01) and decreased SOD levels by 2.17-fold(P<0.01) after the high-dose of LPS treatment, compared with the control cells.ConclusionsLPS can induce CYP2E1 mRNA and protein levels, and the p38 and ERK signaling pathway may be involved in the regulation. The elevated CYP2E1 levels aggravate the damage to neuronal cells caused by LPS. Brain CYP2E1 may be an important contributing factor to the pathological process of neuroinflammatory injury.
cytochrome P450 2E1; lipopolysaccharide; inflammation; neuron; ERK signaling pathway; p38 signaling pathway
2016-01-22,
2016-04-28
国家自然科学基金资助项目(No 30600773、No 31271327)
那淑芳(1989-),女,硕士生,研究方向:药物代谢,E-mail:nashufang2009@126.com;杨哲琼(1975-),女,博士,副教授,硕士生导师,通讯作者,研究方向:神经药理学,E-mail:yzq751007@126.com;乐江(1975-),女,博士,教授,博士生导师,通讯作者,研究方向:神经药理学,E-mail:yuejiang@whu.edu.cn
10.3969/j.issn.1001-1978.2016.07.010
A
1001-1978(2016)07-0932-06
R322.81;R329.25;R338.1;R345.99;R364.5
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.020.html