趋化因子MCP-1对大鼠海马区NMDA受体介导的兴奋性突触后电流的影响
2016-08-10熊焕贵
李 珊,胡 喆,周 燕,熊焕贵
(1. 广西医科大学药学院,广西 南宁 530021;2. 美国内布拉斯加州立大学医学中心神经科学与药理学系,美国 奥马哈 NE68198-5880)
趋化因子MCP-1对大鼠海马区NMDA受体介导的兴奋性突触后电流的影响
李珊1,胡喆1,周燕1,熊焕贵2
(1. 广西医科大学药学院,广西 南宁530021;2. 美国内布拉斯加州立大学医学中心神经科学与药理学系,美国 奥马哈NE68198-5880)
目的研究趋化因子MCP-1对大鼠海马CA1区NMDA受体介导的兴奋性突触后电流的影响。方法采用全细胞膜片钳技术,记录2.3 nmol·L-1MCP-1对大鼠海马脑片CA1区NMDA受体尤其是其重要受体亚型NR2BR介导的兴奋性突触后电流的影响,观察MCP-1是否对海马CA1区神经元有易化兴奋性作用;应用微管相关蛋白-2(MAP-2)抗体染色的方法,观察海马CA1区神经元轴突结构的完整性,研究在NMDAR、 AMPAR、CCR2受体拮抗剂分别存在的情况下,MCP-1引发海马脑片神经元结构损害的差异,观察上述各种拮抗剂是否对MCP-1导致的神经细胞结构损害有保护作用。结果灌流液内加入MCP-1能明显增加EPSCs、EPSCAMPAR、 EPSCNMDAR电流幅度(P<0.05),MCP-1能增加EPSCNR2BR的电流幅度,冲洗掉MCP-1后上述电流可恢复到接近给药前基础值,说明MCP-1对EPSCNR2BR的易化和促进作用是可逆的。在海马脑片上所做的MAP-2免疫组化染色的实验结果显示MCP-1对神经元轴突结构有损害作用,该作用可被NMDA和AMPA受体拮抗剂或CCR2受体拮抗剂逆转。结论MCP-1对大脑海马CA1区NMDA受体,尤其是NR2B受体介导的突触后神经元的兴奋性有明显易化作用,神经元过度兴奋引发兴奋性神经毒性而导致神经损伤。NMDA和AMPA受体拮抗剂或CCR2受体拮抗剂对MCP-1诱导的神经元轴突结构损伤起到明显保护作用,这些拮抗剂的神经保护效应可为寻找神经退行性疾病的潜在治疗方法提供非常有价值的线索。
趋化因子; MCP-1; 海马脑片;兴奋性突触后电流; 神经兴奋性毒性;艾滋性认知功能障碍
HIV-1是引起全球艾滋病流行的主要病原,艾滋病病毒感染的进程中往往发生认知功能障碍、行为改变和神经损伤,这些表现统称为艾滋性认知功能障碍(HIV-1-associated neurocognitive disorder,HAND)[1]。HAND是HIV-1相关性神经退行性疾病,目前没有有效治疗HAND的方法,其发生机制是全球病毒学和神经科学界共同关注的热点。对HIV-1脑部感染引起认知功能障碍的具体机制虽然仍不明确,但学术界较为公认的一种学说认为, HIV-1感染和免疫激活的单核细胞分泌一系列的神经毒素,包括来源细胞的因子(如炎性细胞因子,趋化因子、兴奋性氨基酸等)和来源于HIV病毒因子(gp120,tat等),这些毒素是导致神经元损伤并诱发HAND的致病因子[2]。在这些分泌的趋化因子中有一类叫CC趋化因子家族,功能上被称为单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1),MCP-1能选择性的募集单核细胞和巨噬细胞到炎症病灶[3]。在HIV-1感染者的的脑脊液中MCP-1的水平明显高于正常人,确定MCP-1在促进艾滋性脑炎(HIVE)和艾滋性认知功能障碍(HAND)发生发展中起着极其关键的作用[4]。然而,在HIV-1感染的大脑内,MCP-1介导的神经损伤是如何导致HAND发病的机制仍然还不得而知。此外NMDA受体在与学习记忆关系密切的大脑海马CA1区分布丰富,在神经退行性疾病发生过程中也起重要作用。因此,为研究MCP-1是否通过作用于海马CA1区神经元NMDA受体,引发兴奋性神经毒性而导致神经损伤和认知功能障碍,我们应用全细胞膜片钳技术,研究MCP-1对大鼠海马CA1区锥体神经元NMDA受体及其受体亚型NR2B的兴奋性突触后电流的影响,以探讨相关受体拮抗剂对HAND患者神经保护作用的可能机制。
1 材料与方法
1.1溶液和试剂实验液体配方:人工脑脊液ACSF(in mmol·L-1):NaCl 124.0,KCl 3.0,CaCl22.0,MgCl22.0,NaH2PO41.25,NaHCO326.0,D-glucose 10.0,pH=7.4;电极内液(in mmol·L-1):K-gluconate 130.0,K-methysulphate 17.5, NaCl 8.0, HEPES 10.0,Mg-ATP 2.0,Na-GTP 0.2, EGTA 0.1,电极内液用KOH调节pH值在7.25~7.35范围内,渗透压在292~308 mOsm范围内。MCP-1(R&D Systems, Minneapolis, MN),Picrotoxin,CNQX,APV,D-CPP,ifenprodil,RS102895。印防己毒素和 RS102895溶解于二甲基亚砜(DMSO),并且使DMSO的浓度在ACSF溶液中的终浓度小于或等于0.1%。MCP-1、 CNQX、APV、D-CPP和ifenprodil用去离子水稀释1000倍配成母液,每次实验前先稀释于ACSF后立即使用。药物通过灌流系统到达海马脑片表面的时间约10 min。所用的药物均购于美国Sigma-Aldrich 公司,另有说明的除外。
1.2海马脑片制备选用3~4周的健康♂ Waster大鼠,用乌拉坦(1.5 g·kg-1,ip)腹腔注射,快速断头,在冰面上分离出全脑,用刀片修块,将海马区全脑粘于切片机的载物台上,置于装有-4℃人工脑脊液冰水混合物(以95% O2和5% CO2混合气体饱和)的切片槽中,用震动切片机横状面切出400 μm厚度的海马脑片。随后将脑片转至33℃的恒温孵育槽中孵育至少1 h,然后置于室温条件(22~25)℃下继续孵育。孵育槽中仍以95% O2和5% CO2混合气体饱和人工脑脊液。
1.3电生理记录所有实验均在室温下进行,脑片移至记录槽中,通过蠕动泵持续灌注以95% O2和5% CO2混合气体饱和的ACSF。利用拉制仪(SUTTER-P97,USA)将硅硼酸玻璃管(外径1.5 mm,内径0.84 mm,World Precision Instruments Inc,USA)拉制成实验用记录电极,电极电阻为4~8 Ω,实验用MCP-1(2.3 nmol·L-1)经过细胞外浴液途径给药。Master-8可编程刺激器(A.M.P.I,Israel)连接刺激电极(FHC,USA),刺激Schaffer侧枝/联合纤维(刺激参数:频率0.05 Hz,波宽0.02 ms,30~100 μA)。记录EPSCs时先以50 μmol·L-1Picrotoxin(GABA受体非竞争性受体拮抗剂)预孵脑片20 min。全细胞记录采用Axopatcp00B(Axon Instrument,USA)放大器,电刺激脉冲的给出及电信号的采集均通过计算机程序Clampex 8.0及Digidata 1440A接口来完成。
1.4微管相关蛋白-2(MAP-2)抗体免疫组化染色将海马脑片(厚400 μm)分为5组,各组海马脑片均在常温下(22~25)℃以下列含各组干预药的ACSF液孵育6 h,干预药分别为:正常的ACSF液为对照组,含 2.3 nmol·L-1MCP-1(MCP-1组),2.3 nmol·L-1MCP-1和10 μmol·L-1CNQX(MCP-1+CNQX组),2.3 nmol·L-1MCP-1和50 μmol·L-1APV(MCP-1+APV组),2.3 nmol·L-1MCP-1和10 μmol·L-1RS102895(MCP-1+ RS102895组),在室温下孵育6 h,在此过程中用混合气体(95% O2和5% CO2)持续充氧,以维持孵育液的pH在7.4~7.5。然后取出脑片,用4%的多聚甲醛浸泡固定24 h,15%的蔗糖,30%的蔗糖过夜,取出脑片在干冰上用OCT包埋,-80℃保存。冰冻切片机的温度调至-25℃~-20℃,切片前从-80℃冰箱取出含脑片的样本,置于切片机内至少30 min以平衡温度,然后将样本切为30 μm厚的脑片。一抗用兔抗小鼠微管相关蛋白-2(MAP-2; Chemicon, Temecula, CA)抗体按1 ∶100稀释,二抗为羊抗兔IgG(invitrogen, Molecular probes)。抗体按1 ∶500稀释。应用图像分析系统(Leica Qwin,GER ),每张切片所测面积大于50%海马CA1区,应用Qwin软件测量荧光强度灰度值,同时测定该切片胼胝体的灰度值作为背景,取测定值减去背景测定值的绝对值即实际灰度值,以避免非特异性染色所造成的误差。取3次平均值作为该例样本测定值。再以该组样本的均值作为该组的实验结果,所有灰度值测量均在相同光学条件下完成。

2 结果
2.1MCP-1 增强海马脑片CA1区NMDA受体和AMPA受体介导的兴奋性突触后电流全细胞记录形成后,把神经元钳制在-70 mV,通过刺激CA1区Schaffer侧枝/联合纤维引出CA1区锥体细胞EPSCs。在CA1区锥体神经元细胞记录基础受体介导的兴奋性突触后电流EPSCs(baseline EPSCs)10 min,灌流MCP-1(2.3 nmol·L-1)后,神经元EPSCs的幅度较给药前明显增加到(194.82±13.05)%(Fig 1A, D ;n=17,P<0.05)。由于海马兴奋性突触传递主要是通过NMDA受体和 AMPA受体介导的,为了记录NMDA受体介导的EPSCs,全细胞记录形成后,将神经元膜钳制在-50 mV并用低 Mg2+(0.5 mmol·L-1) ACSF的灌流,灌流液加中10 μmol·L-1CNQX 和1 μmol·L-1甘氨酸。MCP-1灌流后,NMDA受体介导的兴奋性突触后电流EPSCNMDAR增加到 (155.60±22.12)%(Fig 1B,D;n=13,P<0.05)。在记录 AMPA受体介导的EPSCs时,将膜电位钳制在-70 mV并在灌流液中加入50 μmol·L-1APV,记录到EPSCAMPAR较给药之前记录到的基础值提高了(142.35±15.57)%(Fig 1C,D;n=9,P<0.05) 。实验结果表明,MCP-1既能增加EPSCAMPAR也能增加EPSCNMDAR,且对EPSCNMDAR的增强作用比对EPSCAMPAR的增强作用更明显。
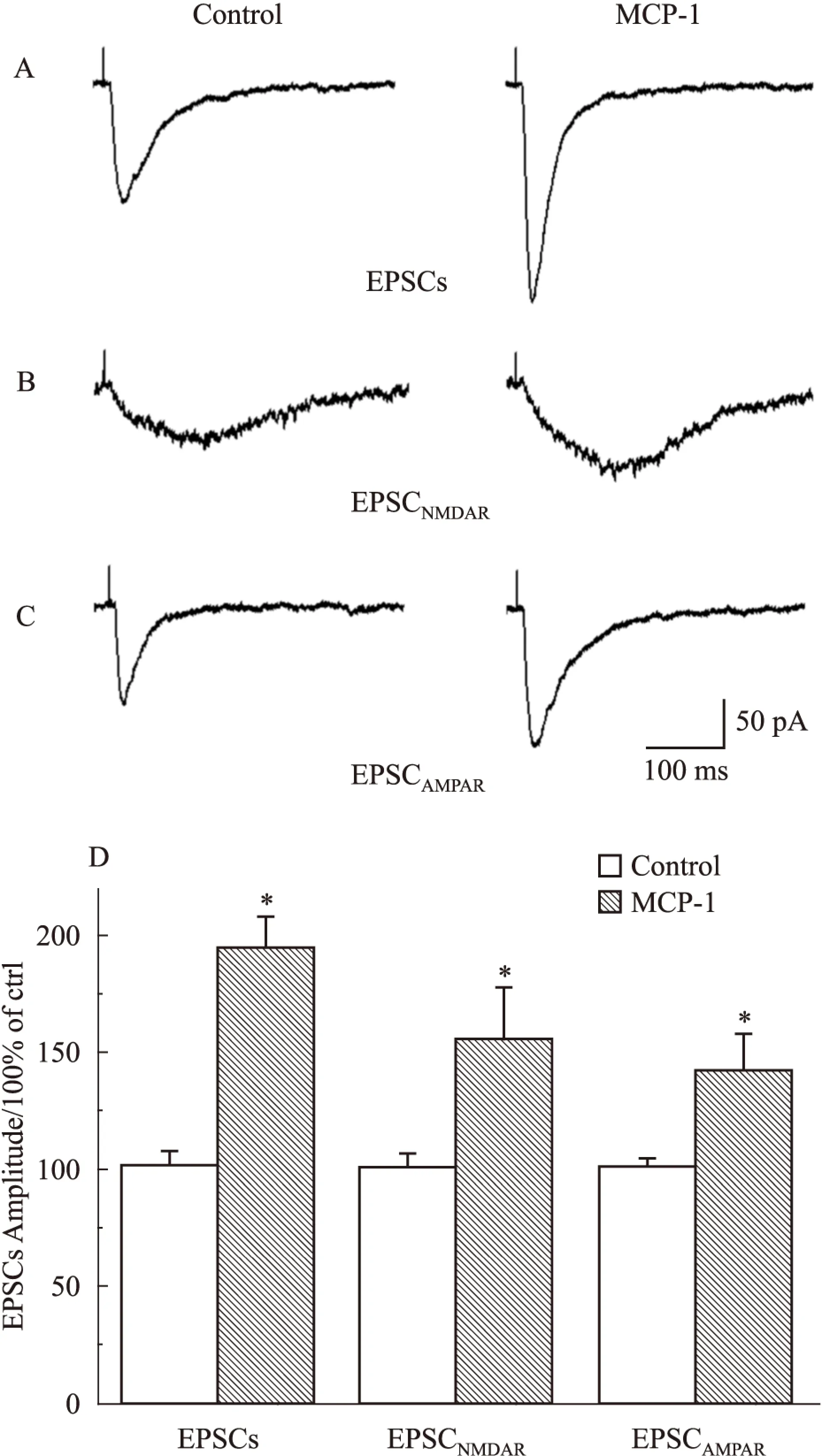
Fig 1 MCP-1(2.3 nmol·L-1) increased both NMDAR-and AMPAR-mediated EPSCs
A: Before and after the MCP-1(2.3 nmol·L-1) perfusion measured EPSCs actual waveforms. B: Isolation of EPSCsNMDARwas achieved with the addition of AMPA/kainate receptor antagonist CNQX(10 μmol·L-1, Sigma)to low Mg2+(0.5 mmol·L-1) ACSF. The left traces shown are averaged responses of 10 evoked EPSCs.C: Isolation of EPSCAMPARwas achieved with the addition of NMDA receptor antagonist AP-V(50 μmol·L-1, Sigma)to normal ACSF.D: MCP-1(2.3 nmol·L-1)significantly enhanced the amplitude of EPSCs [from control level to (194.82±13.05)% of control level,P<0.05,n=17], EPSCAMPAR[from control level to (142.35±15.57)% of control level,P<0.05,n=9] and EPSCNMDAR[from control level to (155.60±22.12)% of control level,*P<0.05,n=13].*P<0.05vscontrol
2.2MCP-1增强海马脑片CA1区锥体神经元NMDA亚基NR2B受体介导的兴奋性突触后电流NMDA受体的激活和很多病理生理过程有关,脑组织中表达的NMDA受体主要有NR2A和NR2B受体2种亚型[5]。NR2B受体是在大脑海马组织中有丰富表达的NMDA受体亚型,与NR2A受体在中枢神经系统中扮演神经元保护作用的角色不同,NR2B受体大部分表达在突触外,有研究显示[6],其主要作用是引发神经元损伤。因此,我们进一步研究MCP-1对大鼠海马脑片CA1区NR2B受体介导的兴奋性突触后电流EPSCNR2BR的影响,以探讨MCP-1是否通过改变NR2B受体功能介导神经损伤,并最终导致艾滋性认知功能障碍症状。我们在ACSF灌流液中加入CNQX(10 μmol·L-1),并使用低 Mg2+(0.5 mmol·L-1)液,以阻断EPSCAMPAR获得EPSCNMDAR,再在灌流液中加入D-CPP(1 μmol·L-1, 阻断EPSCNR2AR)得到EPSCNR2BR。实验结果表明,MCP-1能增加 EPSCNR2BR幅度到(137.19±12.09)%(Fig 2B;P<0.05,n=12),冲洗掉MCP-1后上述电流可恢复到接近给药前基础值,说明MCP-1对EPSCNR2BR的易化和促进作用是可逆的,且此电流可被NR2B受体拮抗剂ifenprodil(10 μmol·L-1)阻断,电流幅值减少到(27.65±2.73)%(Fig 2A,P<0.05,n=12),证实其为NR2B受体介导电流。
2.3NMDA、AMPA受体拮抗剂或CCR2受体拮抗剂对MCP-1诱发的大鼠海马CA1区的神经损伤有保护作用上述的结果表明,MCP-1可能参与CA3和CA1区之间锥体神经元的兴奋性突触传递。因此,我们再用MAP-2免疫组化染色来评价MCP-1是否改变神经元的形态结构,导致神经细胞兴奋性毒性。我们发现MCP-1(2.3 nmol·L-1) ,干预组与对照组孵育的海马脑片CA1区锥体神经元轴突MAP-2染色荧光强度显现出很大的差异:对照组的轴突荧光强度为(100.2±2.3)%,而MCP-1组轴突荧光强度明显下降到(43.2±3.0)%的强度。而3个拮抗剂保护组MCP-1 & CNQX、MCP-1 & AP-V、 MCP-1 & RS102895的轴突荧光强度较MCP-1组明显上升,分别为(77.5±2.5)%、(81.1±2.4)%、(93.8±1.9)%。因此,在海马脑片上所做的MAP-2免疫组化染色的实验结果显示,MCP-1对神经元轴突结构有损害作用,该作用可被NMDA和AMPA受体拮抗剂或CCR2受体拮抗剂逆转。在这3种拮抗剂中,NMDA受体拮抗剂APV和CCR2受体拮抗剂RS102895对海马神经元轴突结构的保护作用较AMPA受体拮抗剂CNQX更明显。
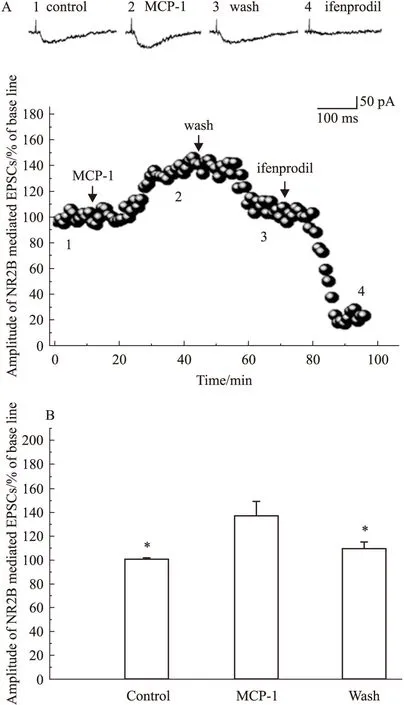
Fig 2 MCP-1(2.3 nmol·L-1) enhanced EPSCNR2BR
A: Figure A is the measured actual EPSCs current waveform; 1: The basis of the measured values of the isolated EPSCNR2BR. 2: MCP-1 perfusion measured EPSCNR2BRamplitude. 3: With CNQX(10 μmol·L-1), D-CPP(1 μmol·L-1) low Mg2+(0.5 mmol·L-1) in ACSF.After MCP-1 eluting, EPSCNR2BRamplitude falls close to the baseline values. 4: EPSCNR2BRcan be blocked by NR2B receptor antagonist ifenprodil, confirmed that the NR2B receptor-mediated currents. B: Panel B is a bar graph exhibiting the average amplitudes of EPSCNR2BRbefore (Control), during (MCP-1) and post (Wash) bath application of MCP-1. All experiments were carried out in the presence of CNQX (10 μmol·L-1) in the perfusate and the cells were voltage clamped at -50 mV.*P< 0.05vsMCP-1 .
3 讨论
MCP-1是CC趋化因子家族中研究最多的趋化因子,有研究表明[7],从HIV-1感染和免疫激活的培养巨噬细胞收集到的上清液能明显增加大鼠海马脑片的EPSCs,说明此种上清液所含有害分泌物和艾滋性脑病之间存在联系。在HIV-1感染和免疫激活的单核细胞(MP)分泌的一系列神经毒中,MCP-1也是重要成分之一,MCP-1能通过趋化作用选择性地调控MP、淋巴细胞等多种白细胞亚群募集和运输[8]。在HIV-1病毒感染的初期,HIV-1感染的MP就随血液从脑外部通过血脑屏障进入脑组织,并将HIV-1病毒带入脑组织,这是HAND/HAD发病的首要环节,而MCP-1在趋化和调控MP进入脑组织的过程中发挥了重要作用,MCP-1及其主要受体CCR2是诱导MP移动的主要趋化因素[9]。有研究证明,在HIV-1感染者脑脊液(CSF)中MCP-1的水平明显高于正常人[4],而且对MCP-1亲和力极高的受体CCR2的数量也在HIV-1病毒感染后明显上调。因此,MCP-1在促进HAND/HAD发生发展的过程中极其关键,研究MCP-1如何介导神经损伤对探讨HAND发病的机制有重要意义。为此,我们应用全细胞膜片钳技术,测定了MCP-1对大鼠海马CA1区锥体神经元AMPA受体、NMDA受体及NMDA亚型NR2B受体的兴奋性突触后电流的影响,并研究了相关受体拮抗剂对海马CA1区神经元的保护作用。
我们的前期研究发现,0.023、0.23、2.3 nmol·L-1的MCP-1能浓度依赖性增加大鼠海马CA1区神经元EPSCs,其中2.3 nmol·L-1MCP-1的作用最明显[10]。在本实验中,我们用作用最明显的浓度2.3 nmol·L-1MCP-1测定对大鼠海马CA1区兴奋性突触后电流的影响,发现MCP-1既能增加NMDA受体,又能增加AMPA受体介导的EPSCs,这些结果和Gao等[11]在其它的“MCP-1能增加孤立脊髓切片NMDA和AMPA受体介导的电流研究”中相类似。我们的数据表明,灌流MCP-1后,增加NMDA受体介导的EPSCs的幅度要比AMPA受体介导的电流幅度更明显,说明NMDA受体在MCP-1导致增强中枢神经兴奋性方面发挥更重要的作用(Fig 1)。
上述的实验结果证明, NMDA受体与AMPA受体相比在神经突触功能和兴奋性神经毒性方面发挥着更重要的作用。大量的研究表明[12],在HIV-1病毒感染的脑内期间,NMDA受体参与单核巨噬细胞介导神经毒性。被HIV-1感染的脑部发现,通过过度刺激谷氨酸亚型NMDA释放神经毒素将导致神经变性, NMDA受体拮抗剂被发现能减轻HIV-1感染或gp120刺激的巨噬细胞和小胶质细胞导致的细胞内、外的神经元损伤。新型益脑双连体[Bis(n)-Cognition]也通过抑制NMDA受体及nNOS ,阻断神经兴奋性毒性的方式来改善学习记忆能力、在体对抗神经细胞凋亡等作用[13]。 NR2A受体和NR2B受体是NMDA受体在海马表达较丰富的亚单位,这两个受体亚型在中枢神经系统中扮演着不同的角色[14]:NR2A受体多在突触上发挥着谷氨酸介导的神经元的存活,而NR2B受体在突触外,主要激活神经元的凋亡。有研究显示[15],从HIV-1感染的单核细胞源性巨噬细胞(MDM)分泌因子能激活NR2B受体,而MCP-1是该分泌物组成部分中最主要的成分。我们的实验结果证明,MCP-1可过度激活NMDA受体及其亚型NR2B受体介导的EPSCs(Fig 2),在谷氨酸介导的神经元兴奋性毒性作用方面发挥明显作用。因此,MCP-1可能通过激活NMDA受体,尤其是其亚型NR2B受体产生兴奋性神经毒作用而介导神经损伤。


为了研究MCP-1是否对与学习记忆密切相关的大脑海马区域神经细胞有损伤作用,我们以大鼠海马脑片完成了MAP-2 免疫组化染色实验。实验结果显示,2.3 nmol·L-1的MCP-1使海马CA1区的神经元轴突荧光强度明显下降,说明MCP-1对海马CA1区神经元有严重损伤(Fig 3)。该损伤作用可被NMDA、AMPA受体拮抗剂或CCR2拮抗剂逆转,其中NMDA受体拮抗剂APV和CCR2拮抗剂RS102895对海马神经元轴突结构的保护作用较AMPA受体拮抗剂CNQX更明显,揭示这两种拮抗剂对MCP-1诱导的神经突触损伤更具保护作用,这可为治疗HIV相关脑损伤提供潜在的治疗方法。
总之,我们的实验证明,大剂量MCP-1能明显增加海马CA1区兴奋性突触活动,这种增强作用与AMPA受体、 NMDA受体尤其是NMDA亚型受体NR2BR的介导有关。此外,观察MAP-2免疫组化染色实验中MCP-1对海马脑片神经元的损伤作用进一步证实MCP-1对与学习记忆相关脑区域产生病理作用,这为揭示HAND等HIV-1相关脑疾病的发生机制提供一种可能联系。我们的研究结果还表明,MCP-1诱导的神经元损伤可以通过AMPA受体拮抗剂、尤其是NMDA受体和CCR2受体拮抗剂减弱,提示这些拮抗剂将提供HAND等HIV-1相关脑疾病的有价值的潜在治疗方法,因此NMDA受体和CCR2受体拮抗剂作为神经保护药物很可能有益于改善HAND患者的认知功能障碍。
[1]Antinori A, Arendt G, Becker J T, et al. Updated research nosology for HIV-associated neurocognitive disorders[J].Neurology, 2007,69(18): 1789-99.
[2]Aquaro S, Ronga L, Pollicita M, et al. Human immunodeficiency virus infection and acquired immunodeficiency syndrome dementia complex: role of cells of monocyte-macrophage lineage[J].JNeurovirol, 2005,11(3):58-66.
[3]Carvallo L, Lopez L, Che F Y, et al. Buprenorphine decreases the CCl2mediated chemotactic response of monocytes[J].JImmunol,2015,194(7): 3246-58.
[4]Dhillon N K, Williams R, Callen S, et al. Roles of MCP-1 in development of HIV-dementia[J].FrontBiosci, 2008,13:3913-18.
[5]Liu Y, Wong T P, Aarts M,et al.NMDA receptor subunits have differential roles in mediating excitotoxic neuronal death bothinvitroandinvivo[J].JNeurosci,2007,27(11):2846-57.
[6]Thomas C G, Miller A J, Westbrook G L.Synaptic and extrasynaptic NMDA receptor NR2 subunits in cultured hippocampal neurons[J].JNeuropysiol,2006,95(3):1727-34.
[7]Yang J, Hu D J,Xia J,et al.Enhancement of NMDA receptor-mediated excitatory postsynaptic currents by gp120-treated macrophages: implications for HIV-1-associated neuropathology[J].JNeuroimmunePharmacol,2013,8(4):921-33.
[8]Spitsin S,Stevens K E,Douglas S D. Expression of substance P, neurokinin-1 receptor and immune markers in the brains of individuals with HIV-associated neuropathology[J].JNeurolSci,2013,334(1-2): 18-23.
[9]Deshmane S L, Kremlev S, Amini S,Sawaya B E .Monocyte chemoattractant protein-1(MCP-1): an overview[J].JInterferonCytokineRes,2009,29(6): 313-26.
[10]Zhou Y, Tang H M,Liu J N,et al, Chemokine CCL2 modulation of neuronal excitability and synaptic transmission in rat hippocampal slice[J].JNeurochem,2011,116(3): 406-14.
[11]Gao Y J, Zhang L, Samad O A, et al.JNK-induced MCP-1 production in spinal cord astrocytes contributes to central sensitization and neuropathic pain[J].JNeurosci,2009, 29(13): 4096-108.
[12]Alirezaei M , Watry D D, Flynn C F, et al.Human immunodeficiency virus-1/surface glycoprotein 120 induces apoptosis through RNA-activated protein kinase signaling in neurons[J].JNeurosci,2007, 27(41): 11047-55.
[13]苏玮,朱龙军,许大平,等.新型益脑双联体防治阿尔采末病作用及机制研究进展[J].中国药理学通报,2014,30(9):1201-5.
[13]Su W, Zhu L J, Xu D P, et al.Research progress in characterizing multiple-target mechanisms of novel anti-Alzheimer’s dimers[J].ChinPharmacolBull, 2014,30(9):1201-5.
[14]Fan J, Vasuta O C, Zhang L Y, et al.N-methyl-D-aspartate receptor subunit-and neuronal-type dependence of excitotoxic signaling through post-synaptic density 95[J].JNeurochem,2010, 115(4): 1045-56.
[15]Xiong H, McCabe L, Skifter D, et al.Activation of NR1a/NR2B receptors by monocyte-derived macrophage secretory products: implications for human immunodeficiency virus type one-associated dementia[J].NeurosciLett,2003, 341(3): 246-50.
Effects of chemokine MCP-1 on NMDA-mediated exciatory postsynaptic current in hippocampal slice of rats
LI Shan1, HU Zhe1,ZHOU Yan1,XIONG Huan-gui2
(1.PharmaceuticalCollegeofGuangxiMedicalUniversity,Nanning530021,China;2.DepartmentofPharmacologyandExperimentalNeuroscience,UniversityofNebraskaMedicalCenter,OmahaNE68198-5880,USA)
AimTo explore how MCP-1 induces neurodisorder by determing the effects of MCP-1 on excitatory postsynaptic current(EPSCs) in the CA1 region of rat hippocampal brain slices.MethodsEPSCs, the AMPA receptor-mediated EPSC(EPSCAMPAR), NMDA receptor mediated EPSCs(EPSCNMDAR) and NR2BR receptor-mediated EPSC(EPSCNR2BR) were recorded using whole-cell patch recording techniques to observe the effects of 2.3 nmol·L-1MCP-1 on pyramidal neurons in hippocampal CA1 region. Microtubule-associated protein-2(MAP-2) staining was used to study whether MCP-1 induced dendritic injuries in hippocampal CA1 region and whether NMDAR, AMPAR or CCR2 receptor antagonists had protective effects against dendritic damage caused by MCP-1.Results① Bath application of MCP-1 produced a significant enhancement of the amplitudes of EPSCs, EPSCAMPARand EPSCNMDAR. ② Further studies revealed that MCP-1 potentiated EPSCNR2BR; ③ The MCP-1-associated dendritic injuries were blocked by NMDAR,AMPAR and CCR2R antagonists respectively.ConclusionsOur results suggest a potential role of MCP-1 which may play in neuroexcitotoxicity and neural injury via NMDA receptor(especially NMDAR subtype NR2BR) and CCR2 receptor. The antagonists of these receptors may have potential therapeutic effect for neurodegeneration.
chemokine; MCP-1; hippocampal slices; EPSCs; neuroexcitoxicity;HAND
2016-02-15,
2016-04-10
国家自然科学基金课题(No 81360192);广西自然科学基金(No 2012GXNSFCA053004);广西教育厅高等学校资助科研项目(No 201203YB041)
李珊(1989-),女,硕士生,研究方向:药理学,E-mail:leeshandeai@sina.com;周燕(1975-),女,博士,副教授,硕士生导师,研究方向:神经药理学,通讯作者,E-mail:yanzhou_412@sina.com
10.3969/j.issn.1001-1978.2016.07.013
A
1001-1978(2016)07-0950-06
R-332;R322.81;R338.13;R392.11;R392.12;R512.91;R742
网络出版时间:2016-6-20 11:49网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160620.1149.026.html