外来种粗毛牛膝菊在秦巴山区的种群发展动态
2016-08-09张璐璐孔彬彬卫欣华朱志红
刘 刚,张璐璐,孔彬彬,卫欣华,朱志红
陕西师范大学生命科学学院, 西安 710119
外来种粗毛牛膝菊在秦巴山区的种群发展动态
刘刚,张璐璐,孔彬彬,卫欣华,朱志红*
陕西师范大学生命科学学院, 西安710119
摘要:外来种能否成功入侵新生境取决于其自身入侵特性(快速生长、足够的繁殖体压力等)和环境因子的作用。原产于热带美洲的粗毛牛膝菊(Galinsoga quadriradiata Ruiz & pav.)在秦巴山区呈现快速爆发趋势,但其种群发展动态尚不明确。通过监测实验和野外调查,对粗毛牛膝菊种群动态和其对入侵地环境选择的偏好性规律进行了研究。在4块样地中开展的监测研究显示,粗毛牛膝菊种群密度最高可达300 株/m2,单株平均种子产量达675粒,单位面积的种子产量达45619 株/m2,说明其在研究地区已能够产生较大规模的稳定增长的种群,可为种群爆发提供较高的繁殖体压力;其种群密度随着时间呈逻辑斯蒂型下降趋势,且在向繁殖阶段过渡期间个体死亡率最高,暗示着种群可能存在负密度制约效应;对秦巴山区30个野外样地的调查研究显示,粗毛牛膝菊主要入侵农田、撂荒地、路边等受到过人为活动干扰的生境;其在群落中出现的频度与土壤紧实度显著正相关,而与坡度显著负相关,表现出对入侵地环境因子的偏好性。调查结果说明,在这些干扰生境中,粗毛牛膝菊种群更容易在土壤紧实度高、坡度小的地段建立,这将为进一步预测其入侵趋势提供依据。
关键词:生物入侵;繁殖体压力;负密度制约效应;环境因子;粗毛牛膝菊
生物入侵会给入侵地的生态系统造成严重损失,有关外来入侵种的研究是当代生态学研究的重要方向。入侵种之所以能够在新生境中入侵成功,一方面归因于其生物学特性,另一方面,也归因于入侵地的环境因子。大量研究显示,入侵种比本地种具有更强的生长、繁殖和扩散能力等[1- 2]。在个体水平上,入侵种个体的快速生长能力使其在与本地种的竞争中获得更高的竞争优势,这一特性主要得益于入侵种较高的光合效率、能量和资源利用效率[3- 4];入侵种通常能够产生大量种子,且种子质量往往较小,具有利于随风扩散的冠毛或翅,实现远距离扩散[5]。在种群层次上,由于阿利效应(Allee effect)的作用,入侵种的种群密度、种群的繁殖和扩散能力等决定了入侵种种群的扩张速度,密度越高的种群更容易持续地产生大量种子,也更容易稳定地入侵和占据本地生境[6- 7]。环境因子也在一定程度上影响着外来入侵种的入侵进程。大量研究表明,入侵种往往更容易在受到干扰或破坏的生境中入侵成功[8- 10]。一方面,入侵地的气候条件和土壤理化性质等决定着外来种能否入侵成功[11- 12]。另一方面,日益加剧的人为活动对自然生态系统的干扰也在一定程度上促进了外来种的成功入侵。例如,土地利用类型的改变导致的生境中可利用资源的增加和本地群落的结构的破坏往往会促进入侵的发生[10,12- 13]。
粗毛牛膝菊(GalinsogaquadriradiataRuiz & pav. 或G.ciliata(Raf.) S.F. Blake)为菊科牛膝菊属一年生草本植物,原产于中美洲和南美洲[14- 16],现已遍布全球大部分温带、暖温带和亚热带地区的撂荒地或农田,成为一种重要的农业入侵杂草[17]。其危害严重时,可以使入侵地农业减产50%左右[14]。该种在我国的文献记录最早出现在1979年版《中国植物志》,且仅见于江西庐山,少量生于路旁、林下和林缘[18]。有报道认为该种自20世纪中叶随园艺植物引入,1943年在四川成都采到标本[15]。在秦巴山区,粗毛牛膝菊遍布于海拔667—1982m的广大范围内,常形成单优群落[19]。前期的调查显示,该种在秦巴山区已经造成了广泛的入侵,并初现爆发趋势。秦岭是我国生物、地理和气候的南北分界线,在我国生物多样性保护工作中处于极其重要的地位。由于入侵种往往会显著降低入侵地的物种多样性[20],如果粗毛牛膝菊已具备在秦巴山区大范围入侵的特性,势必威胁到该地区的生物多样性保护。然而,目前有关该物种在中国的入侵研究报道较少,对于其生长、繁殖特性及其与环境因子的关系尚知之甚少。为此,提出以下科学问题:在秦巴山区粗毛牛膝菊的种群繁殖特性是否能够为其入侵提供足够的繁殖体压力?其种群大小与环境因子之间的关系如何?本研究旨在通过野外定位监测和调查,在种群层次上分析粗毛牛膝菊在秦巴山区的种群发展动态和繁殖力潜势,以及对入侵地非生物环境因子的偏好特点等,为进一步深入研究其入侵机理、预测其入侵动态和制定防控措施奠定基础。
1研究方法
1.1实验设计
本研究主要分为两个部分,一部分为野外定位监测,另一部分为野外路线调查。
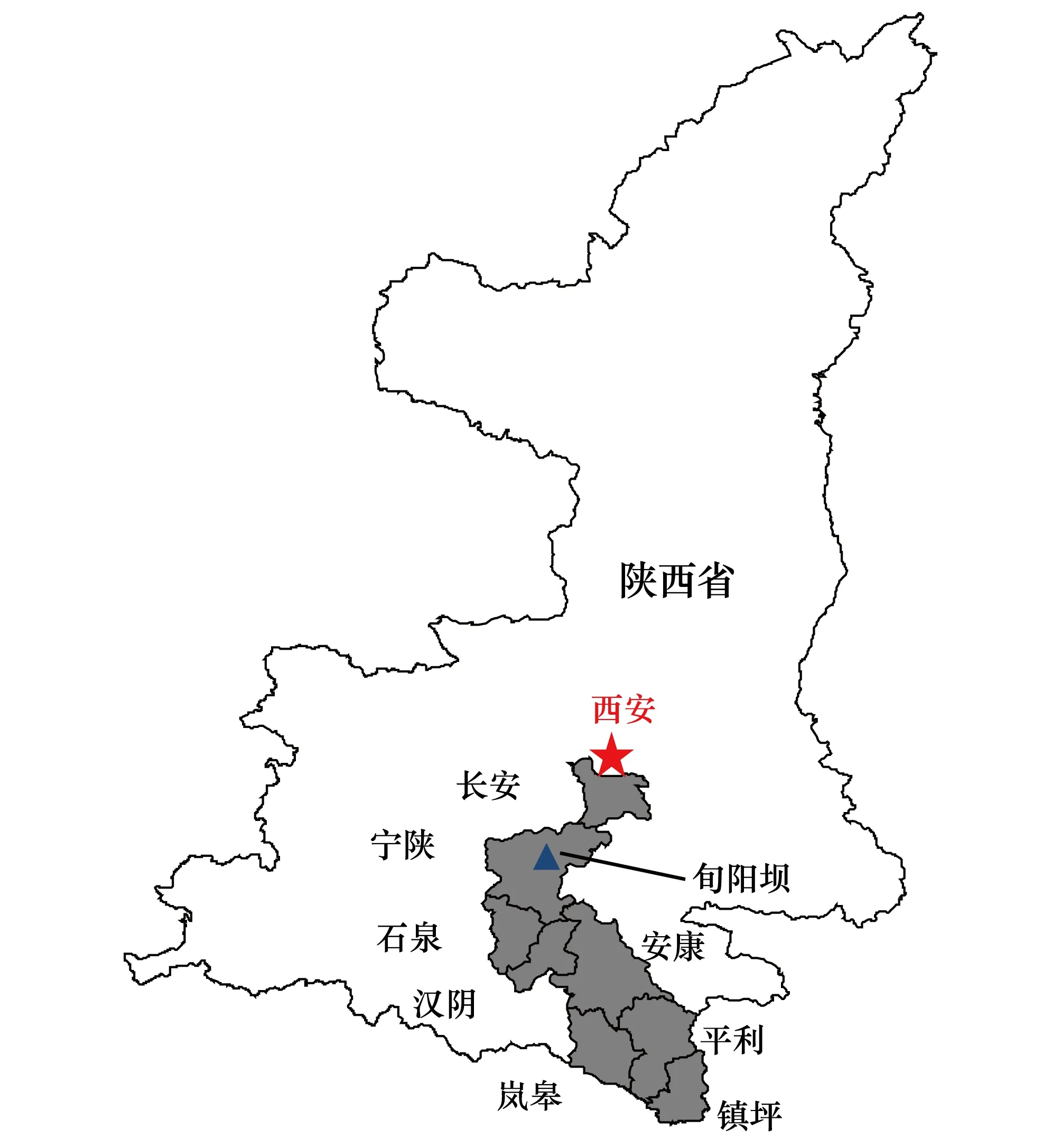
图1 野外定位监测研究和路线调查研究涵盖区域所在地理位置Fig.1 The location of the field experiment and sampling survey
野外定位监测研究在位于秦岭南坡中段的宁陕县旬阳坝镇进行(33°32′N,108°32′E,海拔1300—1700m)。该地区属于山地暖温带气候,植被类型为针叶落叶阔叶混交林(田陌等,2011)。粗毛牛膝菊目前在该地区的入侵生境主要为处于山间沟谷的农田和道路两侧,在林内极少。2014年5月初,在旬阳坝镇沿月河两侧的农田设置了4块监测样地,其生境分别为林缘四季豆+玉米套种地(样地1,面积14m×9m;海拔1350m;地点小茨沟口,平地)、林缘玉米地(样地2,面积17m×8m;海拔1345m;地点小茨沟口南200m,坡地)、林缘玉米+马铃薯套种地(样地3,面积16m×60m;海拔1392m;地点杏子沟口,坡地)和路边玉米地(样地4,面积17m×8m;海拔1428m;地点米家坪,平地)。4块样地的间距在200—500m不等。在每块样地中随机设置3个1m×1m的固定样方,从5月中旬至9月中旬,每隔10—15d记录各样方内粗毛牛膝菊个体株高(cm)、花序数、盖度(%)和密度(株/m2)等,并在每个样方邻近位置取1m×1m样方,连根挖出全部粗毛牛膝菊个体,洗净泥土,60℃烘72h,分别称量根系、茎叶和花序干重(g)。记录持续至全部粗毛牛膝菊自然死亡为止。在种子成熟后随机采集粗毛牛膝菊个体,记录每花序成熟种子数量。监测于2014年9月中旬结束,共计调查8次,涵盖了粗毛牛膝菊从幼苗期、开花期、结实期直至死亡的整个生长发育阶段。最后一次调查时,粗毛牛膝菊已完全枯死,因此样方调查数据仅包含前7个龄级。
野外路线调查于2014年7月18日至26日沿镇坪县—平利县—岚皋县—安康市—汉阴县—石泉县—宁陕县—西安市长安区一线进行(图1;表1),调查范围涵盖巴山和秦岭南北坡。在调查线路沿途两侧1km左右范围出现粗毛牛膝菊的地方随机选取调查样地,共设置30个样地(表1)。在每个调查样地设3个1m×1m样方,测定粗毛牛膝菊种群密度(株/m2)、株高等,并用样圆(0.1m2)在样地范围内随机抛掷50次测定其频度(%),同时记录样地海拔(m)、坡度(°)和经纬度等信息。用土壤紧实度仪SC- 900 (Spectrum Technologies Inc., USA) 测定每个样方5、10cm和15cm深的土壤紧实度(Pa)。
1.2数据分析
为考察粗毛牛膝菊种群在生长期内的数量变化动态,根据4块野外定位监测样地数据编制其种群动态生命表。生命表主要参数如下[21]:
x龄级,以8次调查的时间段划分为8个年龄阶段;
nx存活数,x期开始时的存活个体数;
lx存活率,x期开始时的存活率,lx=nx/n0;
dx死亡数,种群从x期到x+1期的死亡数,dx=nx/nx+1;
qx死亡率,种群从x期到x+1期的死亡率,qx=dx/nx;
kx致死力,种群在一个生活史时期的致死力,kx=lgnx-lgnx+1;
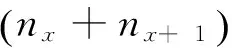
Tx存活个体总寿命,进入x期的全部个体在进入x期后的存活个体总年数,Tx=∑Lx;
ex生命期望或平均余年,种群中某一特定年龄的个体在未来所能存活的平均时长,ex=Tx/nx。
采用GLM-RMANOVA分析粗毛牛膝菊种群密度(株/m2)、单株生物量(g/株)、单株花序生物量(g)、株高(cm)、单株花序数量(个)和盖度(%)在入侵生境间的差异。分析时以监测次数为重复。多重比较采用最小显著差异法(LSD)。
采用线性回归分析路线调查中粗毛牛膝菊频度、密度和高度与环境因子(土壤紧实度、海拔和坡度)间的关系,以揭示粗毛牛膝菊偏好的入侵生境的环境因子特征。为了降低环境因子变量之间的共线性,先采用主成分分析(PCA)将获得的环境因子降维。在PCA分析结果中,筛选特征值不小于1的主成分作为线性回归分析的回归变量。PCA分析采用PC-ORD 5.0软件完成,GLM-RMANOVA和线性回归分析采用SPSS 16.0软件完成。
2结果与分析
2.1粗毛牛膝菊种群动态
时间序列的重复测量分析结果显示,以粗毛牛膝菊的6个主要生长指标分别作为考察变量时,均未通过球形检验(Mauchly′s Test of Sphericity)(表2)。经Greenhouse-Geisser矫正后的检验结果显示,龄级(Age)对6个主要生长指标均有极显著影响(P<0.001),即这6个主要生长指标均随着时间产生了显著变化(表3);由图2可见,粗毛牛膝菊种群密度随时间呈现先增加后降低趋势,单株生物量、花序生物量和株高则随时间呈增加趋势,单株花序数量和盖度也随时间呈先现增加后减少的趋势。样地因素对粗毛牛膝菊的单株花序生物量、株高、单株花序数量和盖度产生了极显著影响(表3),多重比较(LSD)结果见图2;而种群密度和单株生物量在样地之间并未出现显著差异。此外,龄级和样地两个因素对花序生物量、株高和盖度有显著的交互作用。
表2粗毛牛膝菊种群密度、单株生物量、单株花序生物量、株高、单株花序数量和盖度数据的球形检验结果
Table 2The Mauchly′s test of sphericity on density, biomass, inflorescence mass, height, no. of inflorescence, and coverage ofG.quadriradiata

参数Parameters种群密度Density/(株/m2)单株生物量Biomass/g单株花序生物量Inflorescencemass/(g/株)株高Height/cm单株花序数量No.ofinflorescence/(g/株)盖度Coverage/%Mauchly'sW<0.0010.0040.0030.001<0.0010.001df202020202020P0.024<0.001<0.0010.004<0.0010.009
表3粗毛牛膝菊种群密度、单株生物量、单株花序生物量、株高、单株花序数量和盖度在时间尺度上重复测量分析的Greenhouse-Geisser矫正检验结果
Table 3The GLM-RMANOVA analysis on density, biomass, inflorescence mass, height, no. of inflorescence, and coverage ofG.quadriradiata
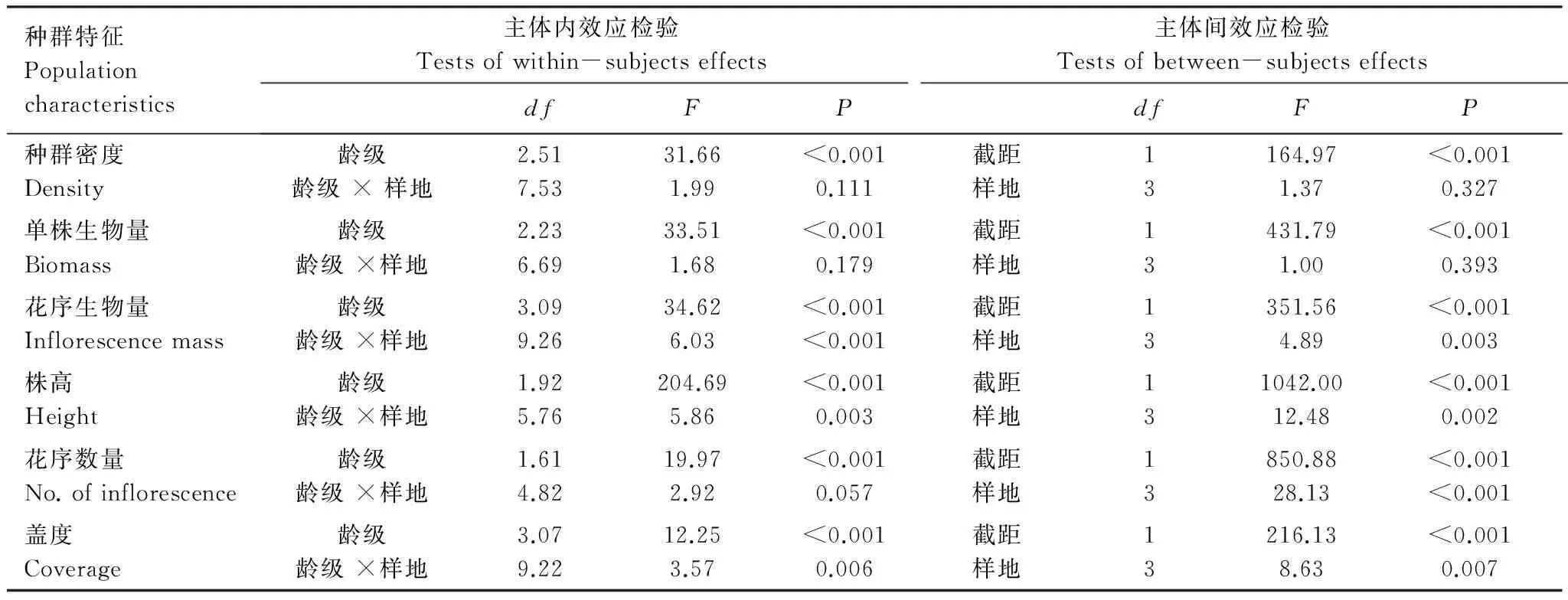
种群特征Populationcharacteristics主体内效应检验Testsofwithin-subjectseffects主体间效应检验Testsofbetween-subjectseffectsdfFPdfFP种群密度Density龄级龄级×样地2.517.5331.661.99<0.0010.111截距样地13164.971.37<0.0010.327单株生物量Biomass龄级龄级×样地2.236.6933.511.68<0.0010.179截距样地13431.791.00<0.0010.393花序生物量Inflorescencemass龄级龄级×样地3.099.2634.626.03<0.001<0.001截距样地13351.564.89<0.0010.003株高Height龄级龄级×样地1.925.76204.695.86<0.0010.003截距样地131042.0012.48<0.0010.002花序数量No.ofinflorescence龄级龄级×样地1.614.8219.972.92<0.0010.057截距样地13850.8828.13<0.001<0.001盖度Coverage龄级龄级×样地3.079.2212.253.57<0.0010.006截距样地13216.138.63<0.0010.007
种群动态生命表显示(表4),粗毛牛膝菊种群存活个体数量在第2龄级(即6月中旬)时达到最大,此后逐步降低,而个体死亡数则在3龄时达到最高,死亡率达57%。第4龄级时个体平均花序数量达到最大(图2),粗毛牛膝菊进入繁殖盛期,单株平均花序数达25个,最高可达309个。
粗毛牛膝菊种群存活个体密度在整个生长发育期内均维持在较高水平,并具有明显的波动性。在营养生长期间(1—3龄级)维持在100 株/m2以上,最高可达约300 株/m2,而进入繁殖期(4—7龄级)以后,其种群密度又降至100 株/m2以下(图2)。
对每花序成熟种子数量的调查显示,成熟之后,每花序平均产生27粒成熟种子,研究样地内粗毛牛膝菊单株平均可产生675粒成熟种子,最大可产生8343粒成熟种子。以第4龄级时的种群密度估算,该入侵种群经过单次生殖之后单位面积最大可产生成熟种子约45619 粒/m2。
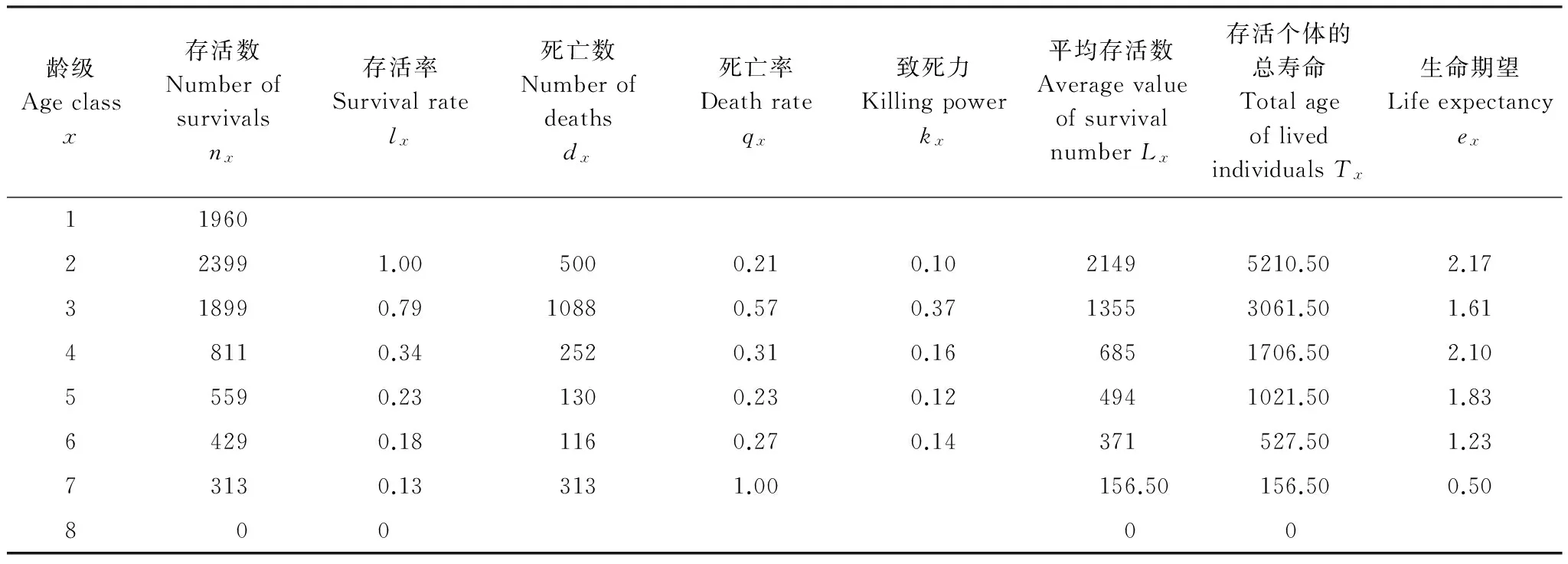
表4 粗毛牛膝菊种群动态生命表
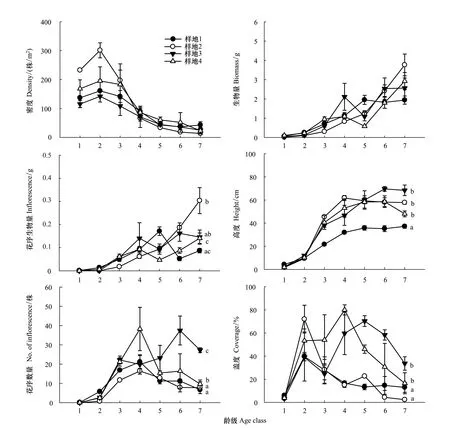
图2 粗毛牛膝菊种群密度、单株生物量、单株花序生物量、株高、单株花序数量和盖度随时间和样地的变异Fig.2 The variation of density, biomass, inflorescence mass, height, no. of inflorescence, and coverage of G. quadriradiata along time in each site在重复测量分析结果(表3)中,若样地的效应显著,通过LSD对比不同样地的粗毛牛膝菊在整个生长发育期间的差别;两两样地之间若无相同字母表示两者在α=0.05水平上差异显著;1—7龄级分别对应的调查时间为:2014年5月26日、6月10日、7月1日、7月18日、7月25日、8月14日和8月22日
2.2粗毛牛膝菊种群特征与入侵地主要环境因子间的相关性
野外线路调查结果显示,在秦巴山区粗毛牛膝菊入侵种群的平均密度为55 株/m2(±4.76 SE),个体平均高度为29.21 cm (±1.35 SE),出现频度平均值为55.87% (±3.47 SE)。通过线路调查发现,粗毛牛膝菊主要出现在农田、撂荒地、苗圃和路边等受到过人为活动干扰的生境中。在不同的生境类型之间,粗毛牛膝菊的出现频度和个体高度均没有显著差异(频度:F=0.50,df=3,P=0.69;高度:F=2.33,df=3,P=0.08);而其种群密度则差异显著(F=5.54,df=3,P=0.02)。苗圃中的粗毛牛膝菊种群密度最高,且显著高于农田和撂荒地的种群密度;四种类型生境中的粗毛牛膝菊种群密度均值由大到小依次为:苗圃>路边>农田>撂荒地(图3)。
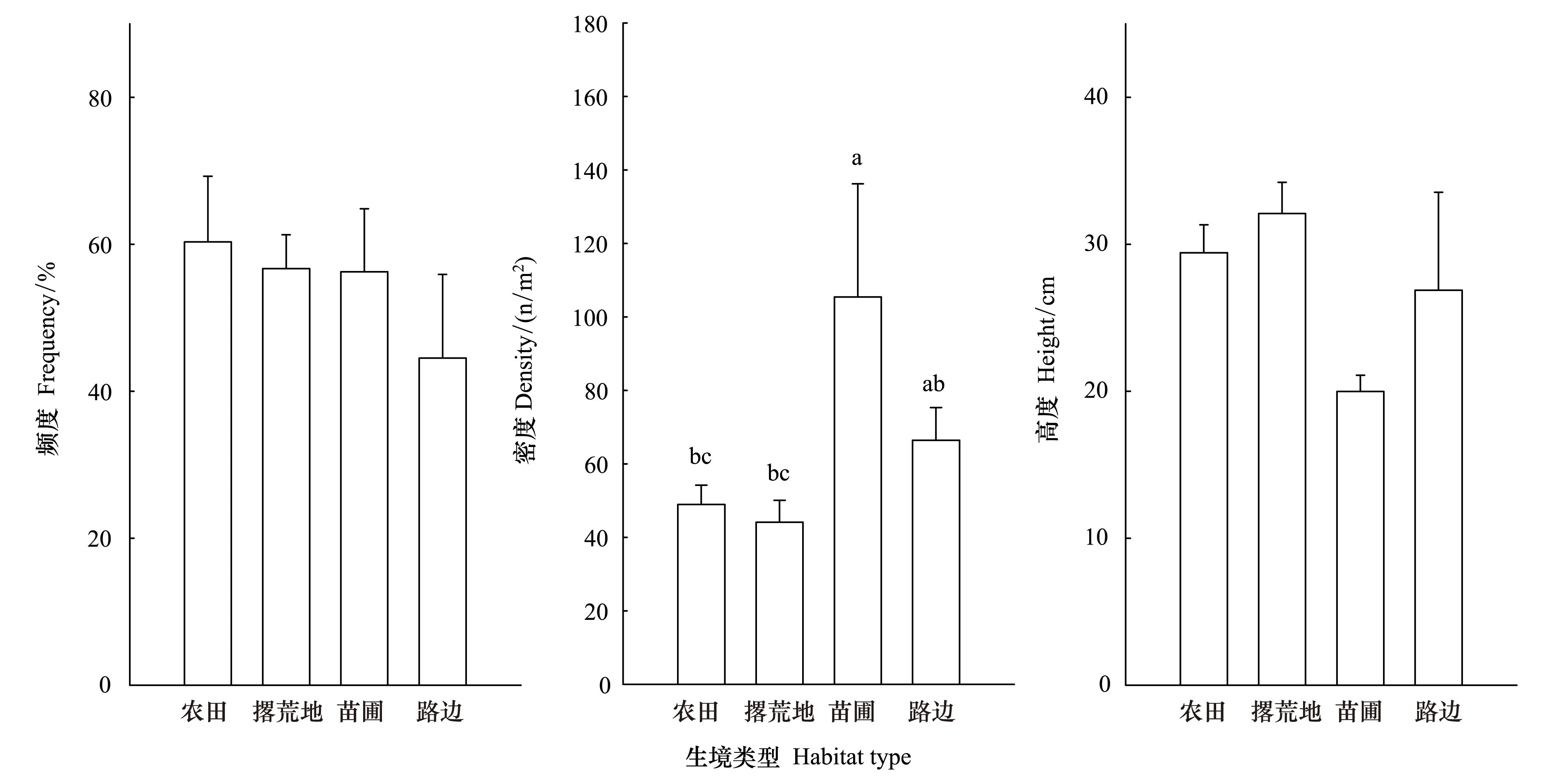
图3 粗毛牛膝菊在不同类型生境中的频度、密度和高度对比Fig.3 Comparisons on the traits (frequency, density, and height) of G. quadriradiata among different habitatsFarmland表示农田;Abandoned land表示撂荒地;Tree nursery表示苗圃;Road side表示路边;两两生境类型之间若无相同字母表示两者在α=0.05水平上差异显著
PCA分析结果显示,前两个主成分PC1和PC2的特征值不小于1,两者对环境因子变化引起的种群变异的解释量分别为44.25%和20.45%,累计解释量达64.69%(表5)。PC1主要与土壤紧实度(SDen)变化有关,且呈负相关关系;PC2主要与坡度因子有关,表现出与坡度负相关的特点(图4)。
线性回归分析结果显示(图5),粗毛牛膝菊种群频度与PC1显著负相关,与PC2显著正相关,即粗毛牛膝菊的出现频度随着土壤紧实度增大而增高,随着坡度增大而降低;种群密度仅与PC2之间显著正相关,与PC1之间无相关性,即粗毛牛膝菊种群密度随着坡度增大而降低,且不受土壤紧实度影响;个体平均高度仅与PC1之间显著负相关,与PC2之间无显著线性相关,即粗毛牛膝菊株高随着土壤紧实度增大而增高。

表5 粗毛牛膝菊所在群落的非生物环境因子PCA各主成分贡献率
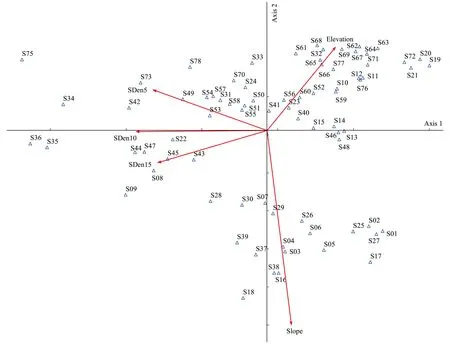
图4 粗毛牛膝菊所在群落的非生物环境因子的PCA分析图Fig.4 The PCA result of environmental factors of the habitats invaded by G. quadriradiataSDen5、SDen10和SDen15分别表示5、10和15cm深度的土壤紧实度(Pa);Slope表示坡度(°);Elevation表示海拔高度(m)
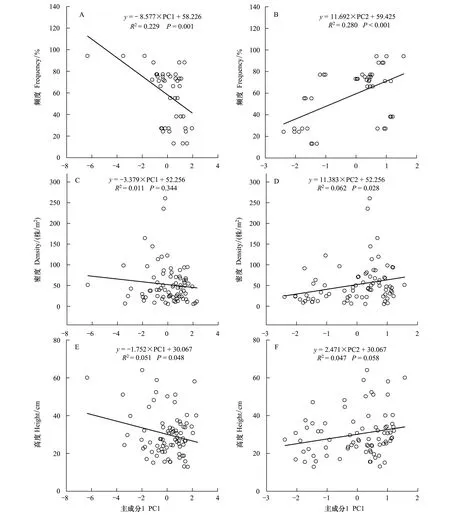
图5 粗毛牛膝菊在群落中的出现频度、密度和株高与环境因子的两个主成分之间的线性关系Fig.5 The linear relation between each of the first principal components and frequency, density, and height of G. quadriradiata
3讨论
繁殖体压力假说认为,入侵种在新生境中的入侵成功几率随着到达该生境的繁殖体数量增加而增大[22- 23]。大量研究结果证实了入侵种通过大量繁殖以维持其在入侵地较高的繁殖体压力,从而促进入侵种群稳定增长和快速扩散[6]。粗毛牛膝菊在秦巴山区的入侵种群密度大、单次生殖繁殖量大,调查样地内每平方米的粗毛牛膝菊单优群落单次生殖产生的成熟种子量可高达约45619粒。该种在北美洲的入侵种群的单株最高产生花序数可达3000个,单株种子产量可高达7500粒[24],高于本研究样地内的单株种子产量。此外,粗毛牛膝菊种子几乎不休眠,种子成熟后在适宜的水热条件下可以很快发芽,该种在一年中可生长发育完成2—3代[25]。由此可见,该种具有繁殖速度快,且繁殖量大的特性,这使其能够在该地区维持较高的繁殖体压力,为其在秦巴山区进一步扩大种群奠定基础。此外,粗毛牛膝菊种子本身具备利于其远距离扩散的特性,例如其种子质量轻、具有可借助风力飘散的冠羽,且冠羽上具倒钩使其可粘附于哺乳动物和人类体表[14]。这些特性有利于降低地形、地貌因素对其种子扩散距离的限制,利于其快速地实现远距离扩散。入侵种的入侵过程一般分为繁殖体的转运、定殖、建立和扩散4个阶段[26]。粗毛牛膝菊种群生长发育动态研究结果显示,入侵种在4块样地中均能够维持较高的个体生长速率、个体密度和种子产量(图2);说明该种在秦岭南坡的宁陕县已经建立起了较大的、稳定增长的入侵种群;该种在本地区的入侵已进入扩散阶段。这意味着粗毛牛膝菊对本地区的自然生态系统和农业生产的危害程度可能会持续急剧升高。
研究样地内的粗毛牛膝菊在一个生长周期内的种群密度随着时间呈逻辑斯蒂型下降(密度=30.6693+151.0567/(1+(x/3.6750)8.3052),R2=0.636,P<0.001;图2),暗示着入侵种群内部存在负密度制约效应[27]。粗毛牛膝菊种群在3龄级向4龄级过渡期间出现了大量个体死亡,其死亡率在整个生长发育周期中处于最高水平(表4)。在此期间,其花序数量和花序生物量也出现较高的增长(图2)。这说明了在进入繁殖期时,如果个体密度过大,该种种群内部会因负密度制约和自疏作用造成死亡率骤然升高。这一时期的种群密度也得到了线路调查结果的印证。线路调查正处于粗毛牛膝菊的这一生长发育阶段,结果表明,处于该阶段的粗毛牛膝菊种群平均密度为55 株/m2(±4.76 SE),这与旬阳坝监测样地的调查结果一致(图2)。然而,已有的研究通常认为入侵种种群更容易表现出密度依赖特征[28]。例如,根据阿利效应(Allee effect)的作用规律,入侵种种群密度越高越容易入侵成功[28- 30]。然而,入侵种的种群密度并不一定就越高越好,过高的密度也会导致入侵种种内竞争加剧,不利于其种群的发展[31]。负密度制约效应的出现很大程度上是由同种个体为竞争有限资源所致[27],粗毛牛膝菊种群的高密度过多消耗了环境资源,这可能是导致其出现自疏现象的外在因素。在内因方面,生物自身生长发育规律也显示植物在繁殖期开始时也正是其较为敏感的时期,容易出现死亡率上升现象。如果这一阶段的生长受到环境资源限制,就可能导致死亡率骤然升高。为考察环境差异的潜在影响,本研究对比了该种群在4块不同样地的生长发育指标,结果显示大部分指标(6项指标中有4项)在样地间有显著差别(图2)。这暗示着即使是在很小的尺度上(4块样地分布范围半径不超过1km),样地间微环境的差别对粗毛牛膝菊的生长发育仍能产生显著的影响。事实上,环境因素的作用的确能够显著影响到一些入侵种的入侵进程[11],有些因子甚至能够有效降低入侵种相对于本地种的竞争优势,从而阻止入侵的发生[32]。此外,样地间的这种差异也暗示了该种可能具有一定的表型可塑性。表型可塑性被认为是同一入侵种种群在缺乏足够遗传变异的情况下得以迅速占据不同类型生境的重要内在原因[33- 35]。然而,本研究尚不足以提供有效的证据证明粗毛牛膝菊具有较高的表型可塑性,也未能揭示主要环境因子对粗毛牛膝菊入侵进程的影响,对此亟待进一步开展相关研究以揭示其入侵发生的内在和外在机理。
线路调查结果显示粗毛牛膝菊主要出现在农田、撂荒地、苗圃和路边等受到过人为活动干扰的生境中,且其种群密度在不同生境间差异显著。在苗圃中的粗毛牛膝菊种群密度最高,而在农田和撂荒地中的种群密度最低,这可能与后者受到人为铲除活动较频繁有关。粗毛牛膝菊对环境因子的选择有明显偏好,其出现频度与生境的土壤紧实度显著正相关,与地形因子坡度显著负相关;种群密度与坡度显著负相关,而与土壤紧实度不相关;个体高度与土壤紧实度显著正相关,而与坡度不相关。这说明粗毛牛膝菊能够在土壤紧实度高的生境中保持较高的均匀度和高度,但是表征其繁殖和种子萌发力的种群密度则与土壤紧实度无关;而坡度越小的生境越利于其种群的建立。事实上,根据野外观察,粗毛牛膝菊往往出现在农田、路边等植被和土壤受过人为活动干扰的生境中。已有的研究也通常认为,入侵种更容易在受到干扰的、土壤紧实度较低的生境中维持较高的存活率和优势度[36- 37]。入侵种之所以对此类生境的表现出明显的偏好,是因为这些生境频繁遭受人为活动的干扰,有未被利用的资源,以及本地植被群落结构和功能遭受破坏后出现的生态位空缺和本地群落抵抗力的下降[8]。本研究结果暗示了,土壤紧实度能够影响粗毛牛膝菊在群落中的均匀度,但不会影响其种群的繁殖和种子萌发力,即入侵力。此外,海拔因子与粗毛牛膝菊种群特征之间的相关性不强,这暗示了该入侵种的种群特征可能未受到海拔高度的影响。然而,在山地生态系统中,环境因子往往随着海拔高度的升高而发生较大的改变,尤其是温度随着海拔的升高往往会出现较大幅度的下降,从而限制了很多物种向高海拔地区扩展[38- 39]。同样,入侵种的种类和数量也往往随着海拔的升高而降低[38,40]。对此,尚需进一步深入研究以预测其向高海拔生境扩散的趋势,并评估该种可能对秦巴山区高海拔地区的脆弱生态系统造成的影响。
参考文献(References):
[1]van Kleunen M, Weber E, Fischer M. A meta-analysis of trait differences between invasive and non-invasive plant species. Ecology Letters, 2010, 13(2): 235- 245.
[2]Dawson W, Fischer M, van Kleunen M. The maximum relative growth rate of common UK plant species is positively associated with their global invasiveness. Global Ecology and Biogeography, 2011, 20(2): 299- 306.
[3]Feng Y L, Li Y P, Wang R F, Callaway R M, Valiente-Banuet A, Inderjit. A quicker return energy-use strategy by populations of a subtropical invader in the non-native range: a potential mechanism for the evolution of increased competitive ability. Journal of Ecology, 2011, 99(5): 1116- 1123.
[4]Osunkoya O O, Bayliss D, Panetta F D, Vivian-Smith G. Leaf trait co-ordination in relation to construction cost, carbon gain and resource-use efficiency in exotic invasive and native woody vine species. Annals of Botany, 2010, 106(2): 371- 380.
[5]Rejmánek M, Richardson D M. What attributes make some plants species more invasive? Ecology, 1996, 77(6): 1655- 1661.
[6]Zenni R D, Simberloff D. Number of source populations as a potential driver of pine invasions in Brazil. Biological Invasions, 2013, 15(7): 1623- 1639.
[7]Dewhirst S, Lutscher F. Dispersal in heterogeneous habitats: thresholds, spatial scales, and approximate rates of spread. Ecology, 2009, 90(5): 1338- 1345.
[8]Davis M A, Grime J P, Thompson K. Fluctuating resources in plant communities: a general theory of invasibility. Journal of Ecology, 2000, 88(3): 528- 534.
[9]Rickey M A, Anderson R C. Effects of nitrogen addition on the invasive grassPhragmitesaustralisand a native competitorSpartinapectinata. Journal of Applied Ecology, 2004, 41(5): 888- 896.
[10]Saltonstall K, Bonnett G D. Fire promotes growth and reproduction ofSaccharumspontaneum(L.) in Panama. Biological Invasions, 2012, 14(12): 2479- 2488.
[11]Alpert P, Bone E, Holzapfel C. Invasiveness, invasibility and the role of environmental stress in the spread of non-native plants. Perspectives in Plant Ecology, Evolution and Systematics, 2000, 3(1): 52- 66.
[12]Dumitrascu M, Grigorescu I, Nastase M, Dragota C, Kucsicsa G. The main environmental driving forces of the invasive plant species in the Romanian protected areas. BALWOIS 2010-Ohrid, Republic of Macedonia, 2010.
[13]Prieur-Richard A H, Lavorel S, Grigulis K, Dos Santos A. Plant community diversity and invasibility by exotics: invasion of Mediterranean old fields byConyzabonariensisandConyzacanadensis. Ecology Letters, 2000, 3(5): 412- 422.
[14]Kabuce N, Priede N. NOBANIS invasive alien species fact sheetGalinsogaquadriradiata. [2015- 06- 01]. https://www.nobanis.org/globalassets/speciesinfo/g/galinsoga-quadriradiata-/galinsoga-quadriradiata.pdf.
[15]徐海根, 强胜. 中国外来入侵生物. 北京: 科学出版社, 2011: 303- 305.
[16]何家庆. 中国外来植物. 上海: 上海科学技术出版社, 2012: 138- 138.
[17]汤东生, 董玉梅, 陶波, 傅杨. 入侵牛膝菊属植物的研究进展. 植物检疫, 2012, 26(4): 51- 55.
[18]中国科学院中国植物志编辑委员会. 中国植物志(第75卷). 北京: 科学出版社, 1979: 383- 385.
[19]田陌, 张峰, 王璐, 梁晓庆, 姜东亮, 邵显会, 任毅. 入侵物种粗毛牛膝菊(Galinsogaquadriradiata)在秦岭地区的生态适应性. 陕西师范大学学报(自然科学版), 2011, 39(5): 71- 75.
[20]MacDougall A S, Turkington R. Are invasive species the drivers or passengers of change in degraded ecosystems? Ecology, 2005, 86(1): 42- 55.
[21]孙儒泳, 李庆芬, 牛翠娟, 娄安如. 基础生态学. 北京: 高等教育出版社, 2002: 66- 76.
[22]Miller A L, Diez J M, Sullivan J J, Wangen S R, Wiser S K, Meffin R, Duncan R P. Quantifying invasion resistance: the use of recruitment functions to control for propagule pressure. Ecology, 2014, 95(4): 920- 929.
[23]Lockwood J L, Cassey P, Blackburn T. The role of propagule pressure in explaining species invasions. Trends in Ecology & Evolution, 2005, 20(5): 223- 228.
[24]Huffman L. Problem weed of the month: Hairy Galinsoga. Canada: Ontario Ministry of Agriculture, Food and Rural Affairs, 2004.
[25]Reinhard F, Herle M, Bastiansen F, Streit B. Economic impact of the spread of alien species in Germany (Report No. 000441e UBA-FB). Berlin: Federal Environmental Agency, 2003.
[26]Theoharides K A, Dukes J S. Plant invasion across space and time: factors affecting nonindigenous species success during four stages of invasion. New Phytologist, 2007, 176(2): 256- 273.
[27]Jansen P A, Visser M D, Joseph Wright S, Rutten G, Muller-Landau H C. Negative density dependence of seed dispersal and seedling recruitment in a Neotropical palm. Ecology Letters, 2014, 17(9): 1111- 1120.
[28]Balasuriya S. Invasions with density-dependent ecological parameters. Journal of Theoretical Biology, 2010, 266(4): 657- 666.
[29]Cappuccino N. Allee effect in an invasive alien plant, pale swallow-wortVincetoxicumrossicum(Asclepiadaceae). Oikos, 2004, 106(1): 3- 8.
[30]Firestone J L, Jasieniuk M. Small population size limits reproduction in an invasive grass through both demography and genetics. Oecologia, 2013, 172(1): 109- 117.
[31]Ward M, Johnson S D, Zalucki M P. When bigger is not better: intraspecific competition for pollination increases with population size in invasive milkweeds. Oecologia, 2013, 171(4): 883- 891.
[32]Suding K N, LeJeune K D, Seastedt T R. Competitive impacts and responses of an invasive weed: dependencies on nitrogen and phosphorus availability. Oecologia, 2004, 141(3): 526- 535.
[33]Agrawal A A. Phenotypic plasticity in the interactions and evolution of species. Science, 2001, 294(5541): 321- 326.
[34]Pigliucci M. Evolution of phenotypic plasticity: where are we going now? Trends in Ecology & Evolution, 2005, 20(9): 481- 486.
[35]Callaway R M, Pennings S C, Richards C L. Phenotypic plasticity and interactions among plants. Ecology, 2003, 84(5): 1115- 1128.
[36]Kyle G P, Beard K H, Kulmatiski A. Reduced soil compaction enhances establishment of non-native plant species. Plant Ecology, 2007, 193(2): 223- 232.
[37]Mattingly W B, Orrock J L. Historic land use influences contemporary establishment of invasive plant species. Oecologia, 2013, 172(4): 1147- 1157.
[38]Becker T, Dietz H, Billeter R, Buschmann H, Edwards P J. Altitudinal distribution of alien plant species in the Swiss Alps. Perspectives in Plant Ecology, Evolution and Systematics, 2005, 7(3): 173- 183.
[39]Dainese M, Kühn I, Bragazza L. Alien plant species distribution in the European Alps: influence of species′ climatic requirements. Biological Invasions, 2014, 16(4): 815- 831.
[40]Alexander J M, Kueffer C, Daehler C C, Edwards P J, Pauchard A, Seipel T, MIREN Consortium. Assembly of nonnative floras along elevational gradients explained by directional ecological filtering. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(2): 656- 661.
基金项目:陕西师范大学秦巴山区可持续发展协同创新中心项目;国家自然科学基金面上项目(31570425);留学人员科技活动项目择优资助;中央高校基本科研业务费专项资金资助(GK201503044);有害生物控制与资源利用国家重点实验室(中山大学)开放课题(SKLBC14KF04)
收稿日期:2015- 06- 30;
修订日期:2015- 11- 30
*通讯作者
Corresponding author.E-mail: zhuzhihong@snnu.edu.cn
DOI:10.5846/stxb201506301371
The population growth dynamic ofGalinsogaquadriradiataRuiz & Pav. on Qinling-Bashan Mountain
LIU Gang, ZHANG Lulu, KONG Binbin, WEI Xinhua, ZHU Zhihong*
CollegeofLifeSciences,ShaanxiNormalUniversity,Xi′an710119,China
Abstract:Whether an exotic plant can successfully invade a novel habitat depends on the invasiveness of the species (e.g., growth rate, propagule pressure) and the invasibility of the habitat (environmental factors). Mountain areas are difficult for exotic species to invade owing to high variation in environmental factors and the low propagule pressure of invaders. However, anthropogenic activities, particularly farming, frequently disrupt restrictions due to such factors, and subsequently benefit the range expansion of some exotic plants in mountain areas. The population of Galinsoga quadriradiata Ruiz & Pav., introduced from tropical America, has exhibited an explosive increase on Qinling-Bashan Mountain, mid-west China. However, the population growth dynamics and habitat preferences for this invasive species are unknown. In the present study, we conducted a field experiment and a sampling survey to determine the population growth dynamics and habitat preferences of G. quadriradiata. The field experiment was conducted in Xunyangba (Ankang, Shaanxi) beginning in late May 2014, with 12 1m × 1m plots in 4 sites of farmland which were in close proximity to each other. The coverage, height, number of inflorescences, and seed production of G. quadriradiata were measured or counted in each plot every 15—20 d until mid-September, by which time all the plants had died. The sampling survey was conducted in Qinling-Bashan mountain in July, 2014. In total, 90 1m × 1m plots at 30 sites were established with different altitudes, slopes, and aspects. The frequency, density, and height of G. quadriradiata were measured in each plot. Environmental factors, soil compaction, altitude, and slope were measured. A repeated-measures ANOVA (GLM-RMANOVA) was used to determine the population dynamics of G. quadriradiata within a complete growth cycle. PCA and multivariate analyses were used to detect the influence of environmental factors on the population characteristics of G. quadriradiata. Our results show that the population density of this invasive species reached 300 individuals/m2, the average seed production was 675 seeds per individual, and the seed production of the whole population was 45,619 seeds/m2 within one generation. This indicated that this high level of propagule pressure could provide sufficient seeds for a successful invasion in the study area. The population density decreased with time following a logistic pattern, and its mortality rate reached the highest level during the transition between vegetative growth and maturity. This suggests that G. quadriradiata may exhibit an inverse density-dependent effect during population growth. The result of the field survey shows that the frequency of G. quadriradiata in the local plant community is positively related to soil compaction, but negatively related to slope. This information is useful to predict its invasive tendency in the future. To summarize, G. quadriradiata would be a successful invader in habitats on Qinling-Bashan Mountain due to its high invasion potential; therefore, measures for controlling the an invasion of this exotic species are urgently needed.
Key Words:biological invasion; propagule pressure; inverse density dependency; environmental factors; Galinsoga quadriradiata
刘刚,张璐璐,孔彬彬,卫欣华,朱志红.外来种粗毛牛膝菊在秦巴山区的种群发展动态.生态学报,2016,36(11):3350- 3361.
Liu G, Zhang L L, Kong B B, Wei X H, Zhu Z H.The population growth dynamic ofGalinsogaquadriradiataRuiz & Pav. on Qinling-Bashan Mountain.Acta Ecologica Sinica,2016,36(11):3350- 3361.
