汾河中上游湿地植被β多样性
2016-08-09张淼淼
张淼淼,秦 浩,王 烨,张 峰,2,*
1 山西大学黄土高原研究所, 太原 030006 2 山西大学生命科学学院, 太原 030006
汾河中上游湿地植被β多样性
张淼淼1,秦浩1,王烨1,张峰1,2,*
1 山西大学黄土高原研究所, 太原030006 2 山西大学生命科学学院, 太原030006
摘要:探讨和揭示群落构建机制(生态位理论和中性理论)是生态学和生物地理学研究的热点和难点之一。研究β多样性格局及其与空间距离和环境异质性的关系为解释群落构建机制提供了一定的理论依据,以往群落β多样性的研究主要集中于物种组成的差异性,对种间在进化关系和功能属性方面的差异则关注较少。在野外调查的基础上,分析了汾河中上游湿地植被Tβ(taxon β-diversity)、Pβ(phylogenetic β-diversity)和Fβ(functional β-diversity)多样性格局及其与空间距离和生境异质性的关系。结果表明:(1)随着样地间距离的增加,Tβ、Pβ和Fβ整体上表现出逐渐增加的趋势,即表现出群落的距离衰减效应。(2)土壤因子中,TP是影响样地间Tβ、Pβ和Fβ的主要因子(P<0.05);pH、TOC和TN对Tβ、Pβ和Fβ的影响均未达到显著水平(P>0.05)。(3)由于受到空间扩散限制和生境异质性的影响,样地间β多样性表现出较大的差异,Tβ(0.66—1)、Pβ(0.42—0.85)和Fβ(0.51—0.94)。(4)尽管Tβ、Pβ和Fβ反映了多样性的不同方面,但三者之相关性极显著(P<0.01);(5)对Tβ、Pβ和Fβ多样性格局及其与空间距离和生境异质性的关系进行研究,表明环境因子和扩散限制共同决定着β多样性的格局,即群落的构建机制由生态位理论和中性理论共同主导。
关键词:β多样性; 系统发育多样性; 功能多样性; 空间距离; 生境异质性; 汾河上中游
在时间和空间尺度上研究和解释群落构建已逐渐成为生态学研究的热点[1- 2]。生态位理论和中性理论研究群落构建长期以来一直是生态学家感兴趣的问题之一。生态位理论认为物种共存的先决条件是生态位分化,具有特定性状的物种共同构建群落[3]。因此,当群落所处的生境异质性越大时,群落间的结构和组成差异也会越大,即生境过滤作用[4-6]。中性理论则认为扩散限制作用会限制种子的扩散距离,随着两个群落间距离的增加,群落间的结构和组成差异也会增加,进而表现出较高的β多样性,即群落的距离衰减效应[7-11]。Legendre等[12]对古田山β多样性的研究表明,生态位过程和中性理论过程共同决定群落的组成结构。Benjamin等对物种多度和物种分布影响的研究表明,生态位理论占主导地位,而中性理论几乎没有得到支持[13]。黄运峰等通过对形成热带低地雨林树木空间分布格局的研究表明,扩散作用是最重要的生态过程,而生境异质性作用很小[14]。本文通过对群落间β多样性与空间距离和环境异质性的关系进行研究,探讨群落的构建机制(生态位理论和中性理论)[15]。
已经报道的Beta多样性研究主要集中在物种组成方面,往往忽略了种间在进化等级和功能属性等方面的差异[2]。谱系β多样性不仅反映了群落间物种在进化等级方面的差异,还考虑了历史过程(物种形成、灭绝)对群落构建的影响。可以利用物种的系统发育状况来分析群落内物种谱系亲缘关系是否有一定规律,进而推测历史因素对群落构建的影响[2]。功能多样性是指生态系统或群落中功能性状的数值和范围考虑了共存物种的冗余和互补,反映了群落间物种在功能属性方面的差异[16-18]。本文基于汾河中上游湿地植物群落的野外调查,结合物种间分类等级关系和功能属性,应用Jaccard指数研究了样地间物种、谱系和功能β多样性的格局,分析了它们与空间距离和生境异质性的关系,探讨影响物种、谱系和功能β多样性格局形成的潜在机制和主要因素,为汾河中上游湿地植物群落的构建机制提供理论依据。
1研究区域概况
汾河作为黄河的一级支流是山西最大的,发源于宁武县管涔山,纵贯省域中部,流经太原、临汾两大盆地,至万荣县庙前村附近汇入黄河,全长695km[19- 21]。该流域平均年降雨量504.8mm[22- 23]。研究区域汾河中上游,包括宁武县、静乐县、娄烦县、太原市区及清徐县,流域面积约7705km2[22]。
汾河中上游地区地貌类型有河漫滩、土石山区、黄土丘陵区等,土壤类型为沼泽土、淋溶褐土、黄绵土和亚高山草甸土[20,24]。该区域生物多样性较为丰富,其中被子植物91科391属863种,菊科、蔷薇科、禾本科、蝶形花科为优势科[20]。
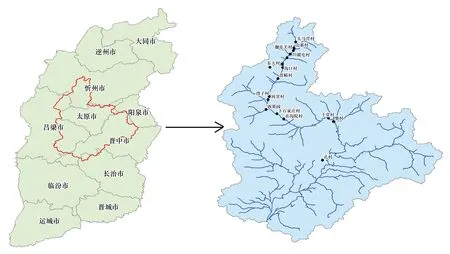
图1 调查位点图Fig.1 Map of field investigated region
2研究方法
2.1样地调查
2014年8月采用典型取样法[25],沿汾河中上游段(宁武到太原)的头马营村、山寨村、蒯屯关村、坝门口村等17个地点进行植被调查(图1)。每个地点布设3个10m×10m样地,再在每个样地内布设5个1m×1m草本样方进行植被调查,记录物种的名称、平均高度、盖度、多度等,同时草本样方外未记录物种;除此之外,详细记录样方经纬度、海拔和干扰情况等[26]。在每个1m×1m草本样方内选取表层20cm的土样,带回实验室并送检测定其pH、全氮(TN)、全磷(TP)、总有机碳(TOC)。共记录51个样方。记录种子植物168种。
2.2数据分析2.2.1二元属性数据
使用物种的二元属性数据(即0、1数据)。物种在样地内存在则记为1,不存在则记为0[27-28]。
2.2.2系统发育结构
综合野外调查记录,系统整理了汾河中上游植物物种总名录。根据恩格勒的分类系统,将所调查的物种按照门、纲、目、科、属、种划分为6个等级,并建立所有物种的系统进化树。在系统进化树内,将最长路径长度定义为100,每一分类等级水平上的权重依次为:种间ω=16.7,属间ω=33.3,科间ω=50,目间ω=66.7,纲间ω=83.3,门间ω=100[29-30]。
2.2.3功能多样性
根据植物的形态、生理、繁殖方式和物候等特征[31],共记录了14个植物属性来度量功能多样性,这些属性包括植物的生长型、生活史、固氮类型、光合途径、叶的形状、花的形状、传粉方式、果实类型、种子传播方式、开花时间、花期、结果时间和果期。这些属性特征能够很好地反映出植物个体在形态、生理和物候等方面的特征,表达出植物个体在生产力、资源的利用方式、生态恢复力及其生态对策等方面的差异。基于所选取的植物功能性状,运用Gower距离构建物种功能属性树[32]。
2.2.4 β多样性指数
选取Jaccard相异性指数作为β多样性的测度指标[33]:
(1)
分别计算物种β多样性(taxonβ-diversity,Tβ)、谱系β多样性(phylogeneticβ-diversity,Pβ)和功能β多样性(functionalβ-diversity,Fβ),所有计算均用R软件完成。式(1)中,a是两个样带所共有的种数或者系统进化树或功能属性树的枝长,b是第1个样地所特有的种数或者系统进化树或功能属性树的枝长,c是指第2个样地所特有的种数或者系统进化树或功能属性树的枝长。
2.2.5Tβ、Pβ和Fβ的相关性
用Pearson相关系数检验Tβ、Pβ和Fβ之间的相关性。
3结果与分析
3.1 Tβ、Pβ和Fβ多样性
样地间Tβ多样性指数皆大于0.5(最小值为0.57,最大值为1)。样地间Fβ多样性指数范围为0.37—0.94,同样表现出较大的差异。其中Fβ多样性指数大于0.5的有112个,占全部数量的82.35%,表明样地间物种功能性状差异较为明显。
样地间Pβ多样性指数范围为0.30—0.86,表现出较大的差异,而Pβ多样性指数大于0.5的有83个,占全部数量的61.03%,说明样地之间的系统分类差异较大。如样地1与样地15间表现出较高的Pβ多样性(0.85)。样地15物种组成以蓼科(Polygonaceae)植物为主,如水蓼(Polygonum hydropiper)和两栖蓼(P. amphibium),群落结构组成单一;而样地1除了蓼科以外,还具有豆科(Leguminosae)、唇形科(Labiatae)、菊科(Compositae)、禾本科(Gramineae)、莎草科(Cyperaceae)、蔷薇科(Rosaceae)和毛茛科(Ranunculaceae)等,物种组成丰富、系统分类单元多样化。Pβ多样性指数小于0.5的有53个,大部分集中于坝门口、蒯屯、川湖屯和潘家湾等地,这些地区都位于汾河源头,样地间的距离较近,群落在物种分类方面具有较高的相似性,植物大多为莎草科、禾本科、菊科、豆科等湿生植物。
Tβ、Pβ和Fβ多样性之间表现出极显著的相关性(图2, P<0.01),表明Tβ、Pβ和Fβ多样性之间存在密切联系。Tβ多样性反映了样地间物种组成的差异性,而Pβ和Fβ反映了是样地间谱系结构和功能性状的差异。一般来说,由于群落内物种间在进化关系和功能属性方面存在冗余现象,样地间物种的更替往往会导致Tβ多样性指数大于Pβ和Fβ。
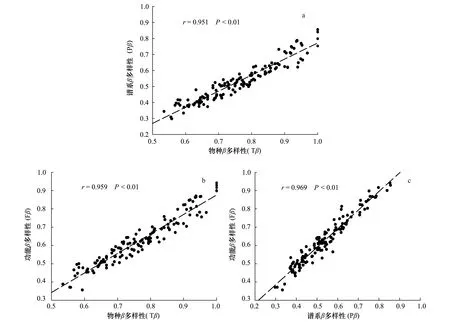
图2 Tβ、Pβ和Fβ多样性间的相关性Fig.2 Correlation between Tβ, Pβ and Fβ
3.2Tβ、Pβ和Fβ与样地距离的关系
以样地1(宁武县头马营村)为例分析样地间Tβ、Pβ和Fβ随距离变化的关系,结果表明:随着距离的增加,Tβ、Pβ和Fβ整体上表现出逐渐增加的趋势(图3)。样地1与其他样地间的Tβ、Pβ和Fβ变化范围分别为0.66—1、0.42—0.85和0.51—0.94,其中样地1与样地(15—17)间的Tβ、Pβ和Fβ相对较高,表明群落的物种组成、谱系结构、功能属性等存在较大的差异。
相邻样地间生境异质性对Tβ、Pβ和Fβ具有一定的影响,研究表明:前11个样地(1—11)间Tβ、Pβ和Fβ的值相对较低且变幅较小,而样地(12,15—17)间Tβ、Pβ和Fβ的值相对较高,表现出较为明显的区域异质性。如样地15(土堂)和16(柴村)虽然都位于太原市尖草坪区,距离较近,但样地间的Tβ、Pβ和Fβ分别为0.90、0.71和0.82,在物种组成、谱系结构和功能属性等表现出较大的差异。样地15位于土堂的橡皮坝,生境遭到严重的人为干扰,群落类型主要以蓼科(水蓼、两栖蓼)植物为主,群落结构单一化比较严重;样地16位于汾河水库,水分条件较好,加之人为活动干扰较少,湿生和水生植物分布较为集中,包括香蒲(Typha orientalis)、野大豆(Glycine soja)、水莎草(Juncellus serotinus)、狼杷草(Bidens tripartita)等;此外,还有许多中生植物分布,如假苇拂子茅(Calamagrostis pseudophragmites)、苍耳(Xanthium sibiricum)、山蒿(Artemisia brachyloba)等)。
3.3Tβ、Pβ和Fβ与土壤因子的关系
从样地距离以及相邻样地间β多样性研究结果(图3,图4)可以看出:除了空间距离外,生境异质性也是导致样地间β多样性差异的重要因素。样地间Tβ、Pβ和Fβ多样性与土壤因子(pH、TN、TP、TOC)间的相关分析表明:影响样地间Tβ、Pβ和Fβ多样性的因子主要是TP,相关系数分别为0.215、0.213和0.190,均达显著水平(P<0.05)。pH、TOC和TN对Tβ、Pβ和Fβ多样性的相关性均不显著(P>0.05),意味着这些因素不是决定Tβ、Pβ和Fβ多样性的主导环境因素。
4讨论
研究β多样性格局与空间距离和环境异质性间的关系有助于人们了解群落构建机制。生态位理论和中性理论是目前被广泛认可的群落构建机制。生态位理论认为生态位分化是物种共存的先决条件,经过环境条件和生物的相互作用,具有特定性状并符合各环境筛的特定物种共同构建群落[3]。因此,在生境过滤作用下,群落间的结构和组成会受到生境异质性的影响[4-6]。基于中性理论的扩散限制同样会影响群落β多样性格局,即群落的距离衰减效应[7-11]。Tuomisto等人对亚马逊热带雨林β多样性的研究表明,环境因子和扩散限制共同决定着β多样性的格局。扩散作用在80km内对群落间的β多样性格局有强烈的作用,超过这个范围则环境因子起主要作用[8]。
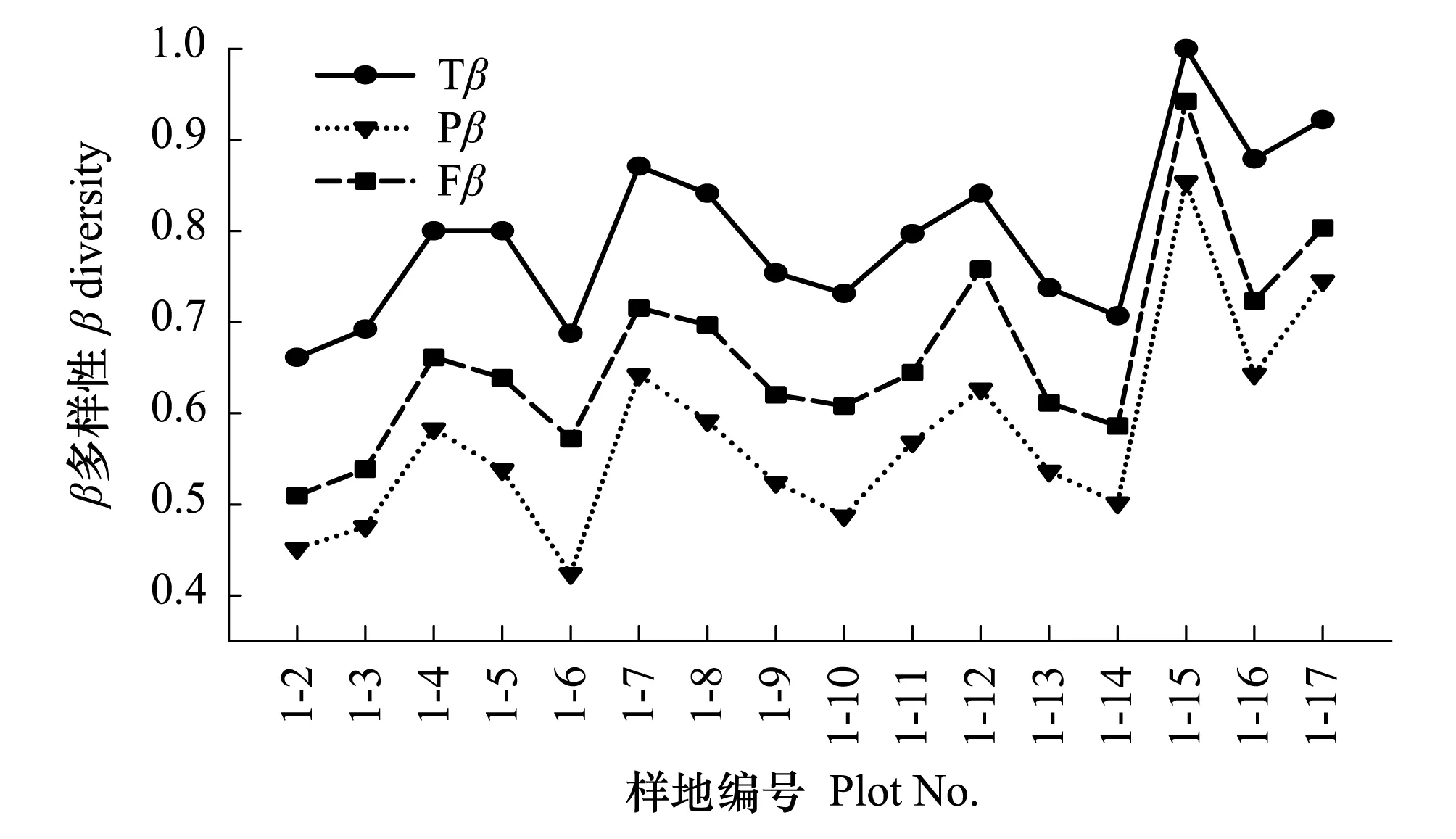
图3 Tβ、Pβ和Fβ与样地距离的关系 Fig.3 Relationship between Tβ, Pβ, Fβ and stand distance
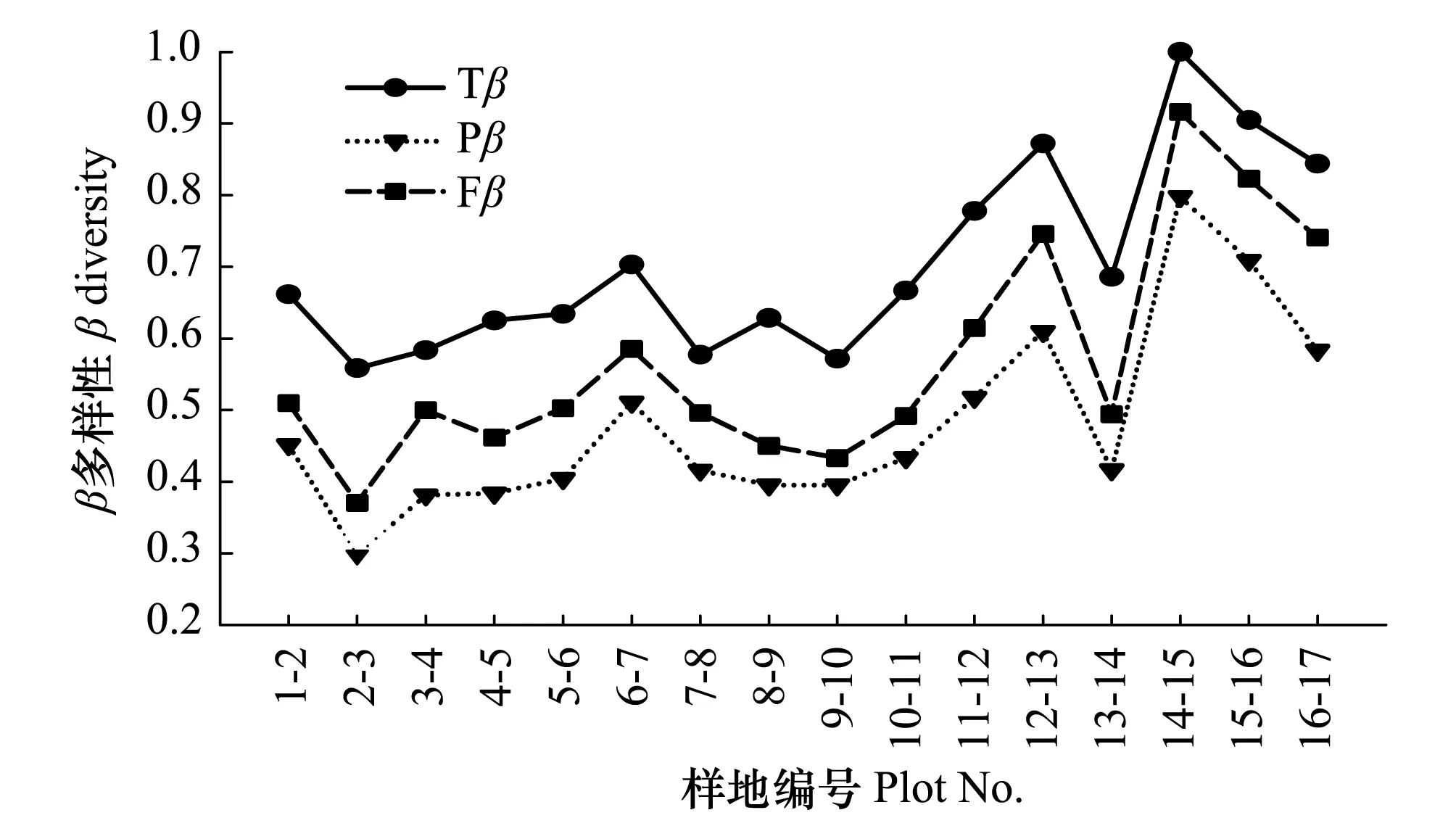
图4 相邻样地间Tβ、Pβ和Fβ的关系 Fig.4 Relationship between Tβ, Pβ and Fβ in the adjacent stand
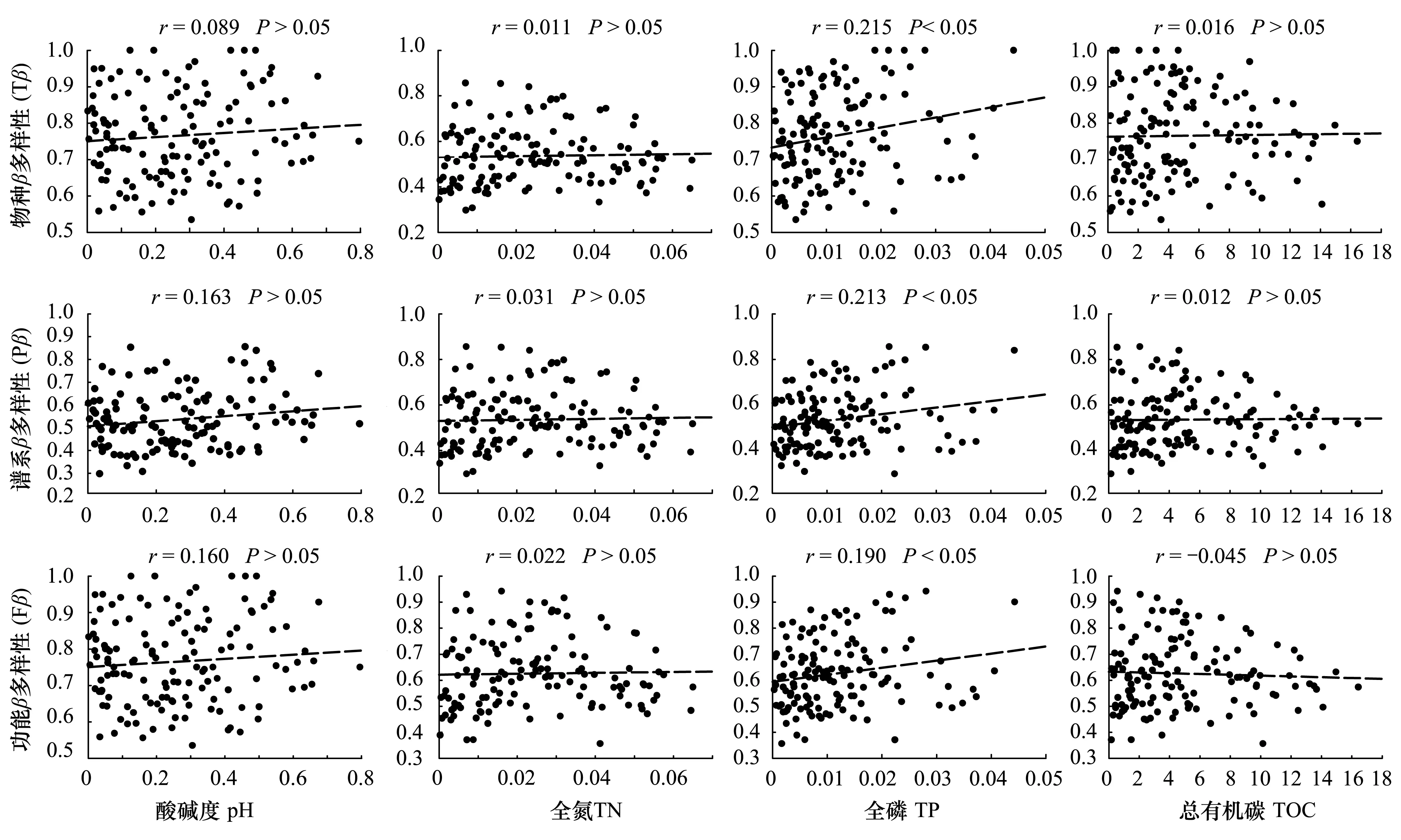
图5 Tβ、Pβ和Fβ与土壤因子的关系Fig.5 Relationship between Tβ, Pβ, Fβ and soil factors
通过分析汾河上中游湿地空间距离和土壤环境因子与Tβ、Pβ和Fβ的关系,可知环境因子和扩散限制共同决定着β多样性的格局,这与TuomistoH等的相关研究结果相一致[12,8]。随着样地间距离的增加,扩散限制对种子的传播束缚能力越大,样地间物种Tβ、Pβ和Fβ整体上表现出逐渐增加的趋势(图3)。汾河中上游湿地植物种子虽然可以顺着水流随机漂泊,但由于受自身生物学特点(寿命、萌发率等)、捕食以及环境因子的影响,植物种子往往选择在下游最近的地区定植、繁衍。随着距离的增加,有些种子虽然能侥幸到达较远的区域,但由于受种子的寿命、成活率等因素限制,这些植物很难在该区域的群落中占据有力的竞争地位。与汾河太原段区域相比,汾河宁武段的类型除了包含全区均有分布的芦苇群落(Form. Phragmites australis)、小香蒲群落(Form. Typha minima)、香蒲群落(Form. Typha angustifolia)、早熟禾群落(Form. Poa annua)和狼杷草群落(Form. Bidens tripartite)等外,还包括扁秆藨草群落(Form. Scirpus planiculmis)、小花灯心草群落(Form. Juncus articulatus)、各类莎草群落(Form. Cyperusspp.)和野大豆群落(Form. Glycine soja)等。扁秆藨草、各类莎草和野大豆等由于种子颗粒较大,河道地形复杂,不利于颗粒较大的种子长远距离的扩散与传播,在下游区域难以形成优势种群。
通过相邻样地间Tβ、Pβ和Fβ的比较,发现生境异质性对Tβ、Pβ和Fβ的影响也极为重要。如样地15(土堂)和样地16(柴村)都位于太原市尖草坪区,距离较近,扩散限制对种子的传播影响甚小,但样地间表现出较高的Tβ、Pβ和Fβ值(0.90、0.71和0.82)。这主要是由于这两个样地的生境类型差异较大。样地15的生境受人为干扰较为严重(水质受到严重污染,河道已成为人工橡胶坝),群落区系组成和结构较为简单,仅有藨草和水蓼两种植物;样地16受汾河水库的影响,植物区系组成和分布较为复杂多样,除了湿生和水生植物外(如香蒲、野大豆、水莎草、狼把草等),还分布有大量的中生植物(如假苇拂子茅、苍耳、山蒿等)。人类活动是相邻样地(样地15和样地16)间植物生境巨大差异的主要原因之一,进而导致样地间表现出较高的Tβ、Pβ和Fβ值。除了人为活动以外,样地间土壤理化性质的差异对群落物种组成和构建同样有着显著的影响,其中TP的影响最为显著(P<0.05)。pH、TOC和TN对Tβ、Pβ和Fβ多样性的影响均未达到显著水平(P>0.05)。关文彬等[35]研究岷江干旱河谷植物群落物种周转速率与环境因子的关系时发现土壤养分(TN、TP、速效磷和水解氮等)和含水量对物种周转速率有着显著的影响,这与我们的结果一致。
由于受到空间扩散限制和生境异质性的影响,样地间β多样性表现出较大的差异,Tβ(0.66—1)、Pβ(0.42—0.85)和Fβ(0.51—0.94)。尽管Tβ、Pβ和Fβ反映了多样性的不同方面(其中Tβ多样性反映的是样地间物种组成的差异性,而Pβ和Fβ反映的是样地间谱系结构和功能性状的差异),但他们之间的相关性极显著(P<0.01),这表明Tβ、Pβ和Fβ多样性间相互关联。群落间物种组成的差异是β多样性形成的基础,而种间进化关系和功能属性可以反映出群落构建过程中历史过程和冗余物种对群落组成和结构的影响。
以往关于β多样性的研究往往集中在群落物种种类组成的变化,忽略了物种自身在进化等级和功能属性等方面的差异。Tβ的研究往往将物种的地位等同起来,认为每个种都是独特的。因此,两个样地间物种的更替和变化会直接导致Tβ多样性的改变,即产生“1+1=1+1”的效果。但由于群落内的物种在进化关系和功能属性方面存在冗余现象,如果将物种的进化等级和功能属性考虑到研究中,种类的更替与种间进化关系和功能属性的变化往往不是一对一的。因此,如果更替的两个种在群落内处于不同的分类单元或者具有较大差异的功能性状时,种间的更替会增加Pβ和Fβ的值,即产生“1+1>1+1”的效果。相反,如果物种间的替换发生在冗余种之间,则Pβ和Fβ的值往往会小于Tβ,即产生“1+1<1+1的效果”。因此,从不同的角度去理解和探讨β多样性格局对准确把握其过程和潜在的机制是必要的。
参考文献(References):
[1]YanYJ,YangX,TangZY.PatternsofspeciesdiversityandphylogeneticstructureofvascularplantsontheQinghai-TibetanPlateau.EcologyandEvolution, 2013, 3(13): 4584- 4595.
[2]刘长柱. 秦岭太白山森林植物群落的功能与谱系多样性[D]. 北京: 中国科学院大学, 2014.
[3]王刚. 生态位理论若干问题探讨. 兰州大学学报: 自然科学版, 1990, 26(2): 109- 113.
[4]TuomistoH,RuokolainenK,KalliolaR,LinnaA,DanjoyW,RodriguezZ.DissectingAmazonianbiodiversity.Science, 1995, 269(5220): 63- 66.
[5]NekolaJC,WhitePS.Thedistancedecayofsimilarityinbiogeographyandecology.JournalofBiogeography, 1999, 26(4): 867- 878.
[6]ValenciaR,FosterRB,VillaG,ConditR,SvenningJC,HernándezC,RomolerouxK,LososE,MagårdE,BalslevH.TreespeciesdistributionsandlocalhabitatvariationintheAmazon:largeforestplotineasternEcuador.JournalofEcology, 2004, 92(2): 214- 229.
[7]ConditR,PitmanN,LeighJrEG,ChaveJ,TerborghJ,FosterRB,NúezP,AguilarS,ValenciaR,VillaG,Muller-LandauHC,LososE,HubbellSP.Beta-diversityintropicalforesttrees.Science, 2002, 295(5555): 666- 669.
[8]TuomistoH,RuokolainenK,Yli-HallaM.Dispersal,environment,andfloristicvariationofwesternAmazonianforests.Science, 2003, 299(5604): 241- 244.
[9]SoininenJ,McDonaldR,HillebrandH.Thedistancedecayofsimilarityinecologicalcommunities.Ecography, 2007, 30(1): 3- 12.
[10]MorlonH,ChuyongG,ConditR,HubbellS,KenfackD,ThomasD,ValenciaR,GreenJL.Ageneralframeworkforthedistance-decayofsimilarityinecologicalcommunities.EcologyLetters, 2008, 11(9): 904- 917.
[11]MorlonH,SchwilkDW,BryantJA,MarquetPA,RebeloAG,TaussC,BohannanBJM,GreenJL.Spatialpatternsofphylogeneticdiversity.EcologyLetters, 2011, 14(2): 141- 149.
[12]LegendreP,MiXC,RenHB,MaKP,YuMJ,SunIF,HeFL.Partitioningbetadiversityinasubtropicalbroad-leavedforestofChina.Ecology, 2009, 90(3): 663- 674.
[13]王丹, 王孝安, 郭华, 王世雄, 郑维娜, 刘史力. 环境和扩散对草地群落构建的影响. 生态学报, 2013, 33(14): 4409- 4415.
[14]黄运峰, 丁易, 臧润国, 李小成, 邹正冲, 韩文涛. 海南岛霸王岭热带低地雨林树木的空间格局. 植物生态学报, 2012, 36(4): 269- 280.
[15]赵谷风. 中国东部常绿阔叶林群落Beta多样性和功能多样性研究[D]. 杭州: 浙江大学, 2010.
[16]薛倩妮, 闫明, 毕润成. 山西五鹿山森林群落木本植物功能多样性. 生态学报, 2015, 35(21),doi: 10.5846/stxb201401280206.
[17]张金屯, 范丽宏. 物种功能多样性及其研究方法. 山地学报, 2011, 29(5): 513- 519.
[18]宋彦涛, 王平, 周道玮. 植物群落功能多样性计算方法. 生态学杂志, 2011, 30(9): 2053- 2059.
[19]岳建英, 郭春燕, 李晋川, 卢宁, 王翔, 李倩冉. 汾河中上游地区禾本科植物调查. 山西农业科学, 2015, 43(3): 305- 309.
[20]李晋川. 汾河源头生物多样性综合考察研究. 太原: 山西科学技术出版社, 2014: 13- 15.
[21]山西省地方志编纂委员会. 山西通志: 第四卷: 地质矿产志. 北京: 中华书局出版社, 1993: 84- 85.
[22]李英明, 潘军峰. 山西河流. 北京: 科学出版社, 2004: 25- 30.
[23]《山西河湖》编纂委员会. 山西河湖. 北京: 中国水利水电出版社, 2013: 17- 22.
[24]梁丽霞, 任志远, 王丽霞, 牛俊杰. 汾河流域气温变化时空特征分析. 干旱区资源与环境, 2010, 24(1): 52- 57.
[25]秦晓娟, 董刚, 邓永利, 毛空, 李旭华, 张峰. 山西平陆黄河湿地植物分类学多样性. 生态学报, 2015, 35(2): 409- 415.
[26]赵小娜, 秦晓娟, 董刚, 张峰. 庞泉沟自然保护区植物群落分类学多样性. 应用生态学报, 2014, 25(12): 3437- 3442.
[27]马克平, 刘灿然, 刘玉明. 生物群落多样性的测度方法: Ⅱ.β多样性的测度方法. 生物多样性, 1995, 3(1): 38- 43.
[28]王丹. 黄土高原草地群落的Beta多样性及其成因探索[D]. 西安: 陕西师范大学, 2013.
[29]ClarkeKR,WarwickRM.Thetaxonomicdistinctnessmeasureofbiodiversity:weightingofsteplengthsbetweenhierarchicallevels.MarineEcologyProgressSeries, 1999, 184: 21- 29.
[30]曾燏. 嘉陵江干流鱼类物种分类多样性研究. 西北师范大学学报: 自然科学版, 2012, 33(3): 246- 250, 260- 260.
[31]ZhangJT,ZhangB,QianZY.FunctionaldiversityofCercidiphyllum japonicum,communitiesintheShennongjiareserve,centralChina.JournalofForestryResearch, 2014, 26(1): 171- 177.
[32]PodaniJ,SchmeraD.Ondendrogram-basedmeasuresoffunctionaldiversity.Oikos, 2006, 115(1): 179- 185.
[33]张金屯. 数量生态学. 北京: 科学出版社, 2004.
[34]关文彬, 冶民生, 马克明, 刘国华, 汪西林, 谭辉. 岷江干旱河谷植物群落物种周转速率与环境因子的关系. 生态学报, 2004, 24(11): 2367- 2373.
基金项目:科技部科技基础性工作专项资助项目(2011FY110300,2015FY110300);山西省自然科学基金资助项目(2013011037- 1)
收稿日期:2015- 06- 30;
修订日期:2015- 10- 29
*通讯作者
Corresponding author.E-mail: fzhang@sxu.edu.cn
DOI:10.5846/stxb201506301348
BetadiversityofwetlandvegetationinthemiddleandupperreachesoftheFenheRiverwatershed
ZHANGMiaomiao1,QINHao1,WANGYe1,ZHANGFeng1, 2 *
1 Institute of Loess Plateau, Shanxi University, Taiyuan 030006, China 2 School of Life Science, Shanxi University, Taiyuan 030006, China
Abstract:Exploring and revealing the mechanisms of community construction (niche theory and neutral theory) is a hot topic and a difficulty in ecology and biogeography research. Studies on the relationship between beta diversity and spatial distance and natural distance provide some theoretical basis for the construction of the community. However, studies on beta diversity have mainly been focus on species differences and little on differences in the evolutionary relationships and functional properties between species. Based on field investigations, we evaluated the two-element attribute data of the total species, that is when the species was in the stands, it was denoted as 1 and when it was not in the stands, it was denoted as 0. We developed a master plant list of seed species found in the middle and upper reaches of the Fenhe River. According to the Linnaean classification system, the species were divided into six levels: Phylum, Class, Order, Family, Genus, and Species, and the phylogenetic trees of all species were built. Considering the plant morphology, physiology, and breeding phenology, plant properties including growth form, life history of plants, types of nitrogen fixation, photosynthetic pathway, light tolerance, leaf shape, flower shape, pollination mode, fruit type, seed dispersal mode, flowering time, flowering phase, fruit time, and fruit phase, were recorded to measure functional diversity and to express differences between individual plants in terms of productivity, resource utilization, ecological resilience, and ecological countermeasures. The measurement indicator, beta diversity, was calculated using the Jaccard index. The Tβ, Pβ, and Fβ diversity patterns of 17 stands in the middle and upper reaches of the Fenhe River were calculated, respectively, and the correlations among diversity patterns, spatial distance, and habitat heterogeneity were analyzed. The results showed that (1) with increasing distance of the 17 stands, the Tβ, Pβ, and Fβ patterns showed an increasing trend, that is, the distance of the community showed an attenuation effect. (2) TP (total phosphorus) is the main soil factor that influences the Tβ, Pβ, and Fβ in the sample areas (P<0.05), while the influence of pH, TOC (total organic carbon), and TN (total nitrogen) was not significant (P > 0.05). (3) Because of the restrictions on spatial diffusion and the influence of habitat heterogeneity, the diversity of beta diversity among the samples was obviously different (Tβ 0.66—1, Pβ 0.42—0.85, and Fβ 0.51—0.94). (4) Although the Tβ, Pβ, and Fβ reflected different aspects of diversity, the relationship with each other was highly significant (P < 0.01). (5) Based on the Tβ, Pβ, and Fβ diversity patterns and their relationship with spatial distance and habitat heterogeneity, it is suggested that the environmental factors and diffusion limitation jointly dominated the pattern of beta diversity, namely, the construction mechanism of the community was jointly decided by the ecological niche theory and neutral theory.
Key Words:beta diversity; phylogenetic diversity; functional diversity; spatial distance; habitat heterogeneity; middle and upper reaches of the Fenhe River
张淼淼,秦浩,王烨,张峰.汾河中上游湿地植被β多样性.生态学报,2016,36(11):3292- 3299.
ZhangMM,QinH,WangY,ZhangF.BetadiversityofwetlandvegetationinthemiddleandupperreachesoftheFenheRiverwatershed.ActaEcologicaSinica,2016,36(11):3292- 3299.
