脐带间充质干细胞运载scFvCD20:sTRAIL 融合蛋白对B-淋巴瘤细胞的生长抑制作用①
2016-08-09范冬梅张晓龙杨圆圆袁向飞张砚君熊冬生
范冬梅 张晓龙 张 晴 卢 杨 杨圆圆 袁向飞 张砚君 熊冬生
(中国医学科学院北京协和医学院血液病医院血液研究所,国家重点实验室,天津300020)
·基础免疫学·
脐带间充质干细胞运载scFvCD20:sTRAIL 融合蛋白对B-淋巴瘤细胞的生长抑制作用①
范冬梅张晓龙张晴卢杨杨圆圆袁向飞张砚君熊冬生
(中国医学科学院北京协和医学院血液病医院血液研究所,国家重点实验室,天津300020)
[摘要]目的:探讨脐带间充质干细胞运载scFvCD20:sTRAIL融合蛋白的新型双重靶向系统对CD20+ BJAB细胞的生长抑制作用。方法:采用传统分子生物学技术构建pLenR.scFvCD20:sTRAIL、pLenR.ISZ-sTRAIL、pLenR.scFvCD20 及pLenR.copGFP四种慢病毒表达载体,利用四质粒慢病毒包装系统于293T细胞中包装慢病毒颗粒,并感染人脐带组织来源的MSCs(HUMSCs),使其稳定表达融合蛋白。于体外采用CCK8细胞增殖抑制实验检测scFvCD20:sTRAIL融合蛋白对CD20阳性BJAB细胞和Raji细胞、CD20阴性Jurkat细胞以及正常人外周血单个核细胞(PBMCs)的生长抑制作用。建立NOD/SCID鼠BJAB细胞皮下移植瘤模型,将MSC.scFvCD20:sTRAIL 经尾静脉注射入小鼠体内,每3 d测量瘤体积,根据肿瘤体积计算抑瘤率。结果:成功构建了慢病毒表达载体pLenR.scFvCD20:sTRAIL、 pLenR.ISZ-sTRAIL、pLenR.scFvCD20及pLenR.copGFP,且经慢病毒感染可在HUMSCs中稳定表达。体外实验显示,scFvCD20:sTRAIL融合蛋白可不同程度地提高对CD20阳性BJAB和Raji细胞的生长抑制作用,而对CD20阴性Jurkat细胞的生长抑制作用降低;而且不影响PBMCs的生长。体内实验表明,MSC.scFvCD20:sTRAIL可显著抑制BJAB淋巴瘤的生长,初始治疗后第24 天,抑瘤率达65.2%,与MSC.ISZ:sTRAIL治疗组比较(抑瘤率为52.7%),具统计学差异(P<0.05)。结论:建立了HUMSCs运载scFvCD20:sTRAIL融合蛋白的双重靶向治疗系统,HUMSCs可向BJAB淋巴瘤部位归巢并表达分泌scFvCD20:sTRAIL融合蛋白,后者在局部经scFvCD20的二次导向发挥CD20特异性抑瘤作用。为MSCs作为肿瘤靶向治疗载体在临床中的应用提供了理论依据。
[关键词]间充质干细胞;CD20;TRAIL;非霍奇金氏淋巴瘤;肿瘤免疫
非霍奇金氏淋巴瘤(Non-Hodgkin’s lymphoma,NHL)是一组起源于淋巴结或其他淋巴组织的恶性肿瘤。NHL 的发病率和流行病率随年龄增长而增加,约70% 以上的NHL 病人在55 岁后被诊断,5年总生存率为68%。近年来NHL新发病率迅速上升,虽然传统放化疗治疗效率高,但毒副作用明显,且部分初治有效病人发生复发。
肿瘤分子生物学和分子克隆技术的飞速发展为临床肿瘤治疗开创了新领域。目前,基于特异性靶点的分子、细胞治疗已成为肿瘤治疗的热点。据统计,B细胞淋巴瘤占NHL的85%,其中95%以上的B细胞NHL表达CD20抗原,因此,CD20是治疗NHL的理想靶点[1,2]。正常情况下,CD20是B细胞的重要分化抗原,分子量为33~37 kD,主要表达于前B 淋巴细胞、未成熟B 淋巴细胞、成熟B 淋巴细胞以及活化的B 淋巴细胞中,而在浆细胞、淋巴多能干细胞以及其他组织均无表达[3,4]。
另一方面,肿瘤坏死因子(Tumor necrosis factor,TNF)超家族成员是凋亡途径中关键的细胞外调控因子,其与细胞表面死亡受体结合,活化下游信号传导分子,从而诱导细胞发生凋亡[5]。TNF相关的凋亡诱导配体(TNF-related apoptosis-induing ligand,TRAIL)属于TNF 超家族,却不同于TNF 及Fas L(CD95 ligand),其对肿瘤细胞具有选择性,对正常组织细胞没有毒副作用,因此在基础和临床研究中受到广泛关注。
间充质干细胞(MSCs)具有肿瘤靶向性、分离纯化方便、可在体外进行大量扩增、能较容易地利用病毒载体进行基因改造、具有较低的免疫原性和内在突变频率等优点[6-8],利用MSCs作为载体体内运输蛋白药物进行肿瘤治疗已成为临床靶向治疗最具希望的手段之一。
本研究工作将可溶性TRAIL片段(sTRAIL)与具有B-NHL特异性的抗CD20抗体scFv(single-chain Fv antibody fragment)融合形成scFvCD20:sTRAIL融合蛋白,并将其表达框利用慢病毒载体掺入人脐带组织WJ来源的MSC(HUMSC)基因组。通过HUMSC的归巢作用,将scFvCD20:sTRAIL分泌在淋巴瘤组织局部,实现抗肿瘤的目的。
1材料与方法
1.1材料
1.1.1细胞系与培养基人B细胞淋巴瘤细胞系BJAB、Raji及人急性T淋巴细胞白血病细胞系Jurkat由本室保存;正常人外周血单个核细胞PBMCs 由中国医学科学院血液学研究所曹善楠博士馈赠,以上细胞均培养于含10% FCS及2 mmol/L L-谷氨酰胺的RPMI1640培养基。293T细胞用含10% FCS及2 mmol/L L-谷氨酰胺的DMEM培养基培养,HUMSCs用含10%FCS(Gibco)的DF-12培养基培养。以上细胞均于5% CO2,37℃,饱和湿度条件下培养。
1.1.2载体及感受态载体pYAZ-anti-CD20Fab、T-sTRAIL由本室构建;pGL3- basic载体(Promega)由本室保存;慢病毒表达载体pCDH1-MSC1-EF1-copGFP (Cat.# CD511A-1)及包装载体pPACKH1-GAG、pPACKH1-REV、pVSV-G 由中国医学科学院血液学研究所马晓彤教授馈赠;大肠杆菌DH5α购自北京索莱宝科技有限公司。
1.2方法
1.2.1HUMSCs 的分离及扩增本实验所使用MSCs来源于人脐带组织WJ。从手术台上取下的脐带在24 h内进行处理,具体分离过程如下:脐带用含双抗的PBS冲洗,将脐带剪成1 cm长的小块,继续冲洗干净。剥离脐带动静脉血管壁,取胶冻状的WJ部分,剪碎至0.5 cm3大小组织块,依次摆放于预先润湿的T-75 cm 塑料培养瓶中倒置培养。4~8 h后翻转培养瓶,次日添加1 ml含10% FCS及2 mmol/L L-谷氨酰胺的DF-12培养基,连续添加3 d,每次1 ml,第4天全量换液,以后每周换液2次。分离10~14 d后,去除组织块,用含0.125%胰酶-0.01%EDTA细胞消化液消化细胞,进行初次原瓶传代(P1),待细胞长至60%~70%融合度时,二次传代(3 000 个细胞/cm2)或冻存。取3~5代HUMSCs 用于实验。
1.2.2慢病毒表达载体的构建cDNA片段scFvCD20-sTRAIL,ISZ-sTRAIL,scFvCD20及CopGFP通过PCR扩增后克隆入慢病毒载体pCDH1-MSC1-EF1-copGFP(Cat.No.CD511A-1,System Biosciences,SBI,USA)。ScFvCD20序列是由嵌合抗体anti-CD20 Fab的轻重链可变区通过柔性肽(G4S)3利用重叠PCR技术融合。人sTRAIL胞外区序列(114-281氨基酸残基)由PBMCs的mRNA通过RT-PCR扩增获得。并将编码序列为ATGAAGCAGATCGAGGACAAAATTGAGGAAATCCTG-TCCAAGATTTACCACATCGAGAACGAGATCGCCCG-GATTAAGAAACTCATTGGCGAGAGGGAA的异亮氨酸拉锁序列(Isoleucine zipper,ISZ)通过PCR连入sTRAIL序列N端(ISZ-sTRAIL)。CopGFP序列克隆自慢病毒表达载体pCDH1-MSC1-EF1-copGFP,并将此序列插入scFvCD20与sTRAIL间,作为荧光及Western blot 检测标记。所构建载体均由上海英潍捷基测序确认。
1.2.3慢病毒表达载体瞬时转染293T细胞根据Lipofectamine 2000 (Invitrogen)说明书的操作步骤将慢病毒表达载体pLenR.scFvCD20:sTRAIL、 pLenR.ISZ-sTRAIL、pLenR.scFvCD20及pLenR.cop GFP分别转染至293T细胞中,48 h后收集培养上清,并于4℃离心,去除残留细胞后用于后续体外实验。
1.2.4包装慢病毒及感染HUMSCs高效表达融合蛋白ScFvCD20:sTRAIL根据SBI慢病毒包装手册的指导于293T细胞中包装慢病毒颗粒。具体过程如下,在转染前17 h将数量为6×106的 293T细胞接种至10 cm 培养皿中。将20 μl(10 μg)pPACK-Packaging plasmid mix和2 μg慢病毒表达载体共同加入至400 μl 无血清培养基Opti-MEM(Gibco)中;同时将30 μl Lipofectamin 2000转染试剂加至另外400 μl 无血清培养基Opti-MEM,混匀后室温放置5 min;接着将稀释后的Lipofectamine 2000加入DNA复合物中,轻柔倒置混匀,室温孵育20 min后将转染复合物加入培养皿中的293T细胞。转染后48 h收集培养上清,并将含病毒颗粒的上清于4℃离心,并经0.45 μm孔径滤膜(Millipore)过滤去除细胞碎片后直接用于感染HUMSCs或于-80℃条件下保存。
将HUMSCs按每瓶2×105的密度接种于T-25塑料培养瓶中,第二天将培养基换成3 ml含慢病毒颗粒及终浓度为8 μg/ml Polybrene(Sigma)的新鲜培养基(MOI=8),8 h后再换成新鲜含10%FCS的DF-12培养基以终止感染。感染48 h后于荧光显微镜下观察HUMSCs,并在感染后第5天通过蛋白免疫印迹检测目的蛋白的表达水平。细胞收集后用含PMSF的RIPA(碧云天)裂解液裂解细胞提取蛋白,通过BCA蛋白定量试剂盒测定蛋白浓度。不同分子量蛋白变性后通过SDS聚丙烯酰胺凝胶电泳分离,进而通过电转移至NC膜。再将膜上的蛋白分别与一抗anti-copGFP(CST)以及偶联辣根过氧化酶的二抗孵育,膜最后于暗室中曝光至X-胶片中以显示目的条带。
1.2.5融合蛋白ScFvCD20:sTRAIL对细胞增殖的抑制作用将细胞按每孔8×103的密度接种于96孔板过夜培养,将293T瞬转上清的目的蛋白按照不同浓度加入培养基中,作用72 h后通过CCK-8(Dojindo)试验检测细胞的存活,于synergy H4酶标仪(BioTek,USA)中测定每孔在450 nm处的吸光度。细胞存活率=(OD测量组-OD零孔)/(OD空白组-OD零孔)×100% 。
1.2.6MSC.scFvCD20:sTRAIL对NOD/SCID小鼠移植性CD20+BJAB 细胞淋巴瘤模型的治疗作用选用NOD/SCID小鼠,雌性,5~6周龄,以260 cGy/只剂量进行γ射线照射。实验分为6组,每组5只NOD/SCID鼠。收集对数生长期的BJAB细胞,冷PBS洗涤2次后,按每只1×107细胞数(200 μl)的剂量接种至NOD/SCID小鼠右前肢根部背侧皮下。待肿瘤长至一定体积时进行如下分组给药:(a) 5×105MSC.scFvCD20-sTRAIL,i.v.(b) 5×105MSC.ISZ-sTRAIL,i.v.(c) 5×105MSC.scFvCD20,i.v.(d) 5×105MSC.CON,i.v.(e) 5×105HUMSCs,i.v.(f) PBS,i.v.自开始治疗起,每隔3 d用游标卡尺测量小鼠移植瘤模型的肿瘤直径,动态观察药物的抗肿瘤效应。肿瘤体积的计算公式如下:V=1/2×a×b2(a和b分别为肿瘤的长径和短径)。同时在结束治疗后小鼠眼眶取血,检测各组中ALT及AST水平。
2结果
2.1慢病毒表达载体的构建成功构建了慢病毒表达载体pLentR.scFvCD20:sTRAIL、pLenR.ISZ-sTRAIL、pLenR.scFvCD20及pLenR.copGFP(图1A)。sTRAIL片段由编码TRAIL蛋白的第114~281个氨基酸残基构成的具有分泌和功能性的结构部分,我们还在其N末端加上了一个异亮氨酸拉锁以促进sTRAIL形成具有活性的三聚体。为促进目的蛋白的分泌,所有载体均连接有编码鼠源κ轻链的信号肽序列。为检测目的蛋白的表达,我们将所构建的表达载体瞬转至293T细胞。通过TRAIL ELISA试剂盒检测结果表明pLentR.scFvCD20:sTRAIL及pLenR.ISZ-sTRAIL均表达高水平的sTRAIL[pLentR.scFvCD20:sTRAIL,(2 529±363)pg/ml;pLenR.ISZ-sTRAIL,(9 475±786)pg/ml],而在不转染或者转染其他载体的293T上清均未检测到sTRAIL(图1B)。融合蛋白scFvCD20:sTRAIL在自然状态下大多为三聚体形式,加入β-巯基乙醇(β-ME)后还原成单体形式(图1C)。
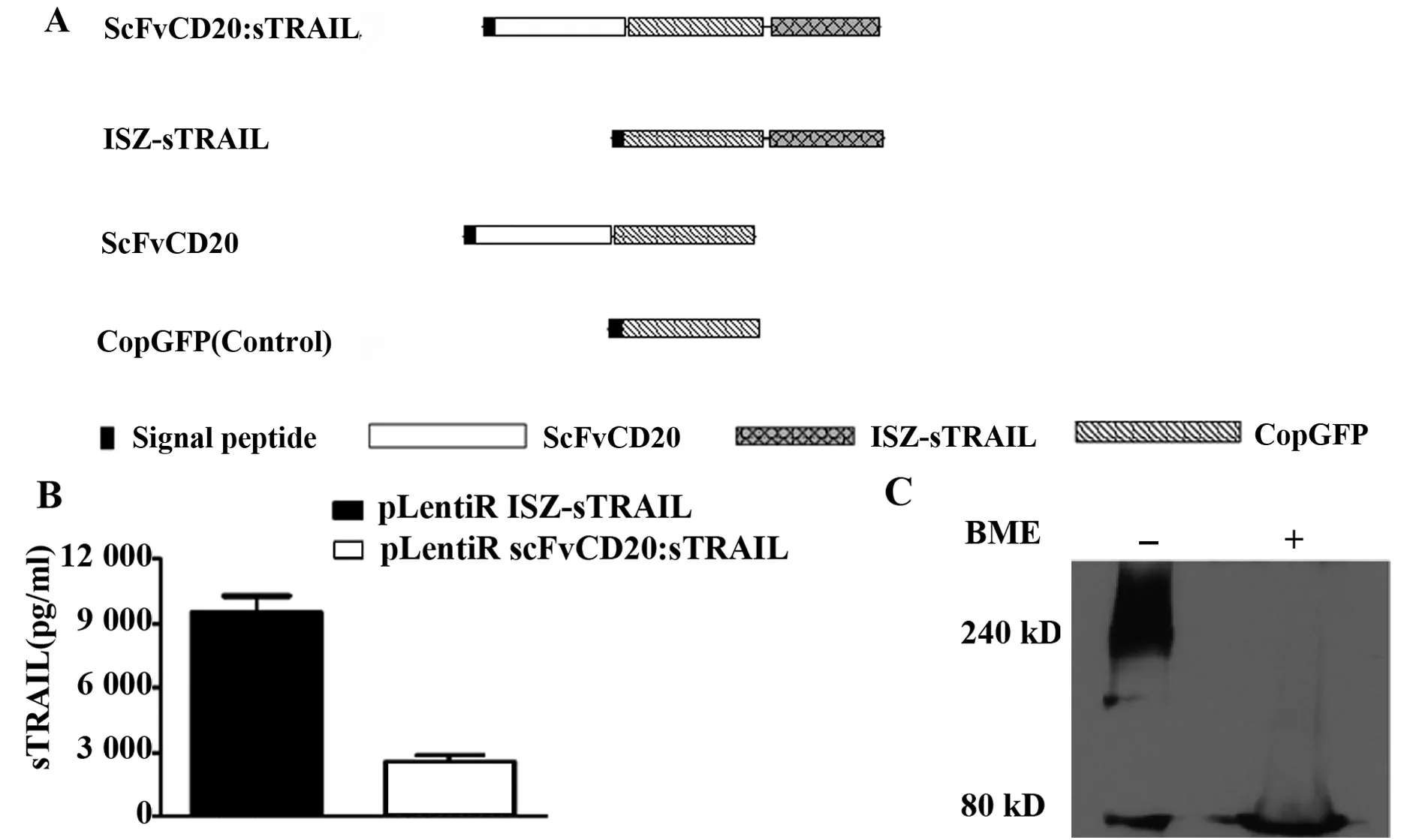
图1 慢病毒表达载体的构建及融合蛋白scFvCD20:sTRAIL的表达Fig.1 Construction of lentivirus expression vectors and expression of fusion protein scFvCD20:sTRAILNote: A.Schematic representation of various DNA constructs employed in this study; B.The level of sTRAIL in 293T cells after 48 hours of transient transfection; C.Identification of trimeric scFvCD20-sTRAIL fusion protein.
2.2慢病毒感染的HUMSCs高效表达融合蛋白scFvCD20:sTRAIL 将以上慢病毒表达载体分别与包装质粒共转染293T细胞,所得病毒上清以MOI 8 感染HUMSCs。感染后48 h,荧光显微镜下观察可见绿色荧光(图2A)。感染后5 d,流式检测感染效率达83.7%(图2B)。此时收集被感染的HUMSCs的胞浆蛋白进行Western blot 检测,结果表明目的蛋白scFvCD20:sTRAIL、ISZ-sTRAIL、scFvCD20、CopGFP(Control)均在其相应的被感染的HUMSCs中表达(图2C),而且目的蛋白在上清中的分泌量在感染后第5天达到最大值(图2D)。
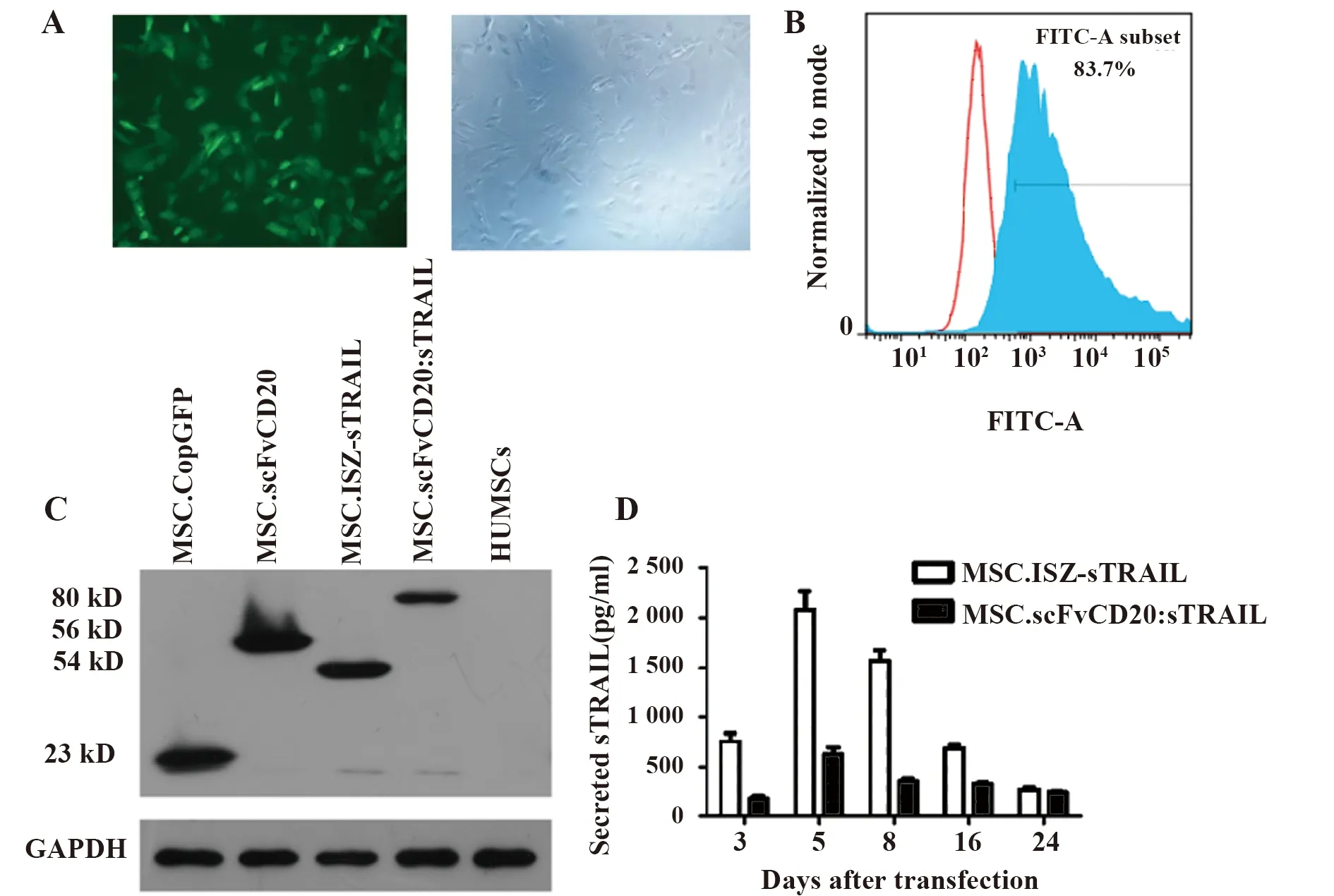
图2 HUMSCs高效表达融合蛋白scFvCD20:sTRAILFig.2 Transduced HUMSCs expressed fusion protein scFvCD20:sTRAIL efficienthyNote: A.Fluorescence of CopGFP was observed after 48 hours of transduction; B.Efficiency of transduction was assayed by flow cytometry; C.Expression of scFvCD20:sTRAIL,IST-sTRAIL and scFvCD20 protein which was fused with CopGFP gene in transduced HUMSCs was tested by Western blot using anti-CopGFP antibody after 5 days of transduction; D.MSC.scFv CD20:sTRAIL and MSC.IST-sTRAIL expressed the desired protein scFvCD20:sTRAIL or IST-sTRAIL constantly.The sTRAIL protein in MSC.scFvCD20,MSC.CopGFP or un-transduced HUMSCs was not detectable.

图3 不同浓度的融合蛋白scFvCD20:sTRAIL 在体外对细胞增殖的抑制作用Fig.3 Proliferation inhibition of fusion protein scFvCD20:sTRAIL with different concentrations in vitroNote: A.HUMSCs cells;B.BJAB cells;C.Raji cells;D.Jurkat cells;E.PBMC cells.*.P< 0.05;**.P< 0.01;#.P< 0.05;##.P<0.01.
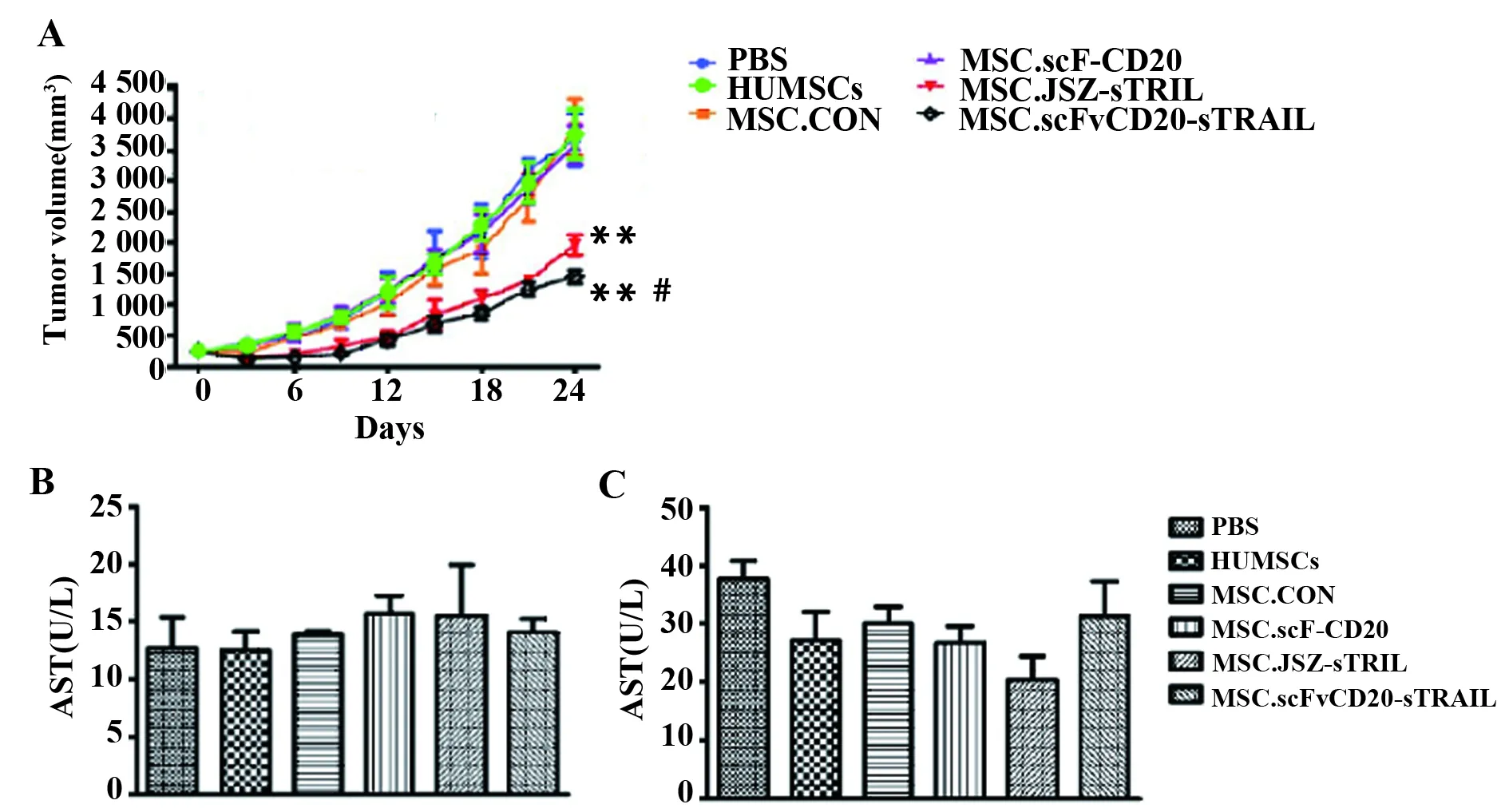
图4 MSC.scFvCD20:sTRAIL对NOD/SCID小鼠移植性CD20+BJAB细胞淋巴瘤模型的治疗作用Fig.4 Treatment of MSC.scFvCD20:sTRAIL in NOD/SCID mice bearing tumor with CD20+BJAB cellsNote: A.Effect of MSC.scFvCD20:sTRAIL on tumor growth; B.Safety of engineered HUMSCs infusion.Columns,mean; bars,SD.**.P<0.01 compared with PBS group;#.P<0.05 compared with MSC.IST-sTRAIL treated group;ALT.Alanine aminotransferase;AST.Aspartate aminotransferase.
2.3融合蛋白scFvCD20:sTRAIL在体外对细胞增殖的抑制作用CCK8细胞增殖抑制实验表明,scFvCD20:sTRAIL 及ISZ-sTRAIL对HUMSCs生长无明显抑制作用,与对照组(CopGFP组)比较,不存在统计学差异(P>0.05)(图3A)。ScFvCD20:sTR-AIL可呈浓度依赖性地抑制CD20阳性TRAIL敏感的BJAB细胞的生长,高中低三个浓度的scFvCD20:sTRAIL 处理细胞后细胞生存率分别从ISZ-sTRAIL处理的56.8%、76.8% 和80.7%下降至scFvCD20:sTRAIL 处理的40.0%、49.2% 和65.2%,分别两两比较,均具有高度统计学差异(P<0.01)(图3B)。同时ScFvCD20:sTRAIL可在一定程度上改善CD20 阳性TRAIL耐受的Raji 细胞对TRAIL的敏感性,使其生长抑制率提高,与空载体组比较,具有显著性意义(P<0.05),但与ISZ-sTRAIL 组比较,无显著性意义(P>0.05)(图3C)。而对于CD20 阴性TRAIL 敏感的Jurkat细胞,与ISZ-sTRAIL 组比较,scFvCD20:sTRAIL处理细胞后其生长抑制率反而下降,两者比较具有统计学差异(P<0.01)(图3D)。此外,为检测scFvCD20:sTRAIL 是否对血液系统细胞具有潜在毒性,我们用scFvCD20:sTRAIL处理正常人PBMCs,结果显示scFvCD20:sTRAIL对PBMCs生长无明显影响(P>0.05)(图3E)。
2.4MSC.scFvCD20:sTRAIL 对CD20+BJAB 细胞移植性淋巴瘤模型的治疗当肿瘤长至一定体积时,感染了不同慢病毒颗粒的HUMSCs经尾静脉注射入小鼠体内,每隔3 d测量肿瘤。结果表明,治疗后第3 天,即可见MSC.scFvCD20:sTRAIL与MSC.ISZ-sTRAIL 治疗组肿瘤体积较对照组减小,随着饲养时间的延长,这一趋势更为明显(P<0.01),且MSC.scFvCD20:sTRAIL对肿瘤增殖的抑制作用较MSC.ISZ-sTRAIL 更强(P<0.05)(图4A)。在治疗后第24天,MSC.scFvCD20:sTRAIL治疗组的肿瘤抑制率为65.2%,高于MSC.ISZ-sTRAIL(52.7%)、MSC.scFvCD20(13.9%)、MSC.CON(10.7%)及PBS(10.5%)对照组。曾有报道表明TRAIL能导致正常肝脏细胞的死亡[9],因此为了进一步评价此双重靶向系统在体内应用中可能造成的肝毒性。在治疗后第24天,各治疗组及PBS组小鼠血浆中ALT及AST未发生明显改变(P>0.05)(图4B、C),说明MSC.scFvCD20:sTRAIL治疗系统对肝脏无毒副作用。
3讨论
近年来,随着对肿瘤发病机制、信号传导通路的不断深入研究和基因工程技术的飞速发展,不断涌现出针对肿瘤治疗的新靶点和新策略。研究发现位于体内组织特定龛中的MSCs 能够被招募至组织损伤或是炎症部位[10],这一特点使得MSCs 已被作为基因治疗的运输工具,MSCs可将抗肿瘤药物如细胞因子、凋亡诱导剂、干扰素、前药等运送至肿瘤部位从而抑制肿瘤生长[11,12]。目前,已有几个研究小组报道了将骨髓、脂肪以及脐带血来源的MSCs通过病毒感染的方法使其表达凋亡诱导基因TRAIL用于脑胶质瘤、宫颈癌以及胰腺癌等的治疗,并取得了良好效果[13-16]。而对于人脐带组织WJ来源的MSCs介导的肿瘤靶向治疗知之甚少。HUMSCs 除具有传统骨髓来源的MSCs(BMMSCs)的特点外还拥有其自身的优点。HUMSCs的使用不涉及伦理学问题,且能非常方便地进行大批量分离,HUMSCs具有相对快速的增殖速度,广泛的分化潜能,能在体外较长的培养时间内(9~10代)保持干性,较低的免疫原性,无致瘤性[17-20]。HUMSCs 越来越受到临床应用及基础研究的重视。根据HUMSCs可向肿瘤部位归巢以及融合了特异性抗体scFv 片段的sTRAIL (scFvCD20:sTRAIL)具有靶向性杀伤作用的特点,本实验设计了一种全新的双重靶向治疗体系——具有分泌scFvCD20:sTRAIL 融合蛋白能力的HUMSCs。在此体系中,一方面,HUMSCs可高效准确地定位于肿瘤部位(另文发表),在局部分泌融合蛋白scFvCD20:sTRAIL;另一方面,局部浓度升高的scFvCD20:sTRAIL 发挥其强大的CD20 特异性的抗肿瘤作用,而对正常组织器官不造成毒副作用。本研究的意义在于:在以HUMSC作为靶向治疗的载体的基础上设计了一种新型的能诱导抗原特异性肿瘤细胞发生凋亡的融合蛋白scFvCD20:sTRAIL表达的双重靶向治疗体系。
ScFvCD20:sTRAIL、ISZ-sTRAIL、scFvCD20、CopGFP四种蛋白来自相应的慢病毒表达载体瞬转293T细胞后48 h收集的细胞培养基上清。CCK8细胞增殖抑制实验表明,scFvCD20:sTRAIL对HUMSCs生长无明显抑制作用,并可呈浓度依赖性地抑制CD20阳性TRAIL敏感的BJAB细胞的生长,还可在一定程度上改善CD20阳性TRAIL耐受的Raji细胞对TRAIL的敏感性,使其生长抑制率提高,而对于CD20阴性TRAIL敏感的Jurkat细胞,经scFvCD20:sTRAIL 处理后其生长抑制率反而下降。此外,为了检测ScFvCD20:sTRAIL 是否对血液系统细胞具有潜在毒性,用ScFvCD20:sTRAIL 处理正常人PBMCs,结果显示ScFvCD20:sTRAIL 对PBMCs生长无明显影响。由HUMSCs 运载到达肿瘤部位的融合蛋白scFvCD20:sTRAIL 避免了对其他正常组织器官的不良反应。同时,局部富集的scFvCD20:sTRAIL 在scFvCD20特异的导向作用下既提高了抑瘤效率又避免了对瘤旁正常细胞的毒副作用。与ISZ-sTRAIL相比,scFvCD20:sTRAIL 对CD20阳性的BJAB细胞移植瘤的生长抑制与已报道的scFv:sTRAIL融合蛋白抑瘤作用的特点相似。
本研究利用真核细胞表达抗肿瘤蛋白,同时又利用了HUMSCs 的归巢性。一方面HUMSCs 靶向肿瘤部位,既降低了给药浓度(所需注射细胞数量),又避免了凋亡诱导因子对正常组织器官的影响;另一方面局部释放的scFvCD20:sTRAIL 由于其抗原特异性使瘤旁正常组织细胞免受损伤,从而达到高效、安全的目的。MSC.scFvCD20:sTRAIL强大的抑瘤作用归功于双重靶向治疗系统的巧妙设计,这一系统使整个治疗过程得到了最佳优化。
参考文献:
[1]Van Meerten T,Hagenbeek A.CD20-targeted therapy:a breakthrough in the treatment of non-Hodgkin’s lymphoma[J].Neth J Med,2009,67(7):251-259.
[2]Cragg MS,Glennie MJ.Antibody specificity controls in vivo effector mechanisms of anti-CD20 reagents[J].Blood,2004,103(7):2738-2743.
[3]Stashenko P,Nadler LM,Hardy R,etal.Characterization of a human B lymphocyte-specific antigen[J].J Immunol,1980,125(4):1678-1685.
[4]Nadler LM,Korsmeyer SJ,Anderson KC,etal.B cell origin of non-T cell acute lymphoblastic leukemia:a model for distance stages of neoplastic and normal pre-B cell differentiation[J].J Clin Invest,1984,74(2):332-340.
[5]Atkins GJ,Bouralexis S,Evdokiou A,etal.Human osteoblasts are resistance to Apo2L/TRAIL-mediated apoptosis[J].Bone,2002,31(4):448-456.
[6]Roura S,Pujal JM,Bayes-Genis A.Umbilical cord blood for cardiovascular cell therapy:from promise to fact[J].Ann N Y Acad Sci,2012,1254:66-70.
[7]Vilalta M,Degano IR,Bago J,etal.Biodistribution,long-term survival,and safety of human adipose tissue-derived mesenchymal stem cells transplanted in nude mice by high sensitivity non-invasive bioluminescence imaging[J].Stem Cells Dev,2008,17(5):993-1003.
[8]Gotherstrom C,Ringden O,Tammik C,etal.Immunologic properties of human fetal mesenchymal stem cells[J].Am J Obstet Gynecol,2004,190(1):239-245.
[9]Jo M,Kim TH,Seol DW,etal.Apoptosis induced in normal human hepatocytes by tumor necrosis factor-related apoptosis-inducing ligand[J].Nat Med,2000,6(5):564-567.
[10]Chamberlain G,Fox J,Ashton B,etal.Concise review:mesenchymal stem cells:their phenotype,differentiation capacity,immunological features,and potential for homing[J].Stem Cells,2007,25(11):2739-2749.
[11]Fritz V,Jorgencen C.Mesenchymal stem cells:an emerging tool for cancer targeting and therapy[J].Curr Stem Cell Ther,2008,3(1):32-42.
[12]Prockop DJ.Repair of tissues by adult stem/progenitor cells(MSCs):controversies,myths,and changing paradigms[J].Mol Ther,2009,17(6):939-946.
[13]Choi SA,Hwang SK,Wang KC,etal.Therapeutic efficacy and safety of TRAIL-producing human adipose tissue-derived mesenchymal stem cells against experimental brainstem glioma [J].Neur Oncol,2011,13(1):61-69.
[14]Grisendi G,Bussolari R,Cafarelli L,etal.Adipose-derived mesenchymal stem cells as stable source of tumor necrosis factor-related apoptosis-inducing ligand delivery for cancer therapy[J].Cancer Res,2010,70(9):3718-3729.
[15]Loebinger MR,Eddaoudi A,Davies D,etal.Mesenchymal stem cells delivery of TRAIL can eliminate metastatic cancer[J].Cancer Res,2009,69(10):4134-4142.
[16]Kim SM,Lim JY,Park SI,etal.Gene therapy using TRAIL-secreting human umbilical cord blood-derived mesenchymal stem cells against intracranial glioma[J].Cancer Res,2008,68(23):9614-9623.
[17]Fong CY,Subramanian A,Biswas A,etal.Derivation efficiency,cell proliferation,freeze-thaw survival,stem-cell properties and differentiation of human wharton’s jelly stem cells[J].Reprod Biomed Online,2010,21(3):391-401.
[18]Fong CY,Richards M,Manasi N,etal.Comparative growth behaviour and characterization of stem cells from human Wharton′s jelly[J].Reprod Biomed Online,2007,15(6):708-718.
[19]Gauthaman K,Fong CY,Suganya CA,etal.Extra-embryonic human Wharton′s jelly stem cells do not induce tumorigenesis,unlike human embryonic stem cells[J].Reprod Biomed Online,2012,24(2):235-246.
[20]Fong CY,Chak LL,Biswas A,etal.Human Wharton′s jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells[J].Stem Cell Rev,2011,7(1):1-16.
[收稿2015-09-21修回2015-10-16]
(编辑许四平)
doi:10.3969/j.issn.1000-484X.2016.07.002
作者简介:范冬梅(1969年-),女,副主任技师,主要从事肿瘤免疫学方面研究,E-mail:fdm19691217@163.com。 通讯作者及指导教师:熊冬生(1961年-),男,硕士,教授,博士生导师,主要从事肿瘤免疫学研究,E-mail:dsxiong@ihcams.ac.cn。
中图分类号R735.7
文献标志码A
文章编号1000-484X(2016)07-0939-06
Human umbilical cord-drived mesenchymal stem cells as vehicles of CD20 specific-TRAIL fusion protein against non-Hodgkin’s lymphoma
FAN Dong-Mei,ZHANG Xiao-Long,ZHANG Qing,LU Yang,YANG Yuan-Yuan,YUAN Xiang-Fei,ZHANG Yan-Jun,XIONG Dong-Sheng .
State Key Laboratory of Experimental Hematology,Insitute of Hematology & Hospital of Blood Diseases,Chinese Academy of Medical Sciences & Peking Union Medical College,Tianjin 300020,China
[Abstract]Objective:To study the therapeutic effect of a novel double-target system,in which human umbilical cord-derived MSCs were used as vehicles to deliver fusion protein scFvCD20:sTRAIL to non-Hodgkin’s lymphoma.Methods: The traditional methods in molecular biology were used to construct lentivirus expression vectors pLenR.scFvCD20:sTRAIL and contrast vectors.Human umbilical cord-derived MSCs (HUMSCs) were labeled with the copGFP by transducing with pseudo viral particles which had been packaged in 293T cells with four plasmid-lentivirus packaging system.Fusion protein scFvCD20:sTRAIL were secreted from MSC.scFvCD20:sTRAIL after that HUMSCs were infected by pseudo viral particles.CCK8 assay was applied to detect the antigen-restricted cell death induced by scFvCD20:sTRAIL in CD20-positive BJAB and Raji cells as well as CD20-negtive Jurkat cells and human normal peripheral blood mononuclear cells (PBMCs).To evaluate the therapeutic effect of MSC.scFvCD20:sTRAIL in vivo,genetically modified HUMSCs were intravenously injected into tumor-bearing mice with BJAB cells.The volume of tumor was measured every three days,and the inhibition ratio of tumor was calculated according to tumor volume.Results: Lentivirus expression vectors pLenR.scFvCD20:sTRAIL,pLenR.ISZ:sTRAIL,pLenR.scFvCD20 and pLenR.CopGFP were successfully constructed and these constructs could be expressed stably in HUMSCs by lentivirus transduction.scFvCD20:sTRAIL fusion protein produced a potent inhibition of cell proliferation in CD20-positive BJAB cells,moderate inhibition of the growth of Raji cells,and weak inhibition in CD20-negtive Jurkat cells when compared with ISZ-sTRAIL treatment,and it had no effect on normal human peripheral blood mononuclear cells (PBMCs). The MSC.scFvCD20:sTRAIL treatment significantly inhibited the tumor growth when compared with those treated with MSC.ISZ-sTRAIL. Conclusion: A double-target therapeutic system is well established,in which HUMSCs migrated to tumor site,secreted a novel fusion protein scFvCD20:sTRAIL,and thus locally concentrated scFvCD20:sTRAIL extended antigen-restricted anti-tumor activity.The engineered HUMSCs secreting scFvCD20:sTRAIL showed potent effect on inhibiting tumor growth in BJAB lymphoma malignancy,which may play an essential role in the clinical research .
[Key words]Mesenchymal stem cell; CD20; TRAIL; Non-Hodgkin’s lymphoma;Tumor immunity
①本文受国家自然科学基金项目资助(81400176)和天津市应用基础与前沿技术研究计划资助项目(14JCYBJC23700)。