肝细胞癌ARF-BP1基因治疗影响HepG2细胞凋亡的相关性分析
2016-08-08张法标方哲平
张法标 方哲平★
肝细胞癌ARF-BP1基因治疗影响HepG2细胞凋亡的相关性分析
张法标 方哲平★
目的 探讨肝细胞癌ARF-BP1基因对HepG2细胞凋亡的影响。方法 随机将对数生长期的HepG2细胞分为细胞转染组、脂质体对照组、阴性对照组和空白对照组,将100nmol/L ARF-BP1 siRNA采用脂质体包裹计数,转染至HepG2细胞;脂质体对照组不加siRNA片段,只加脂质体;转染阴性siRNA片段为阴性对照组;空白对照组加入等量培养基,不加siRNA片段和脂质体。各组ARF-BP1干扰后不同时间HepG2细胞的增殖情况采用四甲基偶氮哇蓝光吸收法测定,各组转染72h后HepG2细胞周期及细胞凋亡采用流式细胞术检测,RF-BP1 siRNA转染组和空白对照组不同时间点ARF-BP1 mRNA、p53 mRNA、mcl-1 mRNA表达水平采用RT-PCR法检测。结果 在24h、48h和72h,ARF-BP1对转染组的HepG2细胞抑制效率逐渐增强(P<0.05);各时间点细胞增殖情况转染组<脂质体对照组<阴性对照组<空白对照组(P<0.05)。转染72h后,HepG2细胞凋亡率为转染组>脂质体对照组>阴性对照组>空白对照组;G1期细胞转染组<脂质体对照组<阴性对照组<空白对照组,G2期细胞转染组>脂质体对照组>阴性对照组>空白对照组(P<0.05)。在ARF-BP1 siRNA转染72h后,p53mRNA和mcl-1 mRNA的相对表达低于空白对照组(P<0.05)。结论 ARF-BP1基因在HepG2中被降低表达可促进HepG2凋亡。
肝细胞癌 ARF-BP1基因 HepG2细胞
近年来研究证实,细胞周期调控、细胞增殖或凋亡的调节异常参与恶性肿瘤的发生发展过程,多数学者认为部分细胞因子的异常表达导致的细胞凋亡及细胞增殖信号通路的激活,显著参与肝癌的发展演变过程中[1]。而ARF-BP1基因作为HECT结构域家族的泛素连接酶,显著参与DNA损伤修复、细胞周期调控及促进相关受损细胞凋亡等过程[2]。2013年8月至2015年1月作者通过实验分析ARF-BP1 siRNA转染肝细胞癌HepG2细胞株后相应的细胞增殖、凋亡以及相关基因转录水平的表达,揭示ARF-BP1基因在肝细胞癌发生发展中的作用。报道如下。
1 材料和方法
1.1 主要试剂和仪器 肝细胞癌HepG2细胞株购自中国科学院上海细胞生物学研究所;脂质体LipofectamineTM2000、Control siRNA和带荧光标记的特异性siRNA 片段购自美国Invitrogen公司;凯基AnneXinV-FITC细胞凋亡检测试剂盒、碘化丙啶(PI) 试剂盒、胰蛋白酶(TryPsin)购自上海吉玛制药技术有限公司。 流式细胞仪(美国BD公司),全自动酶标仪(美国BioTek公司),倒置相差显微镜(日本Olympus公司),台式低温离心机(德国 Eppendorf公司),电子恒温CO2培养箱(美国 SHELLAB 公司),小型高速离心机(美国Thermo公司)。
1.2 细胞检测方法 细胞增殖检测 肝细胞癌HepG2细胞生长至融合度为90%时,用胰蛋白酶EDTA消化液消化细胞,加入适当培养基,吹匀后细胞计数,使细胞最终密度为1×105/ml,96孔板每孔加入100μl吹匀后的细胞,置于37℃、5%CO2饱和湿度的培养箱中培养,并设置6复孔,在37℃、5%CO2饱和湿度的培养箱中共培养,24h后每孔加入10 μl新型细胞增殖及毒性检测溶液CCK-8(南京凯基生物科技有限公司),置于37℃培养箱中孵育2h,酶标仪在450 nm波长处检测每孔的吸光度OD值。(1)细胞周期以及凋亡检测:肝细胞癌HepG2细胞培养至融合度为50%时,用胰蛋白酶消化液(不含EDTA)消化细胞,离心收集细胞后用PBS洗涤细胞1次(2000r/min,离心5min),300μl的1×Binding Buffer悬浮细胞,之后加入5μl Annexin V-FITC混匀后,避光,室温孵育15min,上机前5min再加入5μl的PI染色,避光放置10min,流式细胞仪检测各组凋亡率。细胞周期检测:收集细胞,用PBS洗涤细胞1次(2000r/min,离心5min),收集1×106细胞,加入70%的冷乙醇500μl固定,4℃过夜,染色前用PBS洗去固定液,加入100μl RNase A 37℃水浴30min,再加入400μl PI染色混匀,4℃避光30min,上机检测,记录继发波长488nm处红色荧光。分别统计各组细胞的死亡率(PI+,%)和细胞周期(G0/G1期,S期和G2/M期)。(2)荧光定量PCR检测:采用南京凯基生物科技有限公司生产的RNA提取试剂盒提取,takara试剂盒逆转录为cDNA(引物体系2μl),takaraSYBN荧光定量PCR试剂盒扩增mRNA。PCR反应条件:预变性95℃30s;PCR反应95℃5s,60℃30s,循环40次,溶解曲线:95℃5s,60℃1min,95℃0s,降温:40℃30s。
1.3 统计学方法 采用SPSS 23.0软件。计量资料以(±s)表示,用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 ARF-BP1干扰后不同时间HepG2细胞的增殖情况 在24h、48h和72h,ARF-BP1对转染组的HepG2细胞抑制效率逐渐增强(P<0.05);各时间点细胞增殖情况转染组<脂质体对照组<阴性对照组<空白对照组(P<0.05)。见表1。
表1 ARF-BP1干扰后不同时间HepG2细胞的增殖情况(±s)

表1 ARF-BP1干扰后不同时间HepG2细胞的增殖情况(±s)
注:与脂质体对照组比较,aP<0.05;与阴性对照组比较,bP<0.05;与空白对照组比较,cP<0.05;与组内前一时间点比较,dP<0.05
组别 24h 48h 72h A值 抑制率(%) A值 抑制率(%) A值 抑制率(%)转染组 0.14±0.03abc 36.36d 0.16±0.05 abcd 55.56d 0.20±0.05 abcd 60.78d脂质体对照组 0.17±0.05bc 13.64 0.31±0.08bcd 13.89 0.41±0.07bcd 19.61阴性对照组 0.20±0.03c 9.09 0.33±0.05cd 8.33 0.43±0.08cd 15.69空白对照组 0.22±0.04 0.00 0.36±0.07d 0.00 0.51±0.04d 0.00
2.2 转染72h后HepG2细胞周期及细胞凋亡比较 转染72h后,HepG2细胞凋亡率为转染组>脂质体对照组>阴性对照组>空白对照组;G1期细胞转染组<脂质体对照组<阴性对照组<空白对照组,G2期细胞转染组>脂质体对照组>阴性对照组>空白对照组,(P<0.05)。见表2。
表2 转染72h后HepG2细胞周期及细胞凋亡比较(±s)

表2 转染72h后HepG2细胞周期及细胞凋亡比较(±s)
注:与脂质体对照组比较,aP<0.05;与阴性对照组比较,bP<0.05;与空白对照组比较,cP<0.05
组别 G1期 S期 G2期 凋亡率(%)转染组 26.90±2.28 abc 38.76±0.92 32.36±2.38 abc 26.21±1.32 abc脂质体对照组 38.46±3.71 bc 38.20±1.14 20.24±1.74 bc 4.38±0.53bc阴性对照组 40.59±2.93 c 37.91±0.99 18.25±0.43 c 3.17±0.35c空白对照组 44.75±1.07 38.42±1.68 17.10±0.85 1.54±0.16
2.3 ARF-BP1 siRNA转染后不同时间点ARF-BP1 mRNA、p53 mRNA、mcl-1 mRNA表达水平比较 在ARF-BP1 siRNA转染 72h后,p53mRNA和 mcl-1 mRNA的相对表达低于空白对照组(P<0.05)。见表3。
表3 ARF-BP1 siRNA转染后不同时间点ARF-BP1 mRNA、p53mRNA、mcl-1 mRNA表达水平比较(±s)
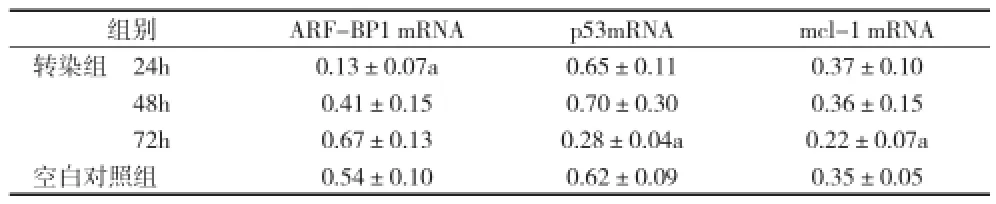
表3 ARF-BP1 siRNA转染后不同时间点ARF-BP1 mRNA、p53mRNA、mcl-1 mRNA表达水平比较(±s)
注:与空白对照组比较,aP<0.05
组别 ARF-BP1 mRNA p53mRNA mcl-1 mRNA转染组 24h 0.13±0.07a 0.65±0.11 0.37±0.10 48h 0.41±0.15 0.70±0.30 0.36±0.15 72h 0.67±0.13 0.28±0.04a 0.22±0.07a空白对照组 0.54±0.10 0.62±0.09 0.35±0.05
3 讨论
近年来,恶性肿瘤基础性理论研究认为信号通路异常以及相关细胞早期调控异常显著参与恶性肿瘤的发生发展过程,当细胞水平发生增殖或者凋亡异常时,相关细胞的癌变以及自身免疫性疾病的发生显著升高[3]。 而泛素连接酶被多数学者认为参与恶性肿瘤如肝细胞肝癌的发生发展过程。Zhu X等[4]学者认为,MDM2泛素通过抑制P53mRNA水平的表达减少P53蛋白的翻译,进而促进细胞增殖、抑制细胞凋亡,而Kang F等[5]学者通过siRNA技术干扰肝细胞癌HepG2细胞株后发现,PI3K/AKT/CMYC信号通路异常活化,同时还发现,转染MDM2泛素基因后,肝癌HepG2细胞株内Notch信号通路内活性区域(NICD)蛋白水平表达显著升高,而下游相关转录调节因子HES-1异常活化,从而导致细胞增殖、凋亡抑制等效应。但迄今为止,对于ARF-BP1 泛素基因的研究较少,贾中芝等[6]发现,在部分肝细胞肝癌特别是小肝癌以及结节型肝癌病例中,ARF-BP1 泛素基因的表达相比于正常肝细胞平均升高(3.76±0.45)倍,李玉梅等[7]认为ARF-BP1 泛素基因翻译后蛋白水平的表达能显著升高,并认为ARF-BP1 泛素蛋白水平的表达能作为预测肝细胞癌术后<5年复发率及无瘤生存率的独立风险因素。
本资料显示,24h、48h和72h,ARF-BP1对转染组的HepG2细胞抑制效率逐渐增强,各时间点细胞增殖情况转染组<脂质体对照组<阴性对照组<空白对照组,提示本试验成功转染ARF-BP1-siRNA,相关细胞活力检测结果提示转染ARF-BP1-siRNA后,细胞增殖明显被抑制,这与Izzo F等[8]认识一致,Izzo F等在肝胆管细胞癌中干扰ARF-BP1基因后,采用MTT法测定细胞增殖活力,结果提示随着干扰剂量的增加,相关细胞凋亡水平显著升高,并体现出了一定的剂量依赖性;而本资料对于转染ARF-BP1-siRNA后,HepG2细胞凋亡率检测提示转染组>脂质体对照组>阴性对照组>空白对照组,进一步证实该结论。Izzo F等进一步研究后发现,ARF-BP1抑制细胞凋亡的途径可能与交错连接至P53抑癌基因mRNA转录水平的启动子区域有关,ARF-BP1通过干扰P53基因上游启动子区域与其他调节性细胞因子的的结合来抑制P53基因以及相关蛋白翻译水平的表达,而刘瑞磊等[9]学者发现,转染ARF-BP1-siRNA后,肝细胞癌细胞株HepG2细胞周期G2期比例显著上升,而G1期细胞比例显著下降,这与本资料结论一致,提示ARF-BP1可能通过PI3K/AKT信号通路或者抑制P53基因的表达来促进细胞停滞于G2期,并显著减缓细胞由G1期进入S期的速率[10,11]。另外突变型P53以及mcl-1 的表达显著降低,提示ARF-BP1-siRNA成功转染后,相关抗肿瘤细胞凋亡因子表达呈现不同程度以及不同时间节点的下降,提示ARF-BP1可能与突变型P53基因以及BCL-2家族基因mcl-1 具有协调作用[10,12]。
1 江颖,周信达,刘银坤,等. 选择性阻断异常Wnt信号通路对肝癌细胞生长及侵袭的影响. 复旦学报(医学版),2010,23(02):146~152.
2 王子豪,段菲,江翰,等.抑制Hedgehog信号通路对肝细胞癌细胞生长和迁移的影响. 中华实用诊断与治疗杂志,2014,32(10):979~982.
3 覃新干,罗殿中,吕自力,等.ARF-BP1基因对肝癌HepG2细胞凋亡的影响及其机制探讨. 山东医药,2014,37(32):4~6.
4 Zhu X, Wu L, Yao J, et al. MicroRNA let-7c Inhibits Cell Proliferation and Induces Cell Cycle Arrest by Targeting CDC25A in Human Hepatocellular Carcinoma. PLOS ONE,2015,10(4):242~266.
5 Kang F, Wang L, Jia H, et al. B7-H3 promotes aggression and invasion of hepatocellular carcinoma by targeting epithelial-to-mesenchymal transition via JAK2/STAT3/Slug signaling pathway. Cancer Cell Intern ational,2015,15(1):112~132.
6 贾中芝,冯耀良. p53基因在肝细胞癌治疗中的现状与展望. 国际医学放射学杂志,2009,21(2):157~159.
7 李玉梅,汪蕊,欧玉荣,等.PTEN和p53在肝细胞癌中的表达及其相关性. 蚌埠医学院学报,2013,34(12):1551~1554.
8 Izzo F, Palaia R, Albino V, et al. Hepatocellular carcinoma and liver metastases: clinical data on a new dual-lumen catheter kit for surgical sealant infusion to prevent perihepatic bleeding and dissemination of cancer cells following biopsy and loco-regional treatments. Infectious Agents and Cancer,2015,10(1):114~132.
9 刘瑞磊,王佳妮,张鹏,等. SIAH2蛋白在肝细胞癌发生、发展中的作用研究. 中华肝脏外科手术学电子杂志,2014,21(3):189~193.
10 余元龙,周仕海,陈宏,等.高迁移率族蛋白HMGA1在肝细胞癌及胆管细胞癌中的表达差异及临床意义.中华普通外科学文献(电子版),2013,11(02):91~95.
11 覃新干,罗殿中,吕自力,等. ARF-BP1基因对肝癌HepG2细胞凋亡的影响及其机制探讨. 山东医药,2014,53(32):4~6.
12 徐军,王健,胡勇,等. 肝细胞癌组织中FoxP3~+调节性T细胞与上皮间质转化和患者预后的关系. 中国癌症杂志,2014,25(12):914~919.
Objective To investigate the effect of ARF-BP1 gene on apoptosis of HepG2 in hepatocellular carcinoma. Method s A randomized logarithmic growth phase cells transfected HepG2 cells were divided into cell transfection group,liposome control group and negative control group and the control group. the 100nmol / L ARF-BP1 siRNA using liposome count,transfected into HepG2 cells; liposome control group without siRNA fragments,just add liposome; transfected with siRNA fragment negative to negative control group; blank control group with the same amount of media,without siRNA fragments and liposomes. The proliferation of HepG2 cells at different times after each group using the interference tetramethyl ARF-BP1 Blu-ray absorptiometry azo wow,each group after transfection 72h HepG2 cell cycle and apoptosis by fl ow cytometry,RF-BP1 siRNA transfection group and control group at different time points ARF-BP1 mRNA,p53 mRNA,mcl-1 mRNA expression levels were detected by RT-PCR. Results 24h,48h and 72h,ARF-BP1 on transfected HepG2 cells inhibit effi ciency gradually increased(P<0.05). At each time point,transfected cell transfection grouP<liposome grouP<negative control grouP<blank group(P<0.05). 72h after transfection,for the HepG2 cell apoptosis rate,cell transfection group> liposome group> negative control group>control group. G1 phase cell transfection grouP<liposome grouP<negative control grouP<blank control group. G2 phase cell transfection group> liposome group> negative control group> blank control group(P<0.05). After the ARFBP1 siRNA transfection 72h,p53mRNA relative mcl-1 mRNA expression and lower than the control group(P<0.05). Conclusion ARF-BP1 gene expression in HepG2 cells is reduced can promote apoptosis of HepG2.
Hepatocellular carcinoma ARF-BP1 gene HepG2 cells
浙江省科技厅计划项目(2009C33096),浙江省台州市科技局资助项目(121ky08)
317000 浙江省台州医院肝胆外科
*
