SOST和β-catenin在不同分期膝骨关节炎患者软骨及软骨下骨表达的研究
2016-08-07吴疆吴龙马龙金群华
吴疆 吴龙 马龙 金群华
宁夏医科大学总医院骨三科,银川 750004
骨关节炎(osteoarthritis,OA)是机械性和生物性因素相互作用,使关节软骨细胞、细胞外基质和软骨下骨合成与降解的正常进行失去平衡的结果。膝骨关节炎的病因较为复杂,尽管年龄因素与OA强烈相关,但是其他因素仍然会导致OA的发生[1,2]。骨关节炎最主要的特征是关节软骨的渐进性破坏,软骨下骨变厚和边缘骨赘形成,并且这种破坏在整个关节的软组织中均有发生[3]。
在OA中,关节软骨的丢失可能与软骨下骨有关。软骨下骨和软骨解剖位置紧密相邻,位于关节软骨下方,包括皮质终板及其下方的骨小梁结构,与软骨共同维持关节形态,承受应力,而且软骨下骨可以通过生物学信息交流,对软骨,尤其是软骨深部组织的营养起着重要作用[4]。下肢负重力线随着OA疾病发展的改变直接或间接的影响了这两部分邻近组织间细胞信号的传递,从而可能会对软骨及软骨下骨产生破坏作用,加速疾病的发展[5]。
Wnt-β-catenin信号通路最初是在胚胎的形成及发育中被广泛认知的,在维持骨与软骨稳定性方面起到重要作用[6]。已有大量实验证明了Wnt信号通路在人类成骨中起到重要作用,并且β-catenin升高使成骨增加。而在人类软骨中,激活的Wnt-β-catenin信号通路会破坏软骨组织,加速OA疾病发展[7]。骨硬化蛋白, 又称SOST,由骨细胞和肥大的软骨细胞表达[8],可以抑制骨形态蛋白(BMP)分泌的同时可以通过结合LRP5/6受体抑制Wnt信号通路[9]。因此,明确在OA疾病的发展过程中,β-catenin和SOST在骨关节炎患者软骨及软骨下骨中所可能产生的变化,对于探究OA疾病的发生发展以及治疗具有重要意义。
1 材料和方法
1.1 人膝关节标本的获取
OA标本和正常标本均取自2013年10月至2015年10月就诊于宁夏医科大学总医院骨三科的患者所捐赠的内侧胫骨平台组织,经过了宁夏医科大学伦理委员会的批准(伦理编号:2015-005)。OA膝关节标本(OA组,39例,其中女性29名,男性10名,平均年龄为 61.6±6.8岁)。取自骨关节炎并内翻屈曲畸形患者的新鲜内侧胫骨平台组织,诊断标准采用美国风湿学会制定的骨关节炎诊断标准[10]。排除因创伤、类风湿等继发性膝关节骨关节炎。正常的膝关节标本(正常组,6例,其中2名女性,4名男性,平均年龄 24.7±5.9岁)。均取自因下肢毁损伤行截肢术患者的新鲜内侧胫骨平台组织,排除因糖尿病、肿瘤等原因行截肢术的患者。将术中截取的新鲜胫骨平台立即置于超净工作台,在内侧胫骨平台的中央负重区用咬骨钳取2.0×2.0×1.0 cm3大小的组织块,保留软骨及软骨下骨。置入10%中性福尔马林浸泡24 h,冲洗后常温下置于10%EDTA液中脱钙,每4d更换脱钙液,脱钙8 w。常规石蜡包埋后做4 μm连续纵行切片。
1.2 番红O-固绿染色及改良Mankin评分
将0.5 g番红O溶于95%乙醇100 mL制成0.5%番红O乙醇溶液。染液滴染2 min,镜下观察染色情况后蒸馏水冲洗掉染液,95%乙醇分化数秒,风干,二甲苯透明,中性树胶封固。置于显微镜下观察,后采用改良Mankin评分(见表1)将标本分为正常组(0~3分),中度OA组(7~9分)和重度OA组(10~12分)。

表1 关节软骨的改良Mankin评分标准Table 1 Modified Mankin score of the joint cartilage
1.3 免疫组化染色
石蜡切片经烤片、水化、抗原修复、消除内源性过氧化物酶之后,用兔源抗SOST抗体,兔源抗β-catenin抗体在37℃下孵育90 min,两步法孵育二抗后,DAB显色数秒,盐酸酒精分化,自来水冲洗反篮,梯度脱水。将切片置于显微镜下观察显色情况。每张切片在10倍光镜下在软骨区域分别随机选取3个视野,以软骨及骨细胞质及细胞核着黄褐色为β-catenin阳性细胞,以软骨细胞、骨细胞及周围的骨陷窝着黄褐色为SOST阳性骨细胞,分别计数软骨下骨板及其下骨小梁区域β-catenin、SOST阳性骨细胞个数,以阳性细胞率(染色阳性的骨细胞个数/总的骨细胞个数×100%)表示蛋白的表达量。
1.4 统计学处理
应用SPSS20.0统计软件,采用SNK-q检验比较正常组、OA中期组、OA晚期组这3组软骨及软骨下骨中SOST和β-catenin的阳性细胞数是否存在组间差异。检验水准α=0.05,以P<0.05为有统计学意义。
2 结果
2.1 39例OA患者和6例截肢患者的内侧胫骨平台组织改良Mankin评分结果
6例截肢患者均分到正常组,改良Mankin评分为(1.3±1.2)分,番红O-固绿染色镜下表现为:软骨表层完整,软骨细胞各层排列整齐,软骨基质红染。14例中度OA组,评分为(7.7±0.9)分,镜下表现为软骨裂隙进入辐射层或深达钙化层,裂隙周围软骨细胞增殖、簇集,软骨基质淡染,局部软骨下骨暴露,软骨下骨板及骨小梁厚度增加。25例重度OA组,评分为(13.0±1.2)分,软骨层纤维化严重或大面积缺失,软骨基质重度失染,广泛软骨下骨暴露、象牙化,软骨下骨板及厚度明显增加(图1)。

图1 内侧胫骨平台标本的番红O-固绿染色,标尺:500 μmFig.1 Safranin O staining of the medial tibial plateau, Bar, 500 μm
2.2 SOST免疫组化染色在内侧胫骨平台软骨及软骨下骨的表达情况
正常组的样本在软骨表层中几乎没有SOST染色阳性的软骨细胞,在深层邻近钙化软骨区域可见少量阳性细胞,SOST染色阳性细胞百分比为11%。在中度OA组中,软骨表层及深层均可见大量的阳性细胞,SOST染色阳性细胞百分比为59%。而在重度OA组中,软骨中阳性细胞数量明显减少,在软骨表层也几乎没有阳性细胞存在,SOST染色阳性细胞百分比为12%。统计阳性细胞百分比后进行统计学分析,发现在中度OA组中SOST染色阳性细胞百分比高于正常组和重度OA组(P<0.05),而正常组和重度OA组两组间没有差异 (P>0.05)(图2,6a)。在正常组软骨下骨中可见大量SOST染色阳性软骨细胞,SOST染色阳性细胞百分比为58%,中度OA组中可见钙化软骨区域及软骨下骨区域有SOST染色阳性细胞,SOST染色阳性细胞百分比为38%,在重度OA组的软骨下骨中可减少量染色阳性的SOST骨细胞,其染色阳性百分比为16%。统计学分析后发现SOST染色阳性细胞数在正常组软骨下骨组织中最高,中度OA组和重度OA组中均有所减少,且重度OA组少于中度OA组(P<0.05)(图3,6b)。

图2 各组软骨中软骨细胞SOST染色阳性情况,标尺:200 μmFig.2 Immunostaining of SOST in joint cartilage of different groups, Bar, 200 μm
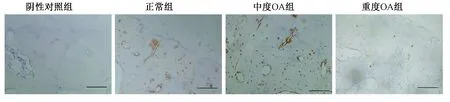
图3 各组软骨下骨中骨细胞SOST染色阳性情况,标尺:200 μmFig.3 Immunostaining of SOST in subchondral bone of different groups, Bar, 200 μm
2.3 β-catenin免疫组化在内侧胫骨平台软骨及软骨下骨的表达情况
在正常组的软骨中β-catenin染色阳性细胞数量很少,β-catenin染色阳性细胞百分比为17%。在中度OA组可以发现染色阳性细胞多数聚集在软骨表层,β-catenin染色阳性细胞百分比为49%,数量明显多于正常组(P<0.05)。但是与中度OA组中SOST染色相比,β-catenin阳性细胞多聚集在软骨表面而SOST阳性细胞多聚集在钙化层及深层软骨区域,这可能与Wnt/β-catenin信号通路对机械应力的感应以及软骨-软骨下骨相互作用有关。在重度OA组中可以发现β-catenin染色阳性细胞已经不仅仅局限于软骨表层,在软骨深层也可见大量染色阳性细胞,β-catenin染色阳性细胞百分比为62%,数量明显多于中度OA组(P<0.05)(图4,图6c)。在正常组的软骨下骨中可见少量的β-catenin染色阳性细胞,阳性细胞百分比为42%,中度OA组中阳性细胞(58%)明显高于正常组(P<0.05),重度OA组中阳性细胞(74%)明显高于中度OA组(P<0.05),表明β-catenin在软骨下骨中的表达量随着OA疾病的发展而逐步增高(图5,图6d)。

图4 各组软骨中软骨细胞β-catenin染色阳性情况,标尺:200 μmFig.4 Immunostaining of β-catenin in joint cartilage of different groups, Bar, 200 μm

图5 各组软骨下骨中骨细胞β-catenin染色阳性情况,标尺200 μmFig.5 Immunostaining of β-catenin in subchondral bone of different groups, Bar, 200 μm

图6 免疫组化染色阳性细胞百分比与正常组比较,*P<0.05;与中度OA组比较,#P<0.05Fig.6 Percentage of positive staining cells*P<0.05, versus control group;#P<0.05, versus mid-stage OA group
3 讨论
OA疾病的发生与发展与很多因素相关,目前,Wnt信号通路在OA中的作用仍在探索, SOST对OA关节软骨是否有保护作用尚存在争论。Wnt/β-catenin信号通路的激活,在骨组织中表现为促进成骨,而在软骨中表现为加速软骨的分解。SOST作为Wnt-β-catenin的膜受体拮抗剂,可以抑制Wnt-β-catenin信号通路,从而对软骨产生保护作用。Chan等[11]证明了在软骨中,升高的SOST可以通过抑制Wnt-β-catenin信号通路控制下游分解酶,MMP-13,ADAMTS-4,5的表达,从而对软骨产生保护作用。SOST单克隆抗体可以拮抗SOST对Wnt/β-catenin信号通路的抑制作用,从而促进成骨,治疗骨质疏松[12]。因此探究SOST随着OA疾病的发展在软骨及软骨下骨中所起到的作用及其作用机制就显得尤为重要。
我们发现在OA疾病过程中,SOST在软骨中和软骨下骨中的变化是不一致的。它们在软骨中的表达随着OA疾病的发展表现为先增多后减少,这与Bouaziz等[13]在OA造模小鼠软骨中的报告相一致。而β-catenin却持续增加,表明Wnt/β-catenin信号通路的表达随着疾病的发展而不断升高,其下游的分解代谢酶,如MMPs和ADAMTSs的表达量也会持续升高,造成软骨细胞凋亡,软骨基质破坏。SOST在软骨中的表达量升高后理论上会抑制Wnt信号通路从而减少β-catenin,然而在软骨中我们并没有发现这一现象。而在软骨下骨中,SOST的表达量持续减少,与之相对应的,β-catenin的表达量也与软骨中一样持续升高,不断的刺激成骨,造成软骨下骨硬化及骨赘形成。然而我们并不能证明在软骨及软骨下骨中观察到的Wnt信号通路活动的变化与SOST变化相关。Wnt信号通路在OA疾病的过程中所起到的作用是极其复杂的,我们即使通过用SOST在软骨中抑制了信号通路的激活,但是在体内,它们也不可避免的会作用到软骨下骨及骨,抑制骨形成,在OA疾病的发展过程中造成更多地微骨折,使软骨下骨丧失缓冲机械应力的作用,这同样也会加速疾病的发展。
OA病变包括了关节内所有的结构,最终导致关节软骨的降解这一观点已达成共识。软骨下骨是关节的重要组成部分,其主要生物力学效应是吸收应力、缓冲震荡和维持关节形状。其弹性模量较关节软骨低,但其数量较多,在缓冲震荡中起主要的衬垫作用,避免关节软骨受过度应力损伤[14]。在软骨中,Wnt/β-catenin信号通路过度激活被认为是起到破坏软骨的作用,而骨硬化蛋白同样亦可以抑制Wnt-β-catenin信号通路保护软骨。我们发现在软骨中SOST随着疾病的发展表现为先升高后降低,SOST作为Wnt-β-catenin信号通路的抑制剂,在软骨中SOST表达量升高后,β-catenin应该下降,而后SOST表达量下降后,β-catenin理应升高。然而在实验中我们并没有观察到这一现象,β-catenin表达持续升高,并没有受到SOST的影响。因此我们推测,不能单纯的认为软骨中的SOST完全由软骨细胞分泌,而软骨下骨中的SOST完全由骨细胞分泌的。软骨和软骨下骨之间会有大量的物质交换,那么SOST是否也会通过软骨-软骨下骨连接处,从而在对两个部分的细胞产生不一样的作用呢?在软骨中SOST的升高是否会激活或者抑制其它信号通路,与Wnt-β-catenin信号通路产生协同或者拮抗作用,从而掩盖了SOST对Wnt-β-catenin信号通路的抑制作用,从而解释我们观察到的β-catenin与SOST随着OA疾病发展而产生的变化。同样,软骨下骨受应力刺激,激活Wnt/β-catenin信号通路促进成骨。SOST分泌增多抑制Wnt-β-catenin信号通路,减少了β-catenin的表达,延缓软骨下骨硬化,从而可以维持软骨下骨的正常结构,使其发挥正常功能。然而考虑到软骨中SOST与β-catenin的反常变化,软骨下骨中这两种因子是否只是单纯的通过Wnt-β-catenin信号通路产生相互作用,仍然未知。我们的实验仅仅是观察到了SOST和β-catenin这个OA疾病发展过程中的关键因子在软骨、软骨下骨中表达的变化情况,而探究SOST以及Wnt-β-catenin信号通路两者在OA疾病发展中的作用机制,可能会为骨关节炎疾病的发生发展及治疗提供新的思路。
