不同牵张应力对成骨细胞MC3T3-E1分化及Wnt信号转导通路的影响研究
2016-08-07陈熙郭健民元宇张玲莉吴隽旎孙忠广陈炳霖邹军
陈熙 郭健民 元宇 张玲莉 吴隽旎 孙忠广 陈炳霖 邹军
1.上海体育学院运动科学学院,上海 200438 2.温州医科大学体育科学学院,温州 325035 3.上海体育学院发展规划处,上海 200438
在人体内,成骨细胞和破骨细胞的动态平衡维持了体内的骨量[1]。机械应力刺激则是其平衡的重要调节因素,在骨生长和骨重建过程中发挥着重要的作用。较多的研究指出,各种机械应力如剪切力、牵张力、压力等都可以对骨细胞以及成骨细胞进行刺激,并促进成骨增殖和分化[2-4]。但是不同的应力强度,频率及刺激时间对成骨细胞的影响也不同,不适宜的牵张力则不利于成骨分化,甚至还会引起细胞凋亡[5]。另外,研究也指出,Wnt信号转导通路在骨的生长发育以及应力影响成骨分化中具有重要作用[1, 6]。因此,本研究采用不同强度和时间对MC3T3-E1细胞进行机械牵张干预,观察牵张应力对成骨细胞分化及Wnt信号转导通路的影响,探讨促进成骨分化的适宜机械牵张应力及其机制。
1 材料与方法
1.1 仪器与主要试剂
Flexcell-FX5000细胞力学系统;细胞培养箱(Thermo,USA);荧光定量PCR仪(ABI StepOne 7300,USA);蛋白电泳仪、(BioRad,USA);酶联免疫检测仪(BioTek,USA);α-MEM(Hyclone,USA);胎牛血清(FBS)(Gibco,Australia);0.25%胰酶、青霉素、链霉素、RIPA裂解液、BCA蛋白定量试剂盒、碱性磷酸酶(ALP)试剂盒(碧云天);抗坏血酸L、β-甘油磷酸钠(Sigma,USA);Trizol、逆转录试剂盒;SYBR荧光定量试剂盒(Takara,宝生物);β-actin、Phosphor-33/37-β-catenin(cell signal technology, USA);Wnt1、β-catenin(abcam,USA);引物合成于上海生物工程技术服务公司。
1.2 细胞培养
成骨细胞系MC3T3-E1(ATCC,CRL-2594)复苏后采用α-MEM培养液(含10%FBS+100 U/ml青霉素+0.1 mg/ml链霉素),在37℃,5%CO2的培养箱中进行常规细胞培养。每3天换一次液,细胞长至70-80%融合时进行传代。
1.3 施加牵张应力
生长良好的MC3T3-E1细胞,在胰酶消化后进行重悬,调整至1×105浓度接种于Flexcell公司生产的底部具有弹性模的专用6孔板(BioFlex© Plate弹性膜6孔板),正常培养2d后,换成含诱导分化剂的培养液(含抗坏血酸L、β-甘油磷酸钠)后对细胞进行牵张应力的干预(Flexcell-FX5000 tension System,USA)。分别采用3%,6%,12%的形变幅度的正弦波,0.5 Hz的频率,牵拉时间分别为2,4,8 h,对照组细胞不进行干预正常培养。在实验结束后即刻收集细胞。每组3个孔,实验重复3次以上。
1.4 ALP活性测定
牵张应力干预结束后吸除孔内培养液,PBS洗涤3次,每孔加入的0.2% TritonX-100 2ml裂解细胞后置于4℃过夜制备样本,按照ALP检测试剂盒说明检测ALP活性:每孔取10 ul细胞裂解液放入96孔细胞培养板(以加PBS的空白管做空白对照),之后分别加入40 ul检测缓冲液和50 ul显色底物,混匀后于37℃孵育10 min,加入100 ul反应终止液终止反应。在405 nm波长下测定吸光度值(BioTek酶标仪),并减去空白对照管吸光度值后进行统计分析。
1.5 Real time-PCR分析
采用Trizol提取每孔细胞的总RNA,测定RNA浓度后按照逆转录试剂盒说明书逆转录成cDNA,然后对cDNA进行SYBR荧光定量扩增分别检测骨钙蛋白(Osteocalcin,OC)、Runx2、Osterix、Wnt1、β-catenin、DKK-1、GAPDH mRNA的表达(各基因引物设计见表1),采用两步法行40个循环。每个样本设3个复孔,取均值得出Ct值,以GAPDH为内参,采用2-△△Ct计算出所有指标mRNA的相对表达量。

表1 各基因引物设计Table 1 Design of gene primers
1.6 Western blot检测
牵拉干预结束后加4℃预冷的PBS洗3次,每孔加入100 ul的RIPA(碧云天)裂解液后用刮刀收集细胞于EP管,之后于4℃冰上裂解细胞30 min,12000 rpm 4 ℃离心10 min,提取上清液即为细胞总蛋白,采用BCA试剂盒对蛋白浓度测定并调平蛋白浓度,与SDS-PAGE上样缓冲液(6×)按5∶1混合,100℃煮沸10 min,分装后-20℃保存。进行Western blot检测时采用8% SDS-聚丙烯酰胺凝胶使蛋白分离后,以300 mA恒流电转2 h。PVDF膜在5%脱脂牛奶室温封闭1 h后,一抗于4℃孵育过夜,TBST洗三次后采用HRP结合的二抗室温孵育2 h,TBST洗三次后采用ECL发光液于暗室显影,并用胶片进行扫描后保存。采用image J软件对所有条带进行灰度值分析。
1.7 统计学分析
所有实验数据采用 SPSS13.0统计软件包进行统计分析,结果以均数±标准差表示, 先用双因素方差分析强度和时间因素对成骨分化的作用,再采用单因素方差分析分别对时间因素和强度因素进行分析,用Bonferrori法进行组间两两比较。以P<0.05为具有显著性差异。
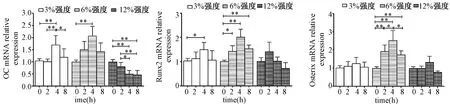
图2 各强度组不同时间牵拉干预后OC、Runx2和Osterix mRNA的相对表达Fig.2 The expression of OC.Runx2 and Osterix mRNA in different mechanical loading and duration groups.
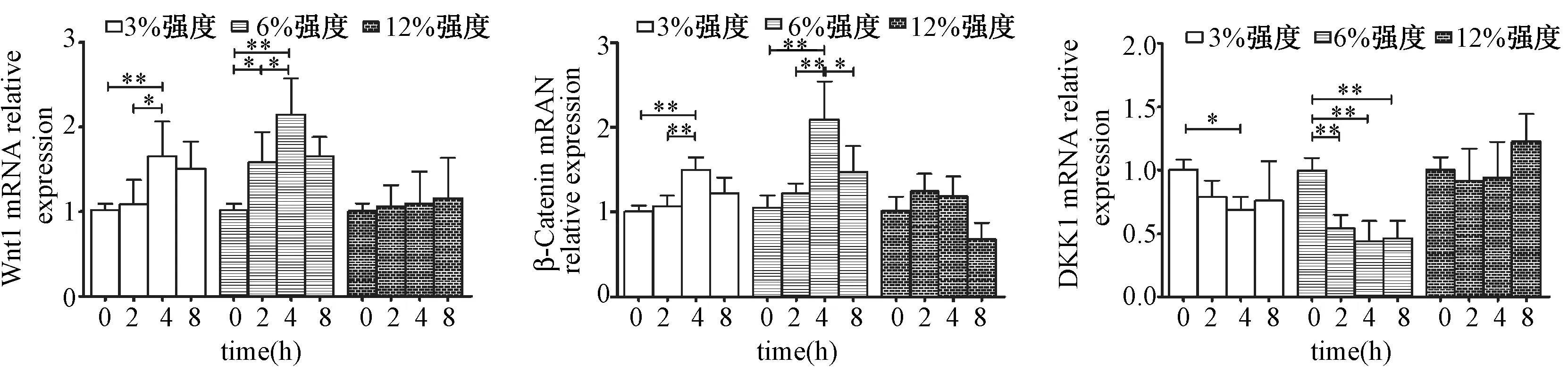
图3 各强度组不同时间牵拉干预后Wnt1、β-catenin和DKK-1 mRNA的相对表达Fig.3 The expression of Wnt1, β-catenin, and DKK-1 mRNA in different mechanical loading and duration groups.
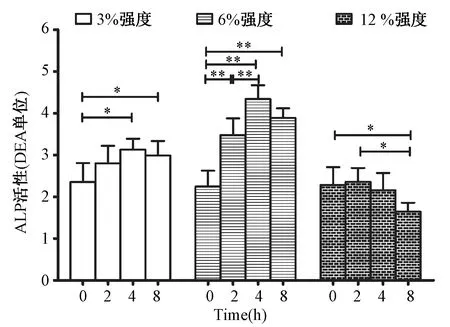
图1 各强度组不同时间连续牵拉干预后ALP活性值Fig.1 ALP results in different mechanical loading and duration groups
2 结果
2.1 ALP活性
如图1所示,3%和6%强度的牵拉均可以增加MC3T3细胞的ALP活性,其中6%强度的应力刺激ALP活性升高的幅度更大,而12%强度的牵拉组的ALP活性出现下降的趋势,在8 h连续干预时有统计学差异。在时间效应上,3%和6%强度组均在4 h时ALP活性达到峰值,8 h时略有下降。
2.2 mRNA表达水平变化
如图2所示,3%和6%强度的连续牵拉干预均使成骨细胞OC和Runx2的mRNA表达增加,6%强度增加的幅度大于3%强度。6%强度的牵拉干预还可以使Osterix mRNA的表达增加,而3%强度无统计学差异。在时间效应上,两组OC、Runx2和Osterix mRNA表达的峰值均在4 h时。另外12%强度的连续牵拉干预后Runx2和Osterix mRNA的表达没有统计学差异,而OC mRNA的表达减少了,在4-8 h的干预后减少的幅度最大。
如图3所示,3%和6%强度的连续牵拉干预后,成骨细胞Wnt1和β-catenin的mRNA表达均升高,6%强度组的升高幅度大于3%强度组,且在4h时升高的幅度最大;DKK-1 mRNA的表达则降低了,6%强度时2 h就开始有显著下降,而3%强度时则到4 h时有统计学差异。12%强度牵拉干预后Wnt1、β-catenin 和DKK-1 mRNA的表达均无显著性差异。
2.3 蛋白表达水平变化
如图4所示,3%和6%强度的连续牵拉干预后,成骨细胞的Wnt1和β-catenin的蛋白均增加了,P-β-catenin蛋白(失活状态的β-catenin)则出现下降趋势,故β-catenin/P-β-catenin的比值显著升高,且6%强度增加的幅度大于3%强度,4小时干预的增加幅度最大。 12%强度干预后,成骨细胞的Wnt1蛋白和β-catenin/P-β-catenin的比值均出现下降趋势,在4 h和8 h干预后差异有统计学意义。
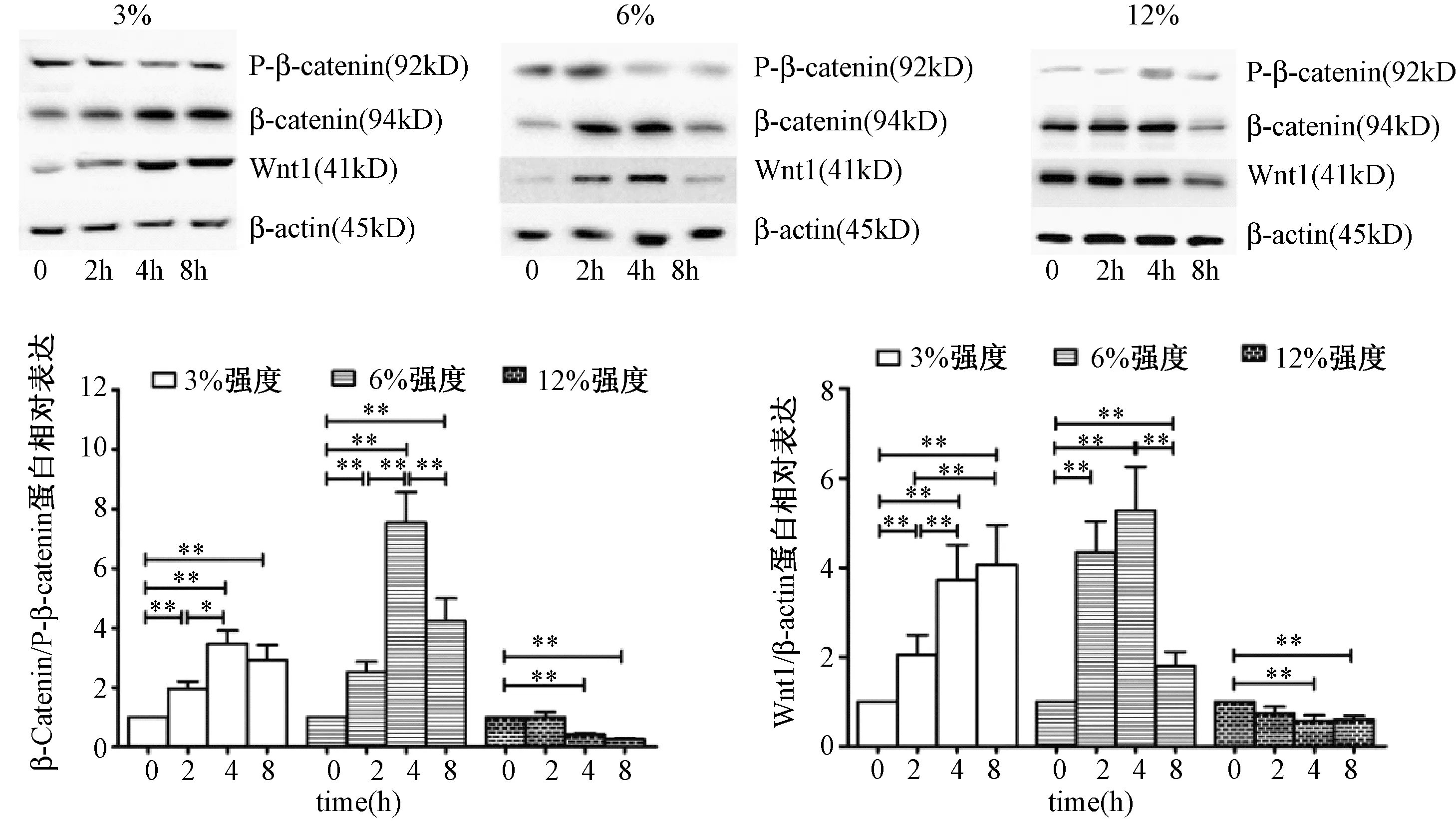
图4 各强度组不同时间牵拉干预后Western blot代表图和蛋白相对表达量Fig.4 The protein expression and representing Western blot chart in different mechanical loading and duration groups
3 讨论
在人体内,骨对机械应力刺激具有适应作用,在应力高的区域则骨形成大于骨吸收,相反在减少应力的作用下,则会引起人体骨量的丢失,如长期卧床病人,宇航员,减肥等[7],因此,机械力学刺激对骨代谢具有重要的调节作用。较多的研究指出,骨髓间充质干细胞、成骨细胞和骨细胞都可以感受外界的机械应力刺激,并做出应答[8-10]。而机械应力的方式、刺激强度大小、频率等均会对细胞产生不同的影响。近些年,国内外采用牵张应力对成骨细胞进行机械干预成为研究的热点,故本研究采用牵张力为干预方式,采用了国际上公认的Flexcell细胞应力加载系统对细胞进行周期性牵张应力刺激。
本次研究发现,在中低强度(3%-6%强度)的应力刺激可以促进MC3T3细胞ALP的分泌,同时促进OC、Runx2、Osterix mRNA的表达。ALP的是成骨细胞早期分化的标志,OC是成骨细胞向矿化发生期分化的标记之一,是其晚期分化的标志,说明中低强度的牵张应力刺激可以促进成骨细胞的分化。Runx2和Osterix则是成骨细胞分化所必需的关键转录因子,在骨髓间充质干细胞向成骨分化的过程中扮演了重要的角色[11, 12]。本次研究中,Runx2和Osterix的mRNA表达水平的升高也说明了牵张应力有较好促进成骨分化作用,与Zhong等人的研究结果一致[4]。
高强度(12%)牵张应力刺激后MC3T3细胞的ALP分泌减少,OC mRNA表达水平下降,提示高强度的机械刺激不利于成骨细胞分化。Koike等对ST2细胞系进行牵张应力干预后也发现,高强度应力(10%和15%)刺激后细胞的ALP活性出现下降趋势[13]。Jacobs等对HOB成骨细胞系进行10%的牵张应力干预也发现细胞的ALP活性下降,OPG mRNA表达下降[14],与本次实验结果一致。但李菲菲等的研究也发现,12%的牵张应力刺激可以促进Sao-2成骨细胞系ALP活性和OC mRNA的表达增加,促进成骨分化[15]。考虑可能是不同细胞系对应力刺激的敏感性和耐受性不同,因此细胞适应的生理刺激强度也会因细胞的不同而有所变化。
另外,有研究指出高频率牵张应力会使成骨细胞分化减少,故本研究采用0.5Hz的实验方案[16]。时间效应上,本次研究显示中小强度牵张应力干预2h,4h时,成骨细胞的分化随着干预时间的增加而增加,但是8h牵张干预后比起4h干预各项成骨分化指标均呈现下降趋势,原因可能是长时间机械应力刺激可能会超过细胞所能承受的生理刺激范围,有部分细胞出现凋亡甚至死亡的现象。而在12%强度牵张应力刺激后,成骨细胞分化的各项指标则随着时间的增加下降。Koike等对ST2细胞进行24h和48h的连续干预后也发现,5%、10%和15%强度牵张应力均使细胞的Runx2表达减少[13],与本次研究结果一致。
有研究指出,多个细胞信号传导通路参与了成骨细胞分化的过程,其中经典Wnt信号转导通路通过上调细胞内β-catenin的活性,在成骨细胞和骨髓间充质干细胞的成骨分化过程中发挥着极为重要的作用[1]。如稳定表达Wnt1、Wnt3a可促进C3H10T1/2细胞系的增殖, 并诱导上调成骨细胞ALP的活性[17]。Phosphor-33/37-β-catenin则是β-catenin的失活状态,故常用β-catenin/Phosphor-33/37-β-catenin的比值来反映Wnt信号路通的激活状态。DKK-1可以通过和Lrp5/6结合竞争性抑制Wnt蛋白,下调Wnt信号通路,从而抑制成骨细胞的增殖和分化[18]。
本研究结果显示,3%和6%强度的牵拉可以促进成骨细胞Wnt1和β-catenin mRNA的表达,并且减少DKK-1 mRNA的表达。而12%强度的牵拉刺激后这三项指标则均无显著性变化。提示3%和6%强度牵张刺激可以上调MC3T3细胞Wnt信号转导通路,而12%强度则无该效应,甚至DKK-1 mRNA表达水平略有上升。Wnt1蛋白表达以及β-catenin/P-β-catenin比值的结果与PCR结果相符,显示牵张应力刺激上调了Wnt信号转导通路,且上调的强度和时间效应与成骨细胞分化的各项指标相一致,提示机械应力(牵张力)可能通过上调细胞内Wnt信号转导通路,促进成骨细胞分化。
综上所述,中小强度的牵张应力刺激可以上调MC3T3细胞的Wnt信号转导通路,促进细胞成骨分化,以6%强度,4 h干预时效果最为显著;大强度(12%)或者长时间(8h)则不利于细胞成骨分化,甚至还有抑制作用。
