两系不育系Y58S的花药培养与花培后代的鉴定筛选
2016-08-06黄翠红杨瑰丽周丹华刘永柱陈志强
黄翠红,杨瑰丽,黄 明,周丹华,刘永柱,郭 涛,陈志强,王 慧
(华南农业大学国家植物航天育种工程技术研究中心,广东 广州 510642)
两系不育系Y58S的花药培养与花培后代的鉴定筛选
黄翠红,杨瑰丽,黄 明,周丹华,刘永柱,郭 涛,陈志强,王 慧
(华南农业大学国家植物航天育种工程技术研究中心,广东 广州 510642)
花药培养技术与传统不育系育种的结合能有效加快新的光温敏不育系材料的选育进程。为了筛选出适合两系不育系Y58S的花药培养条件,利用10种不同培养基对两系不育系Y58S不同杂交组合F2代进行花药培养。培养基E(NMB+2 mg/L 2,4-D+2 mg/L NAA+1 mg/L KT+0.5 g/L脯氨酸+0.5 g/L谷氨酰胺+0.5 g/L水解酪蛋白+25 g/L蔗糖+25 g/L麦芽糖+10 g/L琼脂粉)较为适合两系不育系Y58S的花药培养;同时,材料的基因类型对花药培养力有着显著的影响,粳稻血缘的渗入有利于两系不育系花药培养力的提高。花药培养后代田间性状观察结果表明,在当代花药培养植株中发现较多的二倍体植株,少部分为单倍体、四倍体植株,尚未发现非整倍体;筛选出一个表现较好的不育株系。
水稻;两系不育系;Y58S;花药培养;花培后代
黄翠红,杨瑰丽,黄明,等.两系不育系Y58S的花药培养与花培后代的鉴定筛选[J].广东农业科学,2016,43(5):31-36.
不断提纯改良不育系是两系法杂交水稻研究和超级杂交水稻组合选育的关键。鉴于花培育种具有纯合快、选育效率高、可使农艺性状和育性同步稳定等优点,花药培养技术可在较短的周期内使包括温光反应特性在内的各种性状不再分离,大大缩短育种进程,也可用于育成不育系的提纯[1]。周元昌等对培矮 64 S 的核心种子进行花药培养,结果在H后代株系间发生育性分离,筛选出了完全不育的不育系培矮 64 HS,在不育期间其花粉不育度达99.8%以上,且不育期较长,育性和后代遗传均稳定。证明了花药培养在培矮64S的遗传纯化上是有效的[2]。马镇荣等也用花药培养对两用核不育系培矮64S进行提纯与改良,结果表明花药培养是提纯及改良两用核不育系的有效途径[3]。陈远孟等对3个光(温)敏核不育系培选S、农垦58S、以及培矮64S进行花药培养,其花粉植株均有育性转换的特性,且在H3代花粉植株的株系中,得到花粉不育度>99.5%的植株比对照的株系多,表明了应用花培对光(温)敏核不育系提纯的可行性[4]。但在水稻花药培养中,基因型是影响花药培养里的一个重要因素[5],一般来说,花药培养力的大小为:糯稻>粳稻>粳/籼稻>籼型杂交稻>籼稻[6]。而光温敏核不育系和非光温敏核不育系在花药培养效率上不存在显著差异,花药培养里仅与供试材料的基因型有关[7]。利用光温敏核不育材料进行花药培养虽然可以加速不育系的选育,但可能由于培养条件不合适,或者花粉的败育而影响愈伤的诱导和分化。因此,需要寻找新的培养基或调整现有配方,还包括附加成分的增减、培养条件的改善等,目的在于提高愈伤组织的诱导率和绿苗的分化率[8]。
Y58S 是湖南杂交水稻研究中心新选育而成的光温敏不育系,2005年2月通过湖南省农作物品种审定。它具有配合力高、抗逆性强、综合性状优良等特点,适合配制广适性超级稻组合。我们通过对光温敏核不育系Y58S不同杂交后代进行花药培养研究,探究出对光温敏核不育系材料适宜的花培条件,同时通过对花培后代材料筛选,以期获得新的两系不育系材料,为花培育种提供理论基础。
1 材料与方法
1.1 试验材料
两系不育系材料:Y58S/02428、Y58S/合丰占,F2代(F1代中选择不育株系割兜留禾头,经人工气候箱处理转育后留种)。
1.2 试验方法
1.2.1 取材与低温预处理 试验在华南农业大学教学试验场农学分场进行,供试材料于2013年早造开始种植,常规田间管理。当植株处于孕穗期时,在晴天下午从田间选取剑叶与下一叶的叶枕距约5~10cm的带苞叶稻穗。将多数花粉发育时期处于单核中晚期的稻穗用湿润纱布包裹,置于7~8℃下低温预处理7~10 d。
1.2.2 培养基 诱导、继代培养基:分别选用N6 和NMB为基本培养基,并在激素水平与有机添加物上进行调控(表1)、琼脂10 g/L、蔗糖和麦芽糖各25g/L。
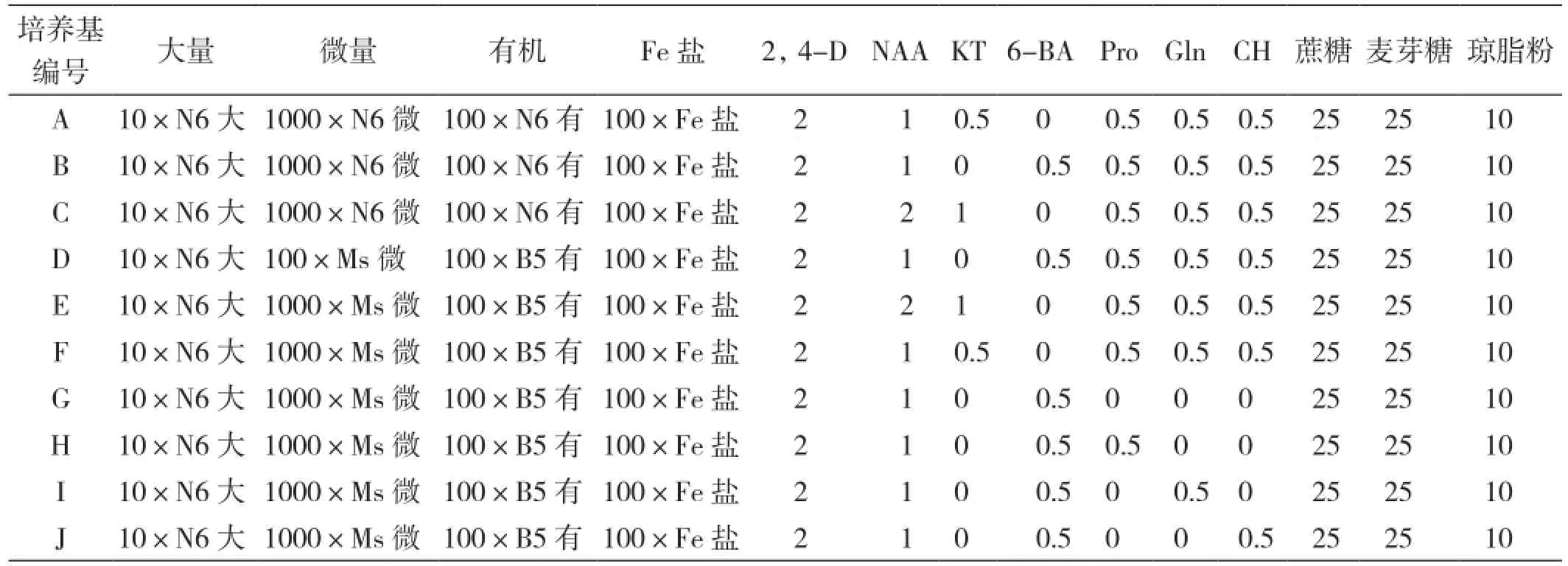
表1 不同培养基水平的筛选
分化培养基:统一使用MS为基本培养基,附加6-BA 3 mg/L、NAA 1 mg/L、蔗糖30 g/L、琼脂10 g/L。
生根壮苗培养基:采用l/2MS培养基,不附加激素,蔗糖25 g/L。
所有培养基pH值均调至5.8左右。
1.2.3 接种条件 用75%酒精对稻穗进行表面消毒,剥除叶鞘,置于烧杯中用2%次氯酸钠消毒10~15 min,期间不时震荡搅拌,以保证消毒完全,然后用无菌水冲洗3遍,用无菌纱布吸干水分,在无菌条件下用“剪颖抖药法”把花药接种至培养瓶中。将供试材料接种在不同诱导培养基中,每种培养基上都分别接种10瓶,每瓶约100~120枚花药,每个处理3次重复。
当愈伤长出至2~3 mm时,挑选乳白色、表面光滑、结构致密的愈伤组织转入分化培养基中培养。每个供试材料分别接种8瓶,每瓶接种8块愈伤组织块。
1.2.4 培养方法 花药培养分为诱导培养阶段和分化培养阶段,诱导阶段于26~28℃下暗培养,于接种后2~3 d统计各培养瓶中所接种的花药枚数,接种后30~60 d统计愈伤组织块数;分化阶段先暗培养3 d,后转至光照培养,使其有一个过渡适应阶段,更快适应转换了的环境,进而提高分化力。一般光培养的光照时间为10~12 h/d,光强1 000~1 500 lx,室温保持26~28℃,分化培养45 d进行统计绿苗丛数、白苗丛数等。

整理数据并进行方差分析,确定各材料在不同培养基中对愈伤组织诱导率和后续分化效果的影响。
利用SAS数据处理系统软件进行数据统计分析。一般的数据处理用Excel,统计分析用SAS 9.1.3软件,差异显著性用邓肯氏新复极差法测验。
2 结果与分析
2.1 Y58S不同杂交组合F2代在不同培养基中的花药培养结果
2.1.1 Y58S不同杂交F2代的愈伤诱导情况 对不同培养基中的水稻材料的出愈率(愈伤组织诱导率)进行统计及分析结果(表2)表明,Y58S/02428的杂交F2代和Y58S/合丰占F2代在不同的诱导培养基上其诱导率有所不同。 可能由于02428是粳稻材料,而合丰占是籼稻材料,所以含有粳稻血缘的Y58S/02428组合的诱导率会高一些。其中,Y58S/02428组合在G培养基上的诱导率最高,为14.33%,而Y58S/合丰占组合反而最低,只有1.57%。而在同一个杂交组合内,诱导率也存在差异,Y58S/02428组合在G培养基上诱导率可达到14.33%,其次分别为12.55%(D培养基)、11.71%(I培养基)、11.12%(E培养基),而在B培养基上才4.27%;Y58S/合丰占组合在E培养基上诱导率表现最高,为8.38%,培养基D (7.18%)、B(6.30%)次之,而在G培养基上的诱导率表现最低,仅为1.57%,说明不同的培养基对花药培养的诱导率有一定影响,而不同血缘的材料对培养基的要求也有所不同。

表2 Y58S不同杂交组合在不同培养基的花药诱导情况
对两种不同的杂交组合在10种培养基上的诱导率进行双因素有重复的方差分析,结果(表3)表明,材料间与培养基间的差异均达到极显著水平,这证明了不同杂交组合的花药来源以及培养基的类型对愈伤组织诱导率的影响显著。进一步对诱导率进行多重比较(统一使用Duncan新复极差测验)的结果表明,在不同杂交组合方面,Y58S/02428组合的平均诱导率为9.37%,显著高于Y58S/合丰占组合(4.54%);而在培养基方面(表4),使用C培养基进行组织培养,所得到的诱导率是最低的,仅为4.40%;而D培养基的诱导率最高,为9.95%,E培养基(9.82%)次之,但两者差异不显著,因而可以将这两种培养基视为较为适合于花药培养的诱导培养基。

表3 Y58S不同杂交组合在不同培养基花药诱导率的方差分析

表4 不同培养基对花药诱导率的多重比较分析
2.1.2 Y58S不同杂交F2代的愈伤分化情况 将10个不同杂交组合F2花药诱导出来的愈伤组织转移到相同的分化培养基上进行后续分化培养,并对其愈伤组织分化结果进行统计,结果(表5)显示,不同诱导培养基诱导出来的愈伤组织因质量水平不同,分化情况各异,部分出现零分化。绿苗分化率方面,最高值表现在F培养基上(75.00%),但只Y58S/合丰占组合有分化,而 Y58S/02428杂交组合却是零分化;对于Y58S/02428杂交组合,最高绿苗分化率出现在培养基E上(25.00%),对应Y58S/合丰占的分化率为15.38%(图1)。总的来说,E培养基对于不同材料的绿苗分化率较为有利,广谱性较强。
在花药培养力(绿苗产率)方面,两个杂交组合在诱导培养基E和诱导培养基B上表现稍好,且培养基E(2.78%、1.29%)更优于培养基B (0.36%、0.35%)。诱导培养基E较为适合Y58S不同血缘材料的花药培养,且具有一定的广适性。Y58S/02428组合的花药培养力均高于Y58S/合丰占杂交组合,表明转入粳稻血缘有利于花培效力的提高,这与前人研究结果相同[6]。

表5 Y58S不同杂交组合在不同培养基的愈伤分化率

图1 Y58S不同杂交组合在不同培养基的绿苗分化率
白苗分化率方面,除了出现零分化的培养基,A培养基对于两个杂交组合的白苗分化率都比较低,在Y58S/02428为1.04%、Y58S/合丰占为4.76%,其次是E培养基,Y58S/02428与Y58S/合丰占杂交组合的白苗分化率分别为8.33%、7.69%。表明诱导培养基A与诱导培养基E在控制白苗分化的水平上表现较好。
2.2 Y58S不同杂交组合F2花药培养后代的田间表现
2.2.1 花药培养后代的倍性观察 经过对花药培养后代植株利用流式细胞仪进行初步倍性鉴定并结合田间种植表现观察,结果(表6)表明:在当代花药培养植株中发现较多的二倍体植株(48.00%),少部分为单倍体(23.05%)、四倍体植株(7.19%),尚未发现非整倍体。其中,单倍体表现为植株矮小,叶片较小,根细小;四倍体表现为植株较高、粗壮,叶片较宽,根较粗壮;而二倍体则处于这两者间,并与原生种相似。

表6 花药培养植株当代的倍性表现
2.2.2 花药培养后代的育性观察 Y58S/02428与Y58S/合丰占两个 F2代组合获得的花培后代的田间表现以偏粳型较多,结合花药培养后代的育性观察与镜检鉴定,同时从花培后代筛选出花粉不育且柱叶型表现较好株系6株,割兜留禾头,待其孕穗、育性转育敏感期移至人工气候箱处理,成功转育并收获株系2株。2015早造继续种植,其中一个来自Y58S/02428 F2代组合的花培后代株系的株叶型表现较好,育性观察与镜检结果(图2、图3,封二)显示为典败类型,其育性稳定性有待于进一步的研究观察。
3 结论与讨论
一般情况下,籼稻品种其花药培养力较低,粳稻培养效率较高,籼粳杂交后代居中[9]。本研究以光温敏核不育系Y58S为材料,对其不同杂交组合F2代进行花药培养也发现,不同基因型材料对花药培养力影响极为显著。不同杂交组合其花药培养力也有所不同,与其杂交导入的外源基因有一定的关系,对于光温敏核不育系Y58S来说,杂交组合Y58S/02428培养效果优于杂交组合Y58S/合丰占,说明导入粳稻血缘能提高不育系的花药培养力,并与前人研究结果相同,但导入粳稻血缘含量高低对籼稻花药培养力影响大小还有待于进一步研究。另外,培养基类型是影响花药培养力的重要影响因素。对于不同的基因型材料,需要的培养基成分组成不同。一般情况下,诱导培养基中,N6适于粳稻、SK3适于籼粳杂交、合5适于籼稻、通用和M8对籼稻和粳稻均较适用。冯双华等选用合5、M8和改良M8为基本培养基对培两优288、P88S/0293、籼型杂交稻两优培九进行花培,结果表明,改良M8培养基比较适合不同的基因型材料[10]。王伍梅等通过多年的试验结果表明,N6培养基对多数籼粳交后代和粳稻的诱导效果都较好[11]。黄慧君等对不同激素种类以及浓度配比进行多次实验研究表明,籼稻品种要求更高的生长素浓度,并且配合一定浓度的KT,有利于愈伤组织诱导率和绿苗的提高[12]。也有人认为,适当的降低生长素的浓度,对愈伤组织的诱导率有促进作用。本研究通过改变培养基配方(包括基本培养基、激素配比以及有机添加物进行综合调配),探索到培养基E是适合光温敏不育系的培养基,其中诱导培养基选用NMB培养基和激素配比2,4-D∶NAA∶KT为2∶2∶1较为适合,但籼稻花药培养力与粳稻相比仍有一段距离,还需要进一步探究最佳的培养基成分。
愈伤组织在诱导阶段往往会发生变异,出现染色体成倍增加、减少或缺失等,从而使花药培养后代出现多倍体、单倍体或非整倍体等,因此对花药培养后代进行倍性鉴定尤为重要。
水稻花药组织培养后产生的植株除单倍体外,还会有二倍体、三倍体以及各种异倍体[13],花药植株倍性发生变异主要是由于离体培养细胞染色体的数目和结构不稳定,在花药培养中发生异常有丝分裂。如要获得单倍体或纯合二倍体,不但要做好倍性鉴定工作,前期培养条件也很重要。花药培养易受到体细胞的干扰,在产生单倍体的同时也产生二倍体或四倍体;同时单倍体细胞的生长很容易被生长旺盛的多倍体细胞所掩盖[14]。本试验采用流式细胞分析法鉴定花药组织培养后代的倍性为辅助手段,并结合田间观察方法,抽样花药培养苗为185株,其中二倍体的平均频率最高;其次为单倍体;而多倍体出现的频率,未发现非整倍体、嵌合体等现象。表明光温敏不育系Y58S/02428与Y58S/合丰占两个 F2代与其他水稻材料一样,经过花药组织培养后会发生自然加倍,并且受到多重因素的影响,其中两个组合获得的花培后代的田间表现以偏粳型居多,通过育性与田间表现筛选,其中一株来自Y58S/02428组合的不育单株表现较好将留作进一步深入的研究,期望获得具有一定育种价值的育性稳定纯合的新两系不育系材料。本研究结果进一步表明利用光温敏核不育材料进行花药培养可以加速两系不育系的选育,同时开展的花药培养条件的优化研究,提高并改善花药培养力,能有效服务于光温敏核不育系水稻的提纯以及水稻育种工作。
[1]梁曼玲,陈彩虹.低温敏核不育系培矮64S的花药培养[J].广西农业科学,2002(4):171-173.
[2]周元昌,林荔辉,江树业,等.花药培养遗传纯化温敏核不育系培矮64S的效果初步分析[J].中国水稻科学,2000(2):56-58.
[3]马镇荣,凌定厚,王昌虎.花药培养对籼稻两用核不育系培矮64S的提纯与改良[J].热带亚热带植物学报,2000(4):308-314.
[4]陈远孟,吕志仁,韦鹏霄,等.花药培养对光(温)敏核不育系亲和力的影响[J].广西农业科学,2002 (3):112-113.
[5]孙宗修,程式华,闵绍楷,等.光敏核不育水稻的光温反应研究Ⅲ.减数分裂期温度对两个籼稻光敏不育系育性转换的影响[J].作物学报,1993(1):83-87.
[6]沈锦骅,李梅芳,陈银全等.花药培养在水稻品种改良上的应用[J].中国农业科学,1982,4(2):15-19.
[7]蔡得田,陈冬玲,祝虹等.湖北光温敏核小育水稻的未受精子房和花药培养出单倍体[J].实验生物学报,1988,2(4):401-407.
[8]李艳萍.水稻花药培养与花培育种研究[J].天津农业科学,2003,9(4):36-38.
[9]Dewi I S,Purwoko B S,Aswidinnoor H,et al.Plant regeneration from anther cultures of several genotypes of indica rice tolerant to aluminum toxicity[J].Indones J Agric Sci,2009,2:1-5.
[10]冯双华,赵森,郭家源,等.不同培养基和激素对超级杂交稻花药培养力的影响[J].西南农业大学学报(自然科学版),2006(4):523-525.
[11]王伍梅,台德卫,张效忠,等.水稻高效花药培养技术体系的构建[J].中国农学通报,2009(16):65-68.
[12]黄慧君.外源激素、培养基对水稻幼穗培养直接分化和脱分化的作用[J].广东农业科学,1993(3):5-7.
[13]Nishi T S,SuokaMit.Occurrence of various ploidy plants from anther culture and ovary culture of rice plant[J].Japan J Genetici,1969,44:341-246.
[14]周旭红,莫锡君.花药培养的研究进展[N].江西农业学报,2007,19(8):74-76.
(责任编辑 杨贤智)
Primary research on anther culture of photothermosensitive genic male sterile rice “Y58S”and selection of descendant of anther culture
HUANG Cui-hong,YANG Gui-li,HUANG Ming,ZHOU Dan-hua,LIU Yong-zhu,GUO Tao,CHEN Zhi-qiang,WANG Hui
(National Engineering Research Center of Plant Space Breeding,South China Agricultural University,Guangzhou 510642,China)
The combination of anther culture techniques and traditional sterile lines breeding can effectively speed up the improvement of photo-thermosensitive genic male sterile(PTGMS) lines.To screen for the optimal culture medium for the two-line male sterile line,Y58S,we studied the effects of 10 different culture mediums on the F2generation of different cross combination between Y58S and selected male parents.The results showed that medium E(NMB+2 mg/L 2,4-D +2 mg/L NAA+1 mg/L KT+0.5 g/L Pro+0.5 g/L Gln+0.5 g/L CH+25 g/L sugar+25 g/L Maltose+10 g/L Agar)was more effective for anther culture of PTGMS lines.And introducing japonica rice by cross breeding improved anther culture ability of PTGMS lines,indicating that genetype played an important role in rice anther culture.The examination on traits in field of descendants displayed that most of the plants were diploid,some were haploid and tetraploid,and no non-integer ploidy,and a new PTGMS lines was screened.
rice;PTGMS lines;Y58S;anther culture;descendant of anther culture
S511.0353
A
1004-874X(2016)05-0031-06
10.16768/j.issn.1004-874X.2016.05.007
2016-01-28
