东方百合‘索邦’基于喷雾式植物反应器的AtCKX3基因转化1)
2016-08-06张倩杜运鹏毕彧陈绪清张秀海杨秀云
张倩 杜运鹏 毕彧 陈绪清 张秀海 杨秀云
(山西农业大学,太谷县,030801) (农业基因资源与生物技术北京市重点实验室(北京市农林科学院农业生物技术研究中心)) (山西农业大学)
东方百合‘索邦’基于喷雾式植物反应器的AtCKX3基因转化1)
张倩杜运鹏毕彧陈绪清张秀海杨秀云
(山西农业大学,太谷县,030801)(农业基因资源与生物技术北京市重点实验室(北京市农林科学院农业生物技术研究中心))(山西农业大学)
摘要以东方百合‘索邦’鳞片为试材,采用喷雾式植物反应器(即开放式培养)手段,进行外源基因AtCKX3的转化,并对除草剂草丁膦(PPT)质量浓度筛选、转化效率进行了研究。以生长情况一致的百合幼苗为材料进行草丁膦质量浓度的筛选,结果表明:8.5 mg·L-1为‘索邦’草丁膦筛选的临界质量浓度;将农杆菌侵染后的鳞片在喷雾式反应器中培养,诱导出不定芽及生根后进行移栽,并对转化植株幼苗进行草丁膦筛选。对抗性植株进一步进行PCR检测和PCR-Southern杂交检测,结果表明:采用喷雾式植物反应器培养,一方面,可有效提高转化效率,缩短培养时间,转化率为0.29%左右;另一方面转化苗移栽成活率更高,达75%。
关键词百合;喷雾式植物反应器;遗传转化;AtCKX3基因
百合(Lilium spp.),百合科百合属多年生草本球根植物,是世界六大鳞茎作物之一[1],被广泛应用于切花、盆花和园林绿地,可观赏,亦可食用和药用,具有较大的经济价值。优良百合新品种选育主要依赖于常规杂交,但远缘杂交出现受精障碍现象十分普遍[2]。此外,亲本遗传背景也是重要的制约因素。另一方面育种周期长,后代分离复杂,定向选育困难。而现代生物技术可弥补其不足,将育种材料并不存在的目的基因引入到受体植物,定向改良其性状而不改变植株其他性状[3]。分子生物学的迅猛发展使通过基因工程手段改良百合品种提高百合品质成为传统育种方式的重要补充。基因工程技术可将不同外源基因导入到百合基因组中,并使之稳定遗传,是短时期内获得新品种的安全有效的新途径[4]。
目前,通过基因工程技术手段主要达到改变百合花色、花型,改善百合采后特性,提高百合抗逆性等目的,使用的外源基因有抗衰老基因、花色调控基因、抗病基因、抗虫基因和抗病毒基因等。在提高百合植株抗逆性方面,陈莉[5]向麝香百合中导入耐热基因Mn-SOD,经过高温胁迫处理,所得到的转基因百合耐热性有很大提高。Li et al.[6]将P5CS基因导入到百合基因组中成功获得了抗盐性强的转化植株,除此之外,关于提高百合抗盐性和抗旱性研究仍基本处于空白。因此,增强百合抗逆性对提高百合观赏价值和品种改良意义重大,同时孕育着不容小觑的经济效益。
在植物遗传转化技术选择方面主要方法包括农杆菌介导法、基因枪法、电击法。基因枪法具有广泛的靶受体类型和不受寄主范围限制的优点,但其成本高,试验时重复率较差[7]。电击法的特点是转化效率相对较高,操作简易,但由于百合原生质体再生植株困难,且电击会对原生质体造成一定伤害,降低植板率,因此在百合上的应用鲜有报道。以农杆菌为载体进行外源基因转化的方法因其低拷贝数、转化效率高而被广泛使用。虽然普遍认为农杆菌转化过程中其有效寄主并不包括单子叶植物,但目前国内外研究者已经在包括百合在内6个科部分单子叶植物中验证了农杆菌介导的遗传转化可行性[8-9]。李邱华等[10]为了获得百合无花粉品种,通过根癌农杆菌介导的遗传转化方法转化百合鳞片,将基因Zm401成功导入到新铁炮百合中。南雪花[11]在双价载体pBLGC转化体系建立的基础上转化百合,并在转化后的兰州百合中检测到了目的基因。刘伟[12]将IPT基因和NPR1基因通过农杆菌介导导入亚洲百合‘布耐罗’,PCR检测到目的基因,生理指标检测表明,转基因植株的抗衰老性、抗病性均有所提高。Mercuit et al.[13]利用农杆菌介导法向百合胚性愈伤组织中导入ROL基因,成功获得了转化植株。Pejman et al.[14]通过农杆菌介导法向L.‘Acapulco’中导入无毒CMV复制酶基因(CMV2-GDD),获得了CMV抗性很强百合植株。Qi et al.[15]将携带GUS基因的载体pCAMBIA1301利用农杆菌介导法成功导入到由百合花丝和茎段诱导的胚性悬浮细胞中。
目前,百合转基因遇到的瓶颈一方面百合基因组巨大,外源基因与受体基因组间的互作以及表达模式不清楚,基因的不表达可能是启动子原因或受体基因组因素导致基因沉默。另一方面植物基因工程的基础是建立稳定高效的再生系统,需要通过组织培养或其他培养途径,向受体细胞中导入外源DNA,使之接受外源基因的整合,但传统的组织培养方式整个过程耗时长,需要在保证分化率的的情况下克服易污染问题,筛选周期长,对操作人员要求较高,工作量大,侵染数量有限,并且不易掌握。
针对这些瓶颈问题,本研究以喷雾式植物反应器为基础进行AtCKX3基因对百合的转化。喷雾式植物反应器(包括雾培箱、水箱、回收水箱和控制系统)在开放环境下通过营养液雾化进行植物离体材料/组织的诱导反应。与传统的组织培养方法相比,具有开放式、大规模、移栽成活率高等特点。细胞分裂素氧化酶(CKX)是一类不可逆降解细胞分裂素氧化酶,影响许多植物细胞分裂素代谢,是代谢中的重要负调控因子之一,影响植物根部顶端分生组织的生长。AtCKX3也可能涉及参与相应的盐和干旱诱导机制的调控[16]。AtCKX基因在转化植株侧根原基中可促进侧根的形成,根部显著生长[17],使植株抗逆性增强。而常用外植体之一的百合鳞片分化的不定芽的诱导率最高[18],有很强再生能力。因此,本研究以东方百合‘索邦’为试材,以喷雾式植物反应器为基础,利用根癌农杆菌介导法侵染,将AtCKX3基因(根特异性启动子EXP-18D驱动并促进其表达)导入百合鳞片,探讨进行百合遗传转化以及提高转化效率的可能性,并获得抗逆性强的转基因种质,从而为百合的遗传转化和抗逆性研究提供借鉴和参考。
1材料与方法
1.1材料
以东方百合品种‘索邦’(Sorbonne)鳞片为植物材料。
菌株为携带质粒的农杆菌EHA105(保存于本实验室)。载体由北京农业生物技术研究中心吴忠义老师构建(图1)。载体含有目的基因AtCKX3,bar基因为筛选标记,具有草丁膦(PPT)抗性[19]。启动子EXP18-D具有根特异性驱动表达的特点。
1.2草丁膦质量浓度的筛选
取生长良好且生长状况均匀一致的百合幼苗,将草丁膦喷施质量浓度设置为A1(0 mg·L-1,为对照)、A2(4.5 mg·L-1)、A3(6.0 mg·L-1)、A4(8.5 mg·L-1)。每个处理45株幼苗,分别喷施后观察并记录幼苗叶片形态变化及生长情况以确定受毒害程度,从而确定百合幼苗对草丁膦的耐性,以筛选较适的质量浓度。
1.3农杆菌的培养
挑取少许菌种,在添加50 mg·L-1利福平(Rif)与50 mg·L-1卡那霉素(Km)的LB固体培养基上划线,28 ℃暗培养。随后挑取单菌落,接种于5~10 mL含有相应抗生素的LB液体培养基中(AtCKX3菌液培养时需加入四环素(TC)),于摇床中200 r·min-1震荡,过夜培养(28 ℃,黑暗)。
将摇好的菌液取适量(一般1 mL)置于LB+50 mg·L-1Rif+50 mg·L-1Km+5 mg·L-1TC的500 mL液体培养基中于摇床震荡(28 ℃,200 r·min-1)暗培养,至生长对数期:OD600为0.6~1.0。
1.4外植体鳞片的预处理
将鳞片从百合鳞茎上剥下,挑取健壮、表面光洁、无病斑的中层百合鳞片,依次用洗洁精浸泡,流水冲洗,除去其表面泥垢,备用作转化。
1.5侵染与转化
将收集好的菌液分装于50 mL离心管中,4 ℃,8 000r·min-1离心8 min,倒掉上清,回收菌体,向下层沉淀中加入少量改良的液体MS培养基:1/2MS(去除大量元素)+0.2 mg·L-1乙酰丁香酮(AS)+1.0 mg·L-16-BA+0.2 mg·L-1NAA,震荡混匀使之重悬,将重悬液倒入无菌三角瓶中,继续加入改良的液体MS培养基至重悬液OD600值达到0.6~1.0(加入的MS培养基体积和菌液体积大致相同即可)。将处理好的百合鳞片在上述重悬菌液中侵染15~20 min,后晾干,将其摆放于底部铺有纱布和经过消毒的陶粒的深色培养盒中,使鳞片基部接触陶粒和共培养培养基(1/2 MS+1.0 mg·L-16-BA+0.2 mg·L-1NAA+0.2 mg·L-1AS)。于恒温箱中28 ℃暗培养3 d(图2B)。
1.6转化鳞片的诱导分化与再生
将共培养后的鳞片(凹面朝上)放置于喷雾式反应器内采用营养液雾化方式培养,进行百合鳞茎不定芽诱导(图2C)。4次·d-1定时喷洒液体培养基30 mg·L-1MS+5 mg·L-16-BA+1 mg·L-1NAA+多菌灵800倍液。

A.喷雾式植物反应器;B.共培养中的百合鳞片;C.侵染后的鳞片于喷雾式植物反应器中分化不定芽。
图2侵染后的百合鳞片
1.6.1抗性筛选
60 d后将喷雾式反应器中分化生根幼苗移栽并进行抗性苗草丁膦的筛选。对移栽后生长良好的百合幼苗叶面均匀喷施筛选质量浓度的草丁膦。观察喷施后的植株叶片颜色变化,若生长状态正常,则认为此植株为抗性植株;若喷施后叶片枯黄并脱落,则为非抗性植株。
1.6.2抗性植株的PCR检测
提取抗性植株的DNA(TIANGEN试剂盒),根据AtCKX3基因序列和bar基因序列,用primer premier 6.2设计引物进行PCR检测。
上游引物:5’-GGA GTT GAG CCT GTT GTA GTT AG-3’
下游引物:5’-GGT TGT GGT GAT GTG TTG GTT-3’
25 μL PCR反应体系:10×PCR buffer 2.5 μL,基因组DNA 1 μL,两种引物各1 μL,LA Taq酶0.2 μL,dNTP Mix 2 μL,ddH2O 17.3 μL。
反应程序:95 ℃预变性5 min,95 ℃变性45 s,随后57 ℃退火1 min,72 ℃延伸150 s,35个循环,最后72 ℃ 2 min。目的片段大小为1 426 bp,反应结束后,取10 μL PCR产物在l%琼脂糖凝胶上进行电泳检测。
1.6.3PCR-Southern
将PCR产物100 ℃消煮10 min后立即放于冰上5 min。AtCKX3基因和bar基因的PCR产物作为杂交探针,按照罗氏DNA-Southern杂交试剂盒说明进行。
1.6.4转化植株与非转化植株根长比较
对转化植株和非转化植株进行根长的测量,每组各3个重复,进行统计,计算平均根长并进行比较。
1.7数据处理与分析
按以下公式计算移栽成活率,PCR阳性率,转化效率:
移栽成活率=(移栽成活的株数/移栽幼苗数)×100%;
PCR阳性率=(PCR检测的阳性植株/抗性植株数)×100%;
转化率=(转化植株数/总的鳞片处理数)×100%。
用SPSS 18.0进行显著性检验。
2结果与分析
2.1草丁膦质量浓度的筛选
百合植株对草丁膦的耐受程度可直接从喷施后植株叶片颜色、形态变化以及生长情况反应出来。由表1可知,与对照相比,当喷施草丁膦质量浓度为4.5 mg·L-1时,叶片枯萎发黄的植株数量较少,少数植株生长受到抑制,叶片死亡率为24.200%。而随着喷施质量浓度的增加,出现毒害现象的百合叶片数显著增多,生长受到的抑制作用也逐渐增加。当质量浓度达到8.5 mg·L-1时,黄化率达到89.800%,幼苗生长受到明显抑制,甚至个别幼小植株逐渐出现枯萎死亡现象(图3)。由此可见,草丁膦喷施的临界质量浓度为8.5 mg·L-1。

表1 百合幼苗草丁膦质量浓度的筛选

图3 百合幼苗草丁膦质量浓度的筛选
2.2百合抗性植株的检测
2.2.1抗性植株的PCR检测
对喷施过除草剂所筛选出生长情况基本良好的65株百合抗性植株进行PCR检测,检测结果表明,其中有3株含有AtCKX3基因的目的条带,如图4所示,初步证明外源基因AtCKX3已经整合到百合基因组中。

M.DL2000 Marker;1.ddH2O对照;2.阴性对照;3.阳性对照;4~6.抗性植株。
图4抗性植株AtCKX3基因PCR检测
2.2.2抗性植株的PCR-Southern检测
根据PCR检测结果,对含有AtCKX3基因的3株阳性植株进行进一步以AtCKX3基因为探针的PCR-Southern检测。
由图5可知,结果出现杂交条带,进一步证明外源基因已整合到受体植株基因组中,结果为阳性,阳性率为4.6%,占鳞片总处理数1030个的0.29%。
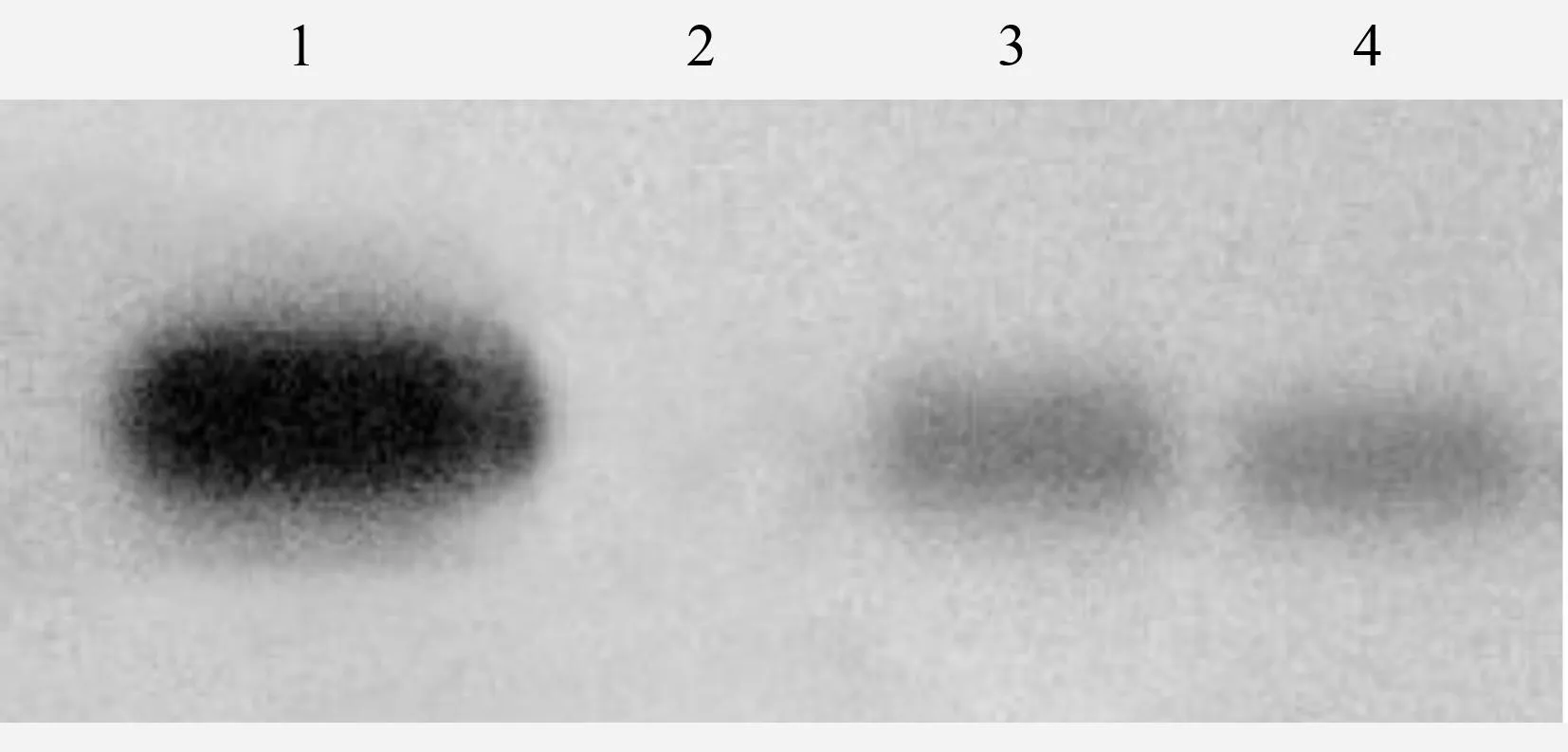
1.阳性对照;2.阴性对照;3~4.PCR阳性植株。
2.3转化植株根系状况
测量转化植株和非转化植株根系长度并进行比较(表2),测量结果显示,未转化植株根系平均长度为7.67 cm;转化植株的根系长度平均为16.56 cm,显著高于未转化植株根系平均长度,且侧根数有明显增加(图6)。

表2 转化植株与非转换植株根系平均长度
注:同列不同字母表示差异显著。

CK.对照;1~3.转化植株。
3结论与讨论
本研究针对百合的转基因瓶颈,一方面探讨了基于喷雾式植物反应器的百合遗传转化方法,提高了百合的转化效率;另一方面,为了获得抗逆新种质,提高百合抗逆性,选用从拟南芥中克隆的AtCKX3基因,成功导入到百合基因组中,获得了转化植株。下一步将扩大规模,开展转化植株田间抗旱性的鉴定等工作,以期更全面地为提高百合的转化效率及抗逆性研究提供参考。
载体的表达直接影响外源基因的表达。表达不同的基因需要不同水平的启动子[20]。非组成型启动子可在部分植物器官组织中或一些特定条件下特异性地启动目的基因的表达。本研究采用根特异性启动子EXP-18D,使目的基因AtCKX3在其驱动下启动并促进在转化植株中的表达。本研究结果表明,转化植株的根系确有明显伸长和侧根的增多。
传统组培方式需在无菌条件下开展,工作量大,而且污染率高,侵染数量有限,移栽成活率较低,而基于喷雾式植物反应器的百合遗传转化方法可实现材料的大批量遗传转化。可有效解决鳞片从外植体到获得无菌苗的易污染问题,易于缩短整个转化过程的时间并降低对操作条件的要求,操作简便,易于掌握,利于降低成本。而且幼苗移栽成活率较高,将由分化出的不定芽所生长成的幼苗进行移栽,成活率可达75%。本试验基于喷雾式植物反应器对百合鳞片进行转化,获得了阳性植株3株,转化率为0.29%,与王莎莎[21]农杆菌介导的索邦鳞片转化率0.33%持平。因此,基于喷雾式植物反应器的遗传转化方法是可行的,且在相近转化率的前提下,可以大批量操作,缩短转化周期。
参考文献
[2]van TUYL J M.Overcoming interspecific crossing barriers in Lilium by ovary and embryo culture[J].Acta Hortic,1990,26(6):317-322.
[3]李宏宇.百合高频再生体系建立及GO基因遗传转化研究[D].沈阳:沈阳农业大学,2006.
[4]储俊,许娜,钱立生,等.百合转基因体系及分子育种相关基因的研究进展[J].安徽科技学院学报,2013,27(6):26-33.
[5]陈莉.麝香百合和仙客来转Mn-SOD基因植株的获得及其耐热性鉴定[D].杨凌:西北农林科技大学,2007.
[6]LI S, DU Y P, WU Z Y, et al.Excision of a selectable marker in transgenic lily (Sorbonne) using the Cre/loxP DNA excision system[J].Canadian Journal of Plant Science,2013,93(5):903-912.
[7]张献龙,唐克轩.植物生物技术[M].北京:科学出版社,2004.
[8]WILMINK A, VAN de VEN B C E, Dons J J M.Activity of constitutive promoters in various species from the Liliaceae[J].Plant Molecular Biology,1995,28(5):949-955.
[9]刘明志.论农杆菌介导的单子叶植物转化[J].遗传,1995,17(增刊):50-52.
[10]李邱华,洪波,仝征,等.新铁炮百合遗传转化体系的建立及Zm401基因的导入[J].农业生物技术学报,2008,16(1):96-102.
[11]南雪花.GA4基因转化烟草和Chitin基因与β-1,3-Glu基因转化百合的研究[D].兰州:兰州大学,2004.
[12]刘伟.亚洲百合‘布耐罗’抗病和抗衰老基因转化的研究[D].北京:北京林业大学,2006.
[13]MERCUIT A, BENEDETTI L D, BRUNA S, et al.Agrobacterium-mediated transformation with ROL gene of Lilium longifloum Thrunb[J].Acta Hortic,2003,612:129-136.
[14]PEJMAN A, NTUI V O, Hasthanasombut S.Increased resistance to cucumber mosaic virus(CMV) in Lilium transformed with a defective CMV replicase gene[J].Biotechnology Letters,2011,33(6):1249-1255.
[15]QI Y Y, DU L J, QUAN Y H, et al.Agrobacterium-mediated transformation of embryogenic cell suspension cultures and plant regeneration in Lilium tenuifolium oriental×trumpet ‘Robina’[J].Acta Physiologiae Plantarum,2014,36(8):2047-2057.
[16]MA X, FENG D S, WANG H G.Cloning and expression analysis of wheat cytokinin oxidase/dehydrogenase gene TaCKX3[J].Plant Molecular Biology Reporter,2011,29(1):98-105.
[17]LAPLAZE L, BENKOVA E, CASIMIRO I, et al.Cytokinins act directly on lateral root founder cells to inhibit root initiation[J].The Plant Cel1,2007,19(12):3889-3900.
[18]王月.百合高效再生体系建立及遗传转化初探[D].上海:上海交通大学,2009.
[19]WU J X, ZHANG Z G, ZHANG Q, et al.Scarabaeid larvae-and herbicide-resistant transgenic perennial ryegras (Lolium perenne L.) obtained by Agrobacterium tumefacien-mediated transformation of cry8Ca2, cry8Ga and bar genes[J].Journal of Integrative Agriculture,2012,11(1):53-61.
[20]WANG X, FAN C M, ZHANG X M, et al.BioVector, a flexible system for gene specific-expression in plants[J].BMC Plant Biol,2013,13(1):198.
[21]王莎莎.农杆菌介导NPR1基因对百合遗传转化的研究[D].哈尔滨:东北农业大学,2008.
第一作者简介:张倩,女,1990年9月生,山西农业大学林学院,硕士研究生。E-mail:zqianabc@163.com。 通信作者:杨秀云,山西农业大学林学院,教授。E-mail:xyyang2002@yeah.net。
收稿日期:2015年11月26日。
分类号Q943.2;Q949.71+8.23
AtCKX3 Transformation for Oriental Lily ‘Sorbonne’ Based on the Spray Plant Bioreactor//
Zhang Qian(Shanxi Agriculture University, Taigu 030801, P.R.China); Du Yunpeng, Bi Yu, Chen Xuqing, Zhang Xiuhai(Beijing Key Laboratory of Agricultural Genetic Resources and Biotechnology (Beijing Agro-Biotechnology Research Center, Beijing Academy of Agriculture and Forestry Sciences); Yang Xiuyun(Shanxi Agriculture University)//
Journal of Northeast Forestry University,2016,44(7):59-63.
To get the higher genetic transformation frequency and obtain Lilium germplasm with good stress resistance, we used a new Agrobacterium-mediatied transformation method with spray plant reactor, an open cultivation system.The scales of Oriental hybrid ‘Sorbonne’ were used as the gene receptors of exogenous gene AtCKX3.We studied the herbicide phosphinothricin (PPT) concentration screening, transformation efficiency.The 8.5 mg·L-1(PPT) was optimal to screen seedling.After the agrobacterium infection and co-cultivation, the scales were placed in the spray bioreactor to induce adventitious buds and roots.The transformed plants were transferred and screened.We analyzed the putatively transformed plantlets by PCR and PCR-southern blotting.The results demonstrate that open culture is available to improve genetic transformed frequency of 0.29%, and the transformed transplanting survival rate is higher, reaching to 75%.
KeywordsLilium; Spray plant bioreactor; Genetic transformation; AtCKX3 gene
1)“863”计划项目(2013AA102706)、北京市农林科学院科技创新能力建设专项(KJCX20140202)。
责任编辑:任俐。
