黔南60份茶树种质资源遗传多样性的SSR分析
2016-08-06张明泽姚玉仙陈世军
张明泽,姚玉仙,陈世军
(黔南民族师范学院 生物科学与农学院,贵州都匀 558000)
黔南60份茶树种质资源遗传多样性的SSR分析
张明泽,姚玉仙,陈世军*
(黔南民族师范学院 生物科学与农学院,贵州都匀 558000)
摘要:为探索黔南野生茶树种质资源的遗传多样性,利用SSR分子标记技术,对黔南60份茶树资源进行了DNA遗传多样性分析。结果表明:15对引物均显示多态性,基因多态性百分率为98.64%。15对SSR引物共扩增出147个观测等位基因和73.778 6个有效等位基因,平均每个引物扩增9.8个观测等位基因,4.918 6个有效等位基因。15个通用位点共产生280种基因型,平均每个位点18.7种基因型。遗传多态信息量变异范围为0.123 9~0.926 8,平均0.572 5,平均观测杂合度、平均期望杂合度和平均Shannon’s信息指数分别为0.470 0、0.602 3、1.464 4。经聚类分析后,60份材料间遗传相似系数在0.205 1~0.863 6之间,以平均遗传相似系数0.477 5为阈值,可将60份种质资源聚为8个类群,其在分子遗传水平上的分类结果与其材料来源分类的结果并不完全一致,而且材料来源地间遗传距离与地理距离不存在显著的相关性,有少部分同一来源的材料分散在各个类群中。研究认为,黔南茶树资源间的遗传差异较大,遗传基础较宽,具有丰富的遗传多样性。
关键词:茶;种质资源;SSR;遗传多样性;黔南
贵州地方茶树资源分布范围广,遗传多样性丰富,特异型茶树资源较多[1]。贵州黔南地理环境独特,为茶树[Camelliasinensis(L.) O. Kuntze]生长创造了多变的环境条件,经过长期演化和选择形成了丰富多样的野生、半野生茶树种质资源,这些资源是茶树品种创新、茶叶品质提升的物质基础[2],研究及评价其遗传多样性对于茶树高产、优质和高抗育种具有重要的参考价值。
评价茶树遗传多样性的方法很多,刘声传等[3]对贵州野生茶树种质资源研究,张小琴等[4]对黔南贵定鸟王群体种研究,陈正武等[5]对贵州野生、半野生、地方品种变异体及杂交的茶树种质资源研究,结果都表明茶树种质资源的生化成分或品质性状存在丰富的多样性和遗传变异。由于茶树是异花授粉多年生植物,在长期演化中又是高度杂合体,所以传统的形态学鉴定周期长、易受生产习惯和环境的影响。DNA分子标记具有多态性丰富、准确性高、重复性好等特点,且无器官发育时期的特异性,不受环境影响,易于分析,因此在种质鉴定和遗传基础分析中显示出了较大潜力[6],如云南、贵州、广西、浙江等茶树种质资源DNA分子标记研究均有报道[7-9],鄢东海[10]采用RAPD分子标记对贵州部分地方茶树品种资源遗传多样性进行过研究。但目前,应用DNA分子标记对黔南野生茶树资源的研究尚少见报道。
SSR与其他分子标记相比,具有多态性高、多等位性、共显性、可重复性高、数量丰富和对基因组有很好的覆盖性等特点,并且该技术简便、快速、稳定性高和等位基因多样性高,因此在基因组研究中作为一种主要的分子标记技术,已经广泛地应用于遗传图谱的构建、遗传多样性分析和系统学研究[11],被认为是目前遗传多样性分析或种质资源鉴定和评价最为有效的工具之一[12 ]。本研究利用SSR分子标记技术对贵州黔南茶树资源进行遗传多样性研究,旨在明确黔南茶树种质资源的亲缘关系,为茶树育种、杂交亲本选择提供依据。

表1 供试材料编号及来源
1材料与方法
1.1供试材料
茶产业是黔南传统优势产业,从事茶产业的相关企业和技术人员较多,各县市设置有茶办等相关管理职能部门。当地从业人员及茶办对典型品系有较全面的了解,因此本试验材料的采集,由各县市茶办及当地从业人员提供线索,课题组及当地从业人员协同采集,共采集黔南地区典型野生型茶树种质资源60个品系(表1)。样品夏秋季摘取一芽二叶新梢,保存条件-80 ℃。
1.2方法
1.2.1SSR扩增基因组DNA提取采用改进的CTAB[13]法,DNA质量和浓度用0.8%琼脂糖凝胶电泳检测。本试验引物为SSR荧光引物,由北京鼎国昌盛生物技术有限责任公司合成。引物序列参照Kaundun等[14]、金基强等[15]、刘本英[13]、姚明哲[16]的文献,从中选择多态性较高的40对引物,以材料Y1、Y7、Y14、W36、W54基因组DNA作模板,进行多态性筛选,最终选择了15对引物(表2)。
1.2.2PCR扩增PCR扩增反应体系(25 μL)为:40 ng/μL 模板DNA(2.0 μL)、引物(各0.5 μL)、10 mmol·L-1dNTPs (0.5 μL)、10×PCR反应缓冲液(2.5 μL)、2UTaqDNA聚合酶(0.5 μL)、ddH2O 18.5(μL)。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,51 ℃至60 ℃不等退火30 s,72 ℃延伸30 s,35个循环;循环结束后在72 ℃延伸10 min。产物4 ℃保存。仪器为:GeneAmp PCR System 9600(Perkin Elmer,USA)。扩增产物采用毛细管电泳、自动荧光检测:在96孔上样板的每个孔中分别加1 μL纯化的PCR产物,8.5 μL甲酰胺和0.03 μL ROX500分子量内标,离心,95 ℃变性5 min,利用DNA测序仪ABI3730(Applied Biosystems,Foster City,USA)进行自动荧光检测。
1.3数据处理与分析
利用GeneMapper v 4.0软件收集电泳结果数据,确定扩增片段长度。基因型数、观测等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)、期望杂合度(He)、Shannon信息多样性指数(I)估计值、材料不同来源地间遗传一致度(genetic identity)和遗传距离(genetic distance),以及F-统计量中的Fit、Fis、Fst用PopGene Ver.1.32软件分析,根据软件处理需要,将统计的DNA片段长度转换为A、B等共显性分子标记基因型数据,其中,Fit指计算出的基因型的实际频率与理论期望频率在所有群体中的偏离程度,Fis指基因型的实际频率与理论期望频率在亚群体(居群间或物种间)中的偏离程度,Fst表示亚群体之间的遗传分化程度。根据公式Nm =0.25×(1-Fst)/Fst计算反映基因流强度(Nm)。多态信息含量(PIC, polymorphism information content)用Powermarker 3.25软件分析。多态性条带数及多态性条带百分率(PPB, percentage of polymorphic bands)利用Excel统计。材料个体间遗传相似系数、遗传距离用软件NTSYS 2.10e分析,根据软件需要,参照夏寒冰等[17]的方法,将不同长度的DNA片段视为一个等位基因,出现该等位基因时赋值“1”,不存在时赋值“0”,建立原始数据矩阵。分子系统树状图采用非加权配对算术平均法(UPGMA)聚类分析方法构建,在软件中的Matrix comp.plot对聚类结果和相似系数矩阵之间的相关性进行分析。采用TFPGA进行Mantel检测,测定材料来源地地理距离与材料来源地遗传距离的相关关系。
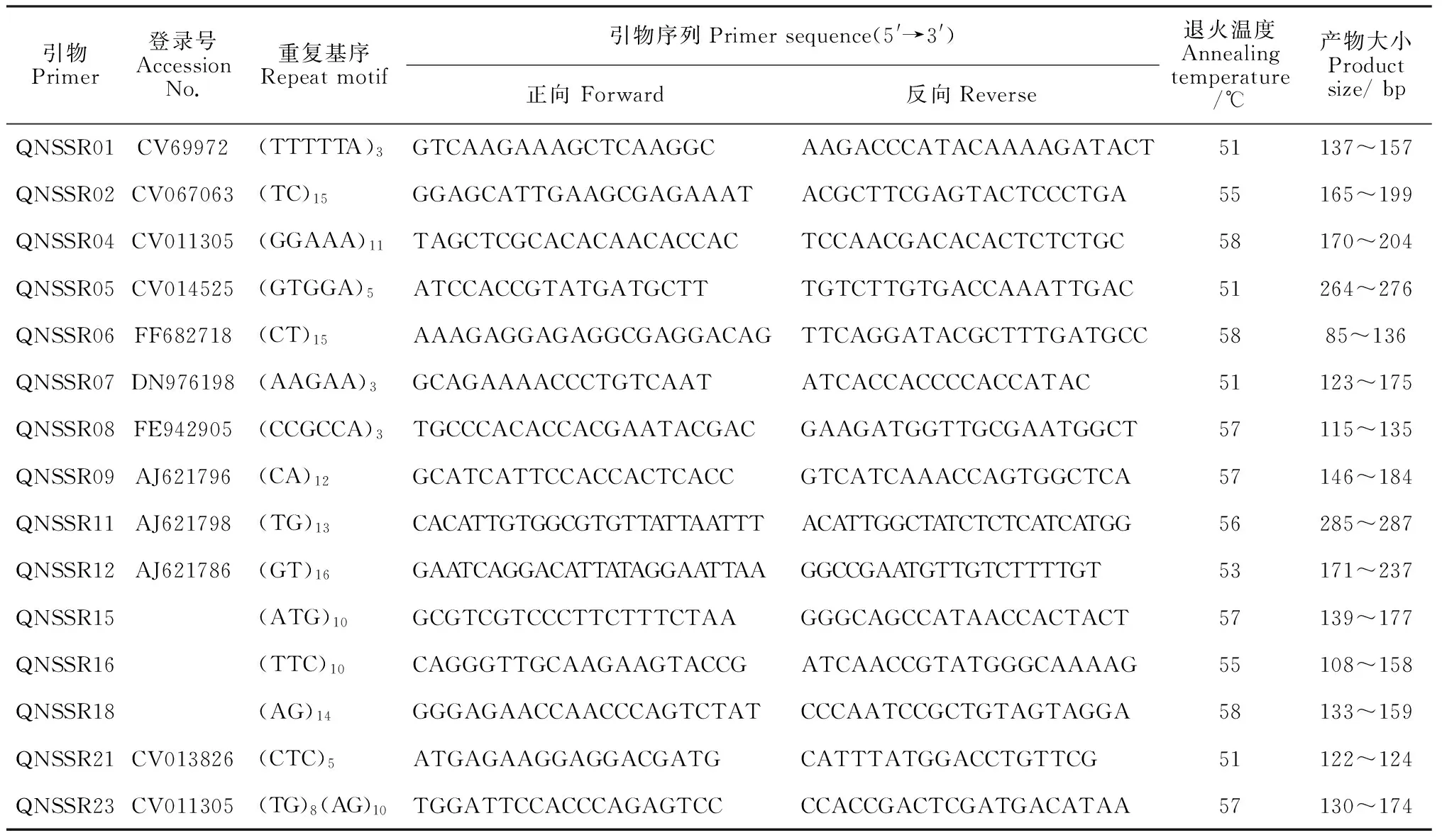
表2 引物信息
2结果与分析
2.1SSR引物标记及材料遗传多样性分析
利用筛选出的15对SSR引物,扩增黔南不同地理环境的60份野生茶树种质资源DNA,结果显示,全部样本中均扩增出谱带(85~287 bp),并且具有较好的重复性和多态性。遗传多样性分析结果(表3)表明,15对SSR引物共检测到147个观测等位基因,等位基因数量(Na)变化为2~23个,平均等位基因数为9.8个,其中多态性基因145个,占总扩增等位基因数的98.64%。每对 SSR 引物平均有效等位基因数为4.918 6。共检测到280个基因型,基因型数变化为2~45个,平均基因型数18.7个。观测杂合度(Ho)变幅在0.000 0~0.850 0之间,期望杂合度(He)变幅在0.128 2~0.938 8之间,平均观察杂合度(0.470 0)小于平均期望杂合度(0.602 3)。多态信息含量(PIC)变化范围较大,最小值为0.123 9,最大值为0.926 8,平均0.572 5;Shannon信息指数(I)变幅在0.309 9~2.862 2之间,平均1.464 4。不同的数据指标表明15对茶树SSR引物能有效揭示黔南60份野生茶树资源遗传多样性,其中5个SSR引物(QNSSR02、QNSSR04、QNSSR06、QNSSR18、QNSSR23)的I≥1.5、PIC≥0.8及Na≥10,为最有效的引物。
数据表明,黔南60份野生茶树资源具有丰富的遗传多样性。有效等位基因数与等位基因变异频率相关联。有效等位基因数与Shannon’s信息指数的变化趋势大体一致,有效等位基因数较大的SSR位点其Shannon’s信息指数也较大,Shannon’s信息指数比有效等位基因数更能反映群体的遗传多样性程度,可作为更好的评判指标。

表3 SSR引物扩增结果及多态性信息
2.2不同来源材料遗传分化分析
对材料的不同来源地(都匀、贵定、独山、惠水、三都、龙里、罗甸、瓮安、平塘、福泉)间遗传分化进行分析,结果(表4)表明,同一来源地内基因多样性(Fis)平均值为-0.040 8,多数位点表现杂合体偏高;不同来源地间基因多样性(Fit)平均值为0.193 6,表明黔南野生茶树资源总体杂合子不足。不同来源地间遗传分化系数(Fst)为0.225 2,表明22.55%的遗传分化系数存在于材料不同来源地间。材料不同来源地间基因流(Nm)平均值为0.860 1,基因流较小,说明不同来源地间基因交流程度较低。
2.3不同来源材料遗传一致度和遗传距离分析
对材料的不同来源地(都匀、贵定、独山、惠水、三都、龙里、罗甸、瓮安、平塘、福泉)间遗传一致度和遗传距离进行分析结果(表5)表明,各来源地间遗传一致度范围为0.643 0~0.943 9,遗传距离范围为0.057 7~0.441 6。都匀与贵定的遗传一致度最大(0.943 9),遗传距离最小(0.057 7),说明都匀与贵定间材料的遗传背景较相似,亲缘关系较近。而三都与罗甸的遗传一致度最小(0.643 0),遗传距离最大(0.441 6),说明三都与罗甸间材料的遗传背景有较大差异,亲缘关系较远。总体来说,10个来源地的遗传一致度都在0.64以上,说明所有来源地之间的遗传分化整体比较低,这也印证了本研究2.2中‘遗传变异主要存在于同一来源地内而非来源地之间’结论。利用Mantel检测分析了茶树资源10个来源地遗传距离与地理距离的相关性,结果表明来源地间遗传距离与地理距离不存在显著的相关性(r=0.209 7,P>0.05)。
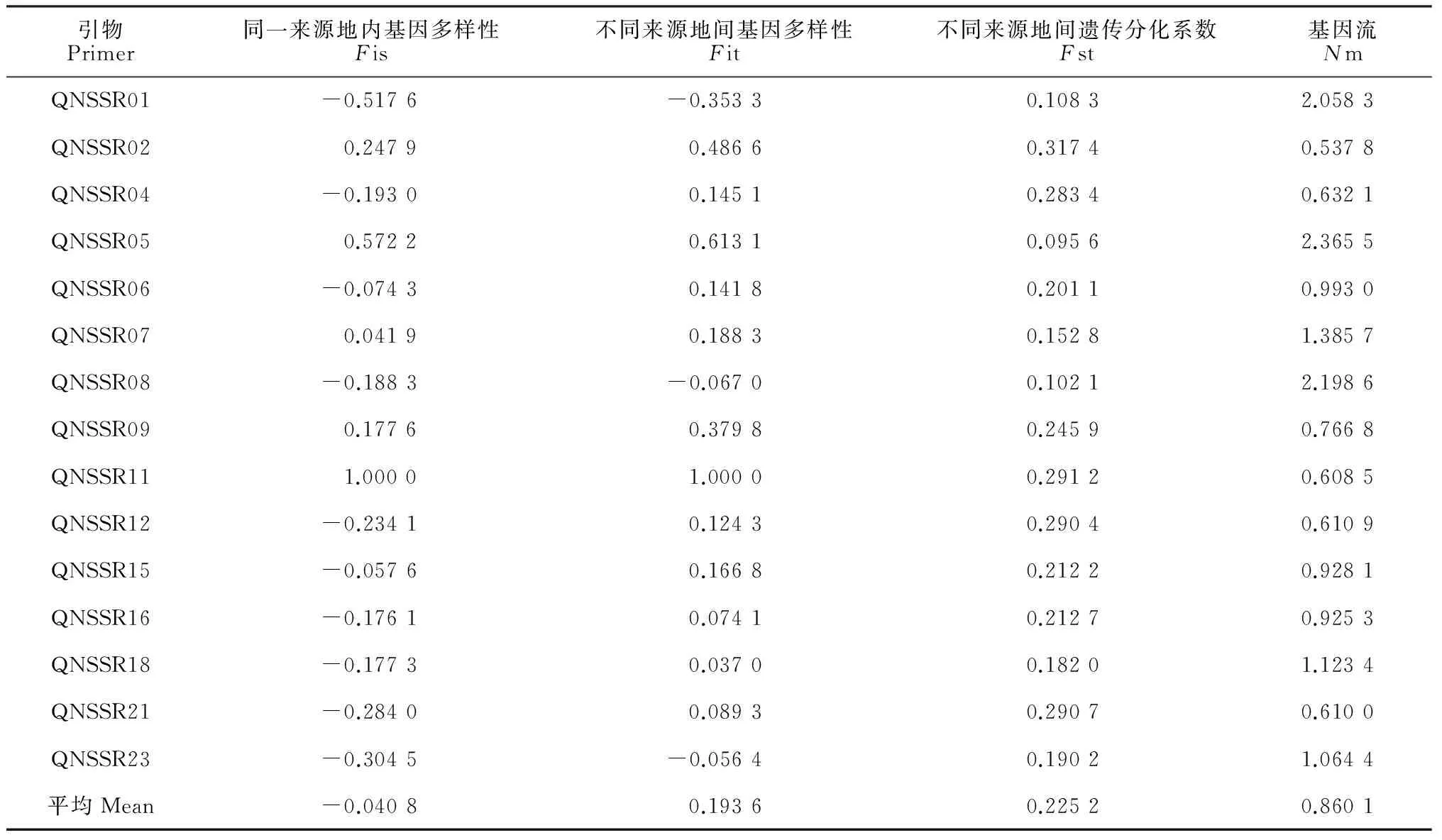
表4 材料来源地间的遗传分化

表5 材料来源地间遗传一致度(对角线以上)和遗传距离(对角线以下)
2.4不同供试材料间的亲缘关系
根据SSR标记计算60份供试材料间的遗传相似系数介于0.205 1~0.863 6之间,平均为0.477 5,其中来自惠水的种质材料W40与来自三都的W41之间的相似系数最大,为0.863 6,遗传距离小,亲缘关系最近;相反来自都匀的种质材料Y32与来自平塘的W57之间的相似系数最小,为0.205 1,亲缘关系最远。各材料间UPGMA聚类(图1)结果进行cophenetic correlation分析,相关系数为0.691 9,说明聚类效果较好。在遗传相似系数为0.477 5处,60份茶树资源被聚为8个类群,第Ⅰ类群共33份种质材料(都匀18份、贵定8份、独山2份、龙里2份、罗甸1份、瓮安1份、福泉1份);第Ⅱ类群共17份种质材料(平塘5份、都匀4份、惠水3份、贵定2份、独山1份、龙里1份、罗甸1份);第Ⅲ类群只有来自都匀的1份种质材料;第Ⅳ类群共有3份种质材料,全部来自独山;第Ⅴ类群只有来自都匀的1份种质材料;第Ⅵ类群共3份种质材料(三都2份、惠水1份);第Ⅶ类群只有来自平塘的1份种质材料;第Ⅷ类群只有来自独山的1份种质材料。以遗传相似系数0.520 0为阈值,第Ⅰ类群和第Ⅱ类群可细分为3个亚群,第Ⅵ类群可细分为2个亚群。材料Y20、Y32、W51、W55分别单独聚类,说明它们与其他地方茶树种质资源间的遗传差异较大,其余种质资源基本按照地域优先聚类。在育种过程中尽量选择第Ⅰ和第Ⅱ这两个核心类群的材料作为亲本,以增加优良性状的基因交流频率。
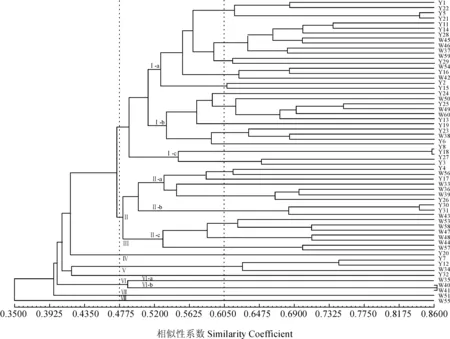
材料编号同表1图1 基于SSR标记的60个供试材料的UPGMA聚类图Materials codes are same as Table 1.Fig. 1 Dendrogram obtained using UPGMA based on SSR marker for 60 tea germplasms
3讨论
茶树种质资源及遗传育种研究以遗传多样性为基础,从而选育新的优良品种。SSR分子标记技术在茶树遗传多样性及种质鉴定研究方面应用广泛,本研究利用该技术揭示了黔南地区60份野生茶树种质资源的遗传多样性水平,筛选出15对SSR核心引物。多态性信息量PIC为评价引物多态性的重要指标,当PIC>0.5时,该位点为高度多态位点;当0.25 相似系数平均值是用来比较不同群体遗传多样性大小的重要指标。本研究结果显示茶树种质资源间遗传相似系数变化范围为0.205 1~0.863 6,平均为0.477 5,相似系数范围较大,表明资源间遗传基础较宽。牛素贞等[19]研究贵州黔南地区茶树地方品种的EST-SSR遗传多样性发现Na、Ne、Ho、He和PIC的平均值分别为3.970 0、3.120 0、0.620 0、0.690 0和0.610 0,这与本研究结果有所区别,可能是由于使用的引物种类不同、供试材料不同以及采用分辨率更高的毛细管电泳所致[20]。本研究60份野生茶树种质资源在遗传相似系数0.477 5处分为8个类群,其在遗传水平上的分类结果与其材料来源分类的结果并不完全一致,材料来源地间遗传距离与地理距离不存在显著的相关性,有少部分同一来源地的材料分散在各个类群中,这与Yao等[21]研究西南地区茶树资源的结果有些类似,可能是因为引种交流导致少部分基因在不同地区间渗入[22-23]。 黔南州是中国十大名茶之一“都匀毛尖”的原产地,茶叶是该地区主要经济作物之一,目前黔南州茶树主栽品种的选育主要通过资源引进与筛选,自育品种很少。本研究中供试材料所表现出较高的多态性和较大的遗传距离,说明该地区茶树种质资源丰富,遗传背景复杂,今后研究的重点在于从这些茶树种质资源中发掘优异的基因资源,进行遗传定位和分子标记,为优异基因聚合新种质的创造奠定基础,从而促进茶树种质资源的创新与利用、新品种选育等研究的进一步开展。 参考文献: [1]鄢东海. 贵州茶树种质资源研究进展及野生茶树资源调查[J]. 贵州农业科学,2009,37(7):184-187. YAN D H. Research progress on tea germplasm resources and investigation of wild tea resource in Guizhou[J].JournalofGuizhouAgriculturalSciences, 2009, 37(7): 184-187. [2]陈亮,杨亚军,虞富莲. 中国茶树种质资源研究的主要进展和展望[J]. 植物遗传资源学报,2004,5(4):389-392. CHEN L, YANG Y J, YU F L. Tea germplasm research in China: recent progresses and prospects[J].JournalofPlantGeneticResources, 2004, 5(4): 389-392. [3]刘声传,段学艺,赵华富,等. 贵州野生茶树种质资源生化多样性分析[J]. 植物遗传资源学报,2014,15(6):1 255-1 261. LIU S C, DUAN X Y, ZHAO H F,etal. Biochemical diversity analysis of wild tea germplasms in Guizhou[J].JournalofPlantGeneticResources, 2014, 15(6): 1 255-1 261. [4]张小琴,周富裕,杨春,等. 贵定鸟王种茶树资源农艺性状和品质性状多样性分析[J]. 分子植物育种,2015,13(2):415-423. ZHANG X Q, ZHOU F Y, YANG C,etal. Diversity of tea germplasm resource (Camelliasinensis‘Guiding-niaowangzhong’) revealed based on agronomic and quality traits[J].JournalofMolecularPlantBreeding, 2015, 13(2): 415-423. [5]陈正武,陈娟,龚雪,等. 28份贵州茶树种质资源的生化成分多样性分析[J]. 西南农业学报,2015,28(4):1 517-1 523. CHEN Z W, CHEN J, GONG X,etal. Diversity analysis for biochemical components of 28 tea germplasm resources in Guizhou[J].SouthwestChinaJournalofAgriculturalSciences, 2015, 28(4): 1 517-1 523. [6]刘本英,王丽鸳,周健,等. 云南大叶种茶树种质资源ISSR指纹图谱构建及遗传多样性分析[J]. 植物遗传资源学报,2008,9(4):458-464. LIU B Y, WANG L Y, ZHOU J,etal. Fingerprinting construction and genetic diversity analysis of Yunnan Dayezhong tea germplasm resources by ISSR markers[J].JournalofPlantGeneticResources, 2008, 9(4): 458-464. [7]刘本英,李友勇,孙雪梅,等. EST-SSR分析云南茶树资源的遗传多样性和亲缘关系[J]. 核农学报,2010,24(5):956-967. LIU B Y, LI Y Y, SUN X M,etal. Genetic diversity and relationship of tea germplasm in Yunnan by EST-SSR markers analysis[J].ActaAgriculturaeNucleataeSinica, 2010, 24(5): 956-967. [8]乔小燕,乔婷婷,周炎花,等. 基于EST-SSR的广东与广西茶树资源遗传结构和遗传分化比较分析[J]. 中国农业科学,2011,44(16):3 297-3 311. QIAO X Y, QIAO T T, ZHOU Y H,etal. Comparative analysis of genetic structure and differentiation of Guangdong and Guangxi tea germplasms based on EST-SSR markers[J].ScientiaAgriculturaSinica, 2011, 44(16): 3 297-3 311. [9]王丽鸳,姜燕华,段云裳,等. 基于SSR分子标记的龙井群体种的遗传多样性及遗传分化研究[J]. 茶叶科学,2011,31(1):40-44. WANG L Y, JIANG Y H, DUAN Y S,etal. Genetic diversity and differentiation of Longjing tea population based on SSR markers[J].JournalofTeaScience, 2011, 31(1): 40-44. [10]鄢东海,刘声传,罗显扬,等. 贵州地方茶树品种资源遗传多样性RAPD分析[J]. 中国农学通报,2015,31(19):30-34. YAN D H, LIU C S, LUO X Y,etal. Analysis of genetic diversity with RAPD markers for local tea populations in Guizhou[J].ChineseAgriculturalScienceBulletin, 2015, 31(19): 30-34. [11]王丽鸳,姜燕华,段云裳,等. 利用SSR分子标记分析茶树地方品种的遗传多样性[J]. 作物学报,2010,36(12):2 191-2 195. WANG L Y, JIANG Y H, DUAN Y S,etal. Genetic diversity of tea landraces using SSR markers[J].ActaAgronomicaSinica, 2010, 36(12): 2 191-2 195. [12]许兰杰,侯起岭,侯春雨,等. 不同抗蚜性小麦品种(系)的遗传多样性SSR标记分析[J]. 华北农学报,2014,29(5): 119-124. XU L J, HOU Q L, HOU C Y,etal. Genetic diversity analysis of wheat varieties with different aphids-resistant by simple sequence repeat (SSR) markers[J].ActaAgriculturaeBoreali-Sinica, 2014, 29(5): 119-124. [13]刘本英. EST-SSR和ISSR分子标记在云南茶树资源中的应用研究[D].北京:中国农业科学院茶叶研究所,2009. [14] KAUNDUN S S, MATSUMOTO S. Heterologous nuclear and chloroplast microsatellite amplification and variation in tea,Camelliasinensis[J].Genome, 2002, 45(6): 1 041-1 048. [15]金基强,崔海瑞,龚晓春,等.用EST-SSR标记对茶树种质资源的研究[J].遗传,2007,29(1):103-108. JIN J Q, CUI H R, GONG X C,etal. Studies on tea plants (Camelliasinensis) germplasms using EST-SSR marker[J].Hereditas(Beijing), 2007, 29(1): 103-108. [16]姚明哲.利用ISSR和EST-SSR标记研究中国茶树资源的遗传多样性和遗传结构[D].杭州:浙江大学,2009. [17]夏寒冰,卢宝荣.共显性分子标记基因型数据转换为二元型数据的处理软件及其在研究种质资源遗传多样性中的意义[J].植物遗传资源学报, 2009, 10(1): 97-102. XIA H B, LU B R. Software for transforming co-dominant genotype scores into binary data matrix: its application to genetic diversity research[J].JournalofPlantGeneticResources, 2009, 10(1): 97-102. [18]李赛君,雷雨,段继华,等. 基于EST-SSR的祁门种群体遗传多样性和亲缘关系分析[J]. 茶叶科学,2015,35(4):329-335. LI S J, LEI Y, DUAN J H,etal. Analysis of genetic diversity and relationship of Qimen population of tea plants based on EST-SSR markers[J].JournalofTeaScience, 2015, 35(4): 329-335. [19]牛素贞,刘玉倩,杨锦标,等. 贵州茶树地方品种的EST-SSR遗传多样性分析[J]. 浙江农业学报,2012,24(5):836-841. NIU S Z, LIU Y Q, YANG J B,etal. Analysis of genetic diversity of tea landrace resources in Guizhou by EST-SSR markers[J].ActaAgriculturaeZhejiangensis, 2012, 24(5): 836-841. [20]刘振,王新超,赵丽萍,等. 基于EST-SSR的西南茶区茶树资源遗传多样性和亲缘关系分析[J]. 分子植物育种,2008,6(1):100-110. LIU Z, WANG X C, ZHAO L P,etal. Genetic diversity and relationship analysis of tea germplasms originated from south western China based on EST-SSR[J].JournalofMolecularPlantBreeding, 2008, 6(1): 100-110. [21]YAO M Z, MA C L, QIAO T T,etal. Diversity distribution and population structure of tea germplasms in China revealed by EST-SSR markers[J].TreeGenetics&Genomes, 2012, 8(1): 205-220. [22]张淑青,刘冬成,刘威生,等. 普通杏品种SSR遗传多样性分析[J]. 园艺学报,2010,37(1):23-30. ZHANG S Q, LIU D C, LIU W S,etal. Analysis of genetic diversities in apricot cultivars (PrunusarmeniacaL.) with simple sequence repeat (SSR) markers[J].ActaHorticulturaeSinica, 2010, 37(1): 23-30. [23]宋常美,文晓鹏,杨尔泰. 贵州樱桃种质资源的ISSR分析[J]. 园艺学报,2011,38(8):1 531-1 538. SONG C M, WEN X P, YANG E T. Cherry germplasm from Guizhou Province analyzed by ISSR markers[J].ActaHorticulturaeSinica, 2011, 38(8): 1 531-1 538. (编辑:宋亚珍) 文章编号:1000-4025(2016)06-1117-08 doi:10.7606/j.issn.1000-4025.2016.06.1117 收稿日期:2016-03-25;修改稿收到日期:2016-05-06 基金项目:贵州省普通高校教育质量提升重点科研项目(2011017);黔南民族师范学院项目(QNSY2010014) 作者简介:张明泽(1986-),男,硕士,讲师,主要从事茶树生理生态和种质创新研究。E-mail:710645368@qq.com *通信作者:陈世军,教授,主要从事植物种质资源研究与利用。E-mail:280241879@qq.com 中图分类号:Q346+.5;Q789;S571.1 文献标志码:A Genetic Diversity Analysis of Tea Germplasm in Qiannan Prefecture by SSR Markers ZHANG Mingze, YAO Yuxian, CHEN Shijun* (College of Bioscience and Agronomy, Qiannan Normal University for Nationalities, Duyun, Guizhou 558000, China) Abstract:In this study, fifteen SSR primer pairs with polymorphism were used to assess genetic diversity and relationship of 60 wild tea germplasms from Qiannan prefecture. The results showed that the percentage of polymorphic bands (PPB) was 98.64%. A total of 147 observed alleles and 73.778 6 effective alleles were generated, with a mean of 9.8 and 4.918 6 per locus. Totally 280 genotypes were detected in all materials, with a mean of 18.7 for each polymorphism primer pairs. The polymorphism information content varied from 0.123 9 to 0.926 8, with an average of 0.572 5. The average observed and expected heterozygosities were 0.470 0 and 0.602 3, respectively. The average Shannon’s information index was 1.464 4. The similarity coefficient among 60 tea germplasms was 0.205 1 to 0.863 6. When the similarity coefficient was 0.477 5, eight major groups were generated from all the accessions tested by UPGMA clustering analysis. The results showed that there were no significant correlation between genetic and geographic distance among the tea germplasms, and some individuals in the same population distributed in different groups of the cluster. These results suggested that the materials used in the experiment possessed a broad genetic variation, showing a high level of genetic polymorphism among tea germplasms revealed by SSR markers. Key words:tea; germplasm resources; SSR molecular mark; genetic diversity; Qiannan prefecture
