基于复杂网络的三种眼睛状态下脑功能连通性比较
2016-08-05陈东太郎曾卫明王倪传石玉虎
陈东太郎,曾卫明,王倪传,石玉虎
(上海海事大学 信息工程学院,上海 201306)
基于复杂网络的三种眼睛状态下脑功能连通性比较
陈东太郎,曾卫明*,王倪传,石玉虎
(上海海事大学 信息工程学院,上海 201306)
摘要:尝试构建不同眼睛状态下的静息态脑功能网络,研究睁眼、闭眼和自由状态下的大脑网络拓扑结构差异.招募了13例被试者,用一台3T的西门子磁共振仪,获取了3种眼睛静息状态下各8 min的功能磁共振数据,并同时采集了结构像.随后,构建3组被试者的功能连通矩阵,计算其复杂网络的全局特征系数、局部特征系数等测度参数.对测度进行方差分析与双样本t检验,以统计分析被试者之间的差异.我们发现,所有的状态在合适的稀疏度下,展现了小世界特性;相比于其他状态,闭眼状态下的全局效率较低.自由状态在复杂网络的各项测度上接近睁眼状态.综上所述,该项研究展现了睁眼、闭眼、自由状态对人脑功能连通网络的影响,并为眼睛状态如何影响功能磁共振实验提供了关键的证据.
关键词:自由状态;静息态功能磁共振;睁闭眼;复杂网络;功能连通性
人类运用视觉系统感知周围环境,收集有价值的信息.眼睛作为空间信息收集的一个主要的感觉器官,长期以来受到研究人员的关注.近些年来,功能性磁共振成像(functional magnetic resonance imaging,简称fMRI)技术广泛地运用于人类行为实验和病理研究当中.在人类行为实验方面,研究人员已经对视觉刺激和听觉刺激进行了初步的探索.而病症方面,fMRI技术已经广泛地应用于许多病症的研究当中,如精神分裂症、阿尔兹海默症、偏头痛等[1].作为一种无创伤的检测手段,fMRI为我们理解人类大脑提供了一个新的视角.随着这项技术在医学诊断上的推广,已经有研究表明,不同的静息状态会对大脑的功能连通网络有着显著的影响[2].
脑功能连通性(functional conectivity,简称FC)是指大脑不同区域的神经细胞群活动之间的瞬时相干性.脑功能连通性研究的发展,有利于深入理解人脑在系统水平上的动态运作方式,是今后认知神经科学发展的一个重要方向.而探究不同眼睛的静息状态fMRI图像的功能连通性的差别,可以帮助研究人员更好地了解静息状态,从而使得人们更好地理解视觉感官与中枢神经系统的运作机制.对于不同眼睛的静息状态的比较,可以为其他病理学研究提供一个判断的依据.在病理学研究中,眼睛的状态是一个重要的影响因素,这一因素对于实验结果的分析会产生显著的影响.
许多研究已经关注到不同的眼睛静息状态在fMRI图像中所表现出来的差异,其中大部分研究关注睁、闭眼之间fMRI信号之间的区别.Marx等[3]发现fMRI图像中存在一些固有的模式,可以通过这些模式观测到状态间的区别.随后,研究人员提出使用特定感兴趣区域(region of interest,简称ROI)之间的相关性来度量fMRI信号之间的距离,并将这一度量运用到研究中.Zou等[4]关注到视觉区和丘脑之间的连通性存在差异.随着相关性研究数量的增加,研究人员提出了大脑的功能连通性[5-7],并将图论运用到大脑的拓扑网络结构中[8-9].关于使用功能连通性与图论的研究,具有代表性的论文有Tian等[10]的大脑半球与性别的研究,这项研究表明大脑半球与性别两个因素会对人脑功能连通性有显著的影响;Xu等[2]发现了睁眼闭眼之间大脑拓扑结构网络之间的区别.
由上述可以看出,运用图论知识,可以帮助研究人员构建核磁共振影像的功能连通矩阵,建立大脑的拓扑结构网络,从而为理解大脑功能区域之间的同步性提供一种良好的手段.图论的方法同样运用于比较许多神经疾病患者的大脑静息态脑功能网络的拓扑结构度量测度的差异.这些拓扑度量包括聚类系数、特征路径长度等,有学者认为这些测度的异常可以作为辅助诊断的生理标志.
然而,多数的研究仅仅注意了睁眼、闭眼状态.在日常的诊断中,扫描人员通常不会指定被试者的眼睛状态,而这种现象在日常实验中是十分常见的.病人常常是处于自由的眼睛开合状态,并不能够长时间的保持双眼睁开与闭合.带有某些精神疾病的病人,在进行fMRI扫描的过程中,也无法控制自己的眼睛状态.在相关文献中,还没有发现对于自由状态的研究.所以,研究人员常常忽视这种常见的自由状态.该文中,笔者扩展了传统的睁眼、闭眼两种状态下fMRI大脑拓扑网络测度比较实验,加入了一种新的状态,即自由状态.探讨了3种眼睛状态下的显著差异,以期为日常的fMRI实验设计提供有效的依据.
1资料与方法
1.1数据获取
笔者从高校中招募了13名健康被试者(其中3名女性,平均年龄23.7岁,方差为±3.19),被试者无精神病史和头部创伤.在对被试者解释了fMRI数据采集过程和实验目的后,要求被试者签署了知情书.
实验包括以下3种状态:1)睁眼状态(eyes open,简称EO)下,要求被试者睁开双眼,盯住机器上方的十字,并保持尽量低的眨眼频率.2)闭眼状态(eyes close,简称EC)下,要求被试者闭上双眼,保持较少的视觉输入.3)眼睛自由状态(eyes free,简称EF)中,被试者可以自由地改变其眼睛状态.数据获取过程中被试者要求保持大脑清醒,平躺于磁共振仪器内,不做任何特定思考,并要求不能进入睡眠状态.
所有的fMRI数据采用了华东师范大学的一台3T的西门子磁共振仪,使用单次激发敏感梯度回波平面成像这一成像方法[11],切片数为36,覆盖整个脑区,扫描间隔时间(repetition time,简称TR)为2.0 s,扫描分辨率为64×64,片内分辨率为3.75 mm×3.75 mm,片厚度为3.5 mm.
1.2方法
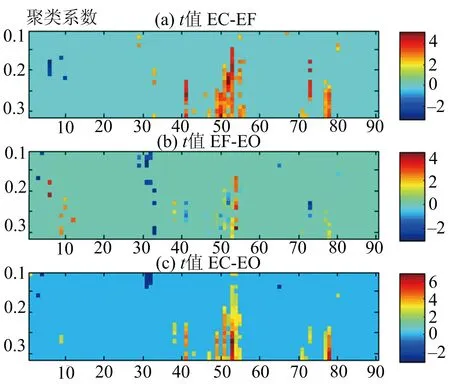
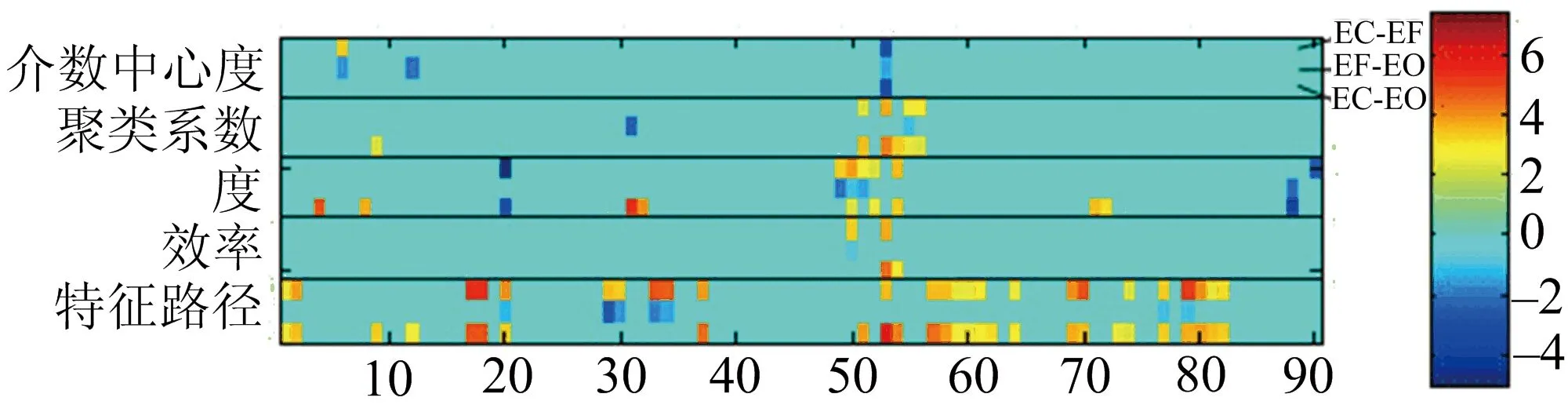
利用DPARSF[12]软件包对数据进行处理,包括以下几个步骤:时间层矫正、头动矫正、标准化、配准等.配准时,若有数据是在任何方向上的头动位移大于2 mm或头部转动大于2°的,这样的数据会被丢弃[13-16].接着,所有的时间序列都去除线性漂移并通过带宽为0.01 Hz 采用自动解剖标签模板(anatomical automatic labeling,简称AAL)[19],将大脑划分为90个ROI,计算ROI内部的均值信号,得到90个ROI的平均信号.对90个平均信号计算其皮尔森相关系数[20],得到90×90的功能连通矩阵.对于功能连通矩阵,使用一系列的稀疏度(0.1~0.3,间隔为0.01)将权重矩阵转化为二值矩阵,之后计算网络的相关测度. 1.3复杂网络的构建 对于每个功能连通矩阵,计算5个全局的网络系数和3个局部系数[5].全局系数包括:平均聚类系数[21]、特征路径长度[22]、全局效率[23]、同配性、传递性.5个局部系数包括:介数中心度[23]、局部聚类系数[24]、局部特征路径长度、节点的度、局部效率.这些测度的计算方法,都可以在其对应的文献中查询.同时,模拟随机的被试者网络[15, 24-25],并计算小世界性质的相关参数[21].对于所有的参数,使用方法分析比较3个样本是否来自同一个总体,再使用成对的t检验,检验两个样本之间差异的显著程度[5-6,8]. 2结果 2.1全局参数的比较 图1展示了3种眼睛状态下,实验中被试者的脑功能网络全局系数比较,展现被试组在不同稀疏度下的同配性、平均聚类系数、特征路径长度、全局效率、传递性.图中横轴为稀疏度,其值的范围从0.1到0.3,间隔为0.01;纵轴为参数值或p值. 由图1可知,在全部的稀疏度下,3种状态的同配性,没有显著差异(图1A).在全部的稀疏度下,特征路径长度显著增加(图1C).在稀疏度大于0.13时,全局效率显著下降(图1D).闭眼状态与睁眼状态、自由状态相比,在稀疏度大于0.25时,平均聚类系数有显著的增强(图1B);传递性显著增强(图1E).从图1中还可以知道,睁眼状态与自由状态的复杂网络的测度没有显著差异.在两个标准化的测度下,3种眼睛状态的标准化聚类系数(图1F)没有显著差异,其值都大于1.标准化的特征路径长度(图1G)与真实的特征路径长度相似,其值约等于1.最后,3种眼睛状态的小世界性(图1H)的值都大于1. 2.2局部参数的比较 图2展示了3种眼睛状态下,被试者的脑功能连通网络的局部聚类系数的比较.图中横轴为脑区的标签,从1到90,每一个标签对应于AAL模板中的一个脑区;纵轴为稀疏度,从0.1到0.3,间隔为0.01,图为热力图,颜色表示t检验的t值. 从图2中可以看出,显著的差异集中在部分脑区(49—58)上,主要包括左侧枕上回(Occipital_Sup_L,49)、右侧枕上回(Occipital_Sup_R,50)、左侧枕中回(Occipital_Mid_L,51)、右侧枕中回(Occipital_Mid_R,52)、左侧枕下回(Occipital_Inf_L,53)、右侧枕下回(Occipital_Inf_R,54)、左侧丘脑(Thalamus_L,77)和右侧丘脑(Thalamus_R,78). 图3展示了3种眼睛状态下,被试者的脑功能连通网络的聚合的局部系数的比较.图中横轴为脑区的标签,从1到90,每一个标签对应于AAL模板中的一个脑区;纵轴为各项指标,每个指标中有3行,分别表示3种状态之间的相互比较.从图3中可以看出,3种状态在不同的脑区影响不同的参数. 图1 3种眼睛状态下被试者的脑功能连通网络的全局系数比较Fig.1 Global parameters of the human brain functional networks with the status of EC, EF and EO 图2 3种眼睛状态下被试者的脑功能连通网的局部聚类系数比较Fig.2 Local parameters of the human brain functional networks with the status of EC, EF and EO 图3 3种眼睛状态下被试者的脑功能连通网的聚合的局部系数比较Fig.3 Integrated global parameters of the brain functional networks with the status of EC, EF and EO 2.3关键节点的比较 将度变化较大的节点为关键节点.图4展示了3种眼睛状态下,特征路径长度受到影响的关键节点. 图4 关键节点之间的比较Fig.4 The difference of the key hub 从图4中可以看出,相比于睁眼、自由状态,闭眼状态的主要影响关键节点在枕叶部分.睁眼状态与自由状态相比,其关键节点的主要差异存在于如下脑区:左侧枕上回(Occipital_Sup_L,49)、右侧枕上回(Occipital_Sup_R,50)、左侧枕中回(Occipital_Mid_L,51)、右侧枕下回(Occipital_Inf_R,54)和右侧颞中回颞极(Temporal_Pole_Mid_R,88). 2.4功能连通矩阵的比较 图5展示了3种眼睛状态下,功能连通矩阵的差别. 图5 功能连通矩阵之间的比较Fig.5 The difference of raw brain functional connectivity 通过对连接的权值进行比较,可以发现在3种状态之间,各个脑区之间的通路出现显著差异.由图5可以看出,随着视觉信号的输入,枕叶部分的视觉区域与外部的通路出现显著差异.在睁眼状态与自由状态之间的比较上,可以发现一个聚合的网络,构成网络的主要节点包括:左侧梭状回(Fusiform_L,55)、左侧上部中央后回(Parietal_Sup_L,59)、左侧苍白球(Pallidum_L,75)、右侧颞上回颞极(Temporal_Pole_Sup_R,84)、右侧颞中回颞极(Temporal_Pole_Mid_R,88)、左侧颞下回(Temporal_Inf_L,89)、右侧颞下回(Temporal_Inf_R,90). 3讨论 尽管先前的研究已经在特定的ROI区域和脑功能连通网络参数上都发现视觉输入对fMRI信号有显著的影响,但笔者在前人研究的基础之上,发现普通的日常实验中常见的自由状态与睁眼状态,没有过多的差异.参考先前的研究[21],运用图论的方法,将脑功能连通矩阵进行小世界特性分析,结果发现,3种眼睛状态都表现出了小世界特性.传统的观点认为,人类的大脑功能连通网络是一个小世界网络,拥有少数重要的权值和聚合特性.该项研究又为大脑功能连通网络的特性提供了新的证据. 作为复杂网络中的一个重要的参数,聚类系数反映着网络中节点的聚集程度,能很好地用来度量网络皮层之间的相互连接及功能分割情况[21].该研究中发现,随着视觉信号的输入,被试者大脑的聚类系数显著降低,表明网络之间聚集程度降低.因此,认为随着人类睁开双眼,大脑由默认的模式转而去处理视觉信号,造成了聚类系数的降低. 路径是大脑区域之间的信息通路.特征路径长度是全脑信息流的有效度量[22].从结果部分可以看出,自由状态下的特征路径长度,要显著地比闭眼状态下的特征路径长度要低,这说明,被试者在自由状态下,信息的传递路径较短,大脑自发地使自身路径通畅,有利于信号的传递. 研究中发现,网络全局效率[23],在不同的稀疏度下,都表现出了明显的差异,这表明视觉的输入会导致全局效率的提高,这正好符合信息处理模型的假设.根据信息处理模型的假设,假设人体是一个信号处理的机器,随着外部信号的输入,大脑提高了自身的传递效率,从而能够更加便捷地处理信号. 值得注意的是,笔者的研究结果与前人的一些研究结果有稍许差异,这些研究结果发现人类在自由状态相比于闭眼状态,有较高的聚类系数和较低的特征路径长度[2].也有部分研究表明,睁眼、闭眼状态对复杂网络测度没有影响.造成这些现象的原因可能是:1)这些研究没有去除全脑平均信号的协变量(global signal regression, 简称GSR);2)模板的选择不同;3)采样的频率不同;4)采样的空间分辨率不同.上述原因都可能导致实验结果上的差异. 综上,通过对常见的自由状态的研究表明,睁眼、闭眼、自由状态对人脑功能连通网络会产生一定的影响.由于复杂网络理论在fMRI信号上的广泛应用,笔者建议在其他病理学实验上要谨慎控制眼睛状态. 参考文献: [1]CUTRER F M, BLACK D F. Imaging findings of migraine[J]. Headache, 2006, 46 (7): 1095-1107. [2]XU P, HUANG R, WANG J, et al. Different topological organization of human brain functional networks with eyes open versus eyes closed[J]. Neuroimage, 2014, 90: 246-255. [3]OGAWA S, LEE T M, KAY A R, et al. Brain magnetic resonance imaging with contrast dependent on blood oxygenation[J]. Proceedings of the National Academy of Sciences, 1990, 87 (24): 9868-9872. [4]THESEN S, HEID O, MUELLER E, et al. Prospective acquisition correction for head motion with image-based tracking for real-time fMRI[J]. Magnetic Resonance in Medicine, 2000, 44 (3): 457-465. [5]THICKBROOM G, PHILLIPS B, MORRIS I, et al. Differences in functional magnetic resonance imaging of sensorimotor cortex during static and dynamic finger flexion[J]. Experimental Brain Research, 1999, 126 (3): 431-438. [6]FERRIS C F, SNOWDON C T, KING J A, et al. Functional imaging of brain activity in conscious monkeys responding to sexually arousing cues[J]. Neuroreport, 2001, 12 (10): 2231-2236. [7]RUGE M I, VICTOR J, HOSAIN S, et al. Concordance between functional magnetic resonance imaging and intraoperative language mapping[J]. Stereotactic and Functional Neurosurgery, 1999, 72 (2/3/4): 95-102. [8]KHUSHU S, KUMARAN S, TRIPATHI R, et al. Functional magnetic resonance imaging of the primary motor cortex in humans: response to increased functional demands[J]. Journal of Biosciences, 2001, 26 (2): 205-215. [9]BROWN R W, CHENG Y C N, HAACKE E M, et al. Magnetic resonance imaging: physical principles and sequence design[M]. New Jersey: John Wiley & Sons, 2014. [10]SETO E, SELA G, MCILROY W, et al. Quantifying head motion associated with motor tasks used in fMRI[J]. Neuroimage, 2001, 14 (2): 284-297. [11]GRISWOLD M A, JAKOB P M, HEIDEMANN R M, et al. Generalized autocalibrating partially parallel acquisitions (GRAPPA) [J]. Magnetic Resonance in Medicine, 2002, 47 (6): 1202-1210. [12]YAN C G, ZANG Y F. DPARSF: a MATLAB toolbox for “pipeline” data analysis of resting-state fMRI[J]. Front Syst Neurosci, 2010, 4: 13. [13]MOWINCKEL A M, ESPESETH T, WESTLYE L T. Network-specific effects of age and in-scanner subject motion: a resting-state fMRI study of 238 healthy adults[J]. Neuroimage, 2012, 63 (3): 1364-1373. [14]KNIGHT D C, SMITH C N, STEIN E A, et al. Functional MRI of human Pavlovian fear conditioning: patterns of activation as a function of learning[J]. Neuroreport, 1999, 10 (17): 3665-3670. [15]ROMBOUTS S A, BARKHOF F, GOEKOOP R, et al. Altered resting state networks in mild cognitive impairment and mild Alzheimer's disease: an fMRI study[J]. Human Brain Mapping, 2005, 26 (4): 231-239. [16]VAN D K R, SABUNCU M R, BUCKNER R L. The influence of head motion on intrinsic functional connectivity MRI[J]. Neuroimage, 2012, 59 (1): 431-438. [17]FOX M D, SNYDER A Z, VINCENT J L, et al. The human brain is intrinsically organized into dynamic, anticorrelated functional networks[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102 (27): 9673-9678. [18]WANG J, WANG L, ZANG Y, et al. Parcellation-dependent small-world brain functional networks: a resting-state fMRI study[J]. Human Brain Mapping, 2009, 30 (5): 1511-1523. [19]TZOURIO-MAZOYER N, LANDEAU B, PAPATHANASSIOU D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J]. Neuroimage, 2002, 15 (1): 273-89. [20]BISWAL B, ZERRIN YETKIN F, HAUGHTON V M, et al. Functional connectivity in the motor cortex of resting human brain using echo-planar MRI[J]. Magnetic Resonance in Medicine, 1995, 34 (4): 537-541. [21]WATTS D J, STROGATZ S H. Collective dynamics of “small-world” networks[J]. Nature, 1998, 393 (6684): 440-442. [22]SLADKY R, FRISTON K J, TRÖSTL J, et al. Slice-timing effects and their correction in functional MRI[J]. Neuroimage, 2011, 58 (2): 588-594. [23]WANG L, ZANG Y, HE Y, et al. Changes in hippocampal connectivity in the early stages of Alzheimer’s disease: evidence from resting state fMRI[J]. Neuroimage, 2006, 31 (2): 496-504. [24]YOO S S, CHOI B G, JUH R H, et al. Working memory processing of facial images in schizophrenia: fMRI investigation[J]. International Journal of Neuroscience, 2005, 115 (3): 351-366. [25]SKIDMORE F, KORENKEVYCH D, LIU Y, et al. Connectivity brain networks based on wavelet correlation analysis in Parkinson fMRI data[J]. Neuroscience Letters, 2011, 499 (1): 47-51. (责任编辑于敏) doi:10.3969/j.issn.1000-2162.2016.04.012 收稿日期:2015-07-23 基金项目:国家自然科学基金资助项目(31170952,31470954);上海海事大学研究生创新基金项目(2014ycx026) 作者简介:陈东太郎(1991-),男,江西赣州人,上海海事大学硕士研究生;*曾卫明(通信作者),上海海事大学教授,博士生导师, E-mail:zengwm86@sina.com. 中图分类号:R319 文献标志码:A 文章编号:1000-2162(2016)04-0073-07 Brain functional connectivity investigation of three eyes status based on complex networks analysis CHEN Dongtailang, ZENG Weiming*, WANG Nizhuan, SHI Yuhu (College of Information Engineering, Shanghai Maritime University, Shanghai 201306, China) Abstract:This study investigates how eyes status affects the key topological signatures of human brain networks in eyes closed (EC), open (EO) and eyes free (EF) condition. 13 subjects participated and underwent 3 imaging sessions with three 8 min resting-state fMRI scans (EC, EF, EO). Image acquisition was acquired using a 3T MR scanner and consisted of anatomical images for co-registration of fMRI data. Followed by graph theory, the global and local metrics of functional connectivity in a range of sparse degree with the three eyes status were calculated to detect the statistically significant difference between them. Based on graph-theoretic topology metrics, we found that all the subject networks had demonstrated a small-world properties with a proper sparse degree, and the networks in EC had reduced both local and global efficiency. To summarize, our results demonstrated that the topologic structure of human brain network is related to eyes status, and provide an empirical evidence on how eyes status affects fMRI experiments. Keywords:eye free; resting-state fMRI; eyes open and closed; complex network; functional connectivity