贝伐单抗联合一线化疗对晚期结直肠癌生存期和安全性的影响
2016-08-05郑洁郭建霞宋增华张晓云赵春林
郑洁 郭建霞 宋增华 张晓云 赵春林
·论著·
贝伐单抗联合一线化疗对晚期结直肠癌生存期和安全性的影响
郑洁郭建霞宋增华张晓云赵春林
076450河北省张北县医院内科(郑洁、郭建霞、宋增华、赵春林),外科(张晓云)
【摘要】目的研究贝伐单抗联合一线化疗对晚期结直肠癌生存期和安全性的影响。方法选择72例被诊断为晚期结直肠癌的病患实施研究。按随机数字表法分为观察组和对照组,每组36例。其中观察组采用贝伐单抗联合一线化疗方案对患者进行治疗。对照组则单纯采用一线化疗方案对患者进行治疗。对比2组的生存期及不良反应的发生情况。结果观察组总有效率明显高于对照组(P<0.05)。患者出现腹泻、呕吐、贫血以及粒细胞减少患者占比均显著低于对照组(P<0.05)。观察组患者的中位生存期、PFS均显著高于对照组(P<0.04),病死率显著低于对照组(P<0.05)。观察组OCT4、Wnt1a的阳性表达率均显著低于对照组(P<0.05),β-Catenin蛋白的异位表达率显著低于对照组(P<0.05)。结论贝伐单抗联合一线化疗用于治疗晚期结直肠患者,不仅可明显提升治疗效果,还可改善患者的生存时间,不良反应轻微。安全性较好,值得临床推荐。
【关键词】结直肠肿瘤;一线治疗;贝伐单抗;生存期
结直肠肿瘤在临床中是常见的恶性肿瘤之一。近年来,发病率和病死率逐渐上升,由于人们生活习惯及饮食习惯的改变,肠癌发生率呈明显递增趋势,每年上涨约2%。晚期癌症的患者,饮食上需要加强营养,一般直肠癌患者宜进高蛋白,高热量,高维生素,纤维含量高,易于消化的营养丰富的少渣饮食,少量多餐,以增加机体的抵抗力;同时忌辛辣,坚硬食物,禁烟酒,减少对肠道的刺激,注意生活的规律。目前多数研究针对分子层面进行研究,发现血管内皮生长因子参与了肿瘤新生血管的重要过程,成为抗肿瘤研究的热点之一。临床上常采用贝伐单抗联合化疗药物进行治疗,效果显著,尤其是在晚期结直肠癌中有明显效果[1]。本文通过采用贝伐单抗联合一线化疗方案对于晚期直肠癌患者的治疗,对比单纯采用一线化疗方案的疗效,报道如下。
1资料与方法
1.1一般资料选取我院2009年3月至2014年8月期间收治的肠癌患者,所有患者经检查和诊断均符合结直肠癌诊断标准。患者随机分为观察组和对照组,每组36例。对照组中,男23例,女13例;年龄31~76岁,平均年龄(55±4)岁。观察组中,男20例,女16例;年龄33~75岁,平均年龄(54±4)岁。入选标准:(1)患者一般情况较好,均经病理学检查并明确诊断;(2)CT检查后证实为结直肠癌;(3)实验室检查均正常;(4)以往均未接受过针对转移病灶的全身化疗,距上次抗肿瘤化疗结束≥1个月。2组一般资料有均衡性。
1.2研究方法对照组单纯采用一线化疗方案对患者进行治疗,海南齐鲁制药有限公司生产的伊立替康注射液(国产准字 H20084517)静脉滴注治疗,180 mg·m-2·d-1;江苏恒瑞医药股份有限公司生产的亚叶酸钙注射液(国产准字 H20084517)静脉滴注治疗,200 mg·m-2·d-1;上海旭东海普药业有限公司生产的氟尿嘧啶注射液(国药准字 H31020593)静脉滴注治疗,400 mg·m-2·d-1,持续22 h滴入,持续静脉滴入22 h。每2周重复上述药物治疗1次。观察组在上述基础上加入由上海罗氏制药有限公司生产的贝伐单抗(批号:B3426B01)进行治疗,5 mg/kg,2周1次。6周为1个周期,共治疗4个周期。每周复查血常规情况,每2周复查肝功能和肾功能情况等。
1.3疗效评价根据治疗效果评价,完全缓解(CR):病灶消失持续1个月以上;部分缓解(PR):病灶直径减少30%以上;稳定(SD):病灶直径减少30%以下或增大20%以下;进展(PD):病灶直径增加20%以上。并分别选取干细胞标记物OCT4和Wnt 信号通路中Wnt1a、β-Catenin等生物标记物作为研究指标,采用免疫组织化学(immunohistochemistry, IHC)技术检测以上三标记物在结直肠癌、结直肠腺瘤以及正常结直肠黏膜中蛋白水平的表达情况,分析它们与结直肠癌的发生、发展及与患者临床病理特征和预后的相互关系。
1.4生存期随访对患者进行电话随访1年,观察2组患者的生存情况。
1.5不良反应按照美国国家癌症研究所研究所常见毒性事件(NCI-CTC)4.0 毒性评价标准对不良反应进行评价[2,3]。

2结果
2.1治疗效果观察组总有效率明显高于对照组(P<0.05)。见表1。

表1 2组患者治疗效果比较 n=36,例(%)
2.22组不良反应比较观察组患者出现腹泻、呕吐、贫血以及粒细胞减少患者占比均显著低于对照组,差异均有统计学意义(P<0.05)。见表2。
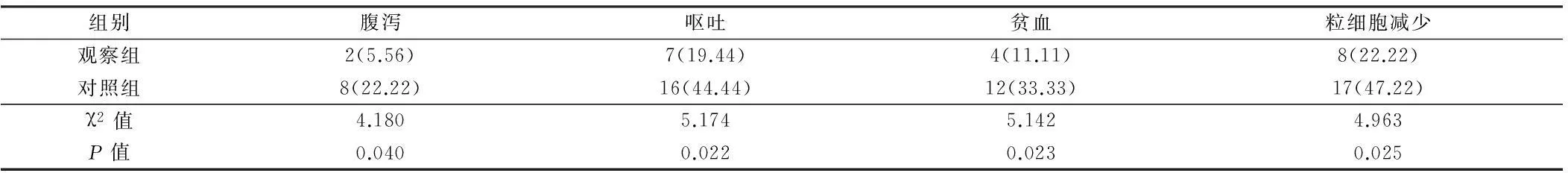
表2 2组别不良反应比较 n=36,例(%)
2.32组患者的PFS、中位生存期以及病死率比较观察组中位生存期、PFS均显著高于对照组,病死率显著低于对照组,差异均有统计学意义(P<0.05)。见表3。
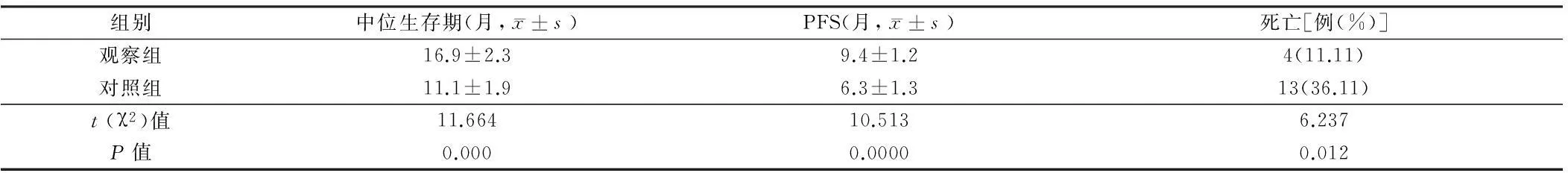
表3 2组患者的PFS、中位生存期以及病死率对比 n=36
2.42组患者在OCT4、β-Catenin以及Wnt1a的表达率观察组OCT4、Wnt1a的阳性表达率均显著低于对照组,β-Catenin蛋白的异位表达率显著低于对照组,差异均有统计学意义(P<0.05)。见表4。

表4 2组患者在OCT4、β-Catenin以及Wnt1a的表达率 n=36,例(%)
3讨论
对于晚期结直肠患者,在临床上为其诊治的技术手段已得到明显发展,但其治疗后的整体有效生存情况仍不容乐观,其主要的治疗手段仍然是全身化疗。有报道表明,目前对于分子靶向治疗研究较多,对于结直肠癌的治疗以抗VEGF和抗表皮生长因子受体单克隆抗体为主,联合化疗治疗效果较佳。贝伐单抗是目前认为最有效的分子靶向药物,是VEGF的单克隆抗体,是针对肿瘤新生血管的靶向药物,经证实贝伐单抗有着良好抗肿瘤活性和应用的安全性[4]。
本文通过对比贝伐单抗联合一线化疗以及单纯采用化疗药物治疗结直肠癌患者,结果显示,观察组、对照组总有效率分别为44.44%、19.44%,观察组明显较高(P<0.05)。符合蔡锐刚[5]等报道结果,表明贝伐单抗联合一线化疗方案治疗效果更佳。而在安全性上发现,观察组患者出现腹泻、呕吐、贫血以及粒细胞减少患者占比均显著低于对照组。与徐兆宏[6,7]等的报道结果一致。表明贝伐单抗联合一线化疗方案对于患者的不良反应的发生有着明显的降低作用。此外,观察组OCT4、Wnt1a的阳性表达率均显著低于对照组,β-Catenin蛋白的异位表达率显著低于对照组。符合史幼梧[8,9]等人的报道结果。表明贝伐单抗联合一线化疗对患者OCT4及Wnt/β-Catenin信号通路起重要的调控作用。究其原因,笔者认为这可能是因为贝伐单抗是以血管内皮生长因子为靶点,竞争性结合VEGF受体对内皮细胞的有丝分裂起到明显抑制作用,阻碍了新生血管的生成,从而阻断肿瘤生长所需的血液、氧气以及营养物质,限制了肿瘤的生长发挥了抗肿瘤作用[10-12],并且贝伐单抗还可调节免疫系统,在加强免疫系统的同时抑制VEGF与受体的结合,有利于抗肿瘤药物直达病灶,发挥药性[13-15]。这些形态和功能上的变化可以增加肿瘤化疗和放疗的敏感性 而对于肝硬化肝癌患者,血管通透性的减少可以减少腹腔积液[16-18]此外,贝伐单抗结合VEGF 后可作用于肝窦内皮细胞(SEC)降低在窦周基质降解及肝窦扩张中发挥重要作用的基质金属蛋白酶9(MMP-9)的表达[19],进而改善患者的肝功能[20]。
有报道表明,贝伐单抗属与IgG1型克隆抗体,在联合化疗药物治疗时不良反应较低,多为Ⅰ度和Ⅱ度[21],且对症处理后大部分患者可消除不良反应症状,不影响患者日常生活[18]。贝伐单抗联合一线化疗虽然仍无法完全杀灭肿瘤细胞,且自身具有一些治疗的局限性和毒副作用,但与传统的治疗方案相比,不良反应低、治疗效果好,明显改善患者化疗后生活质量[22-26]。
综上所述,贝伐单抗联合一线化疗用于治疗晚期结直肠患者,治疗效果显著,不良反应低,明显延长生存时间,值得临床应用及推广。
参考文献
1朱帝文,张海潇,顾俊鹏,等.贝伐单抗动脉灌注联合化疗栓塞术治疗原发性肝癌的血管造影变化及初步评价.中国全科医学,2015,18:350-354.
2张宁刚,王育生,张成琰,等.贝伐珠单抗联合化疗治疗转移性结直肠癌的近期效果及安全性.肿瘤研究与临床,2014,26:741-743,748.
3陆云涛,漆松涛,欧阳辉,等.贝伐株单抗治疗国人复发恶性胶质瘤的初步临床分析与评估.中华医学杂志,2014,94:1165-1168.
4宋湘梅,田汝银,张国明,等.玻璃体腔注射贝伐单抗与光动力疗法治疗病理性近视脉络膜新生血管疗效的Meta分析.中华眼底病杂志,2014,30:509-513.
5蔡锐刚,姚舒洋,徐兵河,等.贝伐珠单抗联合紫杉类药物一线治疗局部复发或转移性乳腺癌患者的安全性及疗效.中国肿瘤,2014,23:253-256.
6徐兆宏.比较贝伐单抗和曲氨奈德在视网膜中央静脉阻塞继发黄斑水肿中的治疗作用.中国药物与临床,2014,14:1104-1106.
7李志强,钟敬雯,蔡展谋,等.玻璃体手术联合玻璃体腔注射贝伐单抗治疗增殖性糖尿病视网膜病变观察.中国实用眼科杂志,2014,32:861-863.
8史幼梧,石远凯,秦燕,等.单纯Hyper-CVAD方案或联合自体造血干细胞移植一线治疗淋巴母细胞淋巴瘤的疗效分析.中国肿瘤临床,2015,42:13-18.
9刘卓,曾珊.伊立替康和紫杉醇联合顺铂二线治疗小细胞肺癌的疗效比较分析.中国现代医生,2014,52:123-125.
10林雯,王鸿彪,林穗玲,等.多西他赛联合卡培他滨二线治疗晚期食管鳞状细胞癌的Ⅱ期研究.肿瘤研究与临床,2014,26:767-769,778.
11Cella D. Bevacizumab and quality of life in advanced cervical cancer.Lancet Oncol,2015,16:241-243.
12Qi WX, Fu S, Zhang Q,et al. Bevacizumab increases the risk of infections in cancer patients: A systematic review and pooled analysis of 41 randomized controlled trials.Crit Rev Oncol Hematol,2015,19:31-33.
13Diéras V, Wildiers H, Jassem J,et al. Trebananib (AMG 386) plus weekly paclitaxel with or without bevacizumab as first-line therapy for HER2-negative locally recurrent or metastatic breast cancer: A phase 2 randomized study.Breast,2015,4:192-193.
14Price TJ, Bruhn MA, Lee CK,et al. Correlation of extended RAS and PIK3CA gene mutation status with outcomes from the phase III AGITG MAX STUDY involving capecitabine alone or in combination with bevacizumab plus or minus mitomycin C in advanced colorectal cancer.Br J Cancer,2015,5:37-38.
15Kawai H, Sugimoto R, Miyauchi S,et al. A Case of Bone Marrow Carcinomatosis with Disseminated Intravascular Coagulation Arising from Breast Cancer Successfully Treated with Paclitaxel plus Bevacizumab.Gan To Kagaku Ryoho,2014,41:1957-1959.
16Roviello G, Francini E, Perrella A,et al. Five years of stable disease with maintenance therapy using bevacizumab and tamoxifen in a patient with metastatic breast cancer.Cancer Biol Ther,2015,16:10-11.
17Wozniak AJ, Moon J, Thomas CR Jr,et al. A Pilot Trial of Cisplatin/Etoposide/Radiotherapy Followed by Consolidation Docetaxel and the Combination of Bevacizumab (NSC-704865) in Patients With Inoperable Locally Advanced Stage III Non-Small-Cell Lung Cancer: SWOG S0533.Clin Lung Cancer,2015,16:3-4.
18Ichihara E, Hotta K, Nogami N,et al. Phase II Trial of Gefitinib in Combination with Bevacizumab as First-Line Therapy for Advanced Non-Small Cell Lung Cancer with Activating EGFR Gene Mutations: The Okayama Lung Cancer Study Group Trial 1001.J Thorac Oncol,2015,10:486-491.
19Osaki Y, Nishikawa H. Treatment for hepatocellular carcinoma in Japan over the last three decades: Our experience and published work review.Hepatol Res,2014,45:59-74.
20Chen X,Liu HP,Li M,et al. Advances in non-surgical management of primary liver cancer.World J Gastroenterol,2014,20: 16630-16638.
21Forner A,Gilabert M,Bruix J,et al. Treatment of intermediate-stage hepatocellular carcinoma.Nat Rev Clin Oncol,2014,11: 525-535.
22刘贤忠,张丽婷,童卫泉,等.贝伐单抗在肺癌中的研究进展.中国全科医学,2015,18:1002-1005.
23韩志军.贝伐单抗联合FOLPOX4方案治疗晚期结直肠癌的临床疗效观察.中华普外科学文献(电子版),2015,9:28-31.
24陈杰,侯恩存.贝伐单抗联合XELOX方案治疗转移性结直肠癌的研究进展.实用肿瘤学杂志,2015,29:157-161.
25郑盈,徐雷鸣,陆震宇,等.贝伐单抗治疗结直肠癌疗效和安全性Meta分析.国济大学学报,2014,35:105-110.
26赵磊,杨薏帆,甄洪超,等.贝伐单抗在脱期结直肠癌维持治疗中疗效和安全性的Meta分析.临床和实验医学杂志,2014,13:1755-1759.
doi:10.3969/j.issn.1002-7386.2016.14.034
【中图分类号】R 735.3
【文献标识码】A
【文章编号】1002-7386(2016)14-2194-03
(收稿日期:2016-02-17)
