经皮冠状动脉介入治疗术后氯吡格雷低反应患者的剂量相关分析与随访研究
2016-08-05陆敏范韬周建龙金骁琦盛晓东
陆敏 范韬 周建龙 金骁琦 盛晓东
·临床研究·
经皮冠状动脉介入治疗术后氯吡格雷低反应患者的剂量相关分析与随访研究
陆敏范韬周建龙金骁琦盛晓东
215500江苏常熟,扬州大学医学院附属常熟医院心血管内科
【摘要】目的探讨大剂量氯吡格雷维持应用对经皮冠状动脉介入治疗(PCI)术后患者氯吡格雷低反应的发生率及临床事件的影响,并分析发生氯吡格雷低反应的可能相关危险因素。方法选取2014年1月至2015年6月在扬州大学医学院附属常熟医院心血管内科行PCI术的患者134例,应用血栓弹力图(TEG)测定血小板抑制率,根据术后24 h的测定结果分为氯吡格雷低反应组(45例)和氯吡格雷敏感组(89例),术后分别给予氯吡格雷150 mg、每日1次和75 mg、每日1次口服维持,3个月后复查TEG,观察氯吡格雷低反应变化情况并分析氯吡格雷低反应相关危险因素。随访6个月间的主要不良心血管事件(MACE)和出血事件的发生情况。结果3个月后,氯吡格雷低反应的发生率从33.6%(45/134)降至11.9%(16/134)。随访6个月,两组患者死亡、非致死性心肌梗死的发生率比较,差异均无统计学意义(均P>0.05);氯吡格雷低反应组的总体MACE[15例(33.3%)比20例(22.5%)]、靶血管再次血运重建[5例(11.1%)比6例(6.7%)]、再次因心绞痛住院[12例(26.7%)比15例(16.9%)]的发生率显著高于氯吡格雷敏感组,差异均有统计学意义(均P<0.05)。氯吡格雷低反应的独立影响因素有吸烟史(OR 4.498,95% CI 1.378~4.018,P=0.036)、合并2型糖尿病(OR 4.385,95% CI 1.370~7.552,P=0.026)、氯吡格雷剂量(OR 0.597,95% CI 1.005~2.676,P=0.019)。结论对于氯吡格雷低反应的PCI患者,术后3个月持续应用氯吡格雷150 mg、每日1次维持剂量与氯吡格雷敏感患者75 mg、每日1次维持剂量在严重不良事件(包括死亡、非致死性心肌梗死)方面的获益相当。
【关键词】经皮冠状动脉介入治疗;氯吡格雷低反应;剂量相关
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是目前治疗冠心病重要的非药物治疗手段,随着对冠心病发病机制及血栓事件发生机制的深入研究,围术期的规范抗栓治疗已达成共识。氯吡格雷作为血小板腺苷二磷酸(adenosine diphosphate,ADP)P2Y12受体抑制剂的代表药物,在联合阿司匹林进行双联抗血小板治疗的过程中,虽然按照临床指南推荐的剂量和时间规范应用,仍有部分患者再次发生临床心血管事件而导致不良预后。抗血小板药物低反应可能是临床血栓相关性事件发生的原因之一。常规剂量氯吡格雷应用中有4%~40%的患者难以发挥有效的抗血小板效果[1-2],此现象称为氯吡格雷低反应。研究表明,氯吡格雷的抗血小板聚集作用在一定限度内呈剂量和时间依赖性[3]。本研究应用血栓弹力图(thrombelastography,TEG)作为抗血小板药物疗效的检测手段,探讨大剂量氯吡格雷维持应用对PCI术后患者氯吡格雷低反应的发生率及临床事件的影响,并分析发生氯吡格雷低反应的可能相关危险因素。
1对象与方法
1.1研究对象
选取2014年1月至2015年6月在扬州大学医学院附属常熟医院心血管内科行PCI术的患者134例。纳入标准:患者经冠状动脉造影检查提示冠状动脉管腔狭窄≥70%,置入药物洗脱支架1枚以上。排除标准:(1)同时应用西洛他唑或血小板糖蛋白Ⅱb/Ⅲa抑制药者;(2)对阿司匹林或氯吡格雷过敏者;(3)存在阿司匹林或氯吡格雷禁忌证者;(4)血液系统疾病或出血高危患者;(5)恶性肿瘤患者;(6)严重肝、肾功能不全患者。
1.2研究用药方案及流程
所有入选患者均予以常规冠心病二级预防药物治疗,包括阿司匹林、他汀类药物及血管紧张素转化酶抑制药(ACEI)/血管紧张素Ⅱ受体拮抗药(ARB);由同一组医师行PCI术,手术操作严格按照2009年中华医学会心血管分会制定的《经皮冠状动脉介入治疗指南》进行。PCI术前未服用阿司匹林和(或)氯吡格雷或服用不足5 d的患者,术前口服负荷剂量氯吡格雷(波立维,杭州赛诺菲公司生产)300 mg与阿司匹林(拜阿司匹林,德国拜耳公司生产)300 mg;术前服药超过5 d的患者,无需给予负荷剂量。术后2 h皮下注射低分子肝素。术后24 h留取抗凝全血,用TEG进行检测,根据ADP诱导的血小板抑制率不同分为氯吡格雷低反应组和氯吡格雷敏感组。术后3个月,氯吡格雷低反应组的患者应用氯吡格雷150 mg、每日1次口服维持,氯吡格雷敏感组常规应用75 mg、每日1次口服维持。3个月后,两组患者均常规应用氯吡格雷75 mg、每日1次口服维持。所有患者均于本院门诊定期随访,术后3个月待血药浓度达到稳态后复查TEG,测定氯吡格雷低反应的发生率,并分析氯吡格雷低反应的可能相关危险因素。随访术后6个月的主要不良心血管事件(major adverse cardiovascular events,MACE)及出血事件。
1.3TEG检测及氯吡格雷低反应定义
术后24 h及术后3个月分别留取抗凝全血,用TEG仪(CFMS,乐普科技)进行检测。TEG检测中最大幅度MA表示正常形成的血凝块的最大强度或硬度,分别测得凝血酶诱导的凝血块强度(MAthrombin)及纤维蛋白诱导的凝血块强度(MAfibrin)。应用ADP作为诱导剂,测定诱导后的凝血块强度(MAADP),ADP诱导的血小板抑制率=1-[(MAADP-MAfibrin)/(MAthrombin-MAfibrin)]×100%[4]。根据目前常用的判断标准,将ADP诱导的血小板抑制率<30%定义为氯吡格雷低反应[5]。
1.4MACE及出血事件
术后通过入院记录、门诊记录、电话随访及冠状动脉造影复查,随访术后6个月的MACE发生情况,包括死亡、非致死性心肌梗死、靶血管再次血运重建(target vessel revascularization,TVR)、再次因心绞痛住院等。出血情况采用GUSTO出血分级[6]进行评价:(1)严重或威胁生命的出血——颅内出血或因出血致血流动力学障碍需及时干预的出血;(2)中度出血——需输血治疗但尚未造成血流动力学影响的出血;(3)轻度出血——未达到中度出血标准的少量出血。
1.5统计学分析
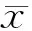
2结果
2.1两组患者的基线资料比较(表1)
两组患者吸烟史、合并2型糖尿病所占比例比较,差异均有统计学意义(均P<0.05);年龄、性别,合并高血压病、高脂血症,体质量指数(BMI),服用质子泵抑制药(PPIs)等资料比较,差异均无统计学意义(均P>0.05)。
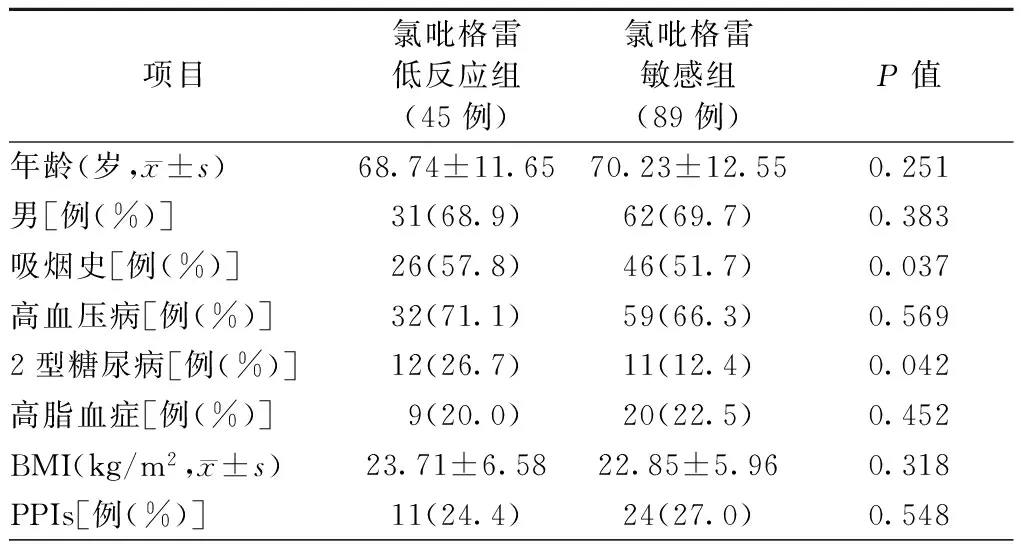
表1 两组患者的基线资料比较
注:BMI,体质量指数;PPIs,质子泵抑制药
2.2两组患者ADP诱导的血小板抑制率比较
术后24 h,氯吡格雷低反应组(45例)ADP诱导的血小板抑制率为(21.39±5.67)%,氯吡格雷敏感组(89例)为(62.38±14.26)%。经服用不同剂量氯吡格雷3个月后,氯吡格雷低反应组的血小板抑制率为(43.14±10.53)%,较术后24 h的测定值显著升高(P=0.021),且29例患者的氯吡格雷低反应消失,氯吡格雷低反应的发生率从33.6%(45/134)降至11.9%(16/134);氯吡格雷敏感组的血小板抑制率为(75.61±16.75)%,较术后24 h的测定值有所升高,但差异无统计学意义(P>0.05)。2.3两组患者的MACE及出血风险比较(表2)
所有患者均完成6个月的临床随访。氯吡格雷低反应组的总体MACE、TVR、再次因心绞痛住院的发生率显著高于氯吡格雷敏感组,差异均有统计学意义(均P<0.05)。两组患者死亡、非致死性心肌梗死的发生率比较,差异均无统计学意义(均P>0.05)。两组患者均未发生严重出血,但氯吡格雷低反应组的轻中度出血发生率高于氯吡格雷敏感组,差异有统计学意义(P=0.032)。

表2 两组患者术后6个月的MACE及出血风险比较[例(%)]
注:MACE,主要不良心血管事件
2.4氯吡格雷低反应相关因素的logistic回归分析(表3)
分析术后3个月测定的氯吡格雷低反应发生情况与各临床因素的相关性,以氯吡格雷低反应为因变量,将变量引入logistic回归模型进行分析,结果显示,氯吡格雷低反应的独立影响因素有吸烟史(OR4.498,95%CI1.378~4.018,P=0.036)、合并2型糖尿病(OR4.385,95%CI1.370~7.552,P=0.026)、氯吡格雷剂量(OR0.597,95%CI1.005~2.676,P=0.019)。

表3 氯吡格雷低反应相关因素的logistic回归分析
3讨论
PCI术后的标准抗血小板治疗中,阿司匹林联合氯吡格雷的应用已成为目前的共识。但由于对于氯吡格雷的药物反应存在很大的变异性,部分患者PCI术后虽然接受了规范双联抗血小板治疗,仍然再次出现不良心血管事件。氯吡格雷低反应的识别和处理已成为目前研究的热点。本研究应用TEG作为识别氯吡格雷低反应的手段,氯吡格雷低反应的发生率为33.6%,符合国内其他应用TEG检测的氯吡格雷低反应率[7],与其他常用检验方法如光密度比浊法、流式细胞仪技术、血小板功能分析等测得的氯吡格雷低反应发生率亦相符[8]。
本研究两组患者基线资料的比较结果显示,年龄、性别、合并高血压病和高脂血症、BMI、服用PPIs等对氯吡格雷低反应的影响不大,而吸烟史、合并2型糖尿病不仅能影响短时氯吡格雷低反应发生率,回归分析亦显示在长期维持应用中对氯吡格雷低反应发生率也起决定性作用。目前氯吡格雷低反应的发生机制尚未明确,现报道较多的内在因素有基因多态性、ADP释放增加和其他血小板聚集途径上调等[9-10]。另有证据表明,患者的血红蛋白、BMI、糖尿病、胰岛素低反应及吸烟均与氯吡格雷低反应的发生存在相关性[11-12]。吸烟使低反应血栓溶解的风险升高,减少血栓溶解,可能与纤维蛋白结构的改变有关,其结果使血凝块的纤维致密[13];在吸烟的冠心病患者中应用氯吡格雷可更显著地降低心肌梗死、心原性死亡和缺血性卒中的发生率[14]。2型糖尿病患者血小板对氯吡格雷的敏感性下降可能与胰岛素低反应有关[15]。有研究对氯吡格雷低反应现象及其影响因素进行回归分析,发现胰岛素低反应、冠心病与氯吡格雷低反应存在明显正相关[16]。胰岛素具有直接抑制血小板活化的作用,可能通过精氨酸/一氧化氮系统发挥效应,后者是重要的细胞内信号转导物质。氯吡格雷是一种前体药物,进入体内后需经细胞色素P450(CYP450)介导的酶联反应代谢为活性产物。CYP2C19作为参与氯吡格雷生物转化两个步骤的关键酶,编码CYP2C19的基因多态性决定了氯吡格雷相关转化产物的活性变化。目前报道发现CYP2C19基因的﹡2、﹡3突变为亚洲人中主要的有意义突变。中国人CYP2C19﹡2、﹡3基因携带者对氯吡格雷的反应较差[17]。最近在印度人群中的小规模研究报道发现,联合CYP2C19﹡2和CYP3A5﹡3基因携带者对抗血小板药物表现出更差的血小板聚集效果[18]。
临床应对氯吡格雷低反应的方法尚未形成明确共识,目前研究集中于增加单次负荷剂量和(或)维持剂量,或换用其他新型抗血小板药物如替格瑞洛等。已有荟萃分析证实,600 mg的氯吡格雷负荷剂量可以更加有效降低急性冠状动脉综合征患者的MACE发生率[19]。国内亦有小规模研究比较服用600 mg与300 mg氯吡格雷负荷剂量后血小板聚集率的变化,发现两种负荷剂量均可快速抑制急性心肌梗死患者PCI术后血小板聚集活化功能,但服用600 mg负荷剂量后能更快达到抑制血小板聚集的目的,同时随访观察的MACE发生率较300 mg负荷剂量组有显著下降[20]。
本研究聚焦于150 mg氯吡格雷维持应用3个月能否对合并氯吡格雷低反应患者有更多的临床获益。结果显示,原有45例氯吡格雷低反应患者中仅有16例出现氯吡格雷低反应,发生率从33.6%降至11.9%。logistic回归分析提示,3个月后,不同的氯吡格雷剂量与氯吡格雷低反应发生情况存在相关性(OR=0.597),说明不同剂量氯吡格雷的应用对患者血小板聚集产生的临床效果不同,大剂量有益于更好的血小板聚集效果。韩国一项研究发现,原有氯吡格雷低反应的患者中,应用150 mg、每日1次的氯吡格雷后使氯吡格雷低反应率由原来的82%降至48%[21],下降幅度与本研究结果相似。氯吡格雷低反应组中死亡、非致死性心肌梗死的发生率与氯吡格雷敏感组相当,说明在氯吡格雷低反应患者中应用双倍剂量维持应用3个月能够减少因氯吡格雷低反应发生的严重不良事件。但是氯吡格雷低反应组再次因心绞痛住院的发生率高于氯吡格雷敏感组,原因可能是氯吡格雷低反应组合并糖尿病比例显著增加,导致冠状动脉多支病变发生率升高,心绞痛再发增多。氯吡格雷低反应组TVR发生率高于氯吡格雷敏感组,5例进行了TVR的患者有3例出现靶病变支架内再狭窄,2例患者靶病变支架前后血管出现严重狭窄后再次置入支架,与原支架有重叠。Tavassoli等[22]比较了氯吡格雷低反应并准备行PCI术的患者分别服用75 mg、每日1次和150 mg、每日1次维持剂量,发现后者术后支架内血栓形成和严重不良心血管事件的发生率更低。CURRENT-OASIS 7试验[23]显示,氯吡格雷标准剂量组与高剂量组早期终点事件发生率的差异无统计学意义,但是高剂量组的支架内血栓发生率降低了约30%,再发心肌梗死率降低22%。在合并慢性肾病并接受PCI的氯吡格雷低反应患者中,研究亦发现,应用150 mg、每日1次的氯吡格雷维持剂量可以改善患者随访1个月的支架内血栓及MACE发生率,同时不增加出血风险[24]。出血方面随访结果中,本研究两组患者均未发生严重出血,但在轻中度出血方面,应用氯吡格雷150 mg、每日1次的氯吡格雷低反应组有轻度增加,这与已发表研究结果一致[25]。因此,更高的药物剂量在带来临床获益的同时,出血风险的增加仍需引起警惕。
综上所述,对于氯吡格雷低反应的PCI患者,术后3个月持续应用氯吡格雷150 mg、每日1次维持剂量与氯吡格雷敏感患者75 mg、每日1次维持剂量在严重不良事件(包括死亡、非致死性心肌梗死)方面的获益相当。但是,高剂量氯吡格雷所带来的有利作用仍需与增加的出血风险进行平衡,需对患者严格评估。本研究样本量较少,未能做到完全随机对照,观察时间较短,对高剂量氯吡格雷的长期效应及出血风险仍需进一步观察及研究。
参考文献
[1] Müller I, Besta F, Schulz C, et al.Prevalence of clopidogrel non-re-spenders among patients with stable angina pectoris scheduled for elective coronary stent placement. Thromb Haemost, 2003, 89(5): 783-787.
[2] Angiolillo DJ, Fernandez-Ortiz A, Bernardo E,et al.Platelet function profiles in patients with type 2 diabetes and coronary artery disease on combined aspirin and clopidogrel treatment.Diabetes, 2005, 54(8): 2430-2435.
[3] Gubel PA,Bliden KP,Zaman KA,et al. Clopidogral loading with eptifibatide to arrest the reactivity of platelets: results of clopidogral loading with eptifibatide to arrest the reactivity of platelets (CLEAR PLATEIETS) study. Circulation, 2005, 111(9): 1153-1159.
[4] Salooga N, Perry DJ.Thrombelastography. Blood Coagul Fibrinolysis, 2001, 12(5): 327-337.
[5] Tantry US, Bliden KP, Gurbel PA. Overestimation of platelet apirin resistance detection by thrombelagtograph platelet mapping and validation by conventional aggregometry using arachidonic acid stimulation.J Am Coll Cardiol, 2005, 46(9): 1705-1709.
[6] No authors listed. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction.N Engl J Med, 1993, 329(10): 673-682.
[7] 龚艳君, 屈晨雪, 邱林,等. 应用血栓弹力图评价经皮冠状动脉介入治疗术后患者抗血小板药物的治疗效果. 中国介入心脏病学杂志, 2015, 23(1): 18-21.
[8] Vadász D, Sztriha LK, Sas K, et al. Aspirin and clopidogrel resistance: possible mechanisms and clinical relevance.Part Ⅱ: Potential causes and laboratory tests.Ideggyogy Sz, 2013, 66(1-2): 15-22。
[9] Arya V, Mahajan P, Saraf A, et al.Association of CYP2C19, CYP3A5 and GP Ⅱb/Ⅲ a gene polymorphisms with Aspirin and Clopidogrel Resistance in a cohort of Indian patients with Coronary Artery Disease. Int J Lab Hematol, 2015, 37(6): 809-818.
[10] Liu YP, Hao PP, Zhang MX, et al.Association of genetic variants in CYP2C19 and adverse clinical outcomes after treatment with clopidogrel: An updated meta-analysis. Thomb Res, 2011, 128(6): 593-594.
[11] Legrand D, Barbato E, Chenu P, et al. The STIB score: a simple clinical test to predict clopidogrel resistance. Acta Cardiol, 2015, 70(5): 516-521.
[12] Wu ZK, Wang JJ, Wang T, et al. Clopidogrel resistance response in patients with coronary artery disease and metabolic syndrome: the role of hyperglycemia and obesity. J Geriatr Cardiol, 2015, 12(4): 378-382.
[13] Barua RS, Sy F, Srikanth S, et al. Acute cigarette smoke exposure reduces clot-association between altered fibrin arehitceture and the response to t-PA. Thromb Res, 2010, 126(5): 426-430.
[14] Ferreiro JL, Bhatt DL, Ueno M, et al. Impact of smoking on long-term outcomes in patients with atherosclerotic vascular disease treated with aspirin or clopidogrel: insights from the CAPRIE trial (Clopidogrel Versus Aspirin in Patients at Risk of Ischemic Events). J Am Coll Cardiol, 2014, 63(8): 769-777.
[15] Lundetröm A, Laska AC, Von Arbin M, et al. Glucose intolerance and insulin resistance as predictors of low platelet response to clopidogrel in patients with minor ischemic stroke or TIA. Platelets, 2014, 25(2): 102-110.
[16] AI-Azzam SI, Alzoubi KH, Khabour OF, et al. Factors that contribute to clopidogrel resistance in cardiovascular disease patients: environmental and genetic approach. Int J Clin Pharmacol Ther, 2013, 51(3): 179-186.
[17] Wu H, Qian J, Xu J, et al. Effects of CYP2C19 variant alleles on postclopidgrel platelet reactivity and clinical outcomes in an actual clinical setting in China. Pharmacogenet Genomics, 2012, 22(12): 887-890.
[18] Arya V, Mahajan P, Saraf A, et al. Association of CYP2C19, CYP3A5 and GP IIb/IIIa gene polymorphisms with Aspirin and Clopidogrel Resistance in a cohort of Indian patients with Coronary Artery Disease. Int J Lab Hematol, 2015, 37(6):809-818.
[19] Siller-Matula JM, Huber K, Christ G, et al. Impact of clopidogrel loading dose on clinical outcome in patients under going percutaneous coronary intervention:a systematic review and meta-analysis. Heart, 2011, 97(2): 98-105.
[20] 朱伟军, 师军峰, 王蕊, 等. 不同负荷剂量氯吡格雷对急性ST段抬高型心肌梗死患者PCI术后血小板聚集率和超敏C反应蛋白水平的影响. 实用临床医药杂志, 2015, 19(9): 129-131.
[21] Choi H, Ryu J, Seo H, et al. Is a high maintenance dose of clopidogrel suitable for overcoming clopidogrel resistance in patients? Int J Clin Pharm, 2015, 37(5):758-761.
[22] Tavassoli N, Voisin S, Carrie D, et al. High maintenance dosage of clopidogrel is associated with a reduced risk of stent thrombosis in clopidogrel-resistant patients. Am J Cardiovasc Drugs, 2010, 10(1): 29-35.
[23] Metha SR, Bassand JP, Chrolavicius S, et al. Dose comparisons of clopidogrel and asapirin in acute coronary syndromes. N Engl Med, 2010, 363(10): 930-942.
[24] Liang J, Wang Z, Shi D, et al. High clopidogrel dose in patients with chronic kidney disease having clopidogrel resistance after percutaneous coronary intervention. Angiology, 2015, 66(4): 319-325.
[25] Gurbel PA, Tantry US. An initial experiment with personalized antiplatelet therapy: the GRAVITAS trial. JAMA, 2011, 305(11): 1136-1137.
DOI:10.3969/j.issn.1004-8812.2016.04.008
通信作者:陆敏,Email:tilia1981@126.com
【中图分类号】R541.4
Corresponding author:LU Min, Email:tilia1981@126.com
(收稿日期:2016-01-27)
Follow-up research and dosage correlation analysis in patient with clopidogrel hypo-responsiveness after percutaneous coronary intervention
LUMin,FANTao,ZHOUJian-long,JINXiao-qi,SHENGXiao-dong.
DepartmentofCardiology,ChangshuHospital,MedicalCollegeofYangzhouUniversity,Changshu215500,China
【Abstract】ObjectiveTo determine if a double maintenance dose of clopidogrel can improve the clinical outcome in patients who have clopidogrel hypo-responsiveness (CH) after percutaneous coronary intervention (PCI) and analyze correlative risk factors of CH. MethodsWe had enrolled 134 consecutive patients undergoing PCI for stable coronary artery disease in our center between January 2014 to June 2015. CH was determined by platelet aggregation measured by thrombelastography (TEG). Blood samples were taken 24 h and 3 months after PCI procedure. All subjects were divided into 2 groups (i.e the CH group and the clopidogral sensitive group) according to their responsiveness by TEG. The CH group (n=45) received a double maintenance dose of clopidogrel as 150 mg/d and the clopidogrel sensitive group (n=89) received a standard maintenance dose as 75 mg/d. Changes in clopidogrel responsiveness and correlative risk factors were observed after 3 months of clopidogrel treatment. Major adverse cardiac events (MACEs) and bleeding incidents were recorded during follow-up lease 6 months. ResultsThe clopidoprel hypo-responsive rate decreased from 33.6% (45/134 patients) to 11.9% (16/134 patients) after 3 months of treatment. No statistical difference found between the 2 groups in mortality rate and non-fatal myocardial infarction (P>0.05). Rates of overall MACE (33.3% vs. 22.5%), rehospitalization (26.7% vs. 16.9%) and target vessel revascularization (11.1% vs. 6.7%) were significant higher in the CH group(all P<0.05). Multivariate regression analysis showed: smoking (OR 4.498, 95% CI 1.378-4.018, P=0.036), diabetes (OR 4.385, 95% CI 1.370-7.552,P=0.026) and clopidogrel dosage (OR 0.597, 95% CI 1.005-2.676, P=0.019) were the risk factors for CH. ConclusionsFor patient with hypo-responsiveness to clopidogrel after PCI, a higher maintenance dose of clopidogrel as 150 mg/d for 3 months can provide equivalent clinical benefit in serious adverse event (including mortality and non-fatal myocardial infarction) compared to standard maintenance dose for clopidogrel responsive patients.
【Key words】Coronary intervention;Clopidogrel hypo-responsiveness;Dosage correlation
